文章信息
- 李鹏祥, 鲍依群, 谭小云. 2016.
- LI Pengxiang, BAO Yiqun, TAN Xiaoyun. 2016.
- 拟南芥exocyst亚基SEC8基因在主根细胞程序性死亡中的功能
- Functional analysis of Arabidopsis exocyst complex subunit SEC8 gene in programmed cell death in primary root
- 南京农业大学学报, 39(2): 228-234
- Journal of Nanjing Agricultural University, 39(2): 228-234.
- http://dx.doi.org/10.7685/jnau.201509019
-
文章历史
- 收稿日期:2015-09-16
囊泡运输是细胞内物质运输的一种重要形式,它可分为囊泡出芽、运动、拴系和融合4个基本步骤[1]。拴系是囊泡与靶膜融合前的相互识别过程,主要由拴系因子介导。exocyst复合体是一个广泛存在于真核生物中的拴系因子复合体,由8个亚基(SEC3、SEC5、SEC6、SEC8、SEC10、SEC15、EXO70 和EXO84)组成。在酵母中,exocyst复合体被认为介导了外泌囊泡与质膜的识别过程[2]。模式植物拟南芥中也存在exocyst复合体,编码其亚基的基因有的是单拷贝,如SEC6、SEC8和SEC10基因;有的是多拷贝,如SEC3、SEC5和SEC15 基因有2个拷贝,EXO 84 基因有3个拷贝,而EXO 70 基因有23个拷贝[3]。研究表明:exocyst复合体在植物生长发育过程中发挥多种重要功能,包括细胞极性生长、细胞板形成、PIN1和PIN2蛋白的再循环、自噬、抗病和维管束发育等[4, 5, 6, 7]。例如:EXO 70A1基因突变体exo70a1-1和exo70a1-2 中,植株主根变短,根毛极性生长受阻,地上部分矮小;细胞分裂过程中细胞板形成过程有缺陷;主根生长素运输和PIN蛋白的再循环受阻;维管束发育缺陷[5, 6, 8]。SEC 8基因突变sec8m1 突导致花粉管极性生长缺陷,形成粗短的花粉管,进而导致雄性不育[9, 10]。从这些研究结果来看,拟南芥exocyst复合体发挥的功能可能比动物和酵母中更为复杂,尽管现在研究者对exocyst复合体在植物中的功能进行了一些研究,但是对于exocyst复合体分子生物学功能的了解还很有限。
细胞死亡是生物体中的一种常见现象,它可分为两种基本类型:细胞程序性死亡(programmed cell death,PCD)和细胞坏死(necrosis)[11]。PCD是生物体在生长发育的一定阶段、在特定组织器官或应对特定环境而出现的一种主动的、有序的细胞死亡过程,这种细胞死亡通常与基因的有序活动相关。PCD在植物的生长发育、衰老及应对逆境过程中发挥重要作用,如维管束分化过程中导管细胞的死亡、雌配子体发育过程中大孢子的退化死亡等都属于PCD[9];植物超敏反应(hypersensitive response,HR)中局部细胞的死亡也属于PCD[12]。PCD往往具有比较典型的形态学和生化特征,比如发生PCD的细胞先以细胞质和细胞核皱缩(condensation)、染色质边缘化为特征,随后由膜包围DNA片段而形成凋亡小体;另外,发生PCD的细胞表现为被诱导产生核酸内切酶,核DNA从核小体间降解断裂,产生带有3′-OH 端的、大小不同的寡聚核小体片段,这些片段能够被TUNEL试剂所检测[13]。而且植物PCD往往和一些植物激素相关,如水杨酸、乙烯等。植物抗病、自噬过程中的PCD往往是依赖水杨酸信号途径的,而衰老过程中发生的PCD往往是依赖乙烯信号途径的[14, 15]。依赖水杨酸信号途径的PCD往往可以通过阻断水杨酸信号传递的关键转录因子NPR1而得到缓解[14, 15]。
本文以exocyst亚基SEC 8 基因表达下调突变体PRsec8m1为材料,初步研究了该突变体主根发育过程。我们发现PRsec8m1突变体会导致主根细胞PCD,说明植物细胞PCD可能与囊泡拴系有关。本研究对于进一步了解exocyst复合体在主根发育中的功能及其与PCD相关的分子机制具有较为重要的意义。
1 材料与方法 1.1 试验材料拟南芥野生型Col-0以及突变体sec 8m1/+、exo70a1-1/+和npr1-1 种子均购自拟南芥生物资源中心 (Arabidopsis Biological Resource Center,ABRC)。PRsec 8m1突变体由本试验室在sec8m1 /+基础上自行构建。
1.2 拟南芥种植和培养拟南芥种子播种在MS固体培养基上,4 ℃同步化2~3 d,置于温室(温度22~23 ℃,光周期为光照16 h,黑暗8 h)中使种子萌发,种子萌发后7~8 d移植到营养土中,同样条件培养。
1.3 PCR和Real-time PCRSDS法提取野生型、sec 8m1/+和PRsec8m1 突变体基因组DNA,利用不同引物(表 1)进行PCR试验,以TUA 2 基因为内参。
| 引物名称Primers | 用途Applications | 引物序列Sequences |
| P1 | SEC8基因基因组DNA和cDNA鉴定Identify genomic DNA and cDNA of SEC8 gene | 5′-TATACAATAGAGGTGAATACAG-3′ |
| P2 | SEC8基因基因组DNA和cDNA鉴定Identify genomic DNA and cDNA of SEC8 gene | 5′-CAAGCATGCAGAGACACTGAAC-3′ |
| LBa1 | sec8m1 T-DNA插入鉴定Identify T-DNA insertion of sec8m1 mutation | 5′-TGGTTCACGTAGTGGGCCATCG-3′ |
| LAT52P1 | P LAT52::SEC8 cDNA转基因鉴定Identify P LAT52::SEC8 cDNA transgene | 5′-GCATGCCTGCAGGTCGAC-3′ |
| LAT52P2 | P LAT52::SEC8 cDNA转基因鉴定Identify P LAT52::SEC8 cDNA transgene | 5′-GATCCTCTAGACTCCATGG-3′ |
| TUA2P1 | 扩增 TUA2基因 Amplify TUA2 gene | 5′-ATGAGAGAGTGCATTTCG-3′ |
| TUA2P2 | 扩增 TUA2基因 Amplify TUA2 gene | 5′-TGTTCCAAGAGTGAGTGAG-3′ |
利用TaKaRa RNAiso Plus(Cat# 9109)试剂提取野生型、PRsec 8m1 幼苗RNA,利用TaKaRa反转录试剂盒(Cat# RR047A)进行反转录,利用实时定量荧光PCR仪进行Real-time PCR,以TUA 2 基因为内参。
1.4 细胞死亡以及细胞程序性死亡(PCD)检测利用台盼蓝(上海生工生物工程有限公司,Cat# TT11040)染色观察主根细胞是否死亡。台盼蓝用水稀释至10 mg • L-1,染色15 min,用PBS缓冲液清洗3次,然后观察照相。
利用活性氧检测试剂盒DHCF-DC(碧云天生物技术研究所,Cat# S0033)检测主根中活性氧积累情 况,检测方法具体如下:试剂盒中DHCF-DC(10 mmol • L-1)按1:1 000稀释于PBS缓冲液中,形成DHCF-DC 染液,将萌发后5 d 幼苗置于1 mL染液中,37 ℃避光孵育20 min,吸掉染液,利用PBS缓冲液清洗样品3次,每次10 min。最后用500 μL PBS缓冲液悬浮样品,利用激光共聚焦显微镜(Zeiss,LSM710)检测幼苗主根荧光,激发波长范围为450~500 nm,发射波长范围为515~565 nm(绿色荧光)。
利用一步法TUNEL细胞凋亡检测试剂盒(碧云天生物技术研究所,Cat# C1086)观察主根细胞死亡是否属于PCD,具体如下:取萌发后5 d幼苗,置于2 mL离心管中,用1 mL PBS缓冲液洗涤样品1次,而后用1 mL 4%多聚甲醛固定样品60 min,再用1 mL PBS缓冲液洗涤1次,加入含0.1% Triton X-100的PBS缓冲液1 mL,冰浴2 min;吸掉缓冲液,加入现配的200 μL TUNEL检测液[V(TDT酶):V(荧光标记液):V(TUNEL试剂)=2:48:50],37 ℃避光孵育60 min。用PBS清洗2次,最后用500 μL PBS缓冲液悬浮样品,利用激光共聚焦显微镜检测幼苗主根荧光,激发波长范围为450~500 nm,发射波长范围为515~565 nm(绿色荧光)。
利用DAPI染色液(碧云天生物技术研究所,Cat# C1005)染色观察主根细胞的细胞核形态。利用激光共聚焦显微镜观察照相。
1.5 统计分析将竖直生长的不同时期(萌发后3、5、7 d)野生型、PRsec 8m1和exo70a1-1 幼苗照相,利用Image J软件测量主根根长(每个时间点,每组样品n>30),数据均重复测定3次以上,取平均值,并计算标准偏差。
2 结果与分析 2.1 PRsec 8m1 突变体的构建Cole等[9]和Hála等[10]的研究表明,sec 8m1 突变破坏了花粉管的极性生长,从而导致雄性不育,因此无法获得sec 8m1纯合体植株。我们利用花粉特异表达的启动子LAT52连接SEC8 cDNA,转化sec 8m1/+植株,在转基因植株后代中获得了花粉回补突变体PLAT52::SEC8/PLAT52::SEC8;sec8m1/sec8m1,将其简写为PRsec8m1(Pollen Rescued sec8m1)突变体。在这个突变体中,LAT52启动子只在花粉中特异表达,不在孢子体里表达。转基因SEC8只能弥补花粉中sec8m1的突变,不能弥补孢子体中sec8m1的突变,因此这个突变体应该是孢子体sec8m1纯合突变体。通过提取PRsec8m1 的DNA进行PCR鉴定,发现它确实是sec 8m1纯合体,其中有PLAT52::SEC8 cDNA转基因插入(图 1-A和B)。Real-time PCR显示:在这个突变体中SEC 8 基因的表达显著下调(图 1-C)。因此,PRsec 8m1是一个SEC8 基因下调突变体。
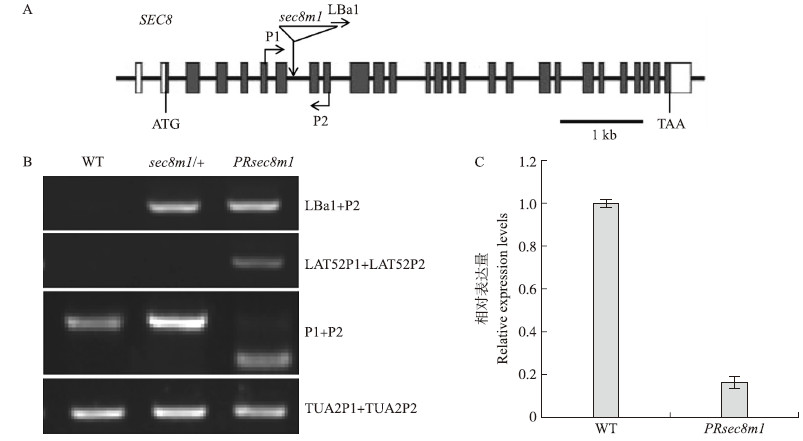 |
图 1 SEC 8基因结构以及PRsec8m1 的鉴定
Fig. 1 SEC 8 gene structure and identification of PRsec 8m1 mutant
A:SEC 8基因结构以及sec8m1 突变位点;B:通过PCR方法对野生型(WT)及sec 8m1/+、PRsec8m1 突变体DNA进行鉴定;C:Real-time PCR表明在PRsec 8m1突变体中,SEC8 基因表达显著下降。 A:SEC 8 gene structure and insertion site of sec 8m1 mutation;B:Genotyping of wild-type,sec 8m1/+,PRsec8m1 by PCR. C:Real-time PCR indicated that SEC 8 gene expression level is down-regulated in PRsec 8m1 mutant. WT:Wild type. |
PRsec 8m1 突变体在幼苗发育阶段表现出明显的发育缺陷,包括子叶尺寸变小、主根变短、主根根毛粗短等(图 2-A)。在萌发5 d后,PRsec 8m1 主根几乎停止生长,显示出较深的黄褐色,主根上根毛很少。而野生型和exo 70a1-1 突变体主根颜色正常(图 2-B)。在萌发后3~7 d,PRsec 8m1 主根增长了296.2%(n>30),而同时期的野生型主根增长了378.5%(n>30),exocyst复合体另一个亚基基因突变体exo 70a1-1 主根增长了430.8%(n>30)(图 2-C)。这些结果说明PRsec 8m1 突变体主根的发育受到严重抑制。
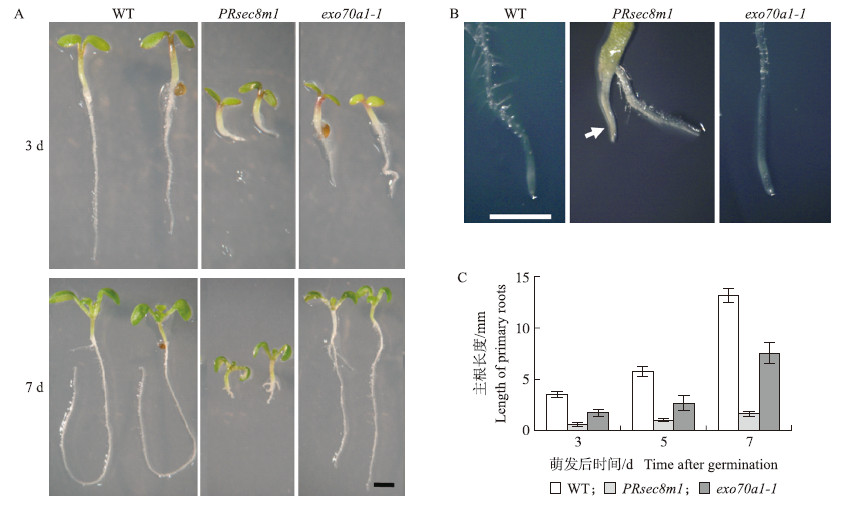 |
图 2 野生型、PRsec 8m1和exo70a1-1 突变体主根生长情况
Fig. 2 Growth of primary roots in wild-type,PRsec 8m1 and exo 70a1-1 mutants
A:野生型(WT)、PRsec 8m1和exo70a1-1 突变体萌发后3和7 d的主根;B:野生型(WT)、PRsec 8m1和exo70a1-1 突变体萌发后5 d的主根;C:野生型(WT)、PRsec 8m1和exo70a1-1 突变体萌发后不同时间的主根长度统计。标尺为1 mm。 A:3 d and 7 d seedling roots after germination of wild-type,PRsec 8m1,exo70a1-1 . B:5 d primary roots after germination of wild-type,PRsec 8m1,exo70a1-1 plants. C:Statistic of primary root length of wild-type,PRsec 8m1,exo70a1-1 seedlings at different time(3,5,7 DAG). Bars are 1 mm. |
PRsec 8m1 突变体主根发育现象暗示主根细胞可能死亡。我们首先通过台盼蓝(Trypan blue)染色来检测主根细胞是否死亡。在萌发后3 d,PRsec 8m1 主根成熟区部分细胞能被染色,萌发后5 d,靠近根尖的细胞也逐渐被染上蓝色,在萌发后7 d,主根几乎全部染上色(图 3-A)。这个现象说明PRsec 8m1主根细胞从成熟区向分生区逐渐死亡。而野生型和exo70a1 突变体的主根一直不能被染上色,说明他们主根细胞没有死亡(图 3-A)。
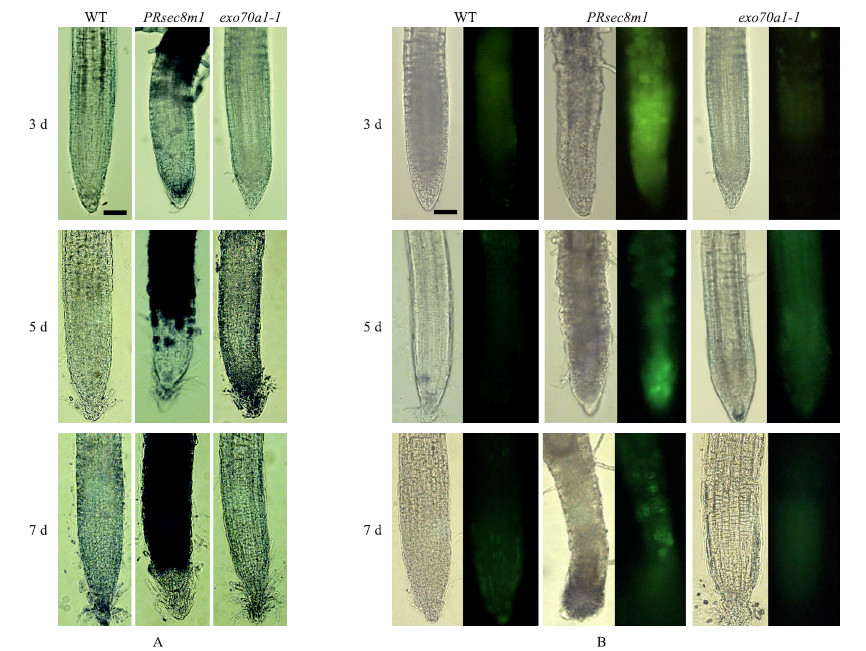 | 图 3 野生型(WT)、PRsec 8m1和exo70a1-1 突变体主根台盼蓝染色(A)和DHCF-DC染色(B) Fig. 3 Primary root in wild-type,PRsec 8m1 and exo 70a1-1 mutants,staining with Trypan blue(A)and DHCF-DC(B) 3、5和7 d分别代表萌发后时间,标尺为50 μm。3,5 and 7 d represent days after germination,Bars are 50 μm. |
PRsec 8m1 突变体主根细胞着色加深的现象有可能是细胞内物质被氧化的结果。我们利用活性氧检测试剂(DHCF-DC)来检测PRsec 8m1 突变体中是否有活性氧含量上升。结果显示:在萌发后3 d的PRsec 8m1 突变体主根成熟区和伸长区,有较强的活性氧信号。在萌发后5 d主根中,分生区有较强的活性氧信号。萌发后7 d,活性氧信号基本检测不到(图 3-B),可能是因为主根细胞已经死亡。在同时期的野生型和exo 70a1-1突变体主根中,只有非常微弱的荧光信号,说明活性氧含量很低。PRsec8m1 突变体主根活性氧升高的部位和2 d后发生细胞死亡的部位相重叠,暗示细胞死亡的现象和活性氧升高密切相关。
2.4 SEC 8 基因突变对主根发生PCD的影响活性氧往往介导动植物细胞PCD过程[16]。PRsec 8m1突变体主根细胞死亡过程中的活性氧积累的现象,暗示PRsec8m1 突变体主根细胞死亡属于PCD。为了进一步确认PRsec 8m1 突变体主根细胞死亡是否属于PCD,我们利用TUNEL试剂盒分别对野生型、PRsec 8m1和exo70a1-1突变体主根进行染色,发现在PRsec8m1 突变体主根中,TUNEL荧光信号显著强于野生型和exo 70a1-1 突变体主根(图 4-A),说明PRsec 8m1 突变体主根TUNEL检测呈阳性。
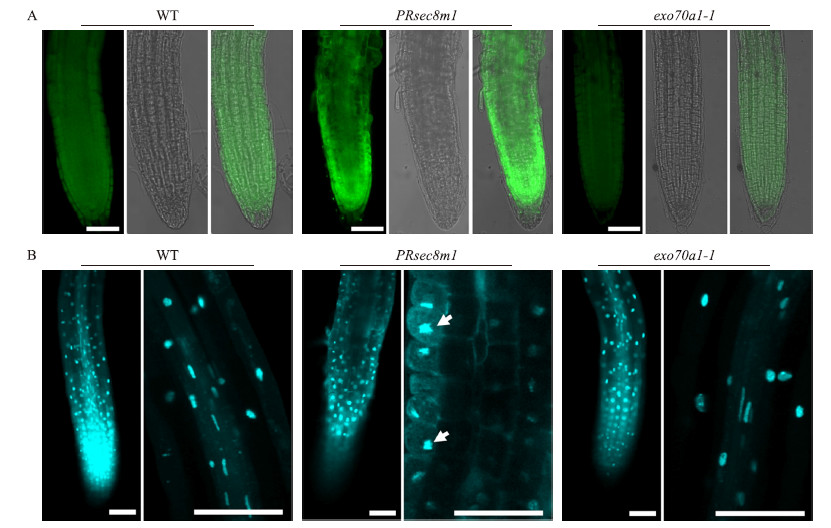 | 图 4 野生型(WT)、PRsec 8m1和exo70a1-1 突变体主根TUNEL检测(A)和DAPI染色(B) Fig. 4 Primary roots of wild-type,PRsec 8m1 and exo 70a1-1 mutants,staining with TUNEL(A)and DAPI(B) 标尺为50 μm。Bars are 50 μm. |
细胞程序性死亡往往伴随细胞核皱缩和染色质片段化的现象,利用DAPI染色观察主根中细胞核的形态,发现在野生型主根和exo 70a1-1伸长区,细胞核呈球状或条状、染色均一、边缘平整。而在PRsec8m1 主根伸长区,细胞核凝集,边缘不整,染色不均一(图 4-B),说明PRsec 8m1主根发生了细胞核皱缩现象。
综上所述,我们判断PRsec8m1 主根中的细胞死亡属于PCD。
2.5 水杨酸信号途径对PRsec 8m1 突变体主根细胞PCD的影响前人的研究表明,部分类型的植物细胞程序性死亡依赖水杨酸信号途径,如在抗病过程中,超敏反应引起的叶片细胞死亡等[14, 15]。另外,在exocyst复合体亚基exo 70b1 突变体中,叶片出现早衰死亡的现象也是依赖水杨酸信号途径的[17]。依赖水杨酸信号途径的PCD现象往往可以通过阻断水杨酸信号途径得到缓解[14, 17]。为了了解在PRsec 8m1 突变体主根中细胞的PCD是否依赖水杨酸信号途径,我们将传递水杨酸信号的关键转录因子NPR 1的突变体npr1-1和 PRsec8m1进行杂交,获得了在npr1-1背景下的 PRsec8m1突变体。发现在npr1-1背景下,PRsec8m1 的主根细胞死亡的现象并没有发生改变(n>30)(图 5-A和B),说明PRsec 8m1 突变体主根细胞死亡可能不依赖于水杨酸信号途径。
 | 图 5 PRsec 8m1突变体和PRsec8m1 npr1-1 双突变体幼苗(A)以及7 d主根台盼蓝染色(B) Fig. 5 Seedlings of PRsec 8m1 mutant and PRsec 8m1 npr1-1 double mutant(A),and Trypan blue staining of 7 days primary roots of wild-type,PRsec 8m1 mutant and PRsec 8-1 npr1-1 double mutant(B) 标尺分别为1 mm(A)和50 μm(B)。Bars are 1 mm in(A)and 50 μm in(B)respectively. |
本文以PRsec 8m1 为材料,初步探讨了exocyst复合体亚基SEC 8 基因在主根发育中的功能,对于了解exocyst复合体的功能以及PCD的分子机制具有积极的意义。
PRsec 8m1 主根细胞死亡过程中的活性氧增加、TUNNEL检测阳性以及细胞核皱缩的表型说明这种细胞死亡现象属于细胞程序性死亡(PCD)。在植物中,细胞程序性死亡往往与抗逆、衰老或某些器官发育有关,由多种因素介导调控,如蛋白水解酶类[14]、植物激素水杨酸、乙烯、小分子活性物质(如活性氧、一氧化氮)以及MAPK信号通路等。已有研究表明拟南芥exocyst复合体亚基SEC8参与细胞极性生长、胞质分离、细胞自噬、PIN1和PIN2蛋白再循环等细胞生物学过程[4, 8, 9, 10]。在这些过程中,目前只有细胞自噬被证实与植物PCD相关,而细胞自噬缺陷导致的PCD往往是依赖于水杨酸信号途径的[18],本文发现阻断水杨酸信号途径不能缓解PRsec 8m1 突变体主根细胞PCD表型。因此,PRsec 8m1 突变体主根PCD现象很可能不是由于细胞自噬缺陷导致,而是由于SEC 8其他的功能缺失而导致。根据酵母和其他植物中的研究结果,我们推测PRsec8m1 主根细胞PCD的原因可能有:1)由于exocyst复合体可能参与某些蛋白分泌到细胞外的过程,sec 8m1 突变会导致一些蛋白积累在主根细胞质中,其中可能包括一些促进细胞衰老死亡的蛋白,如一些类半胱氨酸蛋白水解酶类[19]。这些蛋白的累积可能激活了PCD途径,导致细胞死亡。2)exocyst复合体可能与液泡功能相关。如在莱茵衣藻(Chlamydomonas reinhardtii)中,sec 6 突变导致液泡不能正常形成[20],而液泡在细胞PCD中发挥重要作用[21]。因此SEC 8 基因缺失也可能损害液泡功能而导致细胞程序性死亡。验证上述假设还需要更多试验。
| [1] | Cai H,Reinisch K,Ferro-Novick S. Coats,Tethers,Rabs,and SNAREs work together to mediate the intracellular destination of a transport vesicle[J]. Developmental Cell,2007,12(5):671-682. |
| [2] | He B,Guo W. The exocyst complex in polarized exocytosis[J]. Current Opinion in Cell Biology,2009,21(4):537-542. |
| [3] | Zhang Y,Liu C M,Emons A M,et al. The plant exocyst[J]. Journal of Integrative Plant Biology,2010,52(2):138-146. |
| [4] | Zársky V,Kulich I,Fendrych M,et al. Exocyst complexes multiple functions in plant cells secretory pathways[J]. Current Opinion in Plant Biology,2013,16(6):726-733. |
| [5] | Li S,Chen M,Yu D,et al. EXO70A1-mediated vesicle trafficking is critical for tracheary element development in Arabidopsis[J]. Plant Cell,2013,25(5):1774-1786. |
| [6] | Synek L,Schlager N,Elias M,et al. AtEXO70A1,a member of a family of putative exocyst subunits specifically expanded in land plants,is important for polar growth and plant development[J]. Plant Journal,2006,48(1):54-72. |
| [7] | Cole R A,Mcinally S A,Fowler J E. Developmentally distinct activities of the exocyst enable rapid cell elongation and determine meristem size during primary root growth in Arabidopsis[J]. BMC Plant Biology,2014,14(1):386. |
| [8] | Drdova E J,Synek L,Pecenkova T,et al. The exocyst complex contributes to PIN auxin efflux carrier recycling and polar auxin transport in Arabidopsis[J]. Plant Journal,2013,73(5):709-719. |
| [9] | Cole R A,Synek L,Zarsky V,et al. SEC8,a subunit of the putative Arabidopsis exocyst complex,facilitates pollen germination and competitive pollen tube growth[J]. Plant Physiology,2005,138(4):2005-2018. |
| [10] | Hála M,Cole R,Synek L,et al. An exocyst complex functions in plant cell growth in Arabidopsis and Tobacco[J]. Plant Cell,2008,20(5):1330-1345. |
| [11] | Greenberg J T. Programmed cell death:a way of life for plants[J]. Proc Natl Acad Sci USA,1996,93(22):12094-12097. |
| [12] | Beers E P. Programmed cell death during plant growth and development[J]. Cell Death and Differentiation,1997,4(8):649-661. |
| [13] | Gavriell Y. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J]. Journal of Cell Biology,1992,119(3):493-501. |
| [14] | Hoeberichts F A,Woltering E J. Multiple mediators of plant programmed cell death:Interplay of conserved cell death mechanisms and plant-specific regulators[J]. Bioessays,2003,25(1):47-57. |
| [15] | Delaney T P,Uknes S,Vernooij B,et al. A central role of salicylic acid in plant disease resistance[J]. Science,1994,266(18):1247-1250. |
| [16] | Jabs T. Reactive oxygen intermediates as mediators of programmed cell death in plants and animals[J]. Biochemical Pharmacology,1999,57(3):231-245. |
| [17] | Kulich I,Pe Dč enková T,Sekereš J,et al. Arabidopsis exocyst subcomplex containing subunit EXO70B1 is involved in autophagy-related transport to the vacuole[J]. Traffic,2013,14(11):1155-1165. |
| [18] | Yoshimoto K,Jikumaru Y,Kamiya Y,et al. Autophagy negatively regulates cell death by controlling NPR1-dependent salicylic acid signaling during senescence and the innate immune response in Arabidopsis[J]. Plant Cell,2009,21(9):2914-2927. |
| [19] | Beers E,Woffenden B,Zhao C. Plant proteolytic enzymes:possible roles during programmed cell death[J]. Plant Molecular Biology,2000,44(3):399-415. |
| [20] | Komsic-Buchmann K,Stephan L M,Becker B. The SEC6 protein is required for contractile vacuole function in Chlamydomonas reinhardtii[J]. Journal of Cell Science,2012,125(12):2885-2895. |
| [21] | Hatsugai N,Yamada K,Goto-Yamada S,et al. Vacuolar processing enzyme in plant programmed cell death[J]. Frontiers in Plant Science,2015(6):234. |




