文章信息
- 闫彩虹, 王志强.
- YAN Caihong, WANG Zhiqiang.
- 阿维菌素降解菌的分离鉴定及降解特性研究
- Isolation,identification and biodegradation characteristics of three avermectin-degrading bacteria
- 南京农业大学学报, 2016, 39(01): 127-132
- Journal of Nanjing Agricultural University, 2016, 39(01): 127-132.
- http://dx.doi.org/10.7685/jnau.201503004
-
文章历史
- 收稿日期:2015-03-04
阿维菌素被视为目前最为优良、应用最为广泛的兽用驱虫药与农业杀虫剂,由于其具有脂溶性、体内代谢后大部分以原形排出以及在环境中不易发生降解等特点,而极易在环境中蓄积。化合物在环境体系中的代谢受化合物与土壤的结合能力影响极大。傅强等[1]采用振荡平衡法研究阿维菌素在黑壤、红壤和水稻土中的吸附、解吸特性,结果发现这3种土壤对阿维菌素均表现为很强的吸附特性。模拟农药飘移和流失来评价阿维菌素对土壤环境的作用也证实阿维菌素与土壤颗粒紧密结合,是环境中的不流动农药,其半衰期为20~47 d。因此随着阿维菌素在我国用量的日益增大,环境污染问题必将出现。在处理污染物方法的发展过程中,科研人员已把目光转向新的方向,如固定化微生物技术、生物整治技术、基因工程菌的构建等。微生物降解作用是环境中有机污染物分解与转化的重要途径,利用微生物治理污染是一种行之有效的方法,已显示出良好的应用前景[2, 3, 4]。有关蜡样芽孢杆菌对阿维菌素的降解研究已有报道[5],但是有关枯草芽孢杆菌和黏质沙雷氏菌对阿维菌素降解作用的研究尚未见报道。
本试验从被阿维菌素长期污染的底泥中分离高效降解菌株,为进一步克隆与阿维菌素降解有关的基因和构建降解多种污染物的环保工程菌奠定基础,为污染事故应急处理及污染环境的生物修复提供实践依据。
1 材料与方法 1.1 土壤来源取盐城市某制药厂阿维菌素沉淀池底泥,取回后用自封袋分装,于-20 ℃保存备用。
供试土壤:采自扬州大学试验田0~22 cm表层土,土质为灰潮土。土壤自然风干,去除杂物后过40目筛。加入适量蒸馏水使土壤含水量为田间最大持水量的60%后备用。
1.2 试剂与仪器阿维菌素原料药:浙江升华拜克生物技术有限公司提供,纯度大于95.0%。
普通培养基:营养琼脂粉3.3 g,蒸馏水定容至100 mL,加热溶解并经高压灭菌后铺板。富集培养基:普通灭菌培养基中加入阿维菌素母液,配成不同浓度,再制成不同浓度梯度琼脂平板。无机盐培养基:0.5 g K2HPO4、0.5 g NaH2PO4、2.0 g (NH4)2SO4,超纯水定容至1 L,1 mol·L-1 NaOH调pH值至7.0~7.4。筛选培养基:灭菌无机盐培养基中加入阿维菌素母液,配成不同浓度。
高效液相色谱仪(配LC-10ATVP泵、SPD-10ATVP紫外检测器),日本岛津公司产品;ODS-2HYPERSIL(250 mm×4.6 mm,5 μm)不锈钢色谱柱,菲罗门科技产品。
1.3 阿维菌素浓度的测定无机盐培养基中阿维菌素的提取:取无机盐培养基2 mL,加入4 mL乙腈溶液,再加入0.5 g NaCl,涡旋混合90 s,静置30 min,取上层液体经0.45 μm微孔滤膜过滤后待测。
土壤中阿维菌素的提取:取含不同浓度阿维菌素的土壤样品1 g,加入1 mL超纯水,再加入2 mL乙腈,涡旋混合3 min,5 000 r·min-1离心10 min。吸取全部上清液经0.45 μm微孔滤膜过滤,滤液装于5 mL离心管中,再加入0.25 g NaCl,涡旋混合90 s,静置30 min,取上清液待测。
高效液相色谱分析条件:流动相为甲醇和超纯水,体积比92∶8,流速1 mL·min-1,检测波长250 nm,柱温30 ℃,进样量20 μL。
1.4 菌株的筛选与分离纯化菌株的初步筛选与分离纯化:取一定量底泥样品于灭菌三角瓶中,加入灭菌生理盐水少许,振荡悬浮5 min,自然沉淀1 h。吸取沉淀后的土壤上清液涂布于阿维菌素浓度梯度琼脂平板上,37 ℃培养24 h。挑取不同种类的单个菌落进行反复的划线培养,直至纯种。
菌株的驯化:将已筛出的纯种细菌接种到含有5 mg·L-1阿维菌素的100 mL筛选培养基中,37 ℃、110 r·min-1振荡培养7 d后涂板。挑取生长良好的细菌进行下一个周期的驯化,共驯化4个周期。4个周期阿维菌素的质量浓度分别为5、25、75和125 mg·L-1。
菌株的复筛:挑选经4个周期驯化后生长良好的细菌做成菌悬液,并接种到一定浓度的阿维菌素筛选培养基中,35 ℃振荡培养8 d,每隔2 d取样,HPLC法检测其中阿维菌素含量。
1.5 菌株的鉴定PCR引物对序列:5′-AGAGTTTGATCCTGGCTCAG-3′/5′-AAGGAGGTGATCCAGCCGCA-3′。
PCR反应体系:超纯水16 μL、10×Buffer 2.5 μL,MgCl2 1.5 μL,dNTP(2.5 mmol·L-1)0.7 μL,上、下游引物(25 pmol·μL-1)各0.5 μL,DNA模板2.3 μL,Taq DNA Polymerase 1 μL。PCR程序:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸2.5 min,30个循环;72 ℃再延伸12 min,4 ℃保存。
PCR产物经电泳,回收,纯化,再与T载体连接,转化后的阳性菌提取质粒进行酶切鉴定,送上海生工生物工程有限公司测序。
1.6 细菌含量测定与降解特性研究采用紫外分光光度仪进行细菌含量测定,测定A600。
将细菌在无机盐培养基中培养8 d,通过研究培养基的初始pH值、温度、装样量、底物浓度、细菌接种量、外加碳、氮源、不同金属离子对细菌的生长和降解特性的影响,从而获得菌株生长和降解阿维菌素的最佳条件。
1.7 土壤模拟降解试验取200 g供试土壤于250 mL三角瓶中,按10、25和50 mg·kg-1的量加入阿维菌素,混匀,每个浓度共设灭菌土添加菌液、灭菌土不加菌液、不灭菌土添加菌液、不灭菌土不加菌液4个处理。将处理好的土壤分别置于智能光照培养箱中25 ℃、光照度6 500 lx、光/暗时间12 h/12 h培养。试验过程中定期补充水分,于0、5、10、20、40和60 d采样,HPLC法测定土壤中阿维菌素浓度。
2 结果与分析 2.1 菌株的分离与鉴定结果对阿维菌素沉淀池底泥中的细菌进行富集培养以及进一步的纯化、驯化,共有10株细菌能利用阿维菌素作为唯一碳源生长。最后通过复筛,挑选出3株对阿维菌素降解速率较高的细菌作为后续研究对象,分别命名为G1、G6和G10。
以基因组DNA为模板进行PCR扩增,成功扩增出3条约1 500 bp的条带。将3株高效降解菌株的16S rDNA序列经GenBank相似性检索,G1与枯草芽孢杆菌、G6与黏质沙雷氏杆菌、G10与蜡样芽孢杆菌的同源性均在99%以上。故在分子系统发育分类学上,G1属于枯草芽孢杆菌,G6属于黏质沙雷氏杆菌,G10属于蜡样芽孢杆菌。
2.2 细菌的降解特性 2.2.1 初始pH值pH值影响菌株的稳定性及其降解酶的活性。如图1-A所示:3株细菌均在pH6.0时保持较高的降解活性,对阿维菌素8 d的降解率分别为18.98%、19.67%和21.33%。
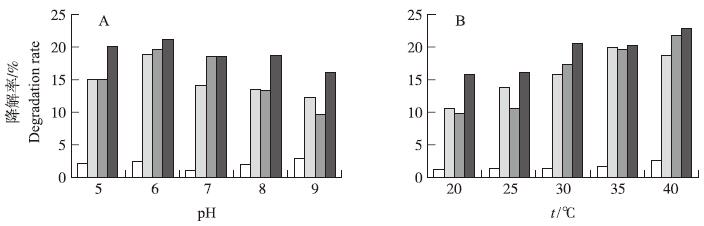 | 图 1 pH值(A)和温度(B)对细菌降解阿维菌素的影响 Fig. 1 Effect of pH values(A)and temperature(B)on degradation of avermectin by bacteria 枯草芽孢杆菌Bacillus subtilis; G6:黏质沙雷氏杆菌Bacillus prodigiosus; G10:蜡样芽孢杆菌Bacillus cereus |
从图1-B可知:在一定范围内随着温度的增加,菌株对阿维菌素的降解速率也随之加快。G1在20~35 ℃对阿维菌素的降解速率随温度的升高而明显增加,8 d内的降解率由10.56%增至19.99%,而后稍有下降;G6和G10在20~40 ℃降解率均随温度的升高而增加,8 d内的降解率分别由9.81%增至21.71%,由15.87%增至22.9%,这可能是由于随着环境温度逐渐接近于微生物生长的最适温度,微生物酶活性大大提高,使阿维菌素的降解速率加快。因此,G1、G6和G10的最适温度分别为35、40和40 ℃。
2.2.3 装样量本试验采用250 mL三角瓶中不同的装液量来改变瓶中的空气量,以此检测不同通气量对细菌降解阿维菌素的影响。由图2-A可以看出:G1在装样量为80 mL时降解率最高,可达19.67%;G6装样量为60 mL时生长最快,降解率最高为19.54%;G10装样量为120 mL时生长最快,降解率最高为21.43%。说明不同的细菌对氧气有不同的需求量,G1、G6和G10的最适装样量分别为80、60和120 mL。
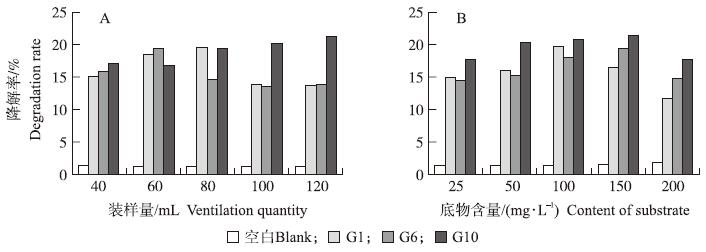 | 图 2 装样量(A)和底物含量(B)对细菌降解阿维菌素的影响 Fig. 2 Effect of ventilation quantity(A)and content of substrate(B)on degradation of avermectin by bacteria |
由图2-B可以看出:在一定范围内,阿维菌素浓度升高有利于阿维菌素的降解。G1、G6和G10分别在底物质量浓度为100、150和150 mg·L-1时降解率达到最高,分别为19.77%、19.43%和21.49%。但当阿维菌素浓度超过微生物的忍受极限时,其活动将受到明显抑制,降解速率又趋于下降。因此G1、G6和G10的最适降解底物浓度分别为100、150和150 mg·L-1。
2.2.5 细菌接种量由图3-A可以看出:G6对阿维菌素的降解率并未随其接种量的增加而增大,反而在最低接种量时阿维菌素的降解率最高;G1和G10在低菌量时阿维菌素降解率随接种量增加而增大,当接种量为0.1%时降解率达到最高,之后降解率便有所下降而后趋于平缓。因此,G1、G6和G10的最佳接种量分别为0.1%、0.05%和0.1%。
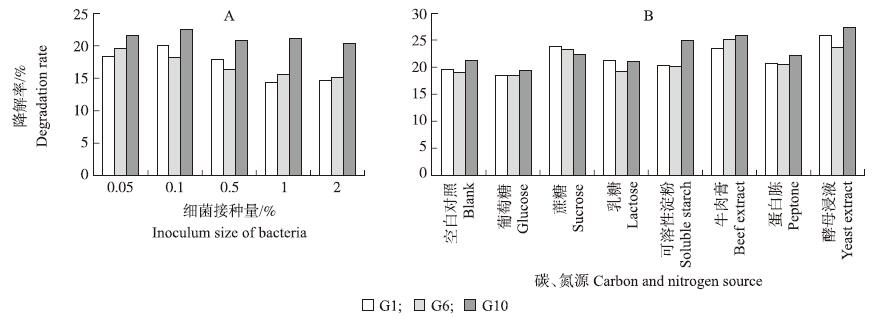 | 图 3 细菌接种量(A)和不同碳、氮源(B)对细菌降解阿维菌素的影响 Fig. 3 Effect of the inoculum size(A)and adding carbon and nitrogen(B)on degradation of avermectin by bacteria |
由图3-B可以看出:外加碳、氮源对细菌降解阿维菌素稍有影响。不同菌种有不同适合自身利用的碳、氮源,当加入少量适合菌种利用的碳、氮源时,能够促进菌株增长和促进菌株产生药物降解酶,从而提高细菌对药物的降解率。G1、G6和G10的最适碳、氮源分别为蔗糖和酵母浸液、蔗糖和牛肉膏、淀粉和酵母浸液。
2.2.7 金属离子由图4可以看出:在无机盐培养基中添加K+、Mn2+、Ba2+和Zn2+对菌株降解阿维菌素的影响不大;而重金属离子Pb2+、Cr3+和Co2+对菌株降解阿维菌素有一定的抑制作用;Fe3+和Cu2+可显著提高阿维菌素的降解速率,其中以Cu2+最为明显。培养基中分别添加Fe3+和Cu2+后,G1、G6和G10对阿维菌素8 d内的降解率分别达到55.25%、73.15%、54.5%和70.79%、54.01%、72.19%,是其未添加组降解率的3~4倍。
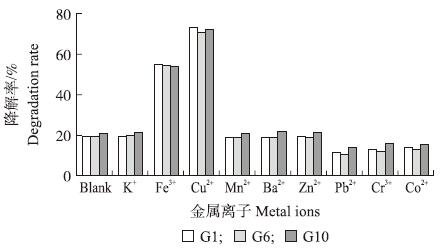 | 图 4 添加金属离子对细菌降解阿维菌素的影响 Fig. 4 Effect of adding metal ions on degradation of avermectin by bacteria |
由图5可以看出:各阿维菌素浓度组未添加降解菌时,未灭菌土壤组阿维菌素的降解率随时间延长而增加,到第60天时,10、25和50 mg·kg-1组细菌降解率分别达到78.42%、79.73%和49.69%;而灭菌土壤组的阿维菌素降解率增长缓慢,60 d时的降解率均低于20%。可见在阿维菌素土壤降解过程中,生物降解起到了主要作用。另外,高浓度土壤比低、中浓度土壤中阿维菌素的降解速率减慢,因此要尽量避免土壤中有高浓度的药物残留。
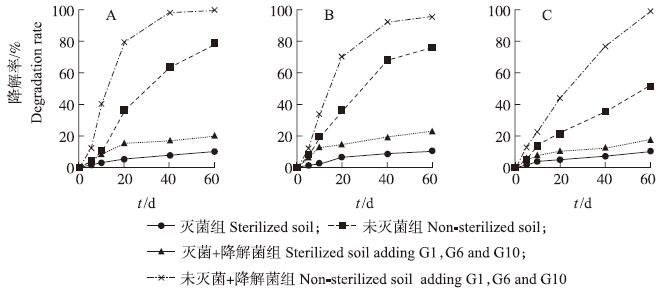 | 图 5 10(A)、25(B)和50(C)mg·kg-1阿维菌素土壤灭菌和未灭菌组降解率的比较 Fig. 5 Comparison of degradation of Avermectin in the 10(A),25(B)and 50(C)mg·kg-1 sterilized and non-sterilized soil |
添加高效降解菌后,未灭菌组各浓度土壤中阿维菌素的降解速率显著提高,到第60天时,10、25和50 mg·kg-1组细菌降解率分别达到100%、100%和95.4%,但灭菌组阿维菌素的降解速率仅稍有提高。可能是由于土壤经过高压灭菌处理后,破坏了土壤中的有机质,土壤有机质含量高,土壤中的微生物才能繁殖快、数量多、活性强。陈莉等[6]证实土壤中有机质含量越高,药物降解速度越快。
3 讨论目前,国内已报道的可降解阿维菌素的微生物主要有嗜麦芽寡养单胞菌[7]、伯克霍尔德氏菌属[3]、蜡样芽孢杆菌[5]及苍白杆菌属[8]等。本试验筛选出3株细菌,经初步验证分别为枯草芽孢杆菌、黏质沙雷氏菌和蜡样芽孢杆菌。经试验证实,均能降解阿维菌素。据文献报道,蜡样芽孢杆菌对其余农药也具有降解能力。高强等[9]从湖北仙桃农药厂附近长期受农药污染的土壤中分离出1株甲基对硫磷降解菌,经16S rDNA鉴定,此细菌为蜡样芽孢杆菌。沙雷氏菌对农药的降解作用在国外也早有报道。Grant等[10, 11, 12]从使用拟除虫菊酯的菜园土壤和农田土壤的混和土样中分离出2株拟除虫菊酯降解菌,经显微镜、生物化学和遗传技术手段分析鉴定,分别属假单胞菌属和沙雷氏菌属。有关枯草芽孢杆菌对农药降解作用的报道较少,但是有文献报道枯草芽孢杆菌对石油具有较强的降解能力。杨雪莲等[]从石油污染土壤中分离出2株高效石油降解菌,经鉴定分别为枯草芽孢杆菌和地衣芽孢杆菌。由此看出本试验筛选出的这3株细菌在降解阿维菌素等土壤修复方面具有一定的应用潜力。
本试验针对这3株细菌的降解特性研究了环境因素对降解效果的影响。培养基的初始pH值、温度、装样量、底物含量、细菌接种量、外加碳、氮源、金属离子对细菌的生长和降解特性均有不同程度的影响,其中影响最大的为金属离子Fe3+和Cu2+,以Cu2+最为明显,可使细菌对阿维菌素的降解率提高3倍左右。李玉华[5]研究了7种金属离子对蜡样芽孢杆菌降解阿维菌素的影响,也发现添加0.1%的Cu2+可显著提高菌株对阿维菌素的降解率。由于室外影响降解活性的因子很多,故对添加适量Cu2+能否在土壤修复中加快高效降解菌对阿维菌素的降解还有待于进一步研究。
土壤模拟降解试验表明:在低、中、高浓度阿维菌素土壤中添加高效降解菌后,阿维菌素的降解速率显著加快。第60天时低、中浓度组已检测不出阿维菌素,而高浓度组阿维菌素的降解率也达到了95%以上,比未添加降解菌组阿维菌素的降解时间缩短了50%左右。因此,本试验所得3株菌株在田间土壤修复中应有很好的应用前景。
| [1] | 傅强,杨仁斌,柳王荣,等. 阿维菌素在土壤中的吸附及在水土中的迁移释放特性[J]. 农业环境科学学报,2012,31(12):2402-2406. Fu Q,Yang R B,Liu W R,et al. The research on the absorption,transportation and release mechanisms of avermectin in water and soil[J]. Journal of Agro-Environment Science,2012,31(12):2402-2406(in Chinese with English abstract). |
| [2] | Courteix A,Bergel A. Horseradish peroxidase-catalyzed hydroxylation of phenol:Ⅰ. Thermodynamic analysis[J]. Enzyme and Microbial Technology,1995,17:1087-1093. |
| [3] | 李荣,管晓进,陈荣宗,等. 阿维菌素降解菌株AW70的分离鉴定及降解特性研究[J]. 土壤,2009,41(4):607-611. Li R,Guan X J,Chen R Z,et al. Screening and identification of degradation bacteria AW70 of Avermectin and its study of degradation characte-ristics[J]. Soils,2009,41(4):607-611(in Chinese with English abstract). |
| [4] | Mulbry W,Kearney P C. Degradation of pesticides by micro-organisms and the potential for genetic manipulation[J]. Crop Protection,1991,10:334-346. |
| [5] | 李玉华. 阿维菌素降解菌株的筛选及其降解性能研究[D]. 扬州:扬州大学,2010. Li Y H. Screening and identification of degradation bacteria of avermectin and its study of degradation characteristics[D]. Yangzhou:Yangzhou University,2010(in Chinese with English abstract). |
| [6] | 陈莉,章钢娅,胡锋. 氰戊菊酯在土壤中的降解及其影响因子研究[J]. 土壤学报,2008,45(1):90-97. Chen L,Zhang G Y,Hu F. Degradation dynamics of Fenvalerate and its influencing factors in soil[J]. Acta Pedologica Sinica,2008,45(1):90-97(in Chinese with English abstract). |
| [7] | 张卫,虞云龙,吴加伦,等. 阿维菌素高效降解菌的筛选及其降解特性[J]. 上海交通大学学报(农业科学版),2004,22(2):157-161. Zhang W,Yu Y L,Wu J L,et al. Screening and identification of degradation bacteria of Avermectin and its study of degradation characteristics[J]. Journal of Shanghai Jiaotong University(Agricultural Science Edition),2004,22(2):157-161(in Chinese with English abstract). |
| [8] | 胡秀虹,黄剑. 阿维菌素降解菌AW1-12的筛选与分类鉴定[J]. 西南农业学报,2013,26(2):583-586. Hu X H,Huang J. Screening and identification of avermectin-degrading bacterium strain AW1-12[J]. Southwest China Journal of Agricultural Sciences,2013,26(2):583-586(in Chinese with English abstract). |
| [9] | 高强,邓灵福,郑永良,等. 甲基对硫磷降解菌的分离鉴定及降解特性研究[J]. 安全与环境学报,2007,7(3):22-24. Gao Q,Deng L F,Zheng Y L,et al. Study on isolating and characterizing HS-MP12:a strain capable of degrading methyl parathion[J]. Journal of Safety and Environment,2007,7(3):22-24(in Chinese with English abstract). |
| [10] | Grant R J,Daniell T J,Betts W B. Isolation and identification of synthetic pyrethroid-degrading bacteria[J]. Journal of Applied Microbiology,2002,92(3):534 -540. |
| [11] | Grant R J,Betts W B. Biodegradation of the synthetic pyrethroid cypermethrin in used sheep dip[J]. Letters in Applied Microbiology,2003,36(3):173-176. |
| [12] | Grant R J,Betts W B. Mineral and carbon usage of two synthetic pyrethroid degrading bacterial isolates[J]. Journal of Applied Microbiology,2004,97(3):656-662. |
| [13] | 杨雪莲,李凤梅,刘婉婷,等. 高效石油降解菌的筛选及其降解特性[J]. 农业环境科学学报,2008,27(1):0230-0233. Yang X L,Li F M,Liu W T,et al. Isolation of petroleum-degrading strains and their degrading characteristics[J]. Journal of Agro-Environment Science,2008,27(1):0230-0233(in Chinese with English abstract). |




