文章信息
- 段亚冰, 效雪梅, 杨莹, 曹君红, 施一渊, 张晓柯, 王勇, 王建新, 周明国.
- DUAN Yabing, XIAO Xuemei, YANG Ying, CAO Junhong, SHI Yiyuan, ZHANG Xiaoke, WANG Yong, WANG Jianxin, ZHOU Mingguo.
- 一种基于LAMP技术快速检测小麦赤霉病菌对多菌灵抗药性方法的建立及应用
- Establishment and application of a loop-mediated isothermal amplification method for detection of carbendazim-resistant mutants in Fusarium graminearum
- 南京农业大学学报, 2016, 39(01): 97-105
- Journal of Nanjing Agricultural University, 2016, 39(01): 97-105.
- http://dx.doi.org/10.7685/jnau.201506027
-
文章历史
- 收稿日期:2015-06-24
由禾谷镰孢菌(Fusarium graminearum)引起的小麦赤霉病是一种分布广、破坏性强的世界性病害,在小麦的整个生长阶段均可发生,可引起种腐、苗腐、茎腐、秆腐和穗腐,其中以穗腐的危害和损失最大[1, 2, 3, 4, 5]。该病菌能在感病的麦粒中产生多种真菌毒素,严重威胁着人和动物的健康[6, 7, 8, 9]。多年来,小麦赤霉病主要依靠扬花灌浆期喷施苯并咪唑类杀菌剂或以这类药剂为主的复配剂来进行化学防治。但随着使用年限和频率的增加,田间逐渐产生了抗药性群体,从而导致该类药剂防效下降。经过多年的研究,南京农业大学周明国教授研究小组发现小麦赤霉病菌对多菌灵的抗药性菌株主要是由禾谷镰孢菌β2微管蛋白基因(FGSG_06611.3)编码的第167位、198位和200位氨基酸密码子发生突变造成的[10, 11, 12, 13, 14, 15]。第167位或者200位氨基酸密码子突变可引起禾谷镰孢菌对多菌灵中等抗药性的产生,第198位氨基酸密码子突变可引起禾谷镰孢菌对多菌灵高等抗药性的产生,其中第167位突变占所有抗药性突变类型总量的95%以上,成为病原菌产生田间抗药性的主要原因[16, 17]。
植物病原菌的抗药性检测能为植物病害抗药性流行预警、抗药性治理提供重要的参考依据。传统的杀菌剂抗性检测或监测的方法主要是通过分离培养病原菌,然后在含药培养基上培养,根据药剂对菌丝生长的抑制作用鉴定是否为抗药性菌株,该方法检测周期较长,从分离到鉴定长达1周,甚至数周,且在病原菌培养过程中存在杂菌污染,给试验结果带来误差;同时,还需投入大量的人力资源,增加检测成本。近年来,随着核酸相关分子检测技术的发展,PCR技术为植物病原菌的抗药性检测提供了快速、灵敏、准确的优势,但是检测需要昂贵的实验仪器及繁琐的电泳过程,且检测时间长,检测成本高昂,不能满足经济高效检测的需求,并且在鉴定过程中还需要接触大量有毒、有害试剂,对实验操作人员存在较大的安全隐患。因此,开发对植物病原菌抗药性检测的新技术已迫在眉睫。环介导等温扩增反应(loop-mediated isothermal amplification,LAMP)是一种新颖的恒温核酸体外扩增技术,具有简便、快速、经济、敏感、特异性强等特点,已经应用于检测病原菌等诸多领域[18, 19, 20, 21, 22]。目前,尚未有LAMP技术在小麦赤霉病菌对多菌灵抗药性检测中应用的报道。本文拟建立一种基于LAMP技术快速检测小麦赤霉病菌对多菌灵抗药性的方法并将其初步应用到实践中,为生产中禾谷镰孢菌对多菌灵抗药性群体发展的动态监测、抗药性小麦赤霉病的流行预测及小麦赤霉病的综合防控提供用药指导。
1 材料与方法 1.1 供试菌株及试剂禾谷镰孢菌2021为野生型菌株,对多菌灵敏感[23];禾谷镰孢菌R9为田间采集到的多菌灵抗性菌株[14],在β2微管蛋白的167位存在点突变(TTT,Phe→TAT,Tyr)。
Bst DNA聚合酶购自New England Biolabs公司;甜菜碱和羟基萘酚蓝(HNB)购自Sigma公司;dNTPs和MgCl2购自TaKaRa公司;DL2000 Marker购自全式金公司。
1.2 引物设计使用在线引物设计软件Primer Explore V4,以禾谷镰孢菌对多菌灵抗性菌株R9的β2微管蛋白基因(GenBank:FJ214663.1)含有167位点突变的序列为模板,设计LAMP引物,从所推荐的38套引物中,通过特异性和灵敏度试验,从中筛选出1套符合要求的LAMP引物。引物由上海生工生物工程有限公司合成,用ddH2O溶解后分装,4 ℃保存备用。
1.3 基因组DNA的快速提取 1.3.1 菌丝基因组DNA的提取采用CTAB法提取供试菌株的DNA。具体方法如下:取少量菌丝,加800 μL 2%十六烷基三甲基溴化铵(CTAB)提取液在球磨仪中研磨2 min,加入等体积的苯酚-氯仿-异戊醇(体积比为25 ∶24 ∶1),颠倒混匀后,12 000 r·min-1离心10 min;取上清液于新离心管中,加入2.5倍体积的无水乙醇,-20 ℃沉淀,12 000 r·min-1离心10 min;弃上清液,沉淀用70%乙醇洗涤2次,风干,加适量无菌蒸馏水溶解沉淀,4 ℃保存备用。该提取方法在1 h内即可提取到菌丝中的DNA。
1.3.2 发病小麦粒中基因组DNA的提取将田间采集的发病的小麦粒用次氯酸钠表面消毒后,浸入无水乙醇中,然后用无菌水冲洗小麦粒,并将小麦粒转移至2 mL的离心管中,加入800 μL 2% CTAB提取液,1个直径为5 mm的不锈钢钢珠,少许石英砂,在球磨仪中振荡研磨4 min后,加入等体积的苯酚-氯仿-异戊醇(体积比为25 ∶24 ∶1),颠倒混匀后,12 000 r·min-1离心5 min;取上清液于新离心管中,加入2.5倍体积的无水乙醇,-20 ℃沉淀,12 000 r·min-1离心5 min;弃上清液,沉淀用70%乙醇洗涤,风干,加适量无菌蒸馏水溶解沉淀,4 ℃保存备用。
1.4 LAMP反应体系的优化将LAMP反应体系设为10 μL,各组分的浓度预设为:Bst DNA聚合酶(8 U·μL-1)0.5 μL、10×Thermo Pol 1 μL、Mg2+(25 mmol·L-1)1.6 μL、dNTP(10 mmol·L-1)1 μL、FIP/BIP(40 μmol·L-1)各0.5 μL、F3/B3(10 μmol·L-1)各0.5 μL、甜菜碱(8 mol·L-1)0.8 μL、HNB(2.5 mmol·L-1)1 μL、DNA模板0.5 μL,无菌超纯水补充至10 μL。LAMP反应参数设为63 ℃,60 min。
LAMP反应结束后,可以通过颜色变化和电泳图谱判定是否为阳性扩增。如果LAMP扩增产物显示天蓝色,这时电泳图谱应为梯状条带,判定待测样品为阳性;如果扩增产物为紫色,这时电泳图谱无条带扩增,判定待测样品为阴性。
1.4.1 Bst DNA聚合酶的优化设反应体系中Bst DNA聚合酶的浓度依次为0.08、0.16、0.24、0.32和0.4 U·μL-1,从而筛选出最适的Bst DNA聚合酶浓度。
1.4.2 dNTP的优化设反应体系中dNTP的浓度依次为0.2、0.4、0.8、1.0和1.2 mmol·L-1,在上述浓度梯度中优化出适宜的dNTP浓度。
1.4.3 甜菜碱的优化设反应体系中甜菜碱的浓度依次为0.2、0.4、0.6、0.8和1.2 mol·L-1,在上述浓度梯度中优化出适宜的甜菜碱浓度。
1.4.4 LAMP引物的优化将反应体系中外引物对F3/B3的浓度依次设为0.1、0.2、0.3、0.4和0.5 μmol·L-1,优化出适宜的F3/B3浓度;将内引物对FIP/BIP的浓度依次设为0.4、0.8、1.2、1.6和2.0 μmol·L-1,优化出适宜的FIP/BIP浓度。
1.4.5 Mg2+的优化反应体系中Mg2+的浓度依次设为1.0、2.0、3.0、4.0和6.0 mmol·L-1,优化出适宜的Mg2+浓度。
1.4.6 羟基萘酚蓝(HNB)的优化HNB作为LAMP反应的显色指示剂,其浓度的高低直接影响到LAMP检测结果。在LAMP反应体系中,将HNB的浓度依次设为50、100、150、200和250 μmol·L-1,优化出适宜的HNB浓度。
1.4.7 LF/LB的优化在LAMP检测体系中加入环引物LF/LB能加速LAMP的扩增速率。本研究在LAMP检测体系中分别加入环引物LF、LB和LF/LB,观察是否加速LAMP反应,能否有效鉴别小麦赤霉病菌对多菌灵敏感、抗性菌株。
1.5 LAMP在检测人工接种小麦赤霉病中的应用随机选取小麦赤霉病菌对多菌灵敏感菌株2021、PH-1、BM402、XY312和抗性菌株R9、nt167、BM411、XY309,在小麦扬花期接种到小麦穗中部一个小穗的颖壳内,约20 d后,取发病部位的任一小麦粒,参照1.3.2节中的提取方法提取基因组DNA,以提取的麦粒基因组DNA作为模板,用上述建立的LAMP方法进行扩增,评价该检测方法的可靠性。
2 结果与分析 2.1 LAMP引物特异性扩增从38套LAMP引物中,仅筛选到1套LAMP引物,敏感菌株2021不能扩增出产物,颜色显示为紫色,琼脂糖凝胶电泳图谱无梯状条带(图 1);抗药性菌株R9(基因型F167Y)有特异性扩增,显示为天蓝色,琼脂糖凝胶电泳图谱呈梯状条带(图 1)。因此,筛选得到的LAMP引物(表 1)能特异性地检测小麦赤霉病菌对多菌灵的抗性基因型F167Y菌株。
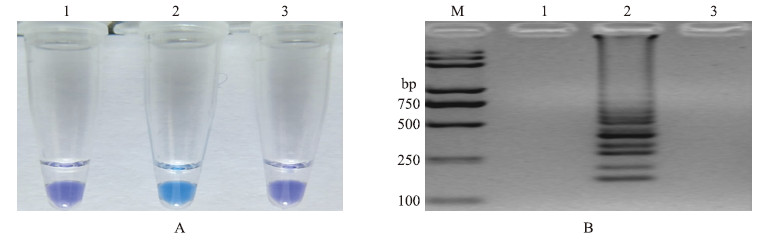 |
图 1 小麦赤霉病菌对多菌灵抗性基因型F167Y菌株的LAMP检测 Fig. 1 LAMP detection of the F167Y mutation genotype of carbendazim resistant mutants in Fusarium graminearum
A:LAMP检测突变基因型F167Y的羟基萘酚蓝(HNB)显色变化图LAMP detection of the F167Y mutation genotype using hydroxynaphthol blue(HNB)as a visual indicator; B:LAMP检测突变基因型F167Y的琼脂糖凝胶电泳图Agarose gel electrophoresis of LAMP products M.DNA marker;1.敏感菌株2021 Carbendazim sensitive strain 2021;2.抗药菌株R9 Carbendazim-resistant mutant R9;3.ddH2O |
| 引物 Primers | 引物序列(5′→3′)Sequence |
| F3 | TTCCAGCTGACGCACTCT |
| B3 | ACAGAAGGTCTCGTCAGAGT |
| FIP | TGCGATCGGGGAACTCCTCG-TGGTACCGGTTCCGGTATG |
| BIP |  AAACCGTTATGCCCTCGCCC-ACGAGCTGGTTCAGAGACAA
AAACCGTTATGCCCTCGCCC-ACGAGCTGGTTCAGAGACAA |
| LF | GGATCTTGGACAGAAGAAGC |
| LB | CGATACCGTTGTTGAACCTTAC |
| 注:方框中的碱基为基因点突变碱基,粗体的碱基为人工错配碱基。Note:Nucleotides in the frame is modified from the wild type,and ones in bold are artificially mismatched. | |
Bst DNA聚合酶是LAMP反应体系中较为昂贵的试剂之一,为了降低检测成本,筛选出最低但能实现LAMP反应的聚合酶浓度,从而筛选出用较低的检测成本就能达到快速检测目的的体系。如图 2所示:Bst DNA聚合酶在优化所用的浓度梯度下均能扩增出条带,但在质量浓度为0.08 U·μL-1时,虽能扩增出梯状条带,但颜色变化并不显著。说明Bst DNA聚合酶的最适质量浓度为0.16 U·μL-1,即在10 μL LAMP检测体系中0.2 μL的Bst DNA聚合酶(8 U·μL-1)是支持反应进行的最少量。
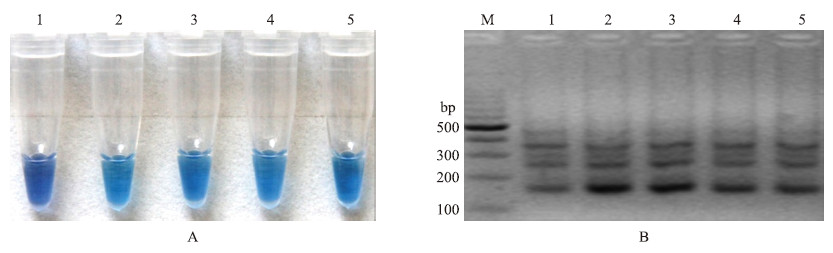 |
图 2 Bst DNA聚合酶浓度的优化 Fig. 2 Optimization of Bst DNA polymerase concentration
A:Bst DNA聚合酶浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:Bst DNA聚合酶浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.0.08 U·μL-1;2.0.16 U·μL-1;3.0.24 U·μL-1;4.0.32 U·μL-1;5.0.40 U·μL-1 |
在进行LAMP反应时,会伴随有大量核酸产生,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物——焦磷酸镁沉淀。LAMP反应体系中Mg2+浓度降低,pH值会发生变化,从而使指示剂HNB的颜色发生相应变化,达到用肉眼就能快速鉴定结果的目的。dNTP浓度过低会降低LAMP的扩增效率,过高会导致LAMP反应体系中pH变化不明显,没有颜色的明显变化而不能达到更好的鉴定效果。因此,对dNTP浓度梯度进行了优化。结果(图 3)表明:dNTP浓度过低时,颜色无变化(图 3-A),LAMP扩增效率较低(图 3-B);随着浓度的升高,扩增效率逐渐增高,颜色变化较为显著,但浓度过高又会抑制LAMP的扩增效率,颜色变化差异也变小。综上所述,LAMP检测体系中dNTP最适浓度为0.8~1.0 mmol·L-1,即在10 μL LAMP检测体系中dNTP(10 mmol·L-1)的使用量为0.8~1.0 μL。
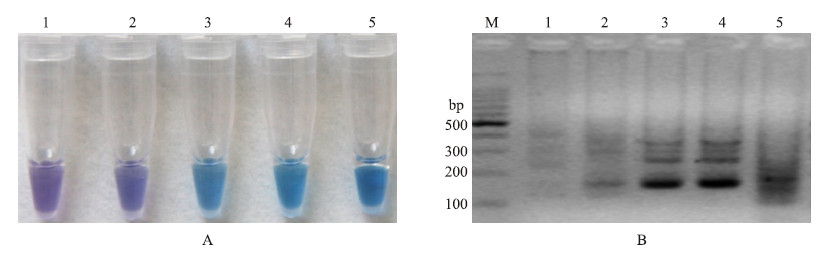 |
图 3 dNTP浓度的优化 Fig. 3 Optimization of dNTP concentration
A:dNTP浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:dNTP浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.0.2 mmol·L-1;2.0.4 mmol·L-1;3.0.8 mmol·L-1;4.1.0 mmol·L-1;5.1.2 mmol·L-1 |
甜菜碱在LAMP体系中不仅对酶的活性具有稳定作用,也能促进DNA双螺旋结构的解链,增加靶序列的特异性,对反应速率也有一定的促进作用;但随着甜菜碱浓度的升高也会造成反应效率的下降。因此,在反应体系中对甜菜碱的浓度进行了优化。从图 4-A可以看出,甜菜碱浓度为0.2、0.4和0.6 mol·L-1时,颜色变化较为显著;从图 4-B梯状条带得出,甜菜碱为0.6 mol·L-1时,LAMP扩增效率最高;因此,LAMP反应体系检测所用甜菜碱的最适浓度为0.6 mol·L-1。
 |
图 4 甜菜碱浓度的优化 Fig. 4 Optimization of betaine concentration
A:甜菜碱浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:甜菜碱浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.0.2 mol·L-1;2.0.4 mol·L-1;3.0.6 mol·L-1;4.0.8 mol·L-1;5.1.2 mol·L-1 |
图 5表明:外引物对F3/B3的浓度对LAMP反应扩增并无影响,在浓度为0.1~0.5 μmol·L-1时,颜色变化及琼脂糖凝胶电泳图谱均能对LAMP反应进行有效鉴定;内引物对的浓度较低时不能进行LAMP扩增,浓度升高会提高LAMP的扩增效率,但浓度过高会导致颜色变化差异不显著,不能进行有效的颜色显示鉴定。因此,外引物适宜浓度为0.1~0.5 μmol·L-1,内引物对最适浓度为1.6 μmol·L-1。
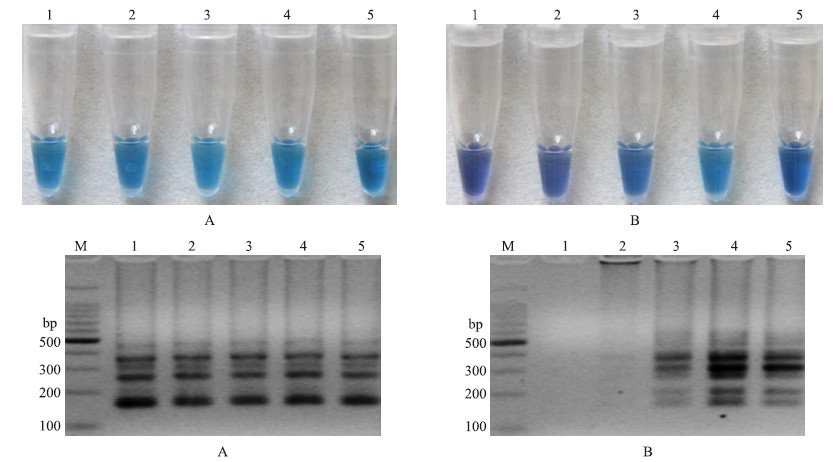 |
图 5 LAMP引物浓度的优化 Fig. 5 Optimization of LAMP primers concentration
A:LAMP引物浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:LAMP引物浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.0.4 μmol·L-1;2.0.8 μmol·L-1;3.1.2 μmol·L-1;4.1.6 μmol·L-1;5.2.0 μmol·L-1 |
LAMP反应会伴随大量终产物焦磷酸镁沉淀的产生,Mg2+浓度会直接影响焦磷酸镁的产生及LAMP反应体系中pH值的变化,从而造成对LAMP的显色反应作出误判,影响试验效果。Mg2+浓度较低时,LAMP不能进行扩增反应;浓度较高会导致扩增效率降低,且颜色变化没有差异(图 6),不能通过颜色变化直接对LAMP反应进行有效鉴定。因此,选择最适的Mg2+浓度为4.0 mmol·L-1。
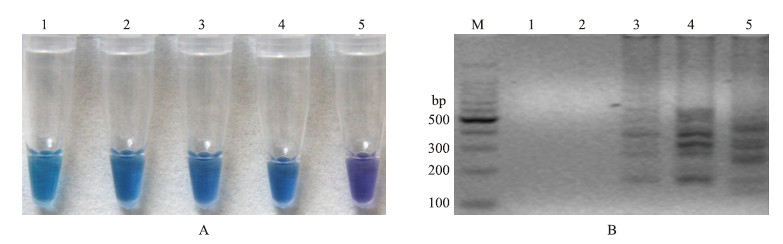 |
图 6 Mg2+浓度的优化 Fig. 6 Optimization of Mg2+ concentration
A:Mg2+浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:Mg2+浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.1.0 mmol·L-1;2.2.0 mmol·L-1;3.3.0 mmol·L-1;4.4.0 mmol·L-1;5.6.0 mmol·L-1 |
不同浓度HNB的LAMP敏感性试验结果(图 7)显示:HNB浓度不影响LAMP的扩增,但颜色变化会随着浓度的升高发生显著变化。当LAMP体系中HNB浓度为150 μmol·L-1时,其颜色变化最为明显,因此,选择LAMP体系中HNB浓度为150 μmol·L-1。
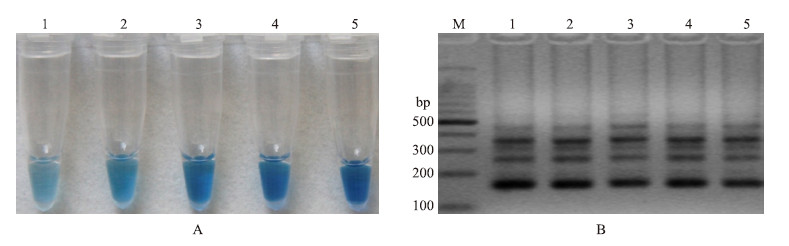 |
图 7 HNB浓度的优化 Fig. 7 Optimization of HNB concentration
A:HNB浓度优化的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:HNB浓度优化的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.50 μmol·L-1;2.100 μmol·L-1;3.150 μmol·L-1;4.200 μmol·L-1;5.250 μmol·L-1 |
环引物在LAMP检测体系中能增加LAMP的扩增速率,故在LAMP反应体系中加入环引物对LF/LB,结果(图 8)显示:LF/LB环引物对任一或者二者共同加入LAMP体系均能加速LAMP反应,但不能有效鉴别小麦赤霉病菌敏感菌株和多菌灵抗性菌株,未能达到有效检测小麦赤霉病菌对多菌灵抗性的目的,因此,在该体系中不选用环引物。
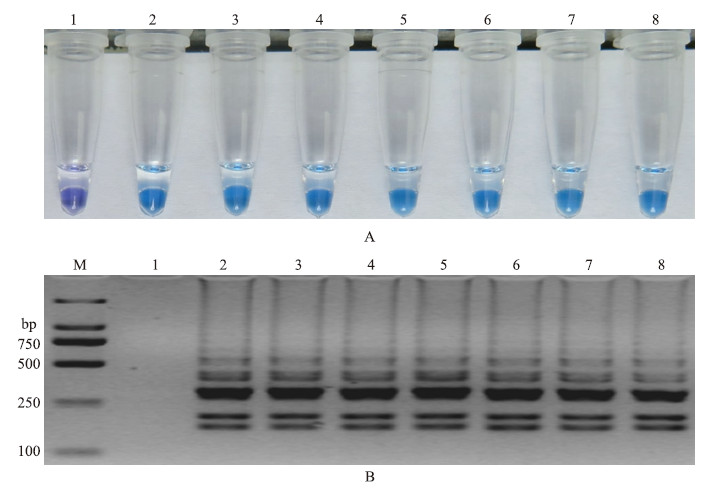 |
图 8 环引物LF/LB对LAMP反应的影响 Fig. 8 Effection of loop primers LF/LB on LAMP
A:LF/LB引物对LAMP反应影响的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; B:LF/LB引物对LAMP反应影响的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1.2021;2.R9;3.2021+LF;4.R9+LF;5.2021+LB;6.R9+LB;7.2021+LF/LB;8.R9+LF/LB |
LAMP扩增体系的特异扩增与靶基因序列、LAMP引物及各组分的浓度配比密切相关,在本研究中,通过对LAMP体系中各组分浓度配比的优化,获得能特异性检测小麦赤霉病菌对多菌灵抗性的最适 LMAP反应体系(10 μL):Bst DNA聚合酶0.16 U·μL-1、dNTP 0.8~1.0 mmol·L-1、甜菜碱0.6 mol·L-1、F3/B3 0.1~0.5 μmol·L-1、FIP/BIP 1.6 μmol·L-1、Mg2+ 4.0 mmol·L-1、HNB 150 μmol·L-1、1×ThermoPol Buffer,补充无菌超纯水至10 μL。
2.10 LAMP在检测人工接种小麦赤霉病中的应用从图 9可以看出:从田间采集到小麦赤霉病菌对多菌灵的敏感、抗性菌株,在小麦扬花期进行人工接种,均能导致小麦穗部的发病,从发病的小麦粒中直接提取基因组DNA,以上述建立的LAMP检测技术进行验证,结果表明敏感菌株均显示紫色,无条带扩增;抗药菌株均显示天蓝色,有条带扩增。这说明该技术在小麦赤霉病菌对多菌灵的抗药性监测中具有广阔的应用前景。
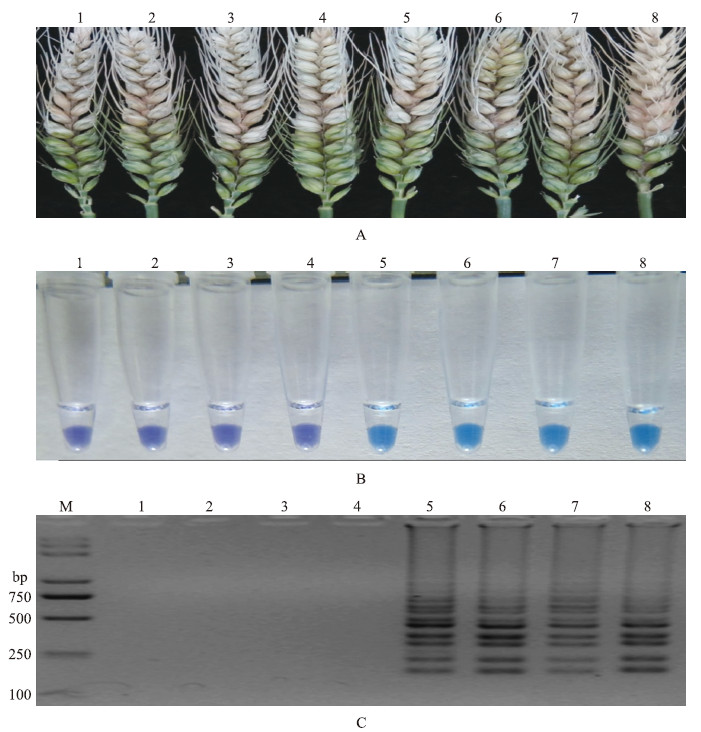 |
图 9 LAMP在检测小麦赤霉病对多菌灵抗性中的应用 Fig. 9 Application of LAMP on detecting carbendazim-resistance mutants of F.graminearum by artificial inoculation
A:人工接种发病的麦穗 Diseased panicles by artificial inoculation; B:人工接种试验的HNB显色变化图 Assessment based on HNB visualization of color change of the LAMP products; C:人工接种试验的琼脂糖凝胶电泳图 Assessment based on gel electrophoresis analysis of the LAMP products M.DNA marker;1-4.Carbendazim-sensitive strains;5-8.Carbendazim-resistant mutants(F167Y) |
自2000年以来,LAMP技术在动物、植物疾病的基因诊断和检测方面得到了广泛应用[18, 19, 20, 21, 22, 24, 25]。近年来,该技术在植物病害的快速诊断及植物病原的鉴定方面已成为植物病理学研究的热点,并取得了一定的研究成果,但在植物病原物抗药性的检测方面至今未有报道。经检索,目前国内外尚未有小麦赤霉病菌对多菌灵抗性的LAMP快速分子检测的相关报道。
病原菌在自然界的数量巨大,抗药性个体在群体中的比例达到3%时,即可引起抗药性病害流行,导致药剂防治失败。因此,开展植物病原菌的抗药性监测,不仅能为植物病害的有效防治提供用药指导,也能为植物病害的抗药性治理提供重要参考数据。
目前已报道的抗药性检测方法存在周期长、操作繁琐、效率低等缺点,已不能满足生产中抗药性检测的需要。小麦赤霉病菌对多菌灵抗药性也存在其他突变基因型。本实验室对小麦赤霉病菌抗多菌灵的监测数据表明,抗性基因型F167Y在抗药性群体中比例高达95%以上。在本试验中,我们开发了小麦赤霉病菌对多菌灵抗性基因型F167的LAMP检测技术。为了评价该检测技术,我们通过人工接种小麦穗部,发病后再进行LAMP检测,结果表明该技术稳定、可靠性强、应用前景广阔。近几年的试验研究证实该技术能对小麦赤霉病菌对多菌灵的抗药性群体进行准确监测,可节省大量的人力、物力投入,同时也为了解我国小麦赤霉病菌的抗药性群体分布规律,为抗药性流行预警、抗药性治理提供丰富的理论数据和参考资料。
| [1] | Bai G,Shaner G. Scab of wheat:prospects for control[J]. Plant Disease,1994,78:760-766. |
| [2] | McMullen M,Jones R,Gallenberg D.Scab of wheat and barley:a re-emerging disease of devastating impact[J]. Plant Disease,1997,81:1340-1348. |
| [3] | Parry D W,Jenkinson P,McLeod L. Fusarium ear blight(scab)in small grain cereals:a review[J]. Plant Pathology,1995,44:207-238. |
| [4] | Goswami R S,Kistler H C. Heading for disaster:Fusarium graminearum on cereal crops[J]. Molecular Plant Pathology,2004,5:515-525. |
| [5] | Xu X M,Parry D W,Nicholson P,et al. Predominance and association of pathogenic fungi causing fusarium ear blight in wheat in four European countries[J]. European Journal of Plant Pathology,2005,112:143-154. |
| [6] | Casale W L,Hart L P. Inhibition of 3H-leucine incorporation by trichothecene mycotoxins in maize and wheat tissue[J]. Phytopathology,1988,78:1673-1677. |
| [7] | Forsyth O M,Yoshizawa T,Morooka N. Emetic and refusal activity of deoxynivalenol to swine[J]. Applied and Environmental Microbiology,1997,34:547-552. |
| [8] | Gilbert J,Abramson D,McCallum S,et al. Comparison of Canadian Fusarium graminearum isolates for aggressiveness,vegetative compatibility,and production of ergosterol and mycotoxins[J]. Mycopathologia,2001,153:209-215. |
| [9] | Snijders C H A. Fusarium head blight and mycotoxin contamination of wheat,a review[J]. Netherlandish Journal of Plant Pathology,1990,96:187-198. |
| [10] | 陆悦健,周明国,叶钟音. 抗苯并咪唑的小麦赤霉病菌β-tubulin基因序列分析与特性研究[J]. 植物病理学报,2000,30(1):30-34. Lu Y J,Zhou M G,Ye Z Y. Cloning and characterizaiton of β-tubulin gene fragment from carbendazim resistance strain of Fusarium graminearum[J]. Acta Phytopathologica Sinica,2000,30(1):30-34(in Chinese with English abstract). |
| [11] | 李红霞,陆悦健,王建新,等. 禾谷镰孢菌β-微管蛋白基因克隆及其与多菌灵抗药性关系的分析[J]. 微生物学报,2003,43(4):424-429. Li H X,Lu Y J,Wang J X,et al. Cloning of β-tubulin gene from Gibberella zeae and analysis its relationshio with carbendazim-resistance[J]. Acta Microbiologica Sinica,2003,43(4):424-429(in Chinese with English abstract). |
| [12] | 陈长军. 禾谷镰孢菌(Fusarium graminearum)对多菌灵抗药性基因的克隆[D]. 南京:南京农业大学,2004. Chen C J. Cloning carbendazim-resistance gene of Fusarium graminearum[D]. Nanjing:Nanjing Agricultural University,2004(in Chinese with English abstract). |
| [13] | Yuan S K,Zhou M G. A major gene for resistance to carbendazim,in field strains of Gibberella zeae[J]. Canadian Journal of Plant Pathology,2005,27:58-63. |
| [14] | Chen C J,Yu J J,Bi C W,et al. Mutations in a beta-tubulin confer resistance of Gibberella zeae to benzimidazole fungicides[J]. Phytopathology,2009,99:1403-1411. |
| [15] | Qiu J B,Xu J Q,Yu J J,et al. Localisation of the benzimidazole fungicide binding site of Gibberella zeae β2-tubulin studied by site-directed mutagenesis[J]. Pest Management Science,2011,67:191-198. |
| [16] | Hou Y P,Luo Q Q,Chen C J,et al. Application of cycleave PCR to the detection of a point mutation(F167Y)in the β2-tubulin gene of Fusarium graminearum[J]. Pest Management Science,2011,67:1124-1128. |
| [17] | Duan Y B,Zhang X K,Ge C Y,et al. Development and application of loop-mediated isothermal amplification for detection of the F167Y mutation of carbendazim-resistant isolates in Fusarium graminearum[J]. Scientific Reports,2014,4:7094. DOI:10.1038/srep07094. |
| [18] | Duan Y B,Ge C Y,Zhang X K,et al. A rapid detection method for the plant pathogen Sclerotinia sclerotiorum based on loop-mediated isothermal amplification(LAMP)[J]. Australasian Plant Patholology,2014,43:61-66. |
| [19] | 沈浩,戴婷婷,吴翠萍,等. 基于环介导等温扩增技术检测大豆北方茎溃疡病菌[J]. 南京农业大学学报,2015,38(2):255-260. DOI:10.7685/j.issn.1000-2030.2015.02.012. Shen H,Dai T T,Wu C P,et al. The tef1α-LAMP method for rapid detection of Diaporthe phaseolorum var.caulivora[J]. Journal of Nanjing Agricultural University,2015,38(2):255-260(in Chinese with English abstract). |
| [20] | 吴旭东,陆辰晨,沈浩,等. 大豆茎褐腐病菌环介导等温扩增检测技术的建立[J]. 南京农业大学学报,2015,38(4):568-574. DOI:10.7685/j.issn.1000-2030.2015.04.006. Wu X D,Lu C C,Shen H,et al. A rapid detection method for the plant pathogen Phialophora gregata f.sp.sojae based on loop-mediated isothermal amplification(LAMP)[J]. Journal of Nanjing Agricultural University,2015,38(4):568-574(in Chinese with English abstract). |
| [21] | 戴婷婷,陆辰晨,沈浩,等. 基于环介导等温扩增技术检测橡树疫霉菌[J]. 南京农业大学学报,2013,36(3):23-28. DOI:10.7685/j.issn.1000-2030.2013.03.005. Dai T T,Lu C C,Shen H,et al. Rapid diagnostic methods for Phytophthora ramorum using LAMP[J]. Journal of Nanjing Agricultural University,2013,36(3):23-28(in Chinese with English abstract). |
| [22] | Duan Y B,Ge C Y,Zhang X K,et al. Development and evaluation of a novel and rapid detection assay for Botrytis cinerea based on loop-mediated isothermal amplification[J]. PLoS ONE,2014,9:e111094. |
| [23] | Liu S M,Duan Y B,Ge C Y,et al. Functional analysis of the β2-tubulin gene of Fusarium graminearum and the β-tubulin gene of Botrytis cinerea by homologous replacement[J]. Pest Management Science,2013,69:582-588. DOI:10.1002/ps.3474. |
| [24] | Niessen L,Vogel R F. Detection of Fusarium graminearum DNA using a loop-mediated isothermal amplification(LAMP)assay[J]. International Journal of Food Microbiology,2010,140:183-191. |
| [25] | Niu J H,Jian H,Guo Q X,et al. Evaluation of loop-mediated isothermal amplification(LAMP)assays based on 5S rDNA-IGS2 regions for detecting Meloidogyne enterolobii[J]. Plant Pathology,2012,61:809-819. |




