文章信息
- 吴颖川, 邹琳, 汪瑾, 张小倩, 卢亚萍.
- WU Yingchuan, ZOU Lin, WANG Jin, ZHANG Xiaoqian, LU Yaping.
- EGCG对铜绿微囊藻的抑制效应及机制研究
- The inhibitory effect and mechanism of EGCG on Microcystis aeruginosa
- 南京农业大学学报, 2016, 39(01): 78-83
- Journal of Nanjing Agricultural University, 2016, 39(01): 78-83.
- http://dx.doi.org/10.7685/jnau.201506007
-
文章历史
- 收稿日期:2015-06-05
工农业以及生活废水大量排入江河和湖泊,造成水体富营养化,有害藻类大量繁殖,导致蓝藻水华频繁发生。微囊藻是我国长江流域湖泊水华蓝藻的优势种,可产生微囊藻毒素,对水环境造成严重污染[1]。为控制有害藻类的生长,我国进行了大量的科研投入。研究显示,植物多酚具有抑菌抑藻的作用[2]。Nakai等[3]研究发现穗花狐尾草的提取物中只有分子质量小于1 000的物质具备抑藻功能。HPLC分析显示,提取物中至少含有4种多酚类物质,分别是蹂花酸、没食子酸、连苯三酚和儿茶素。Nakai等[3]分别对14种植物多酚抑藻效果进行比较研究,结果显示其中有10种植物多酚对铜绿微囊藻产生抑制作用,儿茶素和对苯二酚的EC50值最小。
在前期工作中,我们从常见农作物及茶叶中筛选抑藻材料时,发现茶叶在低浓度时即可对铜绿微囊藻产生持续而高效的抑制效果[4]。茶多酚(tea polyphenols)是茶叶中多酚类物质的总称,在茶叶中的含量一般为20%~35%。它包括黄烷醇类、花色苷类、黄酮类、黄酮醇类和酚酸类等,其中以黄烷醇类物质(儿茶素)最为重要,约占多酚类总量的60%~80%。儿茶素中含量最高的几种组分为EGCG(表没食子儿茶素没食子酸酯,50%~60%)、EGC(表没食子儿茶素,15%~20%)、ECG(表儿茶素没食子酸酯,10%~15%)和EC(表儿茶素,5%~10%)。我们从茶叶中分离得到抑藻活性物质——EGCG和ECG[5]。EGCG是没食子儿茶酚与没食子酸形成的酯,它是绿茶主要的活性和水溶性成分,是儿茶素中含量最高的组分,占绿茶毛质量的9%~13%。EGCG含有多个酚羟基,具有很强的抑藻功能,是一种很有潜力的环保抑藻剂。
本研究从藻细胞生物量、细胞形态、细胞生理生化反应等方面探讨和揭示茶多酚EGCG对铜绿微囊藻抑制的机制及藻细胞对酚胁迫的响应。
1 材料与方法 1.1 材料铜绿微囊藻(Microcystis aeruginosa)PCC7806购自中国科学院武汉水生生物研究所。EGCG(纯度98%)购自南京中标晨曦化学技术有限公司。微囊藻毒素检测试剂盒为美国Beacon公司产品。超氧化物歧化酶(SOD)测定试剂盒购自南京建成生物工程研究所。其他生化试剂为国产分析纯。
1.2 方法 1.2.1 藻的培养、计数及细胞破碎将对数生长期的M.aeruginosa PCC7806转接到新鲜的BG11培养基[6]中,初始浓度为5×105 mL-1。处理组分别加入终质量浓度分别为8、12和16 mg·L-1 EGCG,对照组不加EGCG,对照及处理各3个重复,放入光照培养箱中培养。培养条件为:光/暗培养时间为12 h/12 h,光照强度为40 μmol·m-2·s-1,温度为25 ℃。每2 d取培养液进行显微计数,计算抑制率。
细胞破碎采用超声波法:离心收集后的菌体用无菌水洗涤2次,加入0.01 mol·L-1 Tris-HCl(含0.5% Triton)缓冲液,冰浴超声破碎(超声5 s,间隙5 s,共5 min,重复3次)。离心后,上清液用于酶活性和化学物质含量测定。
1.2.2 EGCG处理对藻细胞光合作用的影响藻细胞光合作用检测采用叶绿素荧光仪(PHYTO-PAM,Becton-Dickinson,USA)。藻液暗适应15 min后测定Fo(暗适应后最小荧光产量),执行饱和脉冲后测定Fm(暗适应后最大荧光产量),根据Fm和Fo可以计算出PS Ⅱ的最大量子产量(Fv/Fm):Fv/Fm=(Fm-Fo)/Fm,它反映了细胞的潜在最大光合能力。然后打开光化光(光照强度为64 μmol·m-2·s-1),在光照下测定F′ o(光下最小荧光产量)、F′ m(光下最大荧光产量)和实时荧光值F,根据F′ m和F可以求出在当前的光照状态下PS Ⅱ的实际量子产量:Y(Ⅱ)=ΔF/F′ m=(F′ m-F)/F′ m,它反映了细胞目前的实际光合效率[7, 8]。根据PS Ⅱ的实际量子产量ΔF/F′ m和光合有效辐射(photosynthetically active radiation,PAR)还可计算出光合最大电子传递速率(ETR):ETR=ΔF/F′ m×PAR×0.84×0.5。
1.2.3 EGCG处理对藻细胞形态的影响将12和16 mg·L-1的EGCG处理2 d后的藻细胞收集,甲醛固定,然后进行电镜制样(由南京农业大学生物学教学实验中心完成)并在透射电子显微镜(transmission electric microscope,TEM)下观测。
1.2.4 EGCG处理下藻细胞丙二醛的含量变化藻细胞丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法:细胞破碎后取上清液150 μL,加入0.5% TBA溶液(溶于20%三氯乙酸)250 μL,沸水浴上反应20 min,冷却后离心。取上清液分别于532、600和450 nm波长下测定吸光值(A)。c(MDA)=6.45(A532-A600)-0.56A450。
1.2.5 EGCG处理下藻细胞内SOD活性的变化SOD活性的测定采用超氧化物歧化酶测定试剂盒,按说明书进行:在酶标板对照孔和对照空白孔中分别加入20 μL双蒸水,在测定孔和测定空白孔中分别加入20 μL待测样本,然后在对照孔和测定孔中分别加入20 μL酶工作液,在对照空白孔和测定空白孔中加入20 μL酶稀释液,最后在所有孔中加入200 μL底物应用液。混匀,37 ℃孵育20 min,根据公式计算样品浓度。SOD抑制率=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%。定义:在反应体系中SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U)。
1.2.6 抗坏血酸(Vc)对EGCG胁迫的缓解作用取对数生长期的新鲜铜绿微囊藻培养液,用BG11培养基稀释到5×105 mL-1。处理组中加入12 mg·L-1 EGCG,再分别加入质量浓度为0、10、20和50 mg·L-1 Vc。分别于处理2 、4 、6 、8 和10 d后用流式细胞仪计数。
1.2.7 EGCG处理对藻细胞藻毒素合成量的影响取对数生长期的新鲜铜绿微囊藻培养液,用BG11培养基稀释到5×105 mL-1。设对照、低浓度处理组(8 mg·L-1)和高浓度处理组(16 mg·L-1),分别处理4 和8 d后取10 mL藻液离心,保存1 mL上清液,并收集藻细胞。用无菌水洗涤藻细胞2次后进行超声波破碎,离心后收集上清液来测定细胞内藻毒素含量。藻毒素含量测定采用微囊藻毒素检测试剂盒,按以下步骤进行:加50 μL酶标记物到微孔板中,然后加入阴性对照,各浓度标准品,稀释好的胞内、外溶液,再加入50 μL抗体后孵育30 min。倒掉孵育液,用清洗液洗涤5次后加入100 μL底物,再孵育30 min后终止反应。测定各孔内450 nm处的吸光值。用标准品作标准曲线,然后计算样品浓度。
1.3 数据处理试验数据为3次重复平均值,表示为平均数±标准误(SE)。采用t测验比较组间差异。
2 结果与分析 2.1 EGCG处理下铜绿微囊藻生长及光合作用效率的变化处理组微囊藻的生长与对照相比受到抑制(图 1-A)。8 mg·L-1 EGCG胁迫下,藻细胞的生长抑制率为40%左右,12 mg·L-1 EGCG对藻的抑制率达到80%以上(图 1-B),而在16 mg·L-1 EGCG中藻基本不能生长,很快黄化死亡。
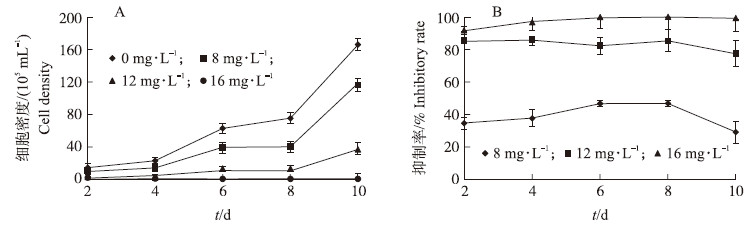 | 图 1 不同质量浓度表没食子儿茶素没食子酸酯(EGCG)处理下铜绿微囊藻 PCC7806生长曲线(A)及抑制率(B) Fig. 1 Growth curves of M.aeruginosa PCC7806(A)and the inhibitory rate(B) under different concentrations of epigalloctechin-3-gallate(EGCG) |
8 mg·L-1 EGCG对藻细胞的光合作用效率没有显著影响(P>0.05),12 mg·L-1 EGCG抑制藻细胞的光合作用,抑制率为20%(4 d),16 mg·L-1 EGCG对藻细胞的光合作用影响非常显著(P < 0.01),光合作用效率仅为对照的40%左右(图 2-A)。
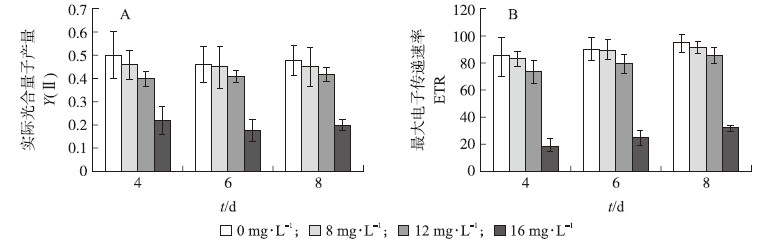 | 图 2 不同质量浓度EGCG处理下M.aeruginosa PCC7806的Y(Ⅱ)值(A)及最大电子传递速率(B) Fig. 2 The value of Y(Ⅱ)(A)and ETR(B)of M.aeruginosa PCC7806 under different concentrations of EGCG |
与对照相比,8 mg·L-1 EGCG对藻细胞最大电子传递速率的影响不显著(P>0.05)。中、高浓度的EGCG对藻细胞最大电子传递速率存在明显影响(图 2-B):处理4 d时,12 mg·L-1 EGCG处理下最大电子传递速率为对照的85%,16 mg·L-1 EGCG处理下最大电子传递速率为对照的23%。由此可以看出,高浓度EGCG对藻细胞的光合作用产生较大的破坏作用,从而起到抑藻的功效。
2.2 EGCG处理对藻细胞形态的影响由于细胞处于对数生长前期,对照中几乎所有的细胞都饱满圆润,结构完整,能清晰地看到细胞内的类囊体结构(图 3-A)。在12 mg·L-1 EGCG胁迫下的藻细胞,出现了细胞形态特征的变化(图 3-B):类囊体结构变得松散、断裂。高浓度EGCG胁迫下的藻细胞结构遭到很大程度的破坏:细胞壁、细胞膜破损皱缩,类囊体结构严重断裂、破损,已经不再具有完整的细胞结构(图 3-C)。这些破损的细胞不再具有生长和繁殖能力,或者说细胞已经死亡,进一步的培养也不会有子细胞的出现,培养液中的生物量维持在很低的程度,这与细胞计数的结果相吻合。
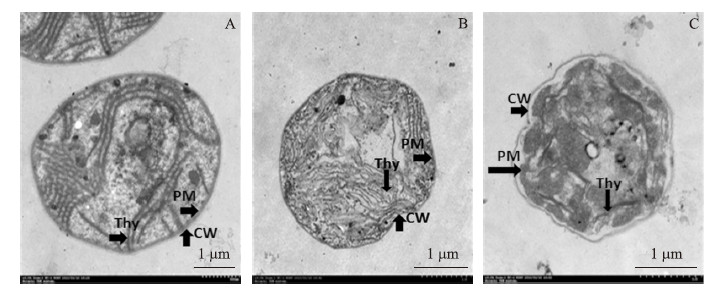 |
图 3 不同浓度EGCG处理下M.aeruginosa PCC7806透射电子显微镜图 Fig. 3 TEM images of M.aeruginosa PCC7806 under different concentrations of EGCG
A.对照 Control cells;B. 12 mg·L-1 EGCG 处理 Treated with 12 mg·L-1 EGCG;C. 16 mg·L-1 EGCG处理 Treated with 16 mg·L-1 EGCG CW:细胞壁 Cell wall;PM:细胞膜 Plasma membrane;Thy:类囊体 Thylakoids |
植物多酚在偏碱性条件下具有自氧化特性,会发生自氧化而生成自由基,研究发现在二价或三价离子如Mg2+存在下多酚会生成半醌。由于自由基的强氧化作用,可引起藻细胞内的抗氧化反应。当胁迫程度超过细胞耐受极限时,细胞会裂解或死亡。氧化胁迫还会引起藻细胞膜过氧化程度加剧,过氧化反应会产生大量的丙二醛(MDA)和新的氧自由基等[9]。
2.3.1 EGCG处理下藻细胞MDA含量的变化由图 4可知:随着EGCG浓度的增大,细胞中MDA的含量在不断上升。4 d时,12和16 mg·L-1 EGCG处理下,藻细胞内MDA含量分别为对照的4.4和6.4倍;16 mg·L-1 EGCG处理6 d后,培养液中的藻细胞几乎死亡,已检测不到MDA。MDA具有强交联性,它可使蛋白质、核酸等交联成shchiff碱,使蛋白质分子变性失活[10]。这是EGCG抑制微囊藻细胞生长的一个重要原因。
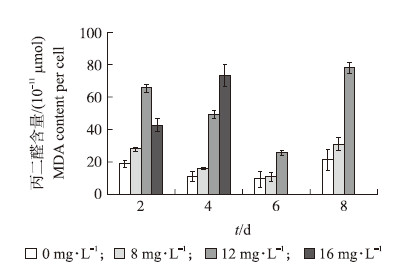 | 图 4 不同质量浓度EGCG处理下细胞内丙二醛含量的变化 Fig. 4 The changes of MDA content under different concentrations of EGCG |
随着EGCG质量浓度的增大,细胞中SOD活性在不断上升(图 5)。在12和16 mg·L-1 EGCG作用下,SOD活性显著大于对照。处理4 d时,16 mg·L-1 EGCG作用下SOD活性为对照的20倍。SOD是生物体内重要的抗氧化酶,当细胞受到氧化胁迫时,细胞内SOD的水平会提高,以减少细胞内的有害的氧自由基。当氧化胁迫超过细胞耐受的极限时,细胞可能会死亡、裂解。
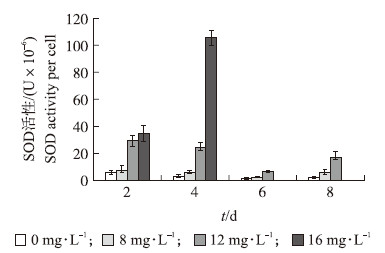 | 图 5 不同质量浓度EGCG处理下细胞内 SOD活性 Fig. 5 SOD activity under different concentrations of EGCG |
在12 mg·L-1 EGCG存在时,藻细胞生长受到抑制。加入Vc 后,藻生长受抑制的程度减轻(图 6)。10和20 mg·L-1 Vc提高了EGCG胁迫下藻细胞的存活率,20 mg·L-1 Vc的作用更为显著。Vc是一种抗氧化的有机化合物,能减轻氧化胁迫,因此Vc对EGCG胁迫下藻细胞受损的缓解作用也佐证了EGCG对藻细胞的氧化胁迫损伤。然而过高浓度的Vc也会产生毒害作用。试验结果显示50 mg·L-1 Vc抑制了藻的生长。10 d时,对藻细胞的生长抑制达到90%以上,同时在培养液内发现了灰色沉淀物。这可能是由于高浓度的Vc与培养基发生反应,或干扰了藻细胞的正常代谢。
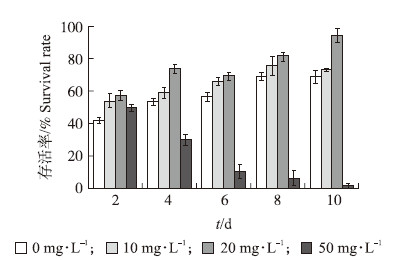 | 图 6 不同质量浓度Vc对EGCG胁迫下M.aeruginosaPCC7806生长的影响 Fig. 6 The effects of different concentrations of Vc on the growth of M.aeruginosa PCC7806 under EGCG stress |
对EGCG处理4 和8 d的藻培养液以及藻细胞内的微囊藻毒素进行了测定,结果如表 1。培养4 d时,培养液中的藻毒素含量在对照组和处理组之间没有明显差异,处理组细胞内藻毒素总量比对照组大幅度下降。培养8 d时,高浓度处理组胞外藻毒素与对照相比显著下降(P < 0.05),胞内的藻毒素含量都显著低于对照组。加入EGCG处理后培养液中藻细胞数比对照组明显减少,但培养液中藻毒素浓度无明星差异,可能是因为处理后部分细胞裂解导致胞外藻毒素含量增加。单位细胞内藻毒素的含量在对照组和处理组之间的差异不显著。Lu等[11]通过荧光定量研究发现EGCG对藻毒素合成酶基因的表达无显著影响,本试验结果与其一致。
| 位置Position | ρ(EGCG)/(mg·L -1) | 藻毒素含量/(mg·L -1)Microcystin content | 单位细胞内的藻毒素含量/(10 -6 μg)Microcystin content per cell | ||
| 4 d | 8 d | 4 d | 8 d | ||
| 细胞外Extracellular 细胞内Intracellular |
0 | 20.0±2.2 | 28.7±3.2 | ||
| 8 | 19.1±1.8 | 23.8±4.2 | |||
| 16 | 21.4±3.1 | 13.6±3.3 | |||
| 0 | 205.8±8.2 | 312.0±6.7 | 17.2±2.9 | 15.52±5.3 | |
| 8 | 88.6±5.4 | 160.2±5.5 | 16.0±4.5 | 16.40±4.6 | |
| 16 | 14.1±2.2 | 16.0±4.2 | 14.1±2.2 | 18.10±3.2 | |
目前,对植物多酚抑藻的机制还不完全清楚,其抑制作用可能通过多种方式实现。植物多酚可与细胞膜蛋白结合,破坏生物体细胞膜结构,使植物多酚物质进一步穿过细胞膜,进入细胞体内[12]。多酚还能影响藻细胞的光合系统。当多酚类物质穿过细胞膜后,将干扰细胞内电子传递过程,对藻细胞的光合系统以及光合作用过程产生干扰,从而抑制藻的活性[13, 14]。还有研究者认为,植物多酚的抑藻作用可能来自植物多酚在环境中的氧化还原产物。在碱性条件下,多酚易被氧化成醌类化合物,而醌类化合物的抑藻作用明显强于植物多酚[15]。另外植物多酚在偏碱性条件下具有自氧化反应,会发生自氧化而生成自由基,而自由基的强氧化作用会破坏细胞结构[16, 17]。
EGCG是茶叶内含量最丰富的茶多酚,分子共有8个酚羟基,其中6个是处于邻位的,另2个是间位的。EGCG对铜绿微囊藻生长的抑制效果非常明显。本研究结果显示,EGCG处理的藻液生物量增长缓慢,细胞黄化并且聚集成团沉底,说明细胞受到了损伤。在电子显微镜下观测,处理后的细胞细胞壁破损,胞内类囊体结构松散或断裂。高浓度EGCG处理后受损细胞的比例大,且受损严重。光合作用是蓝藻细胞最重要的生命活动过程和特征之一,也是化感物质攻击的主要目标。叶绿素荧光仪检测显示,处理后藻细胞的光合效率显著下降,电子传递速率也显著下降。氧化胁迫也是酚类物质对蓝藻细胞生长抑制的一个常见机制[18]。EGCG处理后,细胞的MDA含量显著增加,说明藻细胞膜过氧化程度加剧。MDA 具有强交联性,它可使蛋白质、核酸等交联成shchiff 碱,使蛋白质分子变性失活。同样,细胞内SOD活性在受到多酚胁迫时显著提高,是细胞抵御外来胁迫的一个机制,利用提高酶表达量来分解体内的氧化性物质。和其他化感物质一样,EGCG从多个方面对M.aeruginosa的生长和繁殖产生影响,主要表现在破坏细胞结构、产生氧化胁迫和对光合作用的抑制。
在后续试验中,我们已尝试将茶多酚抑藻应用到湖泊水体中。结果显示,对于湖泊水体中的蓝藻同样具有良好的抑制作用(资料未发表)。茶多酚投入水体,会加深水体颜色。但随着其代谢分解,水体颜色会逐渐恢复。茶多酚在水中的代谢途径还有待进一步研究。
| [1] | Chen Y W,Qin B Q,Teubner K,et al. Long-term dynamics of phytoplankton assemblages:Microcystis-domination in Lake Taihu,a large shallow lake in China[J]. Journal of Plankton Research,2003,25(4):445-453. |
| [2] | Nakai S,Inoue Y,Hosomi M,et al. Growth inhibition of blue green algae by allelopathic effects of marophytes[J]. Water Science and Technology,1999,39(8):47-53. |
| [3] | Nakai S,Inoue Y,Hosomi M. Algal growth inhibition effects and inducement modes by plant-producing phenols[J]. Water Research,2001,35:1855-1859. |
| [4] | 汪瑾,杜明勇,于玉凤,等. 几种植物浸提液对铜绿微囊藻的抑制作用及抑藻特性研究[J]. 南京农业大学学报,2014,37(4):91-96. DOI:10.7685/j.issn.1000-2030.2014.04.013. Wang J,Du M Y,Yu Y F,et al. The inhibitory effect of plant extracts on Microcystis aeruginosa and its algal inhibiting characteristics[J]. Journal of Nanjing Agricultural University,2014,37(4):91-96(in Chinese with English abstract). |
| [5] | Lu Y P,Wang J,Yu Y,et al. Inhibition of Camellia sinensis(L.)O. Kuntze on Microcystis aeruginosa and isolation of the inhibition factors[J]. Biotechnology Letters,2013,35:1029-1034. |
| [6] | Rippka R,Desrulles J,Waterbury J B,et al. Generic assignment,strain histories and properties of pure cultures of cyanobacteria[J]. Journal of General Microbiology,1979,111:1-61. |
| [7] | Genty B,Briantais J M,Baker N R,et al. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta,1989,990:87-92. |
| [8] | Campbell D,Hurry V,Clarke A K,et al. Chlorophyll fluorescence analysis of cyanobacterial photosynthesis and acclimation[J]. Microbiology and Molecular Biology Reviews,1998,62:667-683. |
| [9] | Zhang S L,Zhang B,Xing K Z,et al. Inhibitory effects of golden thread(Coptis chinensis)and berberine on Microcystis aeruginosa[J]. Water Science and Technology,2010,61:763-769. |
| [10] | 刘洁生,陈芝兰,杨维东,等. 凤眼莲根系丙酮提取物抑制赤潮藻类生长的机制研究[J]. 环境科学学报,2006,26(5):815-820. Liu J S,Chen Z L,Yang W D,et al. Inhibitory mechanism of acetone extract from Eichhornia crassipes root on Alexandrium tamarense[J]. Acta Scientiae Circumstantiae,2006,26(5):815-820(in Chinese with English abstract). |
| [11] | Lu Y P,Wang J,Yu Y,et al. Changes in physiology and gene expression of Microcystis aeruginosa under EGCG stress[J]. Chemosphere,2014,117:164-169. |
| [12] | Shao J H,Yu G L,Wang Z G,et al. Towards clarification of the inhibitory mechanism of wheat bran leachate on Microcystis aeruginosa NIES-843(Cyanobacteria):physiological responses[J]. Ecotoxicology,2010,19(8):1634-1641. |
| [13] | Qian H F,Pan X J,Chen J,et al. Analyses of gene expression and physiological changes in Microcystis aeruginosa reveal the phytotoxicities of three environmental pollutants[J]. Ecotoxicology,2012,21(3):847-859. |
| [14] | Shao J H,Wu Z X,Yu G L,et al. Allelopathic mechanism of pyrogallol to Microcystis aeruginosa PCC7806(Cyanobacteria):from views of gene expression and antioxidant system[J]. Chemosphere,2009,75:924-928. |
| [15] | Usenko O M,Guseynova V P,Sakevich A I. Peculiarities of the influence of polyphenols on algae under conditions of changes in pH of the environment[J]. Hydrobiological Journal,2008,44(5):37-44. |
| [16] | Wang J X,Xie P. Antioxidant enzyme activities of Microcystis aeruginosa in response to nonylphenols and degradation of nonylphenols by M.aeruginosa[J]. Environmental Geochemistry and Health,2007,29:375-383. |
| [17] | Wang J,Zhu J Y,Liu S P. Generation of reactive oxygen species in cyanobacteria and green algae induced by allelochemicals of submerged macrophytes[J]. Chemosphere,2011,85:977-982. |
| [18] | Zhu J Y,Liu B Y,Wang J,et al. Study on the mechanism of allelopathic influence on cyanobacteria and chlorophytes by submerged macrophyte(Myriophyllum spicatum)and its secretion[J]. Aquatic Toxicology,2010,98:196-203. |




