文章信息
- 王萃铂, 张瓒, 张晓雪, 展妍丽, 亓钰莹, 蒋甲福.
- WANG Cuibo, ZHANG Zan, ZHANG Xiaoxue, ZHAN Yanli, QI Yuying, JIANG Jiafu.
- 菊花转录因子CmMYB59的克隆与表达特性分析
- Molecular cloning and expression of CmMYB59 from Chrysanthemum morifolium
- 南京农业大学学报, 2016, 39(01): 63-69
- Journal of Nanjing Agricultural University, 2016, 39(01): 63-69.
- http://dx.doi.org/10.7685/jnau.201503029
-
文章历史
- 收稿日期:2015-03-13
MYB是高等植物中数量最多和功能最多样化的转录因子之一,以其结构上都有一段保守的DNA结合区-MYB结合域为共同特征。MYB结合域一般包括1~4个不完全重复序列(R),每个重复片段由50~53个保守的氨基酸残基和间隔序列组成,每18~19个氨基酸间隔1个色氨酸残基。根据重复片段R的数目,MYB转录因子可分为3类:含1个MYB结构的R1/2-MYB或R3-MYB;含2个重复MYB结构域的R2R3-MYB;含3个重复MYB结构的R1R2R3-MYB;含有4个R1/2重复的4R-MYB[1, 2, 3]。植物中绝大多数为R2R3型MYB的转录因子。拟南芥中200个MYB转录因子共有125个R2R3-MYB,结构一般为N端有保守的DNA结合区,C端有转录激活/抑制区[2]。其功能多样,如参与植物苯丙烷类次生代谢调节[4, 5]、生物胁迫及非生物胁迫应答[6, 7]、细胞形态和模式建成[8],参与植物激素应答[9]、植物生物节律钟的调控[10]等。菊花为世界四大切花之一,观赏经济价值极高。近年来,自然界极端天气频繁出现,低温和高温胁迫会严重影响菊花的生长发育,从而影响其产量和品质。在其他物种中,已经分离了很多与逆境相关的MYB转录因子。目前在菊花中已分离2个MYB转录因子基因,CmMYB 1和CmMYB2,其中CmMYB1 能参与木质素合成途径和类黄酮途经,起负调控的作用[11];CmMYB 2和拟南芥AtMYB44 同源,在拟南芥中过表达可以增强拟南芥对干旱胁迫和盐胁迫的抗性[12]。目前,植物中MYB 59 的相关功能探索很少,仅有拟南芥AtMYB 59有较为详尽的功能探究。通过生物信息学比较发现,AtMYB59 中有4个可变剪切类型,且可以通过可变剪切参与多种生物调控[13]。AtMYB 59 能在有丝分裂S期特异性表达,通过延伸有丝分裂中期的细胞来抑制根的伸长,过表达AtMYB 59 能够使下游细胞分裂相关基因CYCB 1 ; 1 等表达量上调[14]。本研究克隆获得菊花中MYB59转录因子,利用生物信息学方法对所克隆基因进行分析,用荧光定量方法研究其组织表达模式、亚细胞定位,并对其进行转录激活活性验证,为进一步研究其功能奠定基础。
1 材料与方法 1.1 植物材料和处理植物材料为切花菊品种‘神马’,取自江苏省张家港骏马基地。分别采集营养期6~8叶龄的菊花的根、茎、顶芽、第3片完全展开叶(从上至下数);花蕾直径约1 cm时取花蕾;盛花期时取舌状花、管状花,保存于-80 ℃冰箱,用于组织定量表达分析。选取长势一致的6~8叶龄的‘神马’扦插苗放入人工气候培养箱,进行低温胁迫处理:低温4 ℃处理,分别在处理0、1、3、9、12和24 h时取叶片样本并立即用液氮速冻,保存于-80 ℃冰箱中备用。
1.2 总RNA提取和cDNA合成RNA的提取方法按照TaKaRa 公司Trizol RNA提取试剂盒说明书进行,用DNaseⅠ(TaKaRa)消化基因组DNA。cDNA反转录按照反转录酶Reverse Transcriptase M-MLV(TaKaRa)试剂盒说明书进行。
1.3 CmMYB 59 基因的克隆取上述cDNA作为模板,根据菊花品种‘优香’转录组库(GenBank登录号:SRP041138),利用Primer Premier 5.0软件[15]设计中间片段引物(表 1)。PCR扩增后,产物回收,纯化,连接pMD19-T载体(TaKaRa),转入大肠杆菌DH5α感受态细胞,蓝白斑筛选,送测序。根据测序结果,设计3′Race引物、5′Race反向引物,PCR扩增得到3′和5′序列,用DNAMAN 2.6软件[16]拼接,设计全长引物,用高保真PCR确定全长序列。
| 引物名称 Primer name | 序列(5′→3′)Sequence | 用途 Usage |
| F R | GGACGAACTGATAACGAGATTCGCCGGTGTCATAAAAACTT | 中间片段扩增Amplifacation for internal fragment |
| 3′-F1 3′-F2 3′-F3 | GGCATTATCTCCATCTTCATCACTTCCTCTTCCTGCTCGTCAACCAATGACAGAAACCGAAGAA | 3′Race扩增Gene specific primers for 3′Race |
| 5′-R1 5′-R2 5′-R3 | CAATGACAGAAACCGAAGAAACAAAATTCCTCTTCCTGCTCGTCAAGAATTATTGGAGGACCCATATGAGG | 5′Race扩增Gene specific primers for 5′Race |
| CmMYB59-F-F CmMYB59-F-R | ACTTAGTCTTACTCAAACATAAGTGAATTTTGCGCTTGTTGTCGGGATA | 全长序列扩增Amplifacation of full length primers |
| EF1α-F EF1α-R | TGTAACAAGATGGATGCCACAATCGCCCTCAAACCCAGAAAT | 内参基因扩增Reference gene amplifacation |
| CmMYB59-Q-F CmMYB59-Q-R | ACGAGATTAAGAATTATTGGAGGACTTGGCATGGAATCAATAGTAGGA | 荧光定量PCR扩增qRT-PCR primers |
| CmMYB59-BamHⅠ CmMYB59-NotⅠ | CGGGATCCGGATGATGCAAGAAGATGAGATTTGCGGCCGCGAAATTTTGCGCTTGTTGTCGG | 亚细胞定位、转录激活活性验证Subcellular localization,transcriptional activation |
序列同源性分析采用GenBank的BLAST程序,开放阅读框框查找采用BioXM 2.6软件,氨基酸、序列比对、进化树分析采用DNAMAN 2.6和MEGA 5.0[17]软件。
1.5 荧光定量表达分析以已登录的菊花基因EF 1 α作为内参基因,设计引物EF 1 α-F和EF 1 α-R。根据CmMYB 59 的全长序列,设计荧光定量引物。荧光定量PCR方法参照试剂盒说明书建立20 μL反应体系,反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 25 s,40个循环。使用CT值计算ΔΔCT,目标基因的相对表达量=2-ΔΔCT。
1.6 转录激活活性验证酵母单杂交所用酵母Y2H菌株、表达载体pCL、载体pGBKT7均由本实验室保存。以‘神马’cDNA为模板,上、下游引入BamHⅠ和NotⅠ酶切位点,进行高保真PCR扩增。将PCR产物和入门载体pENTR1A进行BamHⅠ和NotⅠ双酶切,目的片段与载体片段连接。表达载体质粒用限制性内切酶PvuⅠ(NEB)酶切线性化,取含有CmMYB 59 基因的pENTR1A的线性化质粒和pGBKT7质粒进行LR重组,重组方法为Invitrogen公司的Gateway技术,构成pGBKT7-CmMYB 59 重组表达载体,转化至酵母感受态中,阴性对照为pGBKT7空载体,阳性对照为pCL1。将pGBKT7-CmMYB 59 和pGBKT7空载体涂在SD/-Trp培养基,pCL1涂在SD/-Leu培养基上,30 ℃培养2~4 d,随后将酵母菌落转到SD/-His-Ade双缺培养基上,30 ℃培养2 d,观察菌落生长情况。
1.7 亚细胞定位将上述构建好的pENTR1A-CmMYB 59 载体与pMDC43载体进行LR重组,构建pMDC43-CmMYB 59 重组表达载体。利用基因枪轰击法对洋葱表皮进行轰击,随后将样品放到20 ℃暗培养16 h,随后在激光共聚焦显微镜ZEISS LSM780下观察和拍照。
2 结果与分析 2.1 CmMYB 59 基因的克隆及序列分析提取‘神马’总RNA用于RT-PCR,利用F和R,以cDNA为模板扩增,获得196 bp的中间片段,根据中间片段设计3′和5′引物,进行3′和5′RACE,获得500 bp左右的3′端和400 bp左右的5′端。根据拼接的结果设计全长引物,高保真扩增后得到900 bp左右的条带(图 1)。经过测序后发现得到2个长度不同的序列,长的序列比短的序列在靠近5′端多一段38 bp的片段GTTTGAAGGTGGCGGGAGATACAAAATTGAAAGACTAG,说明存在可变剪切,至少存在2种转录本。经BLAST比对,其与拟南芥AtMYB 59 同源性 较高,故将不含内含子的命名为CmMYB 59 (GenBank登录号:KR052024),含有内含子的命名为CmMYB 59.1 。 CmMYB 59 的全长为904 bp,ORF框为768 bp,编码255个氨基酸,5′非编码区(5′-UTR)为66 bp,3′非编码区(3′-UTR)为70 bp,预测蛋白质相对分子质量61.99×103,等电点4.99。CmMYB 59.1 在第一个起始密码子ATG第40个氨基酸处与R2基团之间插入了38 bp的内含子序列(图 2),插入位置与拟南芥的AtMYB 59的可变剪切AtMYB59.3和水稻同源基因OsMYBAS1 一致,内含子中引入了终止密码子TAG,从而使其翻译提前终止。
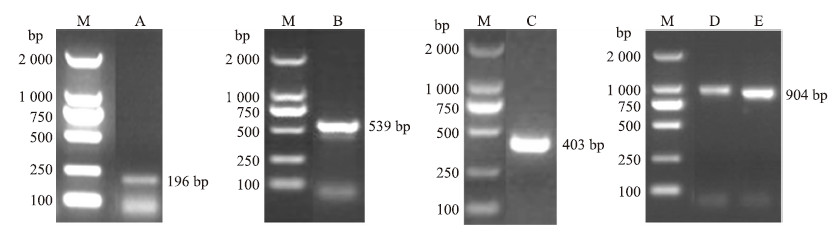 |
图 1 基因克隆电泳图 Fig. 1 Electrophoresis results of CmMYB 59 cloning
M.DL2000 marker;A.中间片段产物;B.3′Race产物;C.5′Race产物;D.CmMYB 59 全长片段;E.可变剪切CmMYB 59.1 全长片段 M.DL2000 marker;A.Internal fragments;B.3′Race fragments;C.5′Race fragments;D.Full length of CmMYB 59 ;E.Full length of CmMYB 59.1 (the alternative splicing transcript of CmMYB 59 ) |
 |
图 2 CmMYB 59 基因氨基酸序列与其他物种比对 Fig. 2 Alignment of the derived amino acid sequences from CmMYB 59 with other MYBs
Cm:菊花 Chrysanthemum morifolium;At:拟南芥 Arabidopsis thaliana;Tc:可可 Theobroma cacao;Sm:丹参 Salvia miltiorrhiza;Zm:玉米 Zea mays 箭头区域表示保守的R2和R3结构域;黑色三角表示内含子插入位点;NLS表示核定位基序;motif表示特征基序[Y/N]SM.DDIW。 The two MYB domain repeat(R2 and R3)are indicated with sets of arrows. The intron position is indicated with black triangles. Two regions corresponding to the predicted NLSs are boxed. motif:[Y/N]SM.DDIW. |
 | 图 3 CmMYB 59 与其他物种的系统进化树 Fig. 3 The phylogenetic tree of CmMYB 59 and other MYBs At:拟南芥 Arabidopsis thaliana;Tc:可可 Theobroma cacao;Ga:树棉 Gossypium arboreum;Mt:蒺藜 Medicago truncatula;Pt:毛果杨 Populus trichocarpa;Sm:丹参 Salvia miltiorrhiza;Bn:欧洲油菜 Brassica napus;Gs:野大豆 Glycine soja;Zm:玉米 Zea mays;Gm:黄豆 Glycine max;Os:水稻(粳稻) Oryza sativa(japonica group);Ll:百合(杂交分离I) Lilium spp.(hybrid division I);Ata:节节麦 Aegilops tauschii;Tu:乌拉尔图小麦 Triticum urartu |
由图 4可知:CmMYB 59 主要在根、茎、叶和管状花中表达,相对表达量由高到低依次为根、叶、茎、管状花,在顶芽、蕾、舌状花中几乎不表达。CmMYB 59 在4 ℃处理下,CmMYB 59 表达量迅速升高,在1 h处达到峰值,随后逐渐下降(图 5)。
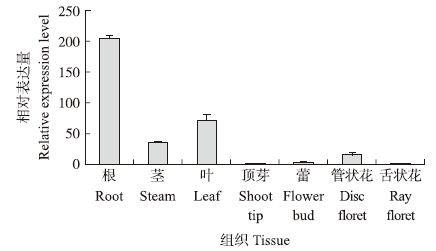 | 图 4 CmMYB 59 在菊花不同组织中的表达分析 Fig. 4 Expression analysis of CmMYB 59 in different tissues of C.morifolium |
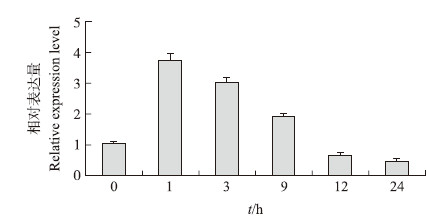 | 图 5 4 ℃下CmMYB 59 在菊花中的表达分析 Fig. 5 Expression analysis of CmMYB 59 in C.morifolium at 4 ℃ |
将重组质粒DNA pMDC43-CmMYB 59 转入洋葱表皮细胞,25 ℃暗培养18 h后,用激光共聚焦显微镜进行观察。结果(图 6)显示:在转pMDC43空载体的细胞内,绿色荧光分布在整个细胞,而转pMDC43-CmMYB 59 载体的细胞只在细胞核处检测到绿色荧光信号。
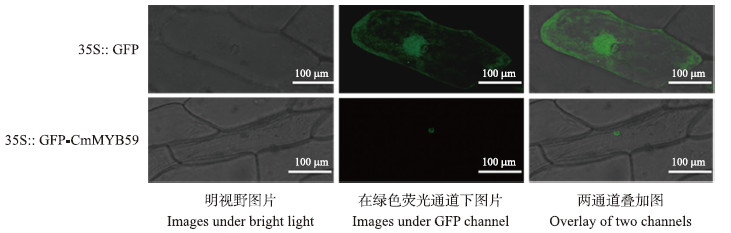 | 图 6 CmMYB59在洋葱表皮细胞中的亚细胞定位 Fig. 6 Subcellurar localization of CmMYB59 protein in onion epidermis cells |
含有重组质粒pGBKT7-CmMYB 59 的酵母菌株均能在SD/-Trp单缺陷培养基上生长(图 7),说明重组质粒成功转入酵母Y2H中。将长出的酵母菌落划板到双缺陷培养基SD/-His-Ade上,重组质粒可以在双缺培养基上生长,但阴性对照pGBKT7空载不能在双缺培养基上生长,阳性对照pCL1生长正常。由此证明,pGBKT7-CmMYB 59质粒可以表达,激活下游报告基因his3 表达,使酵母细胞在SD/-His-Ade培养基上生长。而X-gal显色反应为蓝色,进一步证明其在酵母中具有转录激活活性。
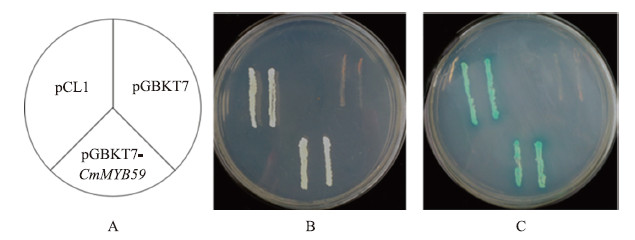 |
图 7 pGBKT7-CmMYB 59 的蛋白转录激活活性分析 Fig. 7 Transcriptional activation assay of pGBKT7-CmMYB 59 protein by yeast expression system
A:各酵母株系分布示意图;B,C:pGBKT7-CmMYB 59 转化酵母的生长情况 A:Aketch panel indicates the position of each yeast strain;B,C:The growth of yeast cells containing pGBKT7-CmMYB 59 |
本研究通过RT-PCR和RACE技术的方法,从菊花‘神马’叶片中分离了1个R2R3型MYB基因和它的一个可变剪切。在真核生物基因组转录过程中,mRNA前体通常按一个剪切方式剪切mRNA,只翻译一种蛋白,而有些基因会选择性地以多种方式剪切产生不同的mRNA,从而产生不同的蛋白,此种方式叫可变剪切[18, 19]。拟南芥的AtMYB 59 基因及水稻同源基因,有至少4种可变剪切,这4种可变剪切在转录水平上有差异,进而会影响其功能[13]。CmMYB 59.1的插入位点与AtMYB59-3 的插入位置一致,均在R2基团处第40个氨基酸处,故推测可变剪切CmMYB 59.1可能与AtMYB59-2 的功能相似。在拟南芥中,含有特定基序W/Y-MDDIW会增强邻近区域的转录激活活性,而自身却不具有转录激活活性[20]。菊花含有类似基序YNSMDEIW,酵母转录激活试验验证了CmMYB 59 的ORF区具有转录激活活性。此外,通过CmMYB 59与拟南芥的同源比对发现,CmMYB59 有2个特定核定位区序列,亚细胞定位结果表明定位在核上,与拟南芥的AtMYB 59的结果一致。组织定量表达结果显示:CmMYB59主要在根、茎、叶、管状花中表达,其中在根中表达量最高。拟南芥AtMYB59在根中表达量高,其通过延伸有丝分裂中期的细胞来抑制根的伸长,过表达AtMYB59 可以使细胞分裂相关基因的表达量升高[14]。因此推测,作为AtMYB 59的同源基因,菊花CmMYB59可能有相似的功能,参与根细胞的有丝分裂进程。在植物中发现了很多逆境胁迫相关MYB基因。水稻OsMYB55 的过量表达能够激活谷氨酸代谢基因,从而提高了水稻在热胁迫下的耐受性[21],OsMYBS 3、OsMYB2 等基因与冷胁迫相关[22, 23]。苹果MdoMYB 121 基因的过表达可以提高苹果对低温、盐害和干旱等非生物胁迫的耐受能力[24]。有证据表明,细胞分裂参与胁迫响应,在水稻上,4 ℃处理可以使细胞分裂相关基因OsMYB 3R-2表达量升高,在过表达OsMYB3R-2的转基因水稻上,冷胁迫处理导致生长发育迟缓,根长变短,OsMYB3R-2 可以通过控制有丝分裂和DREB/CBF途径来提高水稻的耐冷性[25]。有研究表明,菊花在低温胁迫下易受到伤害,其丙二醛和可溶性糖含量在低温胁迫过程中下降,SOD活性呈先上升后下降的趋势[26]。对菊花CmMYB 59 在非生物胁迫下的定量表达分析后发现,4 ℃冷胁迫处理可以诱导CmMYB 59的表达,说明CmMYB59 对低温胁迫有响应。菊花胁迫相关的MYB转录因子很少,CmMYB 59 是否通过细胞分裂来响应低温胁迫还有待研究。植物中MYB家族数量庞大而功能巨多,但关于MYB 59 基因的报道很少,只有拟南芥有较详尽的功能研究。本文克隆了CmMYB 59 基因,通过与拟南芥AtMYB 59 的对比,对其进行了初步研究,后期试验可以通过转基因和分段转录激活活性验证的方式对其功能进行深一步的研究。
| [1] | Rosinski J A,Atchley W R. Molecular evolution of the Myb family of transcription factors:evidence for polyphyletic origin[J]. Journal of Molecular Evolution,1998,46(1):74-83. |
| [2] | Stracke R,Werber M,Weisshaar B. The R2R3-MYB gene family in Arabidopsis thaliana[J]. Current Opinion in Plant Biology,2001,4(5):447-456. |
| [3] | Dubos C,Stracke R,Grotewold E,et al. MYB transcription factors in Arabidopsis[J]. Trends in Plant Science,2010,15(10):573-581. |
| [4] | Bomal C,Bedon F,Caron S,et al. Involvement of Pinus taeda MYB1 and MYB8 in phenylpropanoid metabolism and secondary cell wall biogenesis:a comparative in planta analysis[J]. Journal of Experimental Botany,2008,59(14):3925-3939. |
| [5] | Mehrtens F,Kranz H,Bednarek P,et al. The Arabidopsis transcription factor MYB12 is a flavonol:specific regulator of phenylpropanoid biosynthesis[J]. Plant Physiology,2005,138(2):1083-1096. |
| [6] | Zhang X,Ju H W,Chung M S,et al. The R-R-type MYB-like transcription factor,AtMYBL,is involved in promoting leaf senescence and modulates an abiotic stress response in Arabidopsis[J]. Plant and Cell Physiology,2011,52(1):138-148. |
| [7] | Liu R X,Lu B B,Wang X M,et al. Thirty-seven transcription factor genes differentially respond to a harpin protein and affect resistance to the green peach aphid in Arabidopsis[J]. Journal of Biosciences,2010,35(3):435-450. |
| [8] | Lee M M,Schiefelbein J. WEREWOLF,a MYB-related protein in Arabidopsis,is a position-dependent regulator of epidermal cell patterning[J]. Cell,1999,99(5):473-483. |
| [9] | Song S S,Qi T C,Huang H,et al. The Jasmonate-ZIM domain proteins interact with the R2R3-MYB transcription factors MYB21 and MYB24 to affect Jasmonate-regulated stamen development in Arabidopsis[J]. The Plant Cell,2011,3(3):1000-1013. |
| [10] | Lu S X,Knowles S M,Andronis C,et al. CIRCADIAN CLOCK ASSOCIATED1 and LATE ELONGATED HYPOCOTYL function synergistically in the circadian clock of Arabidopsis[J]. Plant Physiology,2009,2(2):834-843. |
| [11] | Zhu L,Shan H,Chen S M,et al. The heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB1 alters lignin composition and represses flavonoid synthesis in Arabidopsis thaliana[J]. PLoS ONE,2013,8(6):e65680. |
| [12] | Shan H,Chen S M,Jiang J F,et al. Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhances drought and salinity tolerance,increases hypersensitivity to ABA and delays flowering in Arabidopsis thaliana[J]. Molecular Biotechnology,2012,51(2):160-173. |
| [13] | Li J G,Li X J,Guo L,et al. A subgroup of MYB transcription factor genes undergoes highly conserved alternative splicing in Arabidopsis and rice[J]. Journal of Experimental Botany,2006,57(6):1263-1273. |
| [14] | Mu R L,Cao Y R,Liu Y F,et al. An R2R3-type transcription factor gene AtMYB59 regulates root growth and cell cycle progression in Arabidopsis[J]. Cell Research,2009,19(11):1291-1304. |
| [15] | 任亮,朱宝芹,张轶博,等.利用软件Primer Premier 5.0进行PCR引物设计的研究[J]. 锦州医学院学报,2004,25(6):43-46. Ren L,Zhu B Q,Zhang Y B,et al. The research of applying Primer Premier 5.0 to design PCR primer[J]. Journal of Jinzhou Medicine College,2004,25(6):43-46(in Chinese with English abstract). |
| [16] | Woffelman C. DNAMAN for Windows,version 2.6[M]. Lynon Biosoft,Institute of Molecular Plant Sciences,Leiden University,the Netherlands,1994. |
| [17] | Tamura K,Peterson D,Peterson N,et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739. |
| [18] | Moore M J,Proudfoot N J. Pre-mRNA processing reaches back to transcription and ahead to translation[J]. Cell,2009,136:688-700. |
| [19] | Kazan K. Alternative splicing and proteome diversity in plants:the tip of the iceberg has just emerged[J]. Trends in Plant Science,2003,8(10):468-471. |
| [20] | Li J G,Yang X Y,Wang Y,et al. Two groups of MYB transcription factors share a motif which enhances trans-activation activity[J]. Biochemical and Biophysical Research Communications,2006,341(4):1155-1163. |
| [21] | EI-kereamy A,Bi Y M,Ranathunge K,et al. The rice R2R3-MYB transcription factor OsMYB55 is involved in the tolerance to high temperature and modulates amino acid metabolism[J]. PLoS ONE,2012,7(12):e52030. |
| [22] | Su C F,Wang Y C,Hsieh T H,et al. A novel MYBS3-dependent pathway confers cold tolerance in rice[J]. Plant Physiology,2010,46(3):145-158. |
| [23] | Yang A,Dai X Y,Zhang W H. A R2R3-type MYB gene,OsMYB2,is involved in salt,cold,and dehydration tolerance in rice[J]. Journal of Experimental Botany,2012,63(7):2541-2556. |
| [24] | Cao Z H,Zhang S Z,Wang R K,et al. Genome wide analysis of the apple MYB transcription factor family allows the identification of MdoMYB121 gene confering abiotic stress tolerance in plants[J]. PLoS ONE,2013,8(7):e69955. |
| [25] | Ma Q B,Dai X Y,Guo J,et al. Enhanced tolerance to chilling stress in OsMYB3R-2 transgenic rice is mediated by alteration in cell cycle and ectopic expression of stress genes[J]. Plant Physiology,2009,150(1):244-256. |
| [26] | 张严玮,房伟民,黄素华,等. 外源ALA对低温胁迫下切花菊光合作用及生理特性的影响[J]. 南京农业大学学报,2014,37(1):47-52. DOI:10.7685/j.issn.1000-2030.2014.01.009. Zhang Y W,Fang W M,Huang S H,et al. Effects of exogenous 5-aminolevulinic acid on the photosynthesis and physiological characteristics of cut chrysanthemum under low temperature stress[J]. Journal of Nanjing Agriculture University,2014,37(1):47-52(in Chinese with English abstract). |




