文章信息
- 吕炜, 户秋稳, 李艳艳, 吴兴勇, 彭丹, 张蜀宁.
- LÜ Wei, HU Qiuwen, LI Yanyan, WU Xingyong, PENG Dan, ZHANG Shuning.
- 优质四倍体萝卜新种质创新及鉴定
- High-quality new autotetraploid radish germplasm innovation and identification
- 南京农业大学学报, 2016, 39(01): 48-54
- Journal of Nanjing Agricultural University, 2016, 39(01): 48-54.
- http://dx.doi.org/10.7685/jnau.201503030
-
文章历史
- 收稿日期:2015-03-13
萝卜(Raphanus sativus L.)是我国种质资源多样性最丰富,栽培面积最大的蔬菜作物之一。目前,国内外已有萝卜四倍体的报道[1, 2, 3, 4]。然而,以往报道的四倍体萝卜有肉质根呈窄圆锥形,基部细长,短缩茎盘大等缺点,无法满足人们对萝卜外观品质日益增长的需求[5, 6]。创造新四倍体种质时,简化筛选四倍体个体的过程,可极大提高创制四倍体新种质的效率。研究表明,不结球白菜早期选用圆盘状、豆瓣状变异植株,可提高加倍率[7]。至今未见通过早期形态学筛选提高萝卜加倍率相关报道。关于四倍体种子发芽相关内含物质因植物种类不同,测定报道结论不一。四倍体刺槐种子的可溶性蛋白含量和过氧化物酶的活性均低于二倍体[8]。苦荞种子四倍体的蛋白质含量和黄酮含量显著大于二倍体[9]。本研究以‘小顶红’为材料,创制同源四倍体新种质,进行早期形态学分类,以期通过早期筛选提高四倍体加倍率,提供更优质、高产的四倍体萝卜新品种。当前市场中四倍体红皮萝卜较为少见,已广泛推广使用的四倍体‘穿心红’具有良好的品质。为避免单一品种特殊性,本研究引进‘穿心红’二、四倍体种子,通过2个不同品种红皮萝卜种子发芽相关内含物比较,为二、四倍体种子特性研究提供数据。
1 材料与方法 1.1 材料二倍体(2n=2x=18)萝卜‘小顶红’,二倍体‘穿心红’及相应的同源四倍体。2012年9月至2014年12月于南京农业大学作物遗传与种质创新国家重点实验室及江浦园艺站进行。
1.2 试验方法 1.2.1 四倍体‘小顶红’秋水仙素诱导2012年9月30日对二倍体幼苗子叶期用1.5、2.0和2.5 g · L-1秋水仙素点滴生长点,处理4次和6次,每次20 μL。每天上、下午各处理1次,共6个组合,以蒸馏水作对照。日间温度24~30 ℃,夜间17~22 ℃。
1.2.2 叶片响应形态分类和倍性鉴定秋水仙素处理后,进行形态学观察,参照徐丽娟等[7]的方法对叶片响应形态特征进行归类,并统计各类型最终获得的四倍体株数。形态解剖学鉴定参考张红亮等[5]的方法,染色体计数及流式细胞仪鉴定参考张振超等[10]的方法。
1.2.3 二、四倍体‘小顶红’农艺性状及营养成分测定于2014年12月20日参考张红亮等[5]的方法,测定叶片、叶数和肉质根等10个性状。肉质根营养成分用苯酚法[11]测定可溶性糖含量,采用考马斯亮蓝法测定可溶性蛋白含量,采用液相色谱法[11]测定维生素C含量。
1.2.4 二、四倍体萝卜种子发芽观察及相关内含物质测定2014年9月15日选取饱满的种子消毒,置于铺有2层滤纸的培养皿中,每个培养皿30粒种子,重复3次,24 ℃恒温培养箱中无光催芽。于24、36、48、60和72 h进行观察,计算48 h发芽势和全部发芽率及发芽指数。参考尹燕枰等[12]的方法测定种子内含物质,采用苯酚法测定可溶性糖含量,采用考马斯亮蓝法测定可溶性蛋白含量,采用TTC法测定种子脱氢酶活性。
1.2.5 四倍体‘小顶红’萝卜继代选育2013年4月20日对鉴定为四倍体的诱变M0代植株进行严格的单株蕾期人工授粉。2013年5月26日单株收种,获得M1代种子。同年9月10日播种M1代种子,每单株种子播一株系。2013年12月进行单株及株系选择。2014年5月自交获得M2代种子。2014年9月播种M2代种子,小区面积2 m×2 m,重复3次。同年12月进行鉴定。
1.3 数据分析所有数据均采用SPSS 19.0软件进行t测验分析。
2 结果与分析 2.1 不同质量浓度秋水仙素诱导同源四倍体‘小顶红’效果分析由表 1可见:不同浓度秋水仙素、不同次数处理都能够获得四倍体植株,且随着质量浓度和次数的增加,变异率和死亡率增加。2.5 g · L-1秋水仙素处理6次的死亡率最高,达11.11%。诱导四倍体加倍率最高的是2.0 g · L-1秋水仙素处理4次,为4.76%。最终获得34株四倍体,总加倍率为2.87%。
| 编号No. | 秋水仙素质量浓度/(g·L -1)Colchicineconcentration | 处理次数Frequency | 处理株数No.of individualstreated | 变异株数No.of individualswith variation | 变异率/%Variationefficiency | 死亡株数No.ofdeath | 死亡率/%Rate ofdeath | 四倍体株数No.oftetraploid | 四倍体加倍率/%Rate oftetraploid |
| 1 | 1.5 | 4 | 190 | 158 | 83.16 | 4 | 2.11 | 2 | 1.05 |
| 2 | 2.0 | 4 | 210 | 178 | 84.74 | 11 | 5.24 | 10 | 4.76 |
| 3 | 2.5 | 4 | 203 | 184 | 90.64 | 14 | 6.90 | 7 | 3.45 |
| 4 | 1.5 | 6 | 195 | 175 | 89.74 | 5 | 2.56 | 4 | 2.05 |
| 5 | 2.0 | 6 | 190 | 158 | 83.16 | 13 | 6.84 | 6 | 3.16 |
| 6 | 2.5 | 6 | 198 | 166 | 83.83 | 22 | 11.11 | 5 | 2.53 |
在萝卜拉十字期,叶片对秋水仙素的响应根据形态共分为4类(图 1):1)正常叶:两片真叶与对照一致,第一片真叶大于子叶;2)簇状叶:两片真叶比对照小,且均小于子叶,成簇状;3)棒状叶:第一片真叶与子叶相当,但小于对照,成棒状;4)勺状叶:第一片真叶与子叶相当,但小于对照,成勺状。由图 2可以看出:秋水仙素处理后,大部分植株表现为真叶较小且成簇状,不同处理组合出现各类真叶形态数量没有差异。跟踪观察发现,正常叶生长速度同对照,棒状和勺状植株大部分逐渐萎蔫死亡。簇状叶植株生长缓慢,真叶末端弯曲褶皱,叶柄较大,20 d后真叶生长恢复正常,与二倍体相比,表现为叶片厚、叶色深、叶脉深红。正常叶、簇状叶、棒状叶和勺状叶最终获得四倍体株数分别为总四倍体株数的0%、88.24%、8.82%和2.94%。由此可见,秋水仙素诱导前期可选择簇状叶性状植株,以减少后期鉴定工作量。
 | 图 1 秋水仙素处理萝卜苗期性状跟踪观察 Fig. 1 Observation of seedling stage after colchicine-induced 1,5,9. 正常叶 Normal leaf;2,6,10. 簇状叶 Clustered leaf;3,7,11. 棒状叶 Virgate leaf;4,8,12. 勺状叶 Scoop leaf |
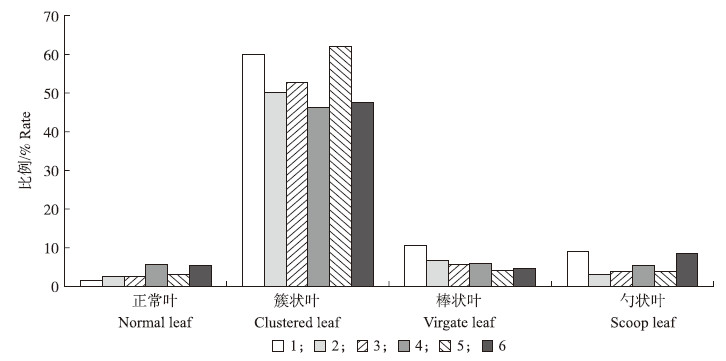 | 图 2 秋水仙素诱导后形态变异统计 Fig. 2 Statistics of the colchicine-induced morphological variation 1~6为处理编号,同表1。1-6 were process No.same as Table 1. |
流式细胞仪鉴定结果(图 3)显示:四倍体的峰值在400附近,为二倍体的2倍。染色体鉴定结果(图 4-A)表明:二倍体萝卜根尖有丝分裂中期染色体数目2n=2x=18,四倍体染色体数目为2n=4x=36,呈二倍的关系。四倍体形态解剖学鉴定表明:四倍体的花器官(花蕾、花瓣、雄蕊)、气孔、花粉粒、角果和种子表现出巨大性(图 4-B~E)。由表 2可知:与二倍体相比,四倍体植株的花蕾、花瓣、花粉粒和气孔长、宽差异显著。其中:四倍体花粉粒长和花粉粒宽比二倍体分别增加了14.16%和52.83%,呈方形;气孔长和气孔宽分别比二倍体增加79.71%和66.36%;气孔密度和单角果种子数目比二倍体少,差异极显著。由此可见,变异株的气孔、花器官可作为四倍体鉴定的初期筛选性状。
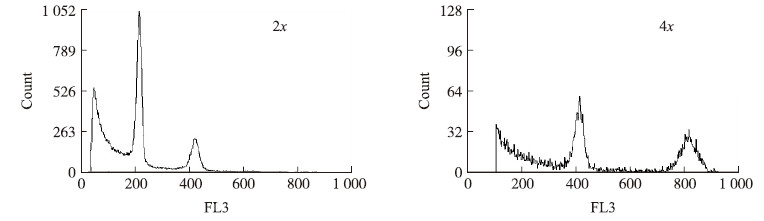 |
图 3 二、四倍体萝卜相对DNA含量比较 Fig. 3 Comparison of DNA relative content between diploid and autotetraploid radish
Count值代表测定细胞数的相对值,横坐标FL3值代表荧光的通道值。 Count value represents the relative value measurement cell number,the abscissa represents the FL3 fluorescence channel values. |
 |
图 4 二、四倍体萝卜形态学、解剖学和细胞学比较 Fig. 4 Comparison of morphological,anatomy and cytological characteristic between diploid and tetraploid radish
A.染色体(400×);B.气孔(200×);C.花粉粒(400×);D.花朵解剖;E.角果;F.植株 A. Chromosomes(400×);B. Stomata(200×);C. Pollen grains(400×);D. Anatomy of a flower;E. Pod;F. Plant |
| 性状 Characters | 倍性 Polidy | 性状 Characters | 倍性 Polidy | |||
| 2 x | 4x | 2 x | 4x | |||
| 花蕾长/cm Bud length | 0.79 | 1.05 ** | 花粉粒宽/μm Pollan grain width | 16.24 | 24.82 ** | |
| 花蕾宽/cm Bud width | 0.22 | 0.37 ** | 雌蕊长/cm Pistil length | 1.34 | 1.55 * | |
| 花瓣长/cm Petal length | 1.58 | 2.12 ** | 单角果种子数 No.of seeds in pod | 5.70 | 3.40 ** | |
| 花瓣宽/cm Petal width | 0.70 | 0.91 * | 气孔长/μm Stoma length | 15.92 | 28.61 ** | |
| 雄蕊长/cm Stamen length | 1.42 | 1.58 | 气孔宽/μm Stoma width | 7.49 | 12.46 ** | |
| 花粉粒长/μm Pollan grain length | 30.42 | 34.73 * | 气孔密度/mm -2 Stoma density | 75.40 | 48.10 ** | |
| Note: * * P<0.01, * P<0.05. The same as follows. | ||||||
由表 3可见:四倍体的先端叶长、先端叶宽、叶基盘直径、肉质根长和肉质根质量分别比二倍体增加29.68%、17.50%、25.74%、14.15%和24.95%,且差异显著。二倍体小区产量10.34 kg,最终选育获得四倍体M2代株系小区产量达12.43 kg,增产20.21%,差异显著。四倍体可溶性糖和维生素C含量分别比二倍体增加23.50%和27.36%,差异显著,可溶性蛋白含量也高于二倍体,表明四倍体营养品质优良。
| 性状 Characters | 倍性 Polidy | 性状 Characters | 倍性 Polidy | |||
| 2 x | 4x | 2 x | 4x | |||
| 叶长/cm Length of leaf | 58.98 | 60.62 | 肉质根质量/g Weight of root | 356.12 | 444.98 * | |
| 先端叶长/cm Length of apex leaflet | 14.42 | 18.72 * | 根颜色 Color of root | 红皮白心 | 红皮白心 | |
| 先端叶宽/cm Width of apex leaflet | 12.34 | 14.52 * | Red skin and | Red skin and | ||
| 小叶数 No.of leaflet | 11.20 | 10.90 | white flesh | white flesh | ||
| 叶片数 No.of leaves | 10.20 | 10.80 | 可溶性糖含量/% Soluble sugar content | 2.00 | 2.74 * | |
| 叶基盘直径/cm Width of stem base | 2.72 | 3.42 * | 可溶性蛋白含量/(mg·g -1) | 0.19 | 0.22 | |
| 肉质根长/cm Length of root | 10.88 | 12.42 * | Soluble protein content | |||
| 肉质根宽/cm Width of root | 7.08 | 7.76 | 维生素C含量/(mg·g -1)Vitamin C content | 2.01 | 2.56 * | |
由表 4和图 5可知:2个不同四倍体品种的种子发芽势和发芽指数均高于对应的二倍体,且差异显著。四倍体‘小顶红’和‘穿心红’的露白率均在催芽后36 h,达到50%,而对应的二倍体的露白率均在催芽48 h后达到50%。四倍体‘小顶红’种子中的可溶性糖含量和脱氢酶活性比二倍体高60.49%和22.22%,且差异极显著。四倍体‘穿心红’种子可溶性糖含量、脱氢酶活性均比对应的二倍体高33.40%和50.00%,差异极显著。四倍体‘穿心红’和‘小顶红’的可溶性糖和可溶性蛋白含量相当,脱氢酶活性前者比后者高出43.18%。
| 品种Varieties | 倍性Ploidy | 可溶性糖含量/%Content ofsoluble sugar | 可溶性蛋白含量/(mg·g -1)Content ofsoluble protein | 脱氢酶活性( D值)Dehydrogenizeactivity( D value) | 发芽势/%Germinationpotential | 发芽率/%Germinationrate | 发芽指数Germinationindex |
| 小顶红 | 2 x | 4.03 | 0.61 | 0.36 | 83.33 | 100.00 | 42.10 |
| Xiaodinghong | 4 x | 6.79 ** | 0.67 | 0.44 ** | 96.67 * | 100.00 | 51.17 * |
| 穿心红 | 2 x | 4.91 | 0.62 | 0.42 | 80.00 | 96.67 | 39.80 |
| Chuanxinhong | 4 x | 6.55 ** | 0.63 | 0.63 ** | 90.00 * | 100.00 | 46.50 * |
 | 图 5 二、四倍体‘小顶红’和‘穿心红’萝卜种子催芽情况比较 Fig. 5 Comparison of the accelerating germination situation of diploid and autotetraploid ‘Xiaodinghong’and‘Chuanxinhong’radish |
于2013年4月20日对鉴定出的34株四倍体进行人工自交授粉,最终有效结籽的为32株,平均结实率为2.8,二倍体平均结实率为5.8。选择结实率高、种子饱满的20个单株,每个单株M1代单独播种为株系,对性状分离、整齐度低、纯度差和肉质根性状不佳的进行淘汰,于2013年12月选取具有叶色深绿、叶脉红色、叶基盘直径小、肉质根较大且保持短椭圆形等性状共10个株系,共42个单株。2014年3月采用流式细胞术结合花期鉴定淘汰嵌合体和生长势弱小的植株后共有15个单株进行自交留种,平均结实率为3.4。同年9月,M2代单独播种自成株系,每个株系15株,按上述流程进行筛选,得到4个整齐度达95%、纯度达95%的株系。
3 讨论化学诱导多倍体以其精确、有效、诱变率高而被普遍采用[13]。离体组培诱导四倍体因受严格的试验条件等限制[14],一般非科研单位很难做到。秋水仙素滴定法是目前最简单、直接、有效的方法。秋水仙素抑制纺锤丝的形成,姐妹染色单体不能向细胞两级移动,导致核内染色体加倍[15]。本研究表明2.0 g · L-1秋水仙素处理4次,四倍体加倍率最高。张红亮等[5]研究发现2.0 g · L-1秋水仙素处理6次的加倍率最高,表明不同基因型对秋水仙素诱导响应不同。徐丽娟等[7]对不结球白菜诱导变异株进行形态分类并进行动态跟踪调查,提供早期快速鉴定方法。本研究首次进行萝卜诱变株叶片响应形态分类,发现簇状叶类型最终获得四倍体株数最多。因此,簇状叶可作为早期诱变筛选形态学指标,以提高筛选效率。
同源四倍体存在低稔性的特点[16]。萝卜分枝、结角果多,一定程度上抵消了单果结实率低的弱点,因此与其他十字花科蔬菜多倍体相比,萝卜四倍体经继代选育后易获得稳定的四倍体群体,可快速投入生产。
多倍体植株的产量、抗逆性往往高于二倍体[17, 18, 19]。可溶性糖和维生素C含量的差异是多倍体植株抗逆性强于二倍体的根本原因。本研究中测定同源四倍体萝卜肉质根可溶性糖和维生素C含量均比二倍体高,但可溶性蛋白含量相差不大。可能的原因是四倍体细胞增大,用于合成细胞组成结构蛋白的氨基酸比例增加,合成可溶性蛋白的氨基酸比例相应减少。有关二、四倍体种子内含物质含量高低比较的说法不一。黄金艳等[20]发现甜瓜种子发芽指数和活性指数二倍体高于四倍体,孙鹏等[21]认为四倍体种子萌发率低。本研究发现,四倍体萝卜‘小顶红’和‘穿心红’种子中可溶性糖含量和脱氢酶活性显著高于相应的二倍体,发芽势和发芽指数高于二倍体。
本试验采用秋水仙素诱导萝卜同源四倍体,证明诱导早期叶片响应形态筛选能有效提高加倍率,为多倍体诱导筛选提供新思路。二、四倍体种子试验表明,四倍体萝卜种子具有更强的生活力,为多倍体种子研究提供了数据。经过多代选育,初步获得外观优质、高产的四倍体萝卜新种质,但还需要进一步的田间检验。
| [1] | 刘惠吉. 蔬菜作物多倍体研究及应用[J]. 长江蔬菜,1995(3):3-5. Liu H J. Ploidy vegetable crops research and application[J]. Journal of Changjiang Vegetables,1995(3):3-5(in Chinese). |
| [2] | Muminovic J,Merz A,et al. Genetic structure and diversity among radish varieties as inferred from AFLP and ISSR analyses[J]. Journal of the American Society for Horticultural Science,2005,130:79-87. |
| [3] | Chun C,Park H,Na H. Microspore-derived embryo formation in radish(Raphanus sativus L.)according to nutritional and environmental conditions[J]. Hort Environ Biotechnol,2011,52:530-535. |
| [4] | Takahata Y,Komatsu H,Kaizuma N. Microspore culture of radish(Raphanus sativus L.):influence of genotype and culture conditions on embryogenesis[J]. Plant Cell Reports,1996,16:163-166. |
| [5] | 张红亮,张蜀宁,张伟,等. 秋水仙素诱导同源四倍体萝卜的研究[J]. 南京农业大学学报,2008,31(3):47-50. DOI:10.7685/j.issn.1000-2030.2008.03.009. Zhang H L,Zhang S N,Zhang W,et al. Studies on the induction of autotetraploid radish with colchicine[J]. Journal of Nanjing Agricultural University,2008,31(3):47-50(in Chinese with English abstract). |
| [6] | Le C T,姜二花,王康,等. 利用氟乐灵进行同源四倍体萝卜种质创制研究[J]. 基因组学与应用生物学,2012,31(3):276-281. Le C T,Jiang E H,Wang K,et al. Auto-tetraploid induction by trifluralin treatment in radish(Raphanus sativus L.)[J]. Genomics and Applied Biology,2012,31(3):276-281(in Chinese with English abstract). |
| [7] | 徐丽娟,张蜀宁,郑于莉,等. 秋水仙素诱导不结球白菜叶片类型与染色体加倍的关系[J]. 西北植物学报,2013,33(6):1239-1244. Xu L J,Zhang S N,Zheng Y L,et al. Relationship between leaf morphological type and chromosome doubling of non-heading Chinese cabbage induced by colchicine[J]. Acta Botanica Boreali-Occidenta Sinica,2013,33(6):1239-1244(in Chinese with English abstract). |
| [8] | 姜金仲,贺佳玉,李云,等. 刺槐同源四倍体种子胚变异及生活力分析[J]. 核农学报,2009,23(3):405-412. Jiang J Z,He J Y,Li Y,et al. Variation and vitality of seed embryos from tetraploid Robinia pseudoacacia[J]. Journal of Nuclear Agricultural Sciences,2009,23(3):405-412(in Chinese with English abstract). |
| [9] | 廉立坤,陈庆富. 二倍体和四倍体苦荞种子蛋白质含量和黄酮含量比较研究[J]. 种子,2013,32(2):1-5. Lian L K,Chen Q F. A comparative study of seed protein content and seed flavonoid content between diploid and tetraploid tartary buckwheat[J]. Seed,2013,32(2):1-5(in Chinese with English abstract). |
| [10] | 张振超,张蜀宁,张伟,等. 四倍体不结球白菜的诱导及染色体倍性鉴定[J]. 西北植物学报,2007,27(1):28-32. Zhang Z C,Zhang S N,Zhang W,et al. Induction of tetraploidy of non-heading Chinese cabbage with late bolting and identification of chromosome configuration[J]. Acta Botanica Boreali-Occidenta Sinica,2007,27(1):28-32(in Chinese with English abstract). |
| [11] | 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:182-202. Li H S. The Experiment Principle and Technique on Plant Physiology and Biochemistry[M]. Beijing:Higher Education Press,2000:182-202(in Chinese). |
| [12] | 尹燕枰,董学会. 种子学实验技术[M]. 北京:中国农业出版社,2008:69-72. Yin Y P,Dong X H. Spermology Experiment Technology[M]. Beijing:China Agriculture Press,2008:69-72(in Chinese). |
| [13] | 周香君. 大蒜多倍体化学诱导技术研究[D]. 杨凌:西北农林科技大学,2008:6-20. Zhou X J. Studies on polyploid chemical induction technique of garlic[D]. Yangling:Northwest A&F University,2008:6-20(in Chinese with English abstract). |
| [14] | 郑于莉,张蜀宁,王雅美,等. 秋水仙素离体双层诱导同源四倍体青花菜的研究[J]. 南京农业大学学报,2014,37(6):13-18. DOI:10.7685/j.issn.1000-2030.2014.06.003. Zheng Y L,Zhang S N,Wang Y M,et al. Study on in vito double-deck induction of autotetraploids in broccoli by colchicines[J]. Journal of Nanjing Agricultural University,2014,37(6):13-18(in Chinese with English abstract). |
| [15] | 任艳,王辉,石延茂,等. 不同预处理对花生根尖细胞有丝分裂制片的影响[J]. 花生学报,2008,37(2):28-31. Ren Y,Wang H,Shi Y M,et al. Effects of pretreatment on mitosis of root tip cells in peanut[J]. Journal of Peanut Science,2008,37(2):28-31(in Chinese with English abstract). |
| [16] | 李树贤. 植物同源多倍体育种的几个问题[J]. 西北植物学报,2003,23(10):1829-1841. Li S X. Several problems on autopolyploid breeding in plants[J]. Acta Botanica Boreali-Occidenta Sinica,2003,23(10):1829-1841(in Chinese with English abstract). |
| [17] | 杨英杰,葛蓓孛,魏倩,等. 秋水仙素诱导细叶百合多倍体研究[J]. 中国农业大学学报,2013,18(1):128-133. Yang Y J,Ge B Q,Wei Q,et al. Colchicines-induced polyploid plants and identification in Lilium pumilum DC[J]. Journal of China Agricultural University,2013,18(1):128-133(in Chinese with English abstract). |
| [18] | 王雅美,张蜀宁,郑于莉,等. 二、四倍体不结球白菜抗寒基因表达及生理生长特性[J].南京农业大学学报,2014,37(5):41-46. DOI:10.7685/j.issn.1000-2030.2014.05.007. Wang Y M,Zhang S N,Zheng Y L,et al. Expression of cold-related genes and physiological characteristics of the diploid and tetraploid non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University,2014,37(5):41-46(in Chinese with English abstract). |
| [19] | 杨德光,刘永玺,张倩,等. 作物渗透调节及抗渗透胁迫基因工程研究进展[J]. 作物杂志,2015(1):6-13. Yang D G,Liu Y X,Zhang Q,et al. Progress on crops osmotic adjustment and genetic engineering of osmotic stress resistance[J]. Crops,2015(1):6-13(in Chinese with English abstract). |
| [20] | 黄金艳,李文信,洪日新,等.不同染色体倍性甜瓜种子萌发特性研究[J]. 南方农业学报,2011,42(9):1108-1111. Huang J Y,Li W X,Hong R X,et al. Germination characteristics of melon seeds with different ploidy levels[J]. Journal of Southern Agriculture,2011,42(9):1108-1111(in Chinese with English abstract). |
| [21] | 孙鹏,李云,姜金仲,等.植物同源四倍体花器官及种子变异研究进展[J].植物研究,2011,31(2):249-256. Sun P,Li Y,Jiang J Z. Progress of variations in floral organs and seeds of autotetraploid plants[J]. Bulletin of Botanical Research,2011,31(2):249-256(in Chinese with English abstract). |




