文章信息
- 孟玲玲, 班晓敏, 张皓博, 张海彬. 2015.
- MENG Lingling, BAN Xiaomin, ZHANG Haobo, ZHANG Haibin. 2015.
- 烟曲霉震颤素C对小鼠的急性和亚慢性毒性试验
- Study on acute and aubchronic toxicities of fumitremorgin C in mice
- 南京农业大学学报, 38(6): 998-1002
- Journal of Nanjing Agricultural University, 38(6): 998-1002.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.06.019
-
文章历史
- 收稿日期: 2014-12-15
2. 启东市渔业技术推广站, 江苏 南通 226241;
3. 包头市动物疫病预防控制中心, 内蒙古 包头 014010
2. Fisheries Technology Extension Station of Qidong, Nantong 226241, China;
3. Animal Disease Prevention and Control Center of Baotou, Baotou 014010, China
烟曲霉震颤素(fumitremorgin,FT)主要是由烟曲霉产生的一类有毒代谢产物,包括烟曲霉震颤素A~N (FTA~FTN)、结构类似的震颤性真菌毒素、疣孢青霉原和TR-2等[1, 2]。其中FTA、FTB、FTC及疣孢青霉原较为常见。烟曲霉在世界范围内分布极广,尤以稻田、菜地土样中检出率高,在高温(40 ℃)时繁殖能力很强,为主要优势菌,极有可能污染粮食、蔬菜、饲料等,对人畜健康造成潜在威胁[2]。烟曲霉震颤素对大鼠、小鼠、家兔、猪、羊等中枢神经系统有较强毒性,可引起动物的强烈痉挛乃至死亡。报道显示烟曲霉震颤素可造成病禽的全身性痉挛强直和麻痹,最后中毒死亡,对火鸡还可以引起斜颈等其他神经症状[3, 4]。我国曾于1995—2000年间对多个省及地区的粮食及土壤中烟曲霉震颤素的污染状况进行了调查,检测结果表明,我国主要粮食中烟曲霉震颤素的平均检出率为6%,但被检测省份的土样检出率高于50%[5, 6, 7, 8, 9, 10],说明污染的范围非常广。本研究拟以小鼠为试验动物,进行FTC对小鼠的急性和亚慢性毒性试验研究,为制定FTC在饲料中的安全限量提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 受试药物
FTC标准品(FTC含量为98%)购自Sigma公司。取FTC标准品一瓶(250 μg)溶于1 mL二甲基亚砜(DMSO),配制成250 μg·mL-1的标准溶液,置4 ℃冰箱中避光保存,有效期为6个月。试验前用DMSO将FTC标准溶液稀释成各试验所需的相应浓度。
1.1.2 试剂
全自动生化试剂和吉姆萨染色液均购自南京建成科技有限公司。
1.1.3 试验动物
试验用清洁级ICR小鼠购自扬州大学比较医学中心;试验期间所有小鼠均投喂全价颗粒饲料。小鼠购买后适应饲养5 d。试验前小鼠隔夜空腹(一般禁食16 h左右,不限制饮水),染毒2 h后提供饲料。
1.2 试验方法
1.2.1 急性毒性试验预试验
根据改良寇氏法进行预试验。选用体质量18~22 g的健康小鼠,雌雄各半,随机分组,每组4只,雌雄各半。有报道[11]对小鼠静脉注射25 mg·kg-1剂量的FTC未出现死亡,据此将配制好的标准溶液稀释成试验所需不同浓度,进行预试验。采用经口灌胃给药法,一次性给予受试动物100 mL·kg-1。观察小鼠24 h内死亡情况,测定小鼠死亡率在0~100%的剂量范围。
1.2.2 急性毒性试验正式试验
根据预试验结果,将50只小鼠随机分成5组,每组10只,雌雄各半。采用经口灌胃给药法,一次性给予受试动物100 mL·kg-1。染毒后连续观察7 d,记录小鼠中毒症状、死亡数及供试小鼠内脏器官的病理变化情况。用改良寇氏法计算FTC的LD50及其95%的可信限。
1.2.3 亚慢性毒性试验
将100只小鼠随机分为5组,每组20只,雌雄各半。1~3组为试验组,即高剂量组(1/20 LD50)、中剂量组(1/40 LD50)、低剂量组(1/80 LD50),第4组为溶剂(DMSO)对照组,第5组为空白对照组。采用经口灌胃给药法,每天染毒剂量为100 mL·kg-1,连续染毒90 d,各组小鼠均自由采食和饮水。试验期间,每天观察小鼠情况,记录死亡数;定期给小鼠称体质量并计算各组变化;定期记录饲料消耗量,计算平均日采食量;最后一次染毒24 h后,对小鼠进行眼眶采血,进行血常规检测和血液生化检测;处死小鼠后,采取肝、肺、肾及脑制作石蜡切片,HE染色,进行病理组织学检查。
1.3 统计分析
采用Excel 2003和SPSS 17.0统计软件对试验数据进行处理与分析,比较试验组和对照组各观察指标的差异显著性。数据均以x±SE形式表示。
2 结果与分析
2.1 急性毒性试验预试验
经预试验得出,FTC全部致死最小剂量为105 mg·kg-1,全部不致死最大剂量为40 mg·kg-1,相邻两剂量间的比例为1 ∶ 1.27较为合适。设计正式试验各组的剂量分别为40.00、50.92、64.82、82.51和105.00 mg·kg-1。
2.2 急性毒性试验正式试验
部分小鼠灌胃FTC毒素30 min后出现震颤、呼吸缓慢等症状;随后在3~4 h内,小鼠表现为呼吸频率降低、跛行及躺卧,严重的则表现为癫痫,甚至死亡;用药24 h后未死亡的部分小鼠表现为不食或少食,闭眼伏地等症状;其余小鼠则逐渐恢复正常。对死亡小鼠进行剖检,肉眼观察到大脑不成形,肝脏质脆肿大。此外观察到小鼠胃肠膨胀,肠内容物呈黑色液体状,有刺激性气味,其他脏器无肉眼可见病变。
急性毒性试验结果(表 1)显示:FTC对小鼠的LD50为71.37 mg·kg-1,95%的可信限为64.13~79.38 mg·kg-1。
| 组别 Group | 动物数 Quantities | 剂量/(mg·kg-1) Dosage | 死亡数 Deaths | 死亡率/% Mortality |
| 1 | 10 | 40.00 | 0 | 0 |
| 2 | 10 | 50.92 | 1 | 10 |
| 3 | 10 | 64.82 | 3 | 30 |
| 4 | 10 | 82.51 | 7 | 70 |
| 5 | 10 | 105.00 | 10 | 100 |
2.3.1 死亡及中毒情况
试验组小鼠在饲喂FTC数日后,可见采食量下降。其中高剂量组表现明显,且小鼠有震颤表现,情况严重的震颤强烈,中后期陆续出现死亡,共死亡9只;未死亡小鼠,逐渐出现呼吸困难等症状。中剂量组,2只小鼠死亡,其余小鼠未出现异常震颤等行为。低剂量组小鼠活动、进食和饮水情况均正常,与空白对照组小鼠无明显差异。
2.3.2 FTC对小鼠采食量的影响
由表 2可知:高剂量组试验小鼠7 d和30 d采食量均显著低于空白对照组(P<0.05),60和90 d采食量均极显著低于空白对照组(P<0.01);中剂量组的采食量在开始1周内与空白对照组差异不显著,但随着试验时间的增加,较空白对照组显著降低;低剂量组与溶剂对照组虽然采食量有所减少,但与空白对照组差异不显著(P&lgt;0.05)。
| g | |||||
| 组别 Group | 试验时间/d Test time | ||||
| 0 | 7 | 30 | 60 | 90 | |
| 高剂量组High-dose group | 6.81±0.27a | 6.70±0.26a | 6.53±0.31a | 6.32±0.23Aa | 5.86±0.20Aa |
| 中剂量组Medium-dose group | 6.80±0.22a | 6.89±0.19b | 6.74±0.21b | 6.66±0.34Bb | 6.47±0.25Ab |
| 低剂量组Low-dose group | 6.80±0.23a | 6.90±0.18b | 7.08±0.23c | 7.19±0.19Bc | 7.41±0.25Bc |
| 溶剂对照组Solvent control group | 6.82±0.34a | 6.90±0.17b | 7.13±0.22c | 7.24±0.21Bc | 7.41±0.18Bc |
| 空白对照组Blank control group | 6.81±0.41a | 6.96±0.25b | 7.19±0.20c | 7.29±0.13Bc | 7.47±0.29Bc |
| 注:同列数据不同上标大、小写字母分别表示在0.01和0.05水平上差异极显著和显著。 Note:Different superscript capital and small letters in the same column mean significant difference at 0.01 and 0.05 levels. The same as follows. | |||||
由表 3可知:高剂量组试验小鼠90 d平均体质量极显著低于空白对照组(P<0.01);中剂量组试验小鼠的平均体质量显著低于空白对照组(P<0.05);低剂量组与溶剂对照组虽然体质量有所减轻,但与空白对照组差异不显著(P&lgt;0.05)。
| g | |||||
| 组别 Group | 试验时间/d Test time | ||||
| 0 | 30 | 60 | 90 | ||
| 高剂量组High-dose group | 18.82±0.16a | 24.96±0.19Aa | 28.79±0.64Aa | 32.68±0.12Aa | |
| 中剂量组Medium-dose group | 18.87±0.15a | 27.68±0.11Bb | 33.00±0.54Bb | 39.40±0.18Bb | |
| 低剂量组Low-dose group | 18.83±0.08a | 30.16±0.17Bc | 36.41±0.28Bc | 43.91±0.06Bc | |
| 溶剂对照组Solvent control group | 18.88±0.06a | 30.26±0.15Bc | 36.67±0.16Bc | 44.00±0.28Bc | |
| 空白对照组Blank control group | 18.78±0.12a | 30.29±0.70Bc | 36.91±0.14Bc | 44.41±0.29Bc | |
根据ICR小鼠血常规正常值范围,由表 4可知:高剂量组试验小鼠的白细胞总数、红细胞计数、血红蛋白和红细胞压积值比正常范围略高,中剂量组、低剂量组和溶剂对照组各指标均在正常值范围内。但随着FTC浓度的升高,血小板出现递降趋势,并且各剂量组间差异极显著并极显著低于空白对照组(P<0.01),而溶剂对照组与空白对照组差异不显著(P&lgt;0.05)。
| 组别 Group | 白细胞数/(109 L-1) White blood cell | 红细胞数/(1012 L-1) Red blood cell | 血红蛋白/(g·L-1) Haemoglobin | 血小板/(109 L-1) Plastocyte | 红细胞压积/(L·L-1) Hematokrit |
| 高剂量组High-dose group | 7.63±0.02a | 5.94±0.05a | 164.41±0.22Aa | 89.67±0.35Aa | 50.34±0.23Aa |
| 中剂量组Medium-dose group | 7.50±0.02b | 5.78±0.09b | 151.65±0.15Bb | 108.19±0.24Bb | 48.19±0.24Ab |
| 低剂量组Low-dose group | 7.41±0.03b | 5.38±0.38c | 149.14±0.35Bb | 146.17±0.30Cc | 45.97±0.07Bc |
| 溶剂对照组Solvent control group | 7.39±0.02b | 5.21±0.29d | 148.48±0.33Bb | 187.07±0.77Dd | 44.37±0.28Bc |
| 空白对照组Blank control group | 7.34±0.04c | 5.21±0.41d | 148.69±0.43Bb | 190.74±1.34Dd | 44.30±0.31Bc |
由表 5可知:高剂量和中剂量组试验小鼠的总蛋白及白蛋白量均显著低于空白对照组(P<0.05),其中高剂量组试验小鼠的总蛋白量极显著低于空白对照组(P<0.01);丙氨酸氨基转移酶和天门冬氨酸氨基转移酶活性呈现逐渐增加的趋势,且高剂量组和中剂量组 极显著高于空白对照组(P< 0.01);尿素氮和肌酐浓度也呈现逐渐增加的趋势,高剂量组和中剂量组显著高于空白对照组(P<0.05),低剂量组和溶剂对照组各指标与空白对照组差异不显著(P&lgt;0.05)。
| 组别 Group | 总蛋白/(g·L-1) Total protein | 白蛋白/(g·L-1) Albumin | ALT/ (U·L-1) | AST/ (U·L-1) | 尿素氮/(mmol·L-1) Urea nitrogen | 肌酐/(μmol·L-1) Creatinine |
| 高剂量组High-dose group | 55.14±1.38Aa | 32.71±0.23a | 54.07±0.11Aa | 264.53±3.40Aa | 10.19±0.02a | 58.01±0.13a |
| 中剂量组Medium-dose group | 62.87±1.08Bb | 36.30±0.37b | 46.42±0.40Bb | 223.73±0.67Bb | 9.30±0.25b | 56.09±0.07b |
| 低剂量组Low-dose group | 65.64±1.36Bbc | 38.54±0.35c | 38.76±0.11Cc | 197.88±2.67Cc | 9.04±0.03c | 55.45±0.29c |
| 溶剂对照组Solvent control group | 66.22±1.48Bc | 38.82±0.37c | 37.11±0.10Cd | 192.73±1.06Cd | 8.97±0.56c | 55.11±0.10c |
| 空白对照组Blank control group | 67.55±1.40Bc | 38.85±0.22c | 37.00±0.09Cd | 190.70±0.77Cd | 8.99±0.07c | 55.12±0.10c |
| 注:ALT:丙氨酸氨基转移酶Alanine aminotransferase;AST:关门冬氨酸氨基转移酶Aspartate aminotransfer | ||||||
中剂量和高剂量组试验小鼠大脑出现不同程度的水肿变性。随着剂量的增加,这种变性的程度逐渐增强,高剂量组试验小鼠脑细胞可见液化性坏死,细胞结构消失(图 1-A)。中剂量和高剂量组试验小鼠肺泡结构出现不同程度的破坏,中剂量组试验小鼠,肺泡间隔明显增宽,高剂量组试验小鼠肺泡结构破坏,成纤维细胞大量增生(图 1-B)。
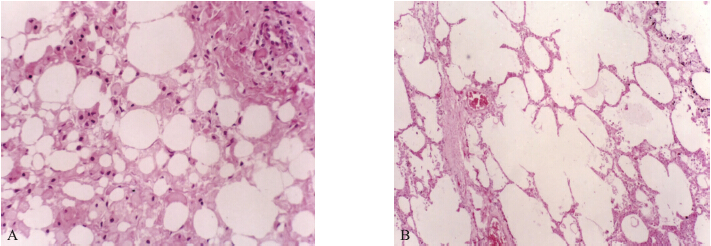 | 图 1 灌服高剂量FTC后死亡小鼠部分脏器病理组织学变化(×40,HE)Fig. 1 Pathomorphological change of mice tissues after high dosage FTC eaten(×40,HE)A.小鼠脑细胞出现液化性坏死The liquefaction necrosis were observed in the brain cells;B.小鼠肺泡结构破坏 The destroyed alveolar structure was observed in the mice. |
烟曲霉震颤素是一种重要的震颤性真菌毒素,能引起试验动物严重的震颤反应,能够减弱动物免疫功能、降低动物的生产性能甚至引起死亡,被认为与伐木工人病、串珠霉症、燕麦草蹒跚症、农民肺等人畜疾病有关[12, 13, 14]。有报道[11],FTC以25 mg·kg-1静脉注射小鼠,15 min内小鼠活动减弱,若被迫活动,出现震颤反应,身体左右摇摆且出现呼吸缓慢症状。
本试验的急性毒性试验结果表明:小鼠灌胃给FTC的LD50为71.37 mg·kg-1,95%可信限为64.13~79.38 mg·kg-1,根据外来化学物急性毒性分级标准[15]可知,FTC属于中等毒性物质。
亚慢性毒性试验结果表明:FTC对小鼠的毒性主要表现在神经系统、消化系统及呼吸系统。神经系统具体表现为高剂量组试验小鼠出现明显震颤表现,情况严重的震颤强烈,病理组织学检查可见液化性坏死,脑细胞结构消失;呼吸系统则具体表现为小鼠呼吸困难等症状,病理组织学检查发现中剂量组部分未死亡小鼠,肺泡间隔明显增宽;而高剂量组肺泡结构破坏,成纤维细胞大量增生。以上结果证明:FTC对小鼠具有呼吸系统毒性;消化系统具体表现为高剂量和中剂量组试验小鼠出现明显的采食量降低,增重降低,这表明灌胃FTC可能引起小鼠的食欲降低。病理剖检死亡小鼠可见肝脏质脆肿大,胃肠膨胀,肠内容物呈黑色液体状,有刺激性气味,这也证实了FTC对小鼠具有消化系统毒性。文献[16]中提及烟曲霉震颤素毒素作用的靶器官主要为神经系统,本试验中肝脏和肾脏病理组织学检查结果未观察到明显的病理变化,是否对肝脏和肾脏造成实质性损伤有待进一步研究。
综上所述,高剂量和中剂量FTC对小鼠有明显毒性作用,低剂量FTC对小鼠毒性反应不明显。长期大量食用含有FTC的有毒饲料,动物存在中毒隐患,临床上应加强对饲料中FTC的检测。关于饲料中FTC的安全限量需要进一步研究。
| [1] | Liu J Y,Song Y C,Zhang Z,et al. Aspergillus fumigatus CY018,an endophytic fungus in Cynodon dactylon as a versatile producer of new and bioactive metabolites[J]. J Biotechnol,2004,114:279-287 |
| [2] | 刘江. 震颤毒素研究进展[J]. 国外医学:卫生学分册,1992(3):155-158 [Liu J. Research progress of Fumitremorgins[J]. Foreign Medical Sciences:Section of Hygiene,1992(3):155-158(in Chinese)] |
| [3] | 李国勤,曹光荣. 禽曲霉菌病发病机理研究进展[J]. 陕西农业科学,1999(3):24-26 [Li G Q,Cao G R. Advances in the pathogenesis of avian aspergillosis[J]. Shaanxi Journal of Agricultural Sciences,1999(3):24-26(in Chinese)] |
| [4] | Hubben K. Case report:Aspergillus meningoencephalitis in turkeys and ducks[J]. Avian Dis,1958,2:110-115 |
| [5] | 魏桂兰,王子坚,赵萍,等. 贵州省粮食、土壤中烟曲霉震颤毒素的污染调查[J]. 中国公共卫生学报,1998,17(5):298 [Wei G L,Wang Z J,Zhao P,et al. Investigation of fumitremorgin infestation in food and soil of Guizhou Province[J]. Chinese Journal of Public Health,1998,17(5):298(in Chinese)] |
| [6] | 廖兴广,张秀丽,王爱月,等. 河南省粮食中伏马菌素、杂色曲霉素和烟曲霉震颤素污染状况研究[J]. 中国公共卫生学报,1999,18(1):46-47 [Liao X G,Zhang X L,Wang A Y,et al. Research of fumonisin sterigmatocystin and fumitremorgin infestation in food of Henan Province[J]. Chinese Journal of Public Health,1999,18(1):46-47(in Chinese)] |
| [7] | 刘桂华,赵共和,孙武长,等. 吉林省三种主粮中烟曲霉及其毒素污染状况的研究[J]. 卫生研究,1998,27(增刊):55 [Liu G H,Zhao G H,Sun W C,et al. Research of aspergillus fumigatus and toxins infestation in three kinds of staple food of Jilin Province[J]. Journal of Hygiene Research,1998,27(Suppl):55(in Chinese)] |
| [8] | 李军,李森,颜燕. 几种真菌毒素在山东省主粮中污染情况调查[J]. 粮食储藏,2000,29(2):42-44 [Li J,Li S,Yan Y. Investigation of mycotoxins infestation in main grain of Shandong Province[J]. Grain Storage,2000,29(2):42-44(in Chinese)] |
| [9] | 何树森,辛又川,刘金秀,等. 四川省部分主粮中霉菌及其毒素污染状况调查[J]. 预防医学情报杂志,1995,15(4):199-201 [He S S,Xin Y C,Liu J X,et al. Investigation of mold and toxins infestation in part of staple food of Sichuan Province[J]. Journal of Preventive Medicine Information,1995,15(4):199-201(in Chinese)] |
| [10] | 谢茂慧,杨晓敏,辛晓芳,等. 湖北省粮食中霉菌毒素调查分析[J]. 湖北预防医学杂志,2001,12(5):3-4 [Xie M H,Yang X M,Xin X F,et al. Investigation of mycotoxin infestation in food of Hubei Province[J]. Hubei Journal of Preventive Medicine,2001,12(5):3-4(in Chinese)] |
| [11] | Garimella T S,Ross D D,Eiseman J L,et al. Plasma pharmacokinetics and tissue distribution of the breast cancer resistance protein(BCRP/ABCG2)inhibitor fumitremorgin C in SCID mice bearing T8 tumors[J]. Cancer Chemother Pharmacol,2005,55:101-109 |
| [12] | Land C J,Hult K,Fuchs R,et al. Tremorgenic mycotoxins from Aspergillus fumigatus as a possible occupational health problem in sawmills[J]. Appl Environ Microbiol,1987,53(4):787-790 |
| [13] | 角田广,辰野高司,上野芳夫. 真菌毒素图解[M]. 孟昭赫,孙玉书,译. 北京:人民卫生出版社,1983:19-22 [Kakuta G,Takashi N,Yoshio U. Mycotoxins Graphic[M]. Meng Z H,Sun Y S,Translate. Beijing:People's Medical Publishing House,1983:19-22(in Chinese)] |
| [14] | 刘江,俞世荣,王玉华,等. 烟曲霉震颤素B的高效液相色谱检测方法的建立[J]. 卫生研究,1996,25(6):368-370 [Liu J,Yu S R,Wang Y H,et al. One-step HPLC method for the determination of fumitremorgin B in corn[J]. Journal of Hygiene Research,1996,25(6):368-370(in Chinese)] |
| [15] | GB 15193.3-2003 急性毒性试验[S]. 北京:中国标准出版社,2003 [GB 15193.3-2003 Acute Toxicity Test[S]. Beijing:Standards Press of China,2003(in Chinese)] |
| [16] | 王志. 动物真菌毒素中毒[J]. 中国兽医杂志,1992,18(10):42-46 [Wang Z. Mycotoxicosis in animls[J]. Chinese Journal of Veterinary Medicine,1992,18(10):42-46(in Chinese)] |
 2015, Vol. 38
2015, Vol. 38


