文章信息
- 李晓琳, 王勤, 朱振营, 吴绍强, 仇松寅, 刘晓飞, 孙敏, 潘登科, 林祥梅. 2015.
- LI Xiaolin, WANG Qin, ZHU Zhenying, WU Shaoqiang, QIU Songyin, LIU Xiaofei, SUN Min, PAN Dengke, LIN Xiangmei. 2015.
- 肌肉生成抑制素基因敲除猪多重PCR检测方法的建立
- Establishment of multiplex PCR for detection of myostatin knockout pigs
- 南京农业大学学报, 38(6): 993-997
- Journal of Nanjing Agricultural University, 38(6): 993-997.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.06.018
-
文章历史
- 收稿日期: 2015-04-27
2. 山东出入境检验检疫局, 山东 青岛 266002;
3. 中国农业科学院北京畜牧兽医研究所, 北京 100094
2. Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266002, China;
3. Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100094, China
近年来,动物转基因技术不断发展,已成功培育出转基因小鼠、兔、绵羊、猪、鱼、昆虫、牛、鸡、山羊等20多种转基因动物[1, 2, 3],也伴随着产生了转基因动物产品。2006年,欧洲药品管理局(European Medicines Agency,EMA)批准首个利用转基因山羊乳腺生物反应器生产的药物ATryn上市。目前,美国食品和药品管理局(Food and Drug Administration,FDA)正在考虑批准携带有生长激素基因的转基因鲑鱼上市。随着越来越多的转基因动物及产品进入商品化生产阶段,其安全性也受到了人们的广泛关注,核心问题集中于环境安全、动物健康与福利、人类健康与食品安全等方面[4],建立快速准确的转基因产品检测技术成为研究的热点。
转基因动物的检测体系尚未完善。目前,主要从DNA水平、转录水平[5]、翻译水平[6]和整体表型[7]进行检测,其中DNA水平的检测主要是PCR技术,它具有简单、快捷的特点。转基因动物的某些导入基因可能与内源性基因同源,而PCR具有高灵敏度的特点,利用单一PCR检测时常常出现假阳性结果。多重PCR(multiplex PCR)是在同一PCR反应体系里加上2对以上的引物,同时扩增出多个核酸片段的反应,可检测转基因样品中多种基因,尽可能地排除了假阳性或假阴性结果,目前已广泛应用于转基因动物 检测[8, 9]。肌肉生成抑制素(myostatin,MSTN),又称生长分化因子8(growth and differential factor-8,GDF-8),属于TGF-β家族,是骨骼肌生长和发育的负调控因子。MSTN基因的敲除有助于提高动物酮体的瘦肉率,达到提高饲料利用率、降低饲养成本的目的。目前国内外尚未见MSTN基因敲除猪检测方法的相关报道。本研究以MSTN基因敲除猪为研究对象,对β2-微球蛋白(β2-microglobulin,B2M)基因、标记基因新霉素磷酸转移酶(neomycin phosphotransferaseⅡ,NPTⅡ)基因和测定的边界序列建立多重PCR检测方法,以确定检测样品的种属,并检测是否为含有标记基因的转基因样品,也是对MSTN基因敲除猪检测方法的一种探索。
1 材料与方法
1.1 试验材料
本研究所用MSTN基因敲除的猪组织样本由中国农业科学院北京畜牧兽医研究所提供。牛、羊及非转基因猪样品购自北京朝阳区物美超市及周边市场,小鼠购自北京维通利华实验动物有限公司。
1.2 试剂
Taq DNA聚合酶、dNTPs及缓冲液均购自TaKaRa公司;pGEMT载体购自Promega公司;琼脂糖凝胶DNA纯化试剂盒、微量质粒抽提试剂盒购自OMEGA公司;QIAGEN DNA Mini Kit购自QIAGEN公司。
1.3 引物
根据GenBank中B2M基因序列(AF452448.1)设计猪内源基因B2M引物,以生产基因敲除猪的质粒设计 NPTⅡ基因引物,根据边界序列设计MSTN的品系特异性引物。用Beacon Designer 7.0设计引物,由Invitrogen公司合成。引物序列见表 1。
| 靶基因 Gene | 引物对序列(5′→3′) Primer pairs sequence | 退火温度/℃ Annealing temperature | 产物大小/bp Products size |
| B2M | CCGAAGGTTCAGGTTTACTC/ACTGATCCACAGCGTTAGG | 60 | 217 |
| MSTN | GAGATCAGCAGCCTCTGTTCC/AGCCTATTGAATTAGCACCATTGG | 60 | 619 |
| NPTⅡ | AGAGGCTATTCGGCTATG/TCTTCGTCCAGATCATCC | 60 | 433 |
利用QIAGEN公司QIAGEN DNA Mini Kit试剂盒提取样品的DNA,严格按照说明书进行操作。
1.5 内源基因和转基因成分的单一PCR验证
PCR反应体系(25 μL)为:10×PCR Buffer(含25 mmol·L-1 MgCl2)2.5 μL,dNTP(2.5 mmol·L-1)2 μL,上、下游引物(10 pmol·μL-1)各1 μL,Taq DNA聚合酶(5 U·μL-1)0.3 μL,基因组(100 mg·L-1)1 μL,ddH2O 17.2 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃ 10 min。PCR产物用15 g·L-1琼脂糖凝胶电泳进行鉴定后回收目的片段。将已纯化的目的基因片段连接到pGEMT载体,转化至E.coli DH5α中,挑取单克隆,PCR鉴定后送北京诺赛基因有限公司测序。
1.6 反应体系的优化
多重PCR反应体系(25 μL)为:10×PCR Buffer(含25 mmol·L-1 MgCl2)2.5 μL,dNTP(2.5 mmol·L-1)2 μL,B2M上、下游引物(10 pmol·μL-1)各0.45 μL,NPTⅡ上、下游引物(10 pmol·μL-1)各1.15 μL,MSTN上、下游引物(10 pmol·μL-1)各0.9 μL;Taq DNA聚合酶(5 U·μL-1)0.3 μL,基因组(100 mg·L-1)1 μL,ddH2O 14.2 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,分别于56 ℃、58 ℃、60 ℃、62 ℃各30 s,72 ℃ 30 s,共40个循环;72 ℃ 10 min。PCR产物用15 g·L-1的琼脂糖凝胶电泳进行鉴定。
1.7 特异性和敏感性试验
用上述方法对牛、羊、小鼠和非转基因猪样品进行检测,验证方法的特异性。
将MSTN基因敲除猪(100%)的基因组与非转基因猪的基因组进行配比混合,得到含20%、10%、5%、1%、0.5%和0.1% MSTN基因敲除猪基因组成分的样品,然后进行多重PCR检测,验证方法的敏感性。
1.8 样品检测
随机选择猪的肺(8个样本)和脾脏(24个样本),共计32个样本,利用QIAGEN DNA Mini Kit提取组织样品基因组后,用建立的方法进行检测。
2 结果与分析
2.1 内源基因和转基因成分的单一PCR验证结果
检测MSTN时,仅MSTN基因敲除猪扩增出条带;检测NPTⅡ时,仅MSTN基因敲除猪和转植酸酶基因猪扩增出条带,非转基因猪、牛和空白对照均未扩增出目的条带;检测B2M时,MSTN基因敲除猪、转植酸酶基因猪和非转基因猪均扩增出条带,牛基因组和阴性对照均未扩增出目的条带,与预期结果一致(图 1)。 将测序结果与GenBank序列进行BLAST比对,B2M与GenBank中猪B2M基因序列(AF452448.1) 相似性为100%,NPTⅡ基因与生产基因敲除猪的质粒序列相似性为100%,MSTN与测定的边界序列相似性为100%。
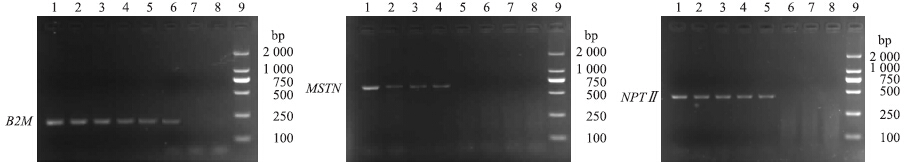 | 图 1 B2M、MSTN和NPTⅡ基因PCR扩增结果Fig. 1 The results of PCR amplification using primers of B2M,MSTN and NPTⅡ1~4.MSTN基因敲除猪MSTN knockout pigs samples;5.转植酸酶基因猪Recombinant salivary phytase transgene pig sample;6.非转基因猪Untransgenic pig sample;7.牛基因组Bovine genome sample;8.阴性对照Negative control;9.DNA分子质量标准DNA marker |
对退火温度、引物相对浓度、缓冲液浓度和Mg2+浓度进行优化的结果表明:引物浓度对扩增效率影响较大。反应体系为25 μL时,B2M引物(10 pmol·μL-1)为0.9 μL,NPTⅡ引物(10 pmol·μL-1)为2.3 μL,MSTN引物(10 pmol·μL-1)为1.8 μL时,MSTN基因敲除猪扩增出3条特异性条带,而非转基因猪仅扩增出B2M条带,空白对照未扩增出任何条带;退火温度对扩增效率影响较小,在56、58、60和62 ℃均能得到较好的扩增(图 2),最终选择56 ℃作为最优的退火温度。
 | 图 2 多重PCR检测方法的温度梯度扩增结果Fig. 2 The results of multiplex PCR amplified from gradient annealing temperature1~4.MSTN基因敲除猪温度梯度Gradient annealing temperature of MSTN knockout pig samples(56 ℃,58 ℃,60 ℃,62 ℃);5~6.非转基因猪 温度梯度Gradient annealing temperature of untransgenic pig samples(60 ℃,62 ℃);7.阴性对照Negative control;8.空白对照Blank control;9.DNA分子质量标准DNA marker |
用上述方法对牛、羊、小鼠和非转基因猪的基因组进行扩增,仅非转基因猪的基因组扩增出B2M条带,检测样品均无NPTⅡ和MSTN的扩增条带(图 3),说明该方法特异性较好。
 | 图 3 多重PCR检测方法的特异性结果Fig. 3 The specificity test results of multiplex PCR1.DNA分子质量标准DNA marker;2~4.猪基因组Pig genome samples;5.牛基因组Bovine genome sample;6.羊基因组Sheep genome sample;7.小鼠基因组Mouse genome sample;8.阴性对照Negative control |
用上述方法对含20%、10%、5%、1%、0.5%和0.1% MSTN基因敲除猪基因组成分的样品进行检测,结果(图 4)显示:含20%、10%、5%和1% MSTN基因敲除猪基因组成分的样品扩增出3条特异性条带,而含0.5%和0.1% MSTN基因敲除猪基因组成分的样品仅扩增出B2M的条带,说明本方法最低可检测出含1% MSTN基因敲除猪基因组成分的样本。
 | 图 4 多重PCR检测方法的敏感性结果Fig. 4 The sensitivity test results of multiplex PCR1~6.含20%、10%、5%、1%、0.5%和0.1% MSTN基因敲除猪基因组成分的样品Including 20%,10%,5%,1%,0.5% and 0.1% MSTN knockout pig genome samples;7.阴性对照Negative control;8.DNA分子质量标准DNA marker |
用上述方法对32份随机选择的猪肺和脾脏样品进行检测,结果(图 5)显示仅扩增出B2M条带,均无MSTN和NPTⅡ的扩增条带。
 | 图 5 市售猪肺和脾脏样品的多重PCR检测结果Fig. 5 Detection on spleen and lung tissue samples of pig by multiplex PCR1,37.DNA分子质量标准DNA marker;2~21,23~26.猪脾脏组织样品Spleen tissue samples of pig;22.阴性对照Negative control;27~34.猪肺脏组织样品Lung tissue samples of pig;35.空白对照Blank control;36.阳性对照Positive control |
多重PCR是转基因动物检测中常用的技术,马馨等[9]和朱振营等[8, 10]建立了针对转基因牛和猪的多重PCR检测方法。本试验针对B2M、标记基因NPTⅡ和测定的边界序列设计引物,对退火温度、缓冲液浓度和Mg2+浓度等进行了优化,发现其均对多重扩增效率影响较小,而引物浓度对PCR反应的影响较大。本试验在反应条件摸索阶段,在PCR反应体系中加入相同摩尔的引物,MSTN扩增条带较弱,而B2M的扩增条带与单一PCR反应的扩增条带无明显差异。对各种引物的量进行优化,对于扩增条带较弱的引物,增加了引物量;对于扩增条带强的内参基因,降低它的引物量,得到了3条特异性条带,与朱振营等[10]对多重PCR的缓冲液浓度、退火温度和引物浓度的优化结果一致。
B2M基因是仔猪研究中常用的内参基因[11],王继英等[12]对β肌动蛋白(β-actin,ACTB)、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、B2M、TATA结合蛋白(TATA-binding protein,TBP)、核糖体蛋白L4(ribosomal protein L4,RPL4)和肽基脯氨酰异构酶A(peptidylprolyl isomerase A,PPIA)共6个常用的内参基因进行筛选,结果发现B2M是最稳定表达的内参基因。研究过程中可通过检测B2M基因的有无鉴定基因组提取的优劣,同时避免了检测过程假阴性结果的出现。NPTⅡ[13]是转基因技术中常用的标记基因,正常动物自身不携带这种基因,对其进行检测可初步筛查是否为携带这种标记基因的转基因动物。研究过程中,对转植酸酶基因猪进行检测时,扩增出NPTⅡ基因的目的条带,说明此品系转基因猪中携带NPTⅡ标记基因。
MSTN作为骨骼肌中一种主要的肌肉生长负调控因子[14],其通过调节靶基因的表达,改变肌肉的纤维组成(红、白肌的比例)及引起肌肉质量的变化。随着转基因技术的不断发展,国内外在载体构建方面做了大量的研究工作,获得了MSTN基因敲除细胞系[15, 16, 17]。应用建立的多重PCR方法对市售猪组织样品进行检测,仅扩增出内参基因B2M的条带,MSTN和NPTⅡ均未扩增出条带,与预期的结果一致,表明抽取样品的市场中无此品系转基因猪流通。
目前国内外尚未见MSTN基因敲除猪检测方法的报道,本试验针对具有商品化前景的MSTN基因敲除猪建立多重PCR检测方法,为此品系转基因猪的检测提供了技术储备,同时也为相关检测标准的建立提供了参考。
| [1] | Bai H,Wang Z X,Hu R,et al. A 90-day toxicology study of meat from genetically modified sheep overexpressing TLR4 in sprague-dawley rats[J]. PLoS ONE,2015,10(4):e0121636 |
| [2] | Li X P,Yang Y,Bu L,et al. Rosa 26-targeted swine models for stable gene over-expression and Cre-mediated lineage tracing[J]. Cell Research,2014,24(4):501-504 |
| [3] | Lyall J,Irvine R M,Sherman A,et al. Suppression of avian influenza transmission in genetically modified chickens[J]. Science,2011,331(6014):223-226 |
| [4] | 许建香,李宁. 转基因动物生物安全研究与评价[J]. 生物工程学报,2012,28(3):267-281 [Xu J X,Li N. Biosafety assessment of genetically engineered animals:a review[J]. Chin J Biotech,2012,28(3):267-281(in Chinese with English abstract)] |
| [5] | Decock J,Hendrickx W,Thirkettle S,et al. Pleiotropic functions of the tumor- and metastasis-suppressing matrix metalloproteinase-8 in mammary cancer in MMTV-PyMT transgenic mice[J]. Breast Cancer Research,2015,17:38 |
| [6] | Huang Y J,Huang Y,Baldassarre H,et al. Recombinant human butyrylcholinesterase from milk of transgenic animals to protect against organophosphate poisoning[J]. Proc Natl Acad Sci USA,2007,104(34):13603-13608 |
| [7] | Lucocq J M. Efficient quantitative morphological phenotyping of genetically altered organisms using stereology[J]. Transg Res,2007,16(2):133-145 |
| [8] | 朱振营,李风翠,林祥梅,等. 转人乳铁蛋白基因奶牛多重PCR检测方法的研究[J]. 中国畜牧兽医,2011,38(11):73-76 [Zhu Z Y,Li F C,Lin X M,et al. Multiple PCR detection of exogenous gene in hLF transgenic cow[J]. Chinese Animal Husbandry and Veterinary Medicine,2011,38(11):73-76(in Chinese with English abstract)] |
| [9] | 马馨,陈奕冰,张鹏,等. 转基因小鼠的多重PCR快速检测方法的建立[J]. 中国兽医学报,2013,33(9):1403-1406,1416 [Ma X,Chen Y B,Zhang P,et al. The establishment of rapid multiple PCR method for detection of transgenic mice[J]. Chin J Vet Sci,2013,33(9):1403-1406,1416(in Chinese with English abstract)] |
| [10] | 朱振营,林祥梅,刘建,等. 转人溶菌酶基因奶牛多重PCR快速检测方法的建立[J]. 中国畜牧兽医,2011,37(6):40-43 [Zhu Z Y,Lin X M,Liu J,et al. Development of multiplex PCR detection of human lysozyme gene in transgenic cow[J]. Chinese Animal Husbandry and Veterinary Medicine,2011,37(6):40-43(in Chinese with English abstract)] |
| [11] | 台玉磊,韩立强,杨国庆,等. 仔猪组织基因表达中实时定量PCR内参基因的选择[J]. 农业生物技术学报,2010,81(4):732-736 [Tai Y L,Han L Q,Yang G Q,et al. Selection of the reference genes of real-time quantitative PCR in the gene expression of piglet tissues[J]. Journal of Agricultural Biotechnology,2010,81(4):732-736(in Chinese with English abstract)] |
| [12] | 王继英,王彦平,郭建凤,等. 仔猪外周血中内参基因的筛选及细胞因子和受体的表达水平[J]. 中国农业科学,2015,48(7):1437-1444 [Wang J Y,Wang Y P,Guo J F,et al. Selection of reference genes and determination of cytokines and receptor mRNA expression in peripheral blood of piglets[J]. Scientia Agricultura Sinica,2015,48(7):1437-1444(in Chinese with English abstract)] |
| [13] | 岳运锋,吴刚,武玉花,等. 转基因植物中标记基因定性PCR检测方法研究[J]. 中国油料作物学报,2011,33(3):280-289 [Yue Y F,Wu G,Wu Y H,et al. Development of qualitative PCR method targeting marker genes in transgenic plants[J]. Chinese Journal of Oil Crop Sciences,2011,33(3):280-289(in Chinese with English abstract)] |
| [14] | McPherron A C,Lee S J. Double muscling in cattle due to mutations in the myostatin gene[J]. Proc Natl Acad Sci USA,1997,94(23):12457-12461 |
| [15] | Huang X J,Zhang H X,Wang H L,et al. Disruption of the myostatin gene in porcine primary fibroblasts and embryos using Zinc-finger nucleases[J]. Mol Cells,2014,37(4):302-306 |
| [16] | 高飞,唐成程,全龙泉,等. 猪MSTN基因敲除载体的构建及细胞筛选[J]. 中国兽医学报,2013,33(1):142-145 [Gao F,Tang C C,Quan L Q,et al. Construction of MSTN knock-out porcine vector and MSTN knock-out porcine fetal fibroblast[J]. Chin J Vet Sci,2013,33(1):142-145(in Chinese with English abstract)] |
| [17] | 曹随忠,岳成鹤,李西睿,等. 锌指核酸酶技术制备肌肉生长抑制素基因敲除的五指山小型猪成纤维细胞[J]. 遗传,2013,35(6):778-785 [Cao S Z,Yue C H,Li X R,et al. Production of myostatin gene knockout Wuzhishan miniature pig fibroblasts with zinc-finger nucleases[J]. Hereditas,2013,35(6):778-785(in Chinese with English abstract)] |
 2015, Vol. 38
2015, Vol. 38


