文章信息
- 崔晓双, 王伟, 张如, 张瑞福. 2015.
- CUI Xiaoshuang, WANG Wei, ZHANG Ru, ZHANG Ruifu. 2015.
- 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究
- Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects
- 南京农业大学学报, 38(6): 958-966
- Journal of Nanjing Agricultural University, 38(6): 958-966.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.06.013
-
文章历史
- 收稿日期: 2015-04-28
微生物肥料又称生物肥料、菌肥或接种剂,是一类以微生物生命活动及其产物导致农作物得到特定肥料效应的微生物活体制品[1, 2]。现代生态农业和有机农业对非化学肥料的需求及人们环境保护意识的提高,使微生物肥料的开发和研究具有巨大的潜力[3]。菌种资源的收集与保存是发展微生物肥料的根本,因此,筛选优良菌株至关重要。
在现代农业中,能直接或间接促进植物生长的根际微生物称为植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)[4]。它们是促生微生物肥料的主要菌种类群,一般通过多种机制促进植物生长,如溶磷、产铁载体、生物固氮、产植物激素、诱导系统性抗性、促进植物与有益微生物共生及产抗生素等[5]。关于植物根际促生菌的筛选,目前应用最广泛的方法是对根际土壤悬浮液中获得的大量根际细菌进行体外促生能力测定,剔除一部分菌株,保留具有促生潜力的菌株。然而此方法不仅工作量大且存在一定的局限性,往往会出现在实验室条件下有效的一些PGPR菌株回接至根际条件后却失去原有作用的现象。张小兰等[6]的研究指出,溶磷菌的筛选不仅要考虑其溶磷能力,还有必要基于菌株在植物根际的定殖能力。可见,PGPR菌株在根际土壤中的定殖和竞争能力对其发挥应有的功能具有非常关键的作用。此外,也有直接对大量的根际细菌进行平皿幼苗促生试验,根据对幼苗的促生效果筛选PGPR菌株的方法,如杨蓉等[7]的筛菌方法,但此方法的工作量繁重。而本研究主要立足于筛菌工作量大及根际竞争能力差的问题,引入新的初筛标准筛选植物根际促生菌。
微生物肥料主要在根际发挥植物促生作用,而根际是一个独特的环境,受宿主植物根系分泌物和根际脱落物的影响。微生物肥料的功能发挥受土著微生物的竞争和根际复杂环境的调控,提高根际竞争定殖能力是保障微生物肥料功能稳定发挥的前提。根系分泌物是指在一定生长条件下,活的且未被扰动的植物根释放到根际环境中的有机物的总称,为微生物提供重要的能量物质[8]。根围内的各类微生物每时每刻都在争夺着这一生境中有限的营养。某些PGPR可抢占作物根表的一些分泌物较多、水分湿度大、适合细菌生长和繁殖的有利位点,有效地利用根际营养和根系分泌物[9],实现根际定殖。本研究采取基于根际竞争能力的筛选策略,以利用植物根系分泌物为唯一营养的生长速度作为初筛标准,同时结合传统的PGPR筛选方法,即辅之各种促生特性的比较和平皿幼苗促生试验的评价,选择促生效果好的PGPR菌株进行盆栽试验验证促生效果,以期为微生物肥料优良菌种资源的收集提供有效的筛选策略并为作物专一性微生物肥料的生产提供优良菌种。
1 材料与方法1.1 材料
1.1.1 根际土壤样品来源及前期处理
根际土壤样品采样时间为2013年5—6月,采集我国不同省份(山东省、四川省、海南省、江苏省、贵州省、内蒙古自治区和新疆维吾尔自治区)长期种植玉米、黄瓜、番茄的7个土壤样品,采样深度为5~20 cm,采回的土壤盛于盆钵中,调节含水量至田间最大持水量的60%。
玉米(京甜紫花糯)、黄瓜(津春四号)、番茄(苏红2003)种子经表面消毒(75%乙醇浸泡1 min,3%次氯酸钠浸泡3 min,无菌水冲洗5~6次)催芽2 d后,一部分播于装有不同土壤样品的盆钵中(种植作物种类与原土壤种植作物一致),富集根际优势微生物,于30 ℃温室(光/暗培养时间为16 h/8 h)种植30 d后,用于促生细菌的分离。另一部分用于水培收集植物根系分泌物,参照Ma等[10]的方法进行,将种子(玉米20粒、黄瓜30粒或番茄50粒)播于装有3 L 1/4 MS培养基[11]的带网筛5 L塑料桶中,每种作物各3桶,每3 d换液1次,种植30 d后收集根系分泌物。收集前夜将1/4 MS培养基换为去离子水,第2天于光照下培养6 h,将收集得到的根系分泌物冻干,称质量,使根系分泌物的终质量浓度为20 mg · L-1。
1.1.2 初筛培养基
不同植物的根系分泌物过0.22 μm滤膜除菌后置于60 ℃水浴预热,40 g ·L-1琼脂培养基高压蒸汽灭菌后水浴冷却至60 ℃,然后二者以体积比为1 ∶ 1混合即得初筛培养基。3种作物(玉米、番茄、黄瓜)的根系分泌物分别配成3种不同的初筛培养基用于不同作物专一性根际促生菌的筛选。
1.1.3 盆栽供试基质
基质为兴农有机栽培基质(镇江兴农有机肥有限公司生产),有机质150~200 g · kg-1,总养分30~50 g · kg-1,pH 5.5~7.5,电导率1~3 ms · cm-1,总孔隙度60%~80%,容重280~350 kg · m-3。
1.2 PGPR菌株初筛
分别取7个土样所种作物,轻轻拔出植株,抖落根上松散的附着土,自根茎处剪断,称取10 g植物根系及其根际土置于盛有灭菌玻璃珠和90 mL无菌水的锥形瓶中,28 ℃、170 r · min-1振荡30 min,得到根际土壤悬浮液,梯度浓度稀释,涂布于相应植物根系分泌物配制的初筛培养基上(选择10-4、10-5、10-6 3个梯度进行涂布,每个梯度3次重复),28 ℃倒置培养18 h,挑取生长迅速、不同形态的单个典型菌落,即获得对根际营养竞争能力强的菌株,经LB平板划线纯化3~4次,分别编号并加入体积分数为15%的灭菌甘油于-70 ℃保藏待用。
1.3 PGPR菌株促生特性研究
1.3.1 NH3产生能力的测定
1.3.2 嗜铁素产生能力的测定
1.3.3 IAA产生能力的测定
参照Glickmann等[16]的方法。
1.3.4 溶磷能力的测定
待测各菌株在LB液体培养基中活化,取1 mL培养液,6 000 r · min-1离心5 min,弃上清液,菌体用无菌水洗涤3次后重悬,采用滴下法点接到植酸酶固体培养基(phytase screening medium)[17]上,28 ℃培养60 h,根据溶磷圈直径(HD)与菌落直径(CD)的比值(HD/CD)判定该菌是否具有溶解有机磷的能力。另将待测菌株接入磷酸盐液体培养基(NBRIP)[6],以不接菌为空白对照,28 ℃、170 r · min-1振荡培养7 d,钼锑抗比色法定量测定溶磷含量[18]及对应pH值。
1.4 平皿幼苗复筛
筛选方法参照Piromyou等[19]的方法稍作修改。操作在无菌条件下进行,玉米、番茄、黄瓜种子经表面消毒(同1.1.1节)晾干备用。将分离纯化后的菌株接种到LB液体培养基中,于28 ℃、170 r · min-1振荡培养24 h,无菌水洗涤菌体后重悬,对菌液进行适当稀释,使其终浓度为107 CFU · mL-1。将消毒后的种子置于装有湿润滤纸的灭菌培养皿中,根据菌株来源,不同菌株的菌悬液各取1 mL加入装有相对应种子的培养皿中,以加入等量无菌水为对照,每个处理重复3次。置于28 ℃光照培养箱(光/暗培养时间为16 h/8 h)定期观察种子萌发情况,4~7 d后根据生长情况复筛促生菌株。
1.5 盆栽试验
盆栽试验2014年5—7月于南京农业大学牌楼实验中心进行,结合菌株的促生特性和平皿复筛结果,各选择3种作物中的4株菌株,共12株菌用于盆栽促生试验。3种作物的种子经表面消毒(同1.1.1节)、催芽后播种于育苗盘,待幼苗长出2~3片真叶后,挑选大小、长势一致的幼苗移入装有灭菌栽培基质和蛭石质量比为1 ∶ 1混合的塑料盆中,每盆500 g基质,移栽1株幼苗。供试菌株接种于LB液体培养基,28 ℃、170 r · min-1振荡培养至对数期,将菌悬液用无菌水洗涤3次后重悬。每盆加5 mL菌悬液,每10 d接菌1次,接种终浓度为106 CFU · g-1,以加入等量无菌水为对照。每处理6~8次重复,随机区组排列,放置于温室且在自然光照下培养。
植物种植40 d后采样,采样前先用SPAD-502仪测量各处理的叶绿素相对含量,然后将作物整株从盆中取出,清水洗净,吸水纸吸干,装入封口袋,置于冰盒中保鲜,带回实验室分析。测量各试验组和对照的各种形态学参数,并用根系扫描仪(LA1600+scanner,Canada)扫描获得根系图像后,用根系分析软件(Winrhizo 2003 b,Canada)进行相关根系指标分析。
1.6 PGPR菌株种类鉴定
待测各菌株在LB液体培养基中培养至对数期,用OMEGA公司的细菌DNA提取试剂盒提取细菌的 基因组DNA。以总DNA为模板,采用通用引物27F/1492R[20](正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′; 反向引物:5′-GGTTACCTTGTTACGACTT-3′)进行16S rDNA扩增。25 μL反应体系:PCR Mix 12.5 μL,上、下游引物各1 μL,模板1 μL,无菌水9.5 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物切胶回收后,委托美吉生物工程(上海)有限公司测序,测序结果在RDP数据库中进行比对,选取同源性较高的序列使用MEGA 4.1软件构建系统发育树,采用1 000次重复取样进行Bootstrap检验,确定菌株的分类地位。
1.7 数据处理
数据处理采用Microsoft Office Excel 2007,统计分析采用SPSS BASE ver.11.5软件。
2 结果与分析2.1 PGPR菌株的初筛结果
采用玉米、番茄、黄瓜的根系分泌物配成的初筛培养基,分别从相对应的7个植物根际样品中分离纯化出24株菌,这些菌株的编号及相关信息如表 1所示。
| 土样来源省份及宿主植物 Source of soil sample and host plant | 菌株编号 Strain code | 培养基 Medium |
| 山东番茄根际Shandong tomato rhizosphere | SDtB,SDtC,SDtF,SDtG | 番茄根系分泌物培养基Tomato root exudates medium |
| 贵州番茄根际Guizhou tomato rhizosphere | GZtB,GZtC,GZtD,GZtE | 番茄根系分泌物培养基Tomato root exudates medium |
| 内蒙古玉米根际Inner Mongolia maize rhizosphere | NMGmA,NMGmD,NMGmE | 玉米根系分泌物培养基Maize root exudates medium |
| 新疆玉米根际Xinjiang maize rhizosphere | XJmD,XJmG | 玉米根系分泌物培养基Maize root exudates medium |
| 四川玉米根际Sichuan maize rhizosphere | SCmA,SCmB,SCmD,SCmE,SCmF | 玉米根系分泌物培养基Maize root exudates medium |
| 海南黄瓜根际Hainan cucumber rhizosphere | HNcB,HNcG,HNcH,HNcI | 黄瓜根系分泌物培养基Cucumber root exudates medium |
| 江苏黄瓜根际Jiangsu cucumber rhizosphere | JScB,JScG | 黄瓜根系分泌物培养基Cucumber root exudates medium |
试验分别测定了24株菌株的多项促生指标(表 2),其中具有产氨能力的有14株,占所筛菌株的58.3%;产IAA的有20株,占所筛菌株的83.3%;可产铁载体的有12株,占所筛菌株的50.0%;具有溶解有机磷能力的有15株,占所筛菌株的62.5%;所筛各菌株均有一定的溶解无机磷的能力,但差异很大。不同菌株的促生效应也不尽相同。其中:JScB菌株的IAA产量最大,达到了73.28 mg · L-1;HNcB菌株溶磷能力最强,达到了200.05 mg · L-1。从图 1中可以看出,细菌溶磷量与培养液pH值呈显著负相关,说明本研究中所得溶磷能力较好的菌株其溶磷机制可能与菌株产酸有关。
| 菌株编号 Strain code | 产氨Ⅰ,Ⅳ NH3 production | 铁载体Ⅱ,Ⅳ Siderophore production | HD/CDⅢ,Ⅳ | IAA产量Ⅲ,Ⅳ/(mg·L-1) IAA production | 溶磷量Ⅲ,Ⅴ/(mg·L-1) Soluble phosphate |
| NMGmA | ++ | + | 2.11±0.22 | - | 80.12±4.32(5.61±0.32) |
| NMGmD | - | + | 1.45±0.08 | 26.59±0.29 | 90.57±3.65(5.35±0.18) |
| NMGmE | ++ | - | 1.57±0.06 | 50.77±2.26 | 133.33±5.34(5.18±0.19) |
| XJmD | ++ | + | - | 19.55±0.23 | 93.68±1.61(5.26±0.22) |
| XJmG | +++ | ++ | 1.40±0.03 | 36.62±0.58 | 28.94±0.16(6.65±0.08) |
| SCmA | + | + | - | 25.33±0.37 | 104.90±2.42(5.29±0.27) |
| SCmB | +++ | - | 1.63±0.13 | 40.82±0.49 | 25.16±0.75(6.64±0.33) |
| SCmD | +++ | +++ | 2.44±0.26 | 22.42±1.03 | 19.14±0.59(6.33±0.31) |
| SCmE | ++ | ++ | - | 35.35±0.62 | 81.47±1.57(5.16±0.18) |
| SCmF | - | - | 1.24±0.04 | - | 144.51±5.66(4.99±0.40) |
| JScB | - | - | - | 73.28±5.12 | 111.80±3.52(5.50±0.46) |
| JScG | +++ | +++ | 1.44±0.12 | 29.42±0.89 | 35.08±1.83(6.61±0.39) |
| HNcB | - | - | 1.12±0.01 | 51.95±1.28 | 200.05±4.54(4.82±0.22) |
| HNcG | ++ | + | - | 30.85±0.36 | 100.94±2.42(5.33±0.32) |
| HNcH | - | - | 1.25±0.05 | 43.68±0.75 | 174.10±3.59(4.86±0.05) |
| HNcI | ++ | +++ | - | - | 135.72±1.57(4.74±0.35) |
| GZtB | - | - | 2.46±0.33 | 41.37±0.67 | 167.59±0.97(5.35±0.24) |
| GZtC | - | - | - | 52.75±0.98 | 26.75±0.74(6.59±0.48) |
| GZtD | ++ | - | 1.42±0.14 | 16.32±0.21 | 25.12±0.53(6.13±0.35) |
| GZtE | - | - | - | 61.33±2.35 | 20.89±0.62(5.90±0.38) |
| SDtB | - | + | - | 35.03±0.65 | 78.20±1.84(5.37±0.21) |
| SDtC | +++ | - | 1.21±0.09 | 43.11±1.55 | 176.69±2.79(4.84±0.33) |
| SDtF | - | - | 1.36±0.07 | - | 163.89±1.21(5.23±0.19) |
| SDtG | +++ | +++ | 1.46±0.11 | 24.18±0.26 | 36.56±0.99(5.79±0.21) |
| 注: 1) Ⅰ.从“+++”到“+”表示产氨能力由强到弱(根据颜色变化);Ⅱ.从“+++”到“+”表示产铁载体能力由强到弱(根据As/Ar);Ⅲ.数值表示平均值±标准误;Ⅳ.“-”表示没有观测到该项指标;Ⅴ.括号中的数据表示培养液pH的平均值±标准误。 2)HD:溶磷圈直径;CD:菌落直径。 Note: 1) Ⅰ. From“+++”to“+”represent different amount of ammonia production from strong to weak(according to color differences);Ⅱ.From“+++”to“+”represent different amount of siderophore production from strong to weak(according to As/Ar);Ⅲ.Values are means±standard error(SE);Ⅳ.“-”represent no corresponding indexes;Ⅴ.Values in parenthesis represent pH(x±SE)of culture solution. 2)HD:Hydrolysis diameter;CD:Colony diameter. | |||||
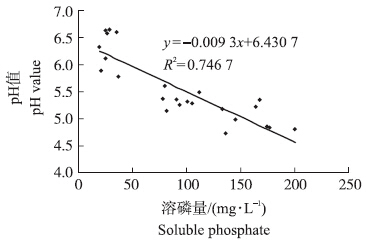 | 图 1 细菌溶磷量与培养液pH值的相关性Fig. 1 Relationship between soluble phosphate and pH value of culture solution |
根据种子萌发及幼苗生长情况进行平皿复筛,筛选结果显示:对玉米有较好促生作用的菌株为SCmB、SCmD、NMGmA、XJmG;对番茄有较好促生作用的菌株为SDtC、SDtG、GZtB、GZtE;对黄瓜有较好促生作用的菌株为HNcB、HNcH、JScB、JScG。图 2显示:相对于对照,经HNcB菌株处理的黄瓜幼苗根长,须根或根毛较多。从图 3可知:接种GZtB菌株的番茄幼苗与不接菌相比,发芽情况好且根较长;经SCmB菌株处理的玉米幼苗相比对照而言,幼根较长。
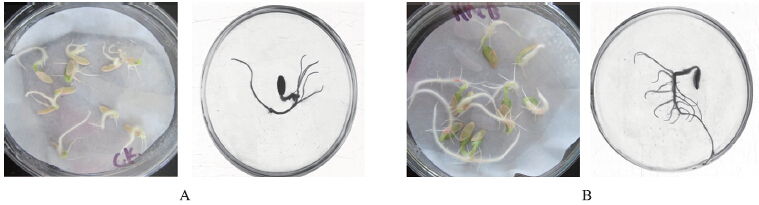 | 图 2 HNcB菌株对黄瓜幼苗生长的影响Fig. 2 Effects of strain HNcB on the growth of cucumber seedlingsA.对照Control;B.HNcB菌株处理Strain HNcB treatment |
 | 图 3 GZtB和SCmB菌株对番茄和玉米幼苗生长的影响Fig. 3 Effects of strain GZtB and SCmB on the growth of tomato and maize seedlingsA.对照Control;B.GZtB和SCmB菌株分别处理番茄与玉米幼苗Tomato and maize seedlings inoculated with strain GZtB and strain SCmB,respectively. |
2.4.1 PGPR对作物株高的影响
玉米、番茄、黄瓜种植40 d后,测量各试验组和对照植株的形态学参数(表 3)。玉米接种SCmB、SCmD和XJmG 3株菌后其株高与对照相比差异显著,分别增加了15.04%、13.10%和14.01%。番茄接种促生菌SDtC、SDtG和GZtB后与对照相比在株高上有显著差异,分别增加了27.99%、26.36%和30.92%。接种促生菌JScB、JScG、HNcB、HNcH显著增加了黄瓜的株高,与对照相比分别增加了10.32%、9.40%、10.48%和6.38%。
2.4.2 PGPR对作物生物量及叶片叶绿素相对含量的影响接种促生菌SCmB、SCmD、NMGmA、XJmG显著促进了玉米的生长,与对照相比在地上部鲜质量和干质量、根干质量等方面有显著差异,分别增加了41.10%~52.65%、38.67%~56.44%和33.09%~66.91%。接种SCmB菌株的玉米苗,其SPAD值与各处理差异显著。番茄接种促生菌SDtC、SDtG、GZtB、GZtE后,在地上部鲜质量和干质量、根干质量、SPAD值等方面与对照相比均有显著差异,分别增加了38.58%~45.53%、35.04%~66.42%、76.92%~138.46%和6.22%~7.02%。接种促生菌JScB、JScG、HNcB、HNcH于黄瓜后,地上部鲜质量增加了17.49%~29.44%,与对照相比有显著差异。地上部干质量与根干质量分别增加了12.63%~24.74%和17.78%~34.44%,SPAD值在各处理与对照间差异不显著(表 3)。
2.4.3 PGPR对作物根系形态的影响供试PGPR菌株对玉米、番茄、黄瓜的根系形态影响显著(图 4)。玉米接种促生菌SCmB、SCmD、NMGmA、XJmG后,总根长和根表面积与对照相比分别增加了6.21%~19.98%和19.28%~43.01%。番茄接种促生菌SDtC、SDtG、GZtB、GZtE后,与对照相比总根长和根表面积分别增加了16.42%~25.91%和30.63%~44.64%。接种促生菌JScB、JScG、HNcB、HNcH显著增加了黄瓜的总根长和根表面积,与对照相比分别增加了12.12%~21.20%和17.49%~29.44%。
| 作物 Crop | 处理 Treatment | 株高/cm Shoot height | 地上部鲜质量/g Shoot fresh weight | 地上部干质量/g Shoot dry weight | 根干质量/g Root dry weight | SPAD值 SPAD value |
| 玉米 | CK | 106.63±3.18b | 38.44±3.25b | 6.75±0.53b | 1.39±0.09c | 35.73±0.96b |
| Maize | SCmB | 122.67±3.06a | 58.68±5.75a | 10.56±1.79a | 2.32±0.12a | 37.13±0.25a |
| SCmD | 120.60±3.50a | 54.24±2.13a | 9.36±0.26a | 1.85±0.05b | 36.03±0.86ab | |
| NMGmA | 111.83±3.88b | 55.82±4.02a | 9.64±1.01a | 2.18±0.10a | 35.97±0.71ab | |
| XJmG | 121.57±3.61a | 57.76±2.33a | 9.86±0.44a | 2.21±0.17a | 36.13±0.59ab | |
| 番茄 | CK | 45.37±5.46b | 12.52±0.88b | 1.37±0.17c | 0.13±0.04b | 32.17±0.35b |
| Tomato | SDtC | 58.07±4.47a | 17.87±0.64a | 1.97±0.22b | 0.26±0.06a | 34.43±0.87a |
| SDtG | 57.33±3.21a | 17.45±0.34a | 2.02±0.13b | 0.28±0.02a | 34.20±0.46a | |
| GZtB | 59.40±5.57a | 18.22±0.32a | 2.28±0.25a | 0.31±0.06a | 34.40±0.95a | |
| GZtE | 53.70±4.97ab | 17.35±0.59a | 1.85±0.11b | 0.23±0.04a | 34.17±0.85a | |
| 黄瓜 | CK | 144.73±2.97b | 37.85±1.05b | 3.88±0.23b | 0.90±0.07b | 37.20±0.53a |
| Cucumber | HNcB | 159.90±4.71a | 47.93±5.53a | 4.84±0.51a | 1.21±0.11a | 37.87±1.36a |
| HNcH | 153.97±3.59a | 43.70±1.61a | 4.37±0.21ab | 1.06±0.11ab | 37.30±0.98a | |
| JScB | 159.67±4.51a | 45.83±0.39a | 4.55±0.08a | 1.10±0.14ab | 37.87±0.68a | |
| JScG | 158.33±4.73a | 44.99±1.52a | 4.49±0.28a | 1.09±0.19ab | 37.33±0.45a | |
| 注:不同字母表示不同处理间数值在0.05水平差异显著。 Note:Different letters represent significant differences in different treatment at 0.05 level. | ||||||
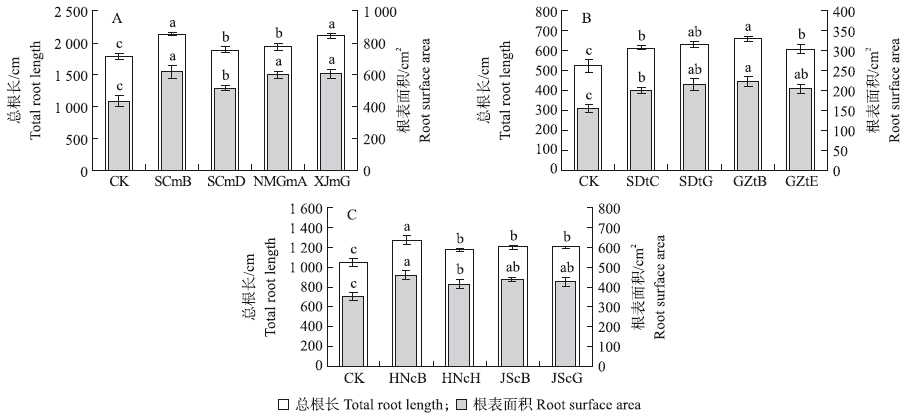 | 图 4 植物根际促生菌对玉米(A)、番茄(B)和黄瓜(C)根系形态的影响Fig. 4 Effects of PGPR on the root morphology of maize(A),tomato(B)and cucumber(C) |
将所筛12株菌株的16S rDNA序列提交NCBI比对,根据与待测菌株同源性较高的菌株名称,初步鉴定菌株种属。结果显示:12株菌株中,SCmB、NMGmA、XJmG、SDtG和JScG属于芽孢杆菌属(Bacillus);JScB、HNcB和GZtE属于剑菌属(Ensifer);GZtB和SCmD属于根瘤菌属(Rhizobium);SDtC属于苍白杆菌属(Ochrobactrum);HNcH属于微杆菌属(Microbacterium)(图 5)。
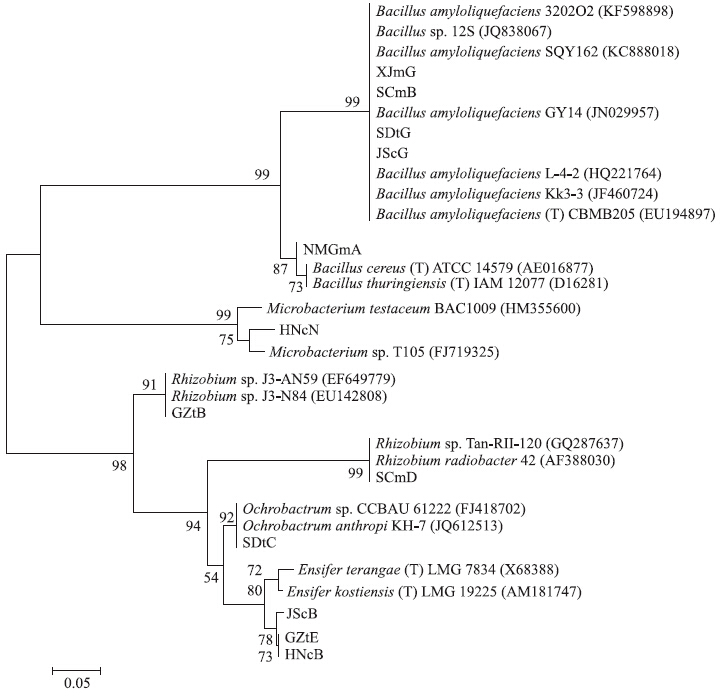 | 图 5 12株植物根际促生菌的16S rDNA序列系统发育树Fig. 5 Phylogenetic tree of 12 PGPR by using 16S rDNA sequences |
近年来,因新型微生物肥料开发对菌种的需求,使植物根际促生菌的筛选成为研究热点。在根际环境中,植物与微生物形成的有益互作关系是植物健康生长和维持土壤肥力的关键因素[21]。荣良燕等[22]通过测定植物根际促生菌株固氮酶活性、溶磷量、分泌植物生长素、对病原菌的拮抗作用及菌株生长速度,筛选出了5株具有较好促生特性的优良菌株,利用筛选的优良促生菌研制的复合微生物接种剂替代20%~30%的化肥,玉米株高、地上植物量、穗长、穗粗、单位面积穗数、穗粒数和经济产量等均有提高。杨蓉等[7]从番茄、黄瓜、茄子、辣椒4种蔬菜作物的根际土壤中分离PGPR菌株,经平皿初筛,分别筛选出对黄瓜幼苗和番茄幼苗生长有显著促生作用的细菌11株和5株,再经营养钵促生试验筛选出2株对黄瓜和番茄幼苗均具有显著促生作用的PGPR菌株。本研究在PGPR菌株的筛选过程中不仅考虑了菌株的多种促生特性和平皿促生表现,同时引入了菌株在根际的竞争生长能力作为初筛标准,根据对根系分泌物竞争能力的强弱先初筛出对根际营养具有高竞争能力的菌株,它们可在植物根际快速生长繁殖,抢占有利位点,促进根际定殖,发挥促生功能。这步初筛大大减少了PGPR菌株筛选的工作量,最终复筛出的优良菌株在盆栽试验中也都表现出良好的促生效果。因此利用根系分泌物筛选植物根际促生菌的方法是可行的。
PGPR一般通过产生长素、产嗜铁素、溶磷等多种机制促进植物生长。吲哚乙酸(IAA)是一种重要的植物激素,在较低浓度下就可以促进细胞的伸长生长。大部分PGPR均能够产生IAA,它可以促进植物根系的生长发育。本研究所筛菌株的产IAA量为16.32~73.28 mg · L-1,而且80%以上的初筛菌株具有产IAA能力,显示产植物激素IAA是PGPR植物促生的主要因素之一[23]。铁元素是大多数生物体的必需元素之一,但土壤中能够被生物直接利用的铁元素很少,PGPR可以合成嗜铁素与铁结合,从而被植物吸收利用,促进生长。本研究分离的24株菌中有12株可以产生嗜铁素,且其中4株产铁载体能力较强。磷是植物生长发育必需的营养元素之一,植物吸收磷素主要来源于土壤。然而,由于磷元素在土壤中通常是以难溶盐的形态存在,导致绝大多数土壤中有效磷缺乏。植物根际存在很多种溶磷菌,可以提高难溶态磷的有效性,直接促进植物生长,但不同菌株的溶磷能力有较大差异。本研究所筛菌株的溶磷量为19.14~200.05 mg · L-1,其中11株溶磷量超过100 mg · L-1。
本研究基于根际竞争能力的初筛策略,同时结合传统的PGPR筛选方法,最终所筛12株根际细菌在盆栽试验中表现出良好的促生效果,为促生微生物肥料的研发提供了菌种资源。尽管本研究引入的初筛程序减少了筛菌的部分工作量,但尚存在改进之处,因为PGPR菌株对根系分泌物的竞争和利用能力只是其可以定殖于植物根际的间接证据,针对从某种植物根际筛选得到的PGPR菌株,其回接至宿主植物后是否具有最强的定殖能力和促生效果,本研究并没有设计相应试验进行直接证明。下一步有必要通过根际定殖试验研究所筛菌株在不同植物根际的定殖能力,以完善此筛菌程序。此外,本研究的筛菌工作仅考虑到了所筛菌株与其宿主植物两者间的关系,下一步还有必要将土壤状况考虑在内,分析所筛株种、植物及土壤三者间的关系,以进一步提高其潜在利用价值。
| [1] | 葛诚. 微生物肥料生产应用基础[M]. 北京:中国农业科技出版社,2000:1-28 [Ge C. Production Application of Microbial Fertilizer[M]. Beijing:China Agricultural Science and Technology Press,2000:1-28(in Chinese)] |
| [2] | 张瑞福,颜春荣,张楠,等. 微生物肥料研究及其在耕地质量提升中的应用前景[J]. 中国农业科技导报,2013,15(5):8-16 [Zhang R F,Yan C R,Zhang N,et al. Studies on microbial fertilizer and its application prospects in improving arable land quality[J]. Journal of Agricultural Science and Technology,2013,15(5):8-16(in Chinese with English abstract)] |
| [3] | 刘静洋,崔松松,韩国民,等. 棉花根际细菌的生理活性和促生效果[J]. 中国土壤与肥料,2013(6):88-92 [Liu J Y,Cui S S,Han G M,et al. Physiological activity and promoting effects of rhizobacteria on cotton[J]. Soil and Fertilizer Sciences in China,2013(6):88-92(in Chinese with English abstract)] |
| [4] | Se-Weon L,Seo-Hyun L,Balaraju K,et al. Growth promotion and induced disease suppression of four vegetable crops by a selected plant growth-promoting rhizobacteria(PGPR)strain Bacillus subtilis 21-1 under two different soil conditions[J]. Acta Physiologiae Plantarum,2014,36:1353-1362 |
| [5] | Bhattacharyya P N,Jha D K. Plant growth-promoting rhizobacteria(PGPR):emergence in agriculture[J]. World Journal of Microbiology and Biotechnology,2012,28:1327-1350 |
| [6] | 张小兰,韦中,梅新兰,等. 一种基于根际定殖能力筛选溶磷菌的方法[J]. 南京农业大学学报,2014,37(2):79-84. doi:10.7685/j.issn.1000-2030. 2014.02.013 [Zhang X L,Wei Z,Mei X L,et al. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains[J]. Journal of Nanjing Agricultural University,2014,37(2):79-84(in Chinese with English abstract)] |
| [7] | 杨蓉,房世杰,杨文琦,等. 植物根际促生细菌(PGPR)分离筛选与鉴定[J]. 新疆农业科学,2011,48(12):2337-2342 [Yang R,Fang S J,Yang W Q,et al. Sieving and identification of plant growth-promoting rhizobacteria[J]. Xinjian Agricultural Sciences,2011,48(12):2337-2342(in Chinese with English abstract)] |
| [8] | 高子勤,张淑香. 连作障碍与根际微生态研究.Ⅰ. 根系分泌物及其生态效应[J]. 应用生态学报,1998,9(5):549-554 [Gao Z Q,Zhang S X. Continuous cropping obstacle and rhizospheric microecological.Ⅰ. Root exudates and their ecological effects[J]. Chinese Journal of Applied Ecology,1998,9(5):549-554(in Chinese with English abstract)] |
| [9] | 刘淑琮,冯炘,于洁. 植物根际促生菌的研究进展及其环境作用[J]. 湖北农业科学,2009,48(11):2882-2887 [Liu S C,Feng X,Yu J. Research progress of plant growth-promoting rhizobacteria and its environmental effects[J]. Hubei Agricultural Sciences,2009,48(11):2882-2887(in Chinese with English abstract)] |
| [10] | Ma J F,Ueno H,Ueno D,et al. Characterization of phytosiderophore secretion under Fe deficiency stress in Festuca rubra[J]. Plant and Soil,2003,256:131-137 |
| [11] | Murashige T,Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures[J]. Acta Physiologia Plantarum,1962,15:473-497 |
| [12] | Dye D W. The inadequacy of the usual determinative tests for identification of Xanthomonas spp.[J]. New Zealand Journal of Science,1962,5:393-416 |
| [13] | 康贻军,程洁,梅丽娟. 植物根际促生菌的筛选及鉴定[J]. 微生物学报,2010,50(7):853-861 [Kang Y J,Cheng J,Mei L J,et al. Screening and identification of plant growth-promoting rhizobacteria[J]. Acta Microbiologica Sinica,2010,50(7):853-861(in Chinese with English abstract)] |
| [14] | Schwyn B,Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,1987,160:47-56 |
| [15] | 林天兴,唐梅,黄明远,等. 高产铁载体棉田土壤细菌SS05的筛选与鉴定[J]. 微生物学通报,2012,39(5):668-676 [Lin T X,Tang M,Huang M Y,et al. Screening and identification of a high yield siderophores-producing bacteria SS05 isolated from cotton soil[J]. Microbiology,2012,39(5):668-676(in Chinese with English abstract)] |
| [16] | Glickmann E,Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology,1995,61(2):793-796 |
| [17] | Kerovuo J,Lauraeus M,Nurminen P,et al. Isolation,characterization,molecular gene cloning,and sequencing of a novel phytase from Bacillus subtilis[J]. Applied and Enviromental Microbiology,1998,64(6):2079-2085 |
| [18] | Ribeiro C M,Cardoso E J B N. Isolation,selection,and characterization of root-associated growth promoting bacteria in Brazil Pine(Araucaria angustifolia)[J]. Microbiological Research,2012,167(2):69-78 |
| [19] | Piromyou P,Buranabanyat B,Tantasawat P,et al. Effect of plant growth promoting rhizobacteria(PGPR)inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand[J]. European Journal of Soil Biology,2011,47:44-54 |
| [20] | 李引,虞丽,李辉信,等. 一株花生根际促生菌的筛选鉴定及其特性研究[J]. 生态与农村环境学报,2012,28(4):416-421 [Li Y,Yu L,Li H X,et al. Isolation,identification and characteristics of a peanut growth-promoting strain of Rhizobacteria[J]. Journal of Ecology and Rural Environment,2012,28(4):416-421(in Chinese with English abstract)] |
| [21] | Rana A,Saharan B,Joshi M,et al. Identification of multi-trait PGPR isolates and evaluating their potential as inoculants for wheat[J]. Annals of Microbiology,2011,61:893-900 |
| [22] | 荣良燕,姚拓,黄高宝,等. 植物根际优良促生菌(PGPR)筛选及其接种剂部分替代化肥对玉米生长影响研究[J]. 干旱地区农业研究,2013,31(2):59-65 [Rong L Y,Yao T,Huang G B,et al. Screening of plant growth promoting rhizobacteria strains and effects of inoculant on growth of maize by replacing part of chemical fertilizers[J]. Agricultural Research in the Arid Areas,2013,31(2):59-65(in Chinese with English abstract)] |
| [23] | Shao J H,Xu Z H,Zhang N,et al. Contribution of indole-3-acetic acid in the plant growth promotion by the rhizosphere strain Bacillus amyloliquefaciens SQR9[J]. Biology and Fertility Soils,2015,51:321-330 |
 2015, Vol. 38
2015, Vol. 38


