文章信息
- 羊杏平, 张曼, 徐锦华, 刘广, 姚协丰, 李苹芳. 2015.
- YANG Xingping, ZHANG Man, XU Jinhua, LIU Guang, YAO Xiefeng, LI Pingfang. 2015.
- 西瓜幼苗根系发育过程中的蛋白质组分析
- Proteomic analysis on root growth and development of watermelon seedlings
- 南京农业大学学报, 38(6): 901-907
- Journal of Nanjing Agricultural University, 38(6): 901-907.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.06.005
-
文章历史
- 收稿日期: 2015-06-05
蛋白质组学是后基因组时代生命科学研究的重要方法和核心内容之一[1]。通过差异蛋白质组的研究,从蛋白功能水平上对植株不同生理状态下的蛋白质组进行比较和鉴定,了解植株代谢调控动态,揭示植物生长以及发育调控机制等具有重要意义。近年来,蛋白质双向电泳技术已广泛应用于植物生长发育、抗逆调控等的研究[2, 3, 4, 5, 6]。
西瓜(Citrullus lanatus)是一类重要的瓜果类经济作物。目前,西瓜基因组测序已完成[7],有关西瓜分子生物学的研究将逐渐成为研究热点。应用蛋白质双向电泳技术研究西瓜的差异蛋白质组学已有报道。Yoshimura等[8]对西瓜根系响应干旱胁迫的蛋白质组进行研究,发现根形态建成相关蛋白和碳/氮代谢蛋白、木质素合成相关蛋白和分子伴侣蛋白分别在根系受胁迫的早期和后期发挥主要作用。杨冬冬[9]研究发现,南瓜砧、葫芦砧和野生西瓜砧嫁接后,西瓜叶片中分别有24、62和57个蛋白被鉴定为上调蛋白,13、18和10个蛋白质点被鉴定为下调蛋白,其中16个蛋白质点在3个砧木嫁接处理中表现明显的易调控性,证明嫁接可以诱导产生新的抗病蛋白质。Yang等[10]对盐胁迫下的葫芦-西瓜嫁接苗和自根苗进行了蛋白质组学研究,发现嫁接或盐胁迫诱导了40个差异表达蛋白,这些蛋白分别参与了光合碳循环、氨基酸生物合成、碳水化合物和能量代谢、活性氧保护系统、激素及信号转导。以上有关西瓜蛋白质组学研究的报道都是围绕西瓜抗逆、嫁接后砧穗互作等方面,而利用蛋白质组技术开展西瓜根系生长发育调控的研究报道甚少。本研究以西瓜幼苗期不同发育时期的根为材料,结合蛋白质双向电泳技术和质谱鉴定技术研究西瓜根系不同发育时期的蛋白质表达谱变化,以期获得可能与西瓜幼苗期根系生长发育相关的重要蛋白,为深入研究西瓜生长发育机制提供参考依据。
1 材料与方法 1.1 植物材料西瓜品种为‘苏蜜1号’,由江苏省农业科学院蔬菜研究所提供。将西瓜种子置于55 ℃温汤浸种 4 h,清洗干净后用纱布包裹,于28 ℃催芽2~3 d,露白后播于消毒的营养基质中,置于人工气候箱(28 ℃/18 ℃,光/暗周期16 h/8 h,湿度70%)中培养。分别取7、15和20 d的西瓜根系,迅速用液氮冷冻,保存于-70 ℃备用。
1.2 蛋白质提取与浓度测定采用TAC-丙酮法[11]提取西瓜根系总蛋白。蛋白沉淀冷冻干燥,再以适量蛋白裂解液[含7 mol · L-1 Urea(尿素)、2 mol · L-1 Thouirea(硫脲)、40 g · L-1 CHAPS(3-(3-胆固醇氨丙基)二甲基氨基-1-丙磺酸)、1%(体积分数)Cocktail、65 mmol · L-1 DTT(二硫苏糖醇)、2%IPG Buffer(pH 3~10)]裂解,涡旋1 h,使蛋白充分溶解。采用Bradford法[12]进行蛋白定量。
1.3 蛋白质双向电泳采用Ettan IPGphorⅡIEF等电聚焦仪(GE Healthcare)进行第一向等电聚焦(IEF),13 cm pH4-7NL IPG胶条(GE Healthcare),样品上样量为800 μg。等电聚焦参数为20 ℃溶胀12 h;20 ℃等电聚焦,每个胶条最大电流50 mA;聚焦程序为:100 V 1 h,250 V 1 h,500 V l h,1 000 V l h,8 000 V 1 h,8 000 V 48 000 V · h,500 V 12 h。
等电聚焦完成后,对胶条进行2次平衡。每次平衡15 min。其中平衡 液Ⅰ含 10 g · L-1 DTT,50 mmol · L-1 Tris-HCI(pH 8.8),6 mol · L-1 Urea,30% Glycerol(甘油),20 g · L-1SDS。平衡液Ⅱ含25 g · L-1 IAA(碘乙酰胺),50 mmol · L-1 Tris-HCl(pH 8.8),6 mol · L-1 Urea,30% Glycerol,20 g · L-1 SDS。
第二向采用SDS-PAGE凝胶(分离胶浓度为12.5%,厚度为1 mm)电泳,先以低功率每根胶条2 W电泳60 min,然后再以每根胶条15 W电泳6 h。采用考马斯亮蓝R-250法[13]染色测定。双向电泳试验重复3次。
1.4 差异蛋白质点的质谱鉴定和检索分析用ImageScanner凝胶成像系统进行扫描,ImageMaster 2D Platinum 6.0(GE Healthcare)软件比较分析差异表达的蛋白质点。将差异表达蛋白质点割胶进行串联质谱(MALDI-TOF/TOF)鉴定,将得到的质谱鉴定信息用Mascot软件检索数据库(http://smart.embl-heidelberg.de)分析蛋白质结构及功能域。
1.5 候选差异表达蛋白的RT-qPCR验证以西瓜不同发育时期的根系为材料,采用RNApure Plant Kit(含DNaseⅠ,北京康为世纪生物科技有限公司)提取根系总RNA,用BU-Superscript RT Kit(Biouniquer,北京康为世纪生物科技有限公司)反转录为cDNA,以此为模板进行候选差异表达蛋白的RT-qPCR分析。荧光定量采用SuperReal PreMix(SYBR Green,天根生化科技有限公司)荧光定量PCR试剂和ABI PRISM7300实时定量PCR仪。反应结束后分析荧光值变化曲线和熔解曲线,采用2-ΔΔCT法分析数据,确定基因的相对表达量。每个样品设3个重复,在同一个批次完成内参基因和目标基因的PCR反应,试验重复3次。
2 结果与分析 2.1 不同发育时期西瓜根系蛋白质双向电泳分析分别取生长7、15和20 d的西瓜根样品,提取根系总蛋白进行双向电泳分析,获得电泳图谱。采用ImageMaster软件(GE)对2-DE图谱分析,在等电点4.0~7.0和蛋白质相对分子质量(10.0~170.0)×103的范围内,7、15和20 d的2-DE图谱上分别分离到(690±10)个、(710±12)个和(700±10)个清晰可见、重复性表达的蛋白质点。对3个不同发育时期西瓜根系蛋白质点的表达丰度进行差异检测,共得到12个差异表达蛋白质点(图 1)。
 |
图 1 不同发育时期西瓜根系蛋白质双向电泳图谱Fig. 1 Comparison of proteome patterns of watermelon roots at different development stagesr1~r12:西瓜根系不同发育时期的差异表达蛋白质点 r1-r12:Differentially expressed protein spots of watermelon roots at different developmental stages. The same as follows. |
进一步对12个差异表达蛋白的表达丰度进行比较,根据各个蛋白质点的表达趋势,可分为5种类型。第1类:共4个蛋白质点(r2、r4、r10、r11),表达丰度随着西瓜根系的生育进程表现持续升高的趋势(图 2-A);第2类:共2个蛋白质点(r1和r12),随着生育进程表现逐渐降低的趋势(图 2-B);第3类:共2个蛋白质点(r6和r8),表现为先升高再降低的趋势,在生长15 d时表达被诱导,随后至20 d时表达量逐渐下降(图 2-C);第4类:共3个蛋白质点(r3、r5、r9),表现为先降低再升高的趋势,随着西瓜根系生育进程的变化,在生长15 d时表达被抑制,随后至20 d时表达量逐步回升(图 2-D);第5类:1个蛋白质点(r7),在7 d时高表达,随着根系生长,表达量下降,随后一直保持较低的水平稳定表达(图 2-E)。
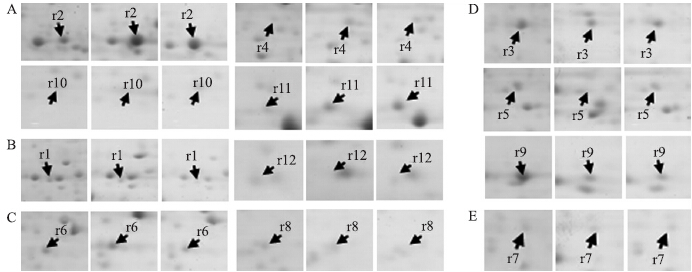 |
图 2 西瓜根系不同发育时期差异表达蛋白质点局部放大图Fig. 2 Close view of differentially expressed protein spots of watermelon roots at different development stagesA.表达量升高的蛋白质点;B.表达量下降的蛋白质点;C.表达量先升高再降低的蛋白质点;D.表达量先降低再升高的蛋白质点;E.表达量降低后平稳表达的蛋白质点 A.Up-regulated proteins;B.Down-regulated proteins;C.Proteins with levels increased first and then decreased;D.Proteins with levels decreased first and then increased;E.Proteins with levels decreased first and then constantly express |
为进一步了解上述差异表达蛋白质点的种类和功能,将上述12个差异蛋白质点挖点、酶解后进行MALDI-TOF/TOF质谱分析,再采用MASCOT软件对质谱信息进行数据库查询。其中,11个蛋白质点被成功鉴定(表 1)。基于质谱鉴定结果,1个蛋白质点鉴定为功能未知蛋白,其余10个差异蛋白质点按其功能可归纳为4大功能类群:蛋白质生物合成(20%)、代谢相关(40%)、防御应答(30%)和GA信号途径(10%)。
| 蛋白质点编号 Spot No. | 登录号 Accession No. | 蛋白名称 Protein name | 相对分子 质量Mr | 等电点 pI | 物种 Species | 得分 Score | 序列覆盖率/% Coverage rate |
| 蛋白质生物合成Protein synthesis |
| r1 | Cla020930 | 天冬氨酰-tRNA合成酶 Aspartate-tRNA synthetase | 60 971 | 5.73 | 西瓜 Citrullus lanatus | 453 | 21 |
| r12 | Cla015328 | 40S核糖体蛋白S12 40S ribosomal protein S12 | 14 851 | 5.76 | 西瓜 Citrullus lanatus | 131 | 37 |
| 代谢相关Metabolism-related protein |
| r2 | gi|99698 | 谷氨酰胺合成酶 Glutamine synthetase | 40 932 | 5.40 | 拟南芥 Arabidopsis thaliana | 405 | 12 |
| r3 | gi|449445580 | 丙酮酸脱氢酶E1元件β亚基 Pyruvate dehydrogenase E1 component subunit beta,mitochondrial-like | 39 680 | 5.60 | 黄瓜 Cucumis sativus | 354 | 26 |
| r8 | Cla005951 | 酸性磷酸酶 Acid phosphatase | 29 877 | 5.91 | 西瓜 Citrullus lanatus | 221 | 20 |
| r9 | gi|197916899 | 抗坏血酸过氧化物酶 Ascorbate peroxidase | 27 418 | 5.31 | 甜瓜 Cucumis melo | 390 | 24 |
| 防御应答Defense response |
| r5 | Cla016930 | 醛-酮还原酶 Aldo-keto reductase 1 | 38 003 | 5.86 | 西瓜 Citrullus lanatus | 335 | 19 |
| r10 | Cla016932 | 茉莉酸诱导蛋白1 Jasmonate-induced protein 1 | 23 670 | 5.95 | 西瓜 Citrullus lanatus | 133 | 15 |
| r11 | Cla002537 | 茉莉酸诱导蛋白2 Jasmonate-induced protein 2 | 21 955 | 6.18 | 西瓜 Citrullus lanatus | 335 | 28 |
| GA信号传导GA-signalling |
| r6 | Cla010253 | 赤霉素受体GID1L2 Gibberellin receptor GID1L2 | 35 271 | 5.65 | 西瓜 Citrullus lanatus | 356 | 27 |
| 其他蛋白Other protein |
| r7 | Cla010432 | NSP蛋白 Nitrile-specifier protein | 35 274 | 5.15 | 西瓜 Citrullus lanatus | 461 | 25 |
为了验证蛋白水平的表达丰度变化是否与mRNA水平的变化一致,或是否与转录后调控有关,从10个已知功能的差异表达蛋白中随机选取4个可能与防御相关的目标蛋白(r6、r9、r10、r11)进行了RT-qPCR验证。结果(图 3)表明:随着生育进程的变化,赤霉素受体GID1L2(r6)基因的表达呈现逐渐降低的趋势,20 d时表达量最低,降幅为60%(图 3-A)。与赤霉素受体基因GID 1L2 的表达模式不同,茉莉酸诱导蛋白1(r10)基因的表达则表现为逐渐升高的趋势,至20 d时表达量升高了45%(图 3-B)。抗坏血酸过氧化物酶(r9)基因的表达模式在西瓜根系不同生育阶段变化较大,15 d时表达量较7 d的表达量急剧降低,降幅为71%;随后表达量略有回升,至20 d时表达量较15 d增加了31%,但仍低于7 d的表达水平(图 3-C)。茉莉酸诱导蛋白2(r11)基因的表达模式与赤霉素受体基因GID 1L2 相同,随着生育进程的变化,表达量逐渐降低,但降幅(37%)比赤霉素受体基因GID 1L2 平缓,20 d时表达量最低(图 3-D)。
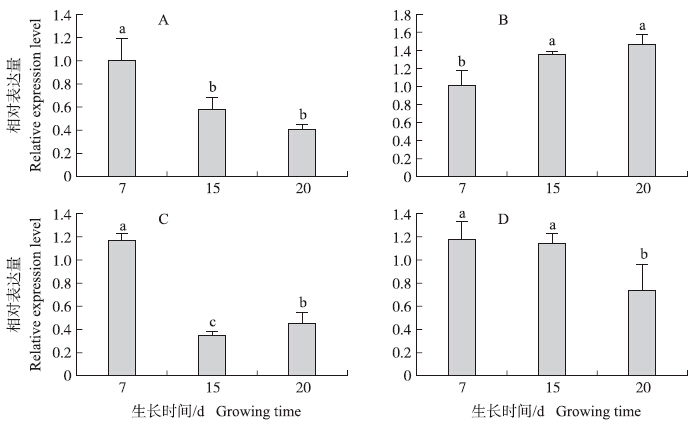 |
图 3 候选蛋白基因在西瓜根系不同发育时期的表达分析Fig. 3 Quantification of candidate proteins in watermelon roots at different development stages1) A.赤霉素受体基因GID 1L2 ;B.茉莉酸诱导蛋白1基因;C.抗坏血酸过氧化物酶基因;D.茉莉酸诱导蛋白2基因 A.Gibberellin receptor gene GID 1L2 ;B.Jasmonate-induced protein 1 gene;C.Ascorbate peroxidase gene;D.Jasmonate-induced protein 2 gene 2)不同小写字母表示差异显著(P<0.05). Different small letters indicate significant difference at 0.05 level. |
蛋白质是细胞功能的执行者,当细胞环境发生变化时,蛋白表达也随之变化,以应对环境的刺激。在整个生物体中,不同发育阶段植株体内酶类降解过程、物质合成途径、细胞循环、单一细胞的作用等会发生相应变化[14]。蛋白质合成是植物体内十分必要的生理调节过程。在植物生长的不同阶段或逆境胁迫下,体内蛋白的表达会发生变化,促进植株生长、增强抗逆的蛋白质大量合成,而在逆境下发生变性的蛋白质则被降解。本研究鉴定出2个与蛋白质合成相关的蛋白质点,分别为天冬氨酰-tRNA合成酶(r1)和40S核糖体蛋白S12(r12)。核糖体蛋白是蛋白质合成过程中所必需的,除参与蛋白质生物合成之外,还具有其他核糖体外功能,如参与细胞分裂、增殖及调控植物发育等[15, 16]。这2个蛋白在西瓜幼苗根系中,随着根系生育进程的变化,表达量逐渐下降。
植物在生长发育过程中会受到各种环境因子的胁迫。土壤温度、水分、盐类浓度、氧气、土壤微生物等对西瓜根系生长有直接的影响,而西瓜根系的生长与植株地上部的生长发育有关,对西瓜抗病、早熟和丰产具有重要作用[17]。本研究中鉴定到3个与防御相关的蛋白,分别为醛-酮还原酶(r5)、茉莉酸诱导蛋白(r10、r11)。茉莉酸诱导蛋白为病程相关蛋白,参与茉莉酸的调节,具有广泛的生理功能和防御反应,在植物生长发育过程中或逆境条件下起着重要的调节作用[18]。本研究中鉴定的2个茉莉酸诱导蛋白,随着西瓜根系的生长,表达量持续升高。研究表明,醛-酮还原酶参与植物抗氧化胁迫反应和转录调节[19, 20],如水稻OsAKR 1 基因的过量表达显著提高了转基因烟草植株的抗氧化胁迫能力和高温耐受性[20]。醛-酮还原酶在生长15 d时表达量下降,随后又逐步回升。上述防御相关蛋白的表达,说明随着西瓜生育进程的变化,根系保护系统逐渐趋于完善,逆境自我调节能力增强,有利于提高西瓜的抗逆性。
本研究发现,在西瓜幼苗根系发育过程中特异表达了4个与代谢相关的蛋白:谷氨酰胺合成酶(r2)、丙酮酸脱氢酶E1元件β亚基(r3)、酸性磷酸酶(r8)和抗坏血酸过氧化物酶(r9)。谷氨酰胺合成酶在无机氮(NH+4)的初始同化过程中起重要作用,调控植物生长发育,影响作物产量及品质。谷氨酰胺合成酶的过量表达直接影响转基因植株体内的氮代谢水平,从而提高植株的光合作用及生长能力[21]。丙酮酸脱氢酶E1元件β亚基是丙酮酸脱氢酶复合体中的一个重要组成部分,研究发现,其活性可被丙酮酸激酶(PDK)磷酸化抑制,反义抑制PDK后植株表型改变,植株变低且生育期缩短[22]。该酶在生长15 d的西瓜根系中活性下降,随后逐步回升。酸性磷酸酶参与植物生长发育过程中磷代谢的调节,与导管分子的分化以及同化物的运输有关[23]。该酶在生长15 d的西瓜根系中表达上调,随后略有下降。抗坏血酸过氧化物酶是植物活性氧代谢中的关键酶,它利用抗坏血酸作为电子供体清除植物体内产生的H2O2,从而提高植物抵御氧化胁迫能力,增强植物抗逆性[24]。抗坏血酸过氧化物酶在西瓜根系生长15 d时表达量下降,随后又逐步回升。以上蛋白的表达量变化表明:这些代谢酶类在西瓜幼苗期根系不同生育阶段的表达量与植株的代谢活动相关,根系通过大量能量代谢为无机离子的主动运输提供能量保障,使得地上部分(叶片)有足够的无机离子用于生长等生命活动。
赤霉素是一种重要的植物激素,在植物生长和发育的各个阶段起重要调节作用。研究发现,其通过增加植物细胞分裂、增加细胞壁组成相关基因表达水平、改变微管排列方向等作用方式促进细胞伸长[25]。本研究中鉴定到1个参与GA信号途径的蛋白,即赤霉素受体GID1L2(r6)。在蛋白表达差异上,赤霉素受体GID1L2在西瓜根系生长15 d时表达量升高,20 d时略有下降,但仍高于7 d的表达量。该蛋白表达量的增加有利于西瓜根系细胞的分裂与增殖,是根系生长的体现。而在mRNA水平上,赤霉素受体基因GID 1L2 的表达方式和蛋白水平的表达不一致,表明其可能与基因的转录后调控有关。在mRNA的加工成熟过程中,通过各种不同的转录后调控机制的调控,基因表达呈现多样化,不同基因的转录物可能被部分选择性表达,或者同一基因的不同转录物被选择性表达,抑或是同一基因的转录物中的不同片段被选择性表达,进而适应植株不同生长发育阶段的需求[26]。
本研究利用蛋白质双向电泳技术对西瓜幼苗期根系不同发育时期的蛋白质组变化进行了分析,检测到12个蛋白质点的表达方式及表达量发生了变化,表明这些蛋白质点在调控西瓜根系生长发育中可能起到重要调节作用。再结合荧光定量技术对其中4个候选蛋白基因进行了表达验证,接下来将进一步对这4个候选蛋白基因进行功能研究,以期探明其在西瓜根系生长发育过程中的代谢途径及其作用机制。
| [1] | Phizicky E,Bastiaens P I H,Zhu H,et al. Protein analysis on a proteomic scale[J]. Nature,2003,422(6928):208-215 |
| [2] | Shen S,Sharma A,Komatsu S. Characterization of proteins responsive to gibberellin in the leaf-sheath of rice(Oryza sativa L.)seedling using proteome analysis[J]. Biological and Pharmaceutical Bulletin,2003,26(2):129-136 |
| [3] | 范宝莉,王振英,陈宏,等. 小麦T型细胞质雄性不育系、保持系蛋白质双向电泳比较研究[J]. 实验生物学报,2004,37(1):45-49 [Fan B L,Wang Z Y,Chen H,et al. Comparative studies on proteins of cytoplasmic male-sterile wheat and its maintainer by 2D-PAGE in Triticum aestivum[J]. Acta Biologiae Experimentalis Sinica,2004,37(1):45-49(in Chinese with English abstract)] |
| [4] | 李跃建,梁根云,刘小俊,等. 黄瓜嫁接苗和自根苗的蛋白质组学研究[J]. 园艺学报,2009,36(8):1147-1152 [Li Y J,Liang G Y,Liu X J,et al. Proteomic study on grafted and non-grafted cucumber(Cucumis sativus L.)[J]. Acta Horticulturae Sinica,2009,36(8):1147-1152(in Chinese with English abstract)] |
| [5] | Schneider T,Gerrits B,Gassmann R,et al. Proteome analysis of fungal and bacterial involvement in leaf litter decomposition[J]. Proteomics,2010,10:1819-1830 |
| [6] | Malter D,Wolf S. Melon phloem-sap proteome:developmental control and response to viral infection[J]. Protoplasma,2011,248:217-224 |
| [7] | Guo S G,Zhang J G,Sun H H,et al. The draft genome of watermelon(Citrullus lanatus)and resequencing of 20 diverse accessions[J]. Nature Genetics,2013,45:51-58 |
| [8] | Yoshimura K,Masuda A,Kuwano M,et al. Programmed proteome response for drought avoidance/tolerance in the root of a C3 xerophyte(wild watermelon)under water deficits[J]. Plant and Cell Physiology,2008,49(2):226-241 |
| [9] | 杨冬冬. 西瓜砧木接穗互作的木质素合成和叶片蛋白质组分析[D]. 上海:上海交通大学,2006 [Yang D D. Lignin biosynthesis and leaf proteome analysis of watermelon rootstock-scion interactions[D]. Shanghai:Shanghai Jiao Tong University,2006(in Chinese with English abstract)] |
| [10] | Yang Y J,Wang L P,Tian J,et al. Proteomic study participating the enhancement of growth and salt tolerance of bottle gourd rootstock-grafted watermelon seedlings[J]. Plant Physiology and Biochemistry,2012,58:54-65 |
| [11] | Jacobs D I,van Rijssen M S,van der Heijden R,et al. Sequential solubilization of proteins precipitated with trichloroacetic acid in acetone from cultured Catharanthus roseus cells yields 52% more spots after two-dimensional electrophoresis[J]. Proteomics,2001,1:1345-1350 |
| [12] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254 |
| [13] | Arndt C,Koristka S,Feldmann A,et al. Coomassie-Brilliant blue staining of polyacrylamide gels[C]//Kurien B T,Hal Scofield R. Protein Electrophoresis:Methods and Protocols,Methods in Molecular Biology. Springer Science,2012,869:465-469 |
| [14] | 邵彩虹,王经源,林文雄. 苗期水稻叶片发育进程的差异蛋白质组学分析[J]. 中国农业科学,2008,41(11):3831-3837 [Shao C H,Wang J Y,Lin W X. Differential proteomics analysis of leaf development at rice(Oryza sativa)seedling stage[J]. Scientia Agricultura Sinica,2008,41(11):3831-3837(in Chinese with English abstract)] |
| [15] | Clemens M J. Targets and mechanisms for the regulation of translation in malignant transformation[J]. Oncogene,2004,23:3180-3188 |
| [16] | 栗现芳,马守才,张改生,等. 小麦核糖体蛋白S15a基因(TaRPS15a)的克隆及其在多子房株系中的时空表达分析[J]. 农业生物技术学报,2011,19(2):236-242 [Li X F,Ma S C,Zhang G S,et al. Cloning of ribosomal protein S15a gene(TaRPS15a)and its expression patterns based on temporal-spatial in multi-ovary line of wheat(Triticum aestivum)[J]. Journal of Agricultural Biotechnology,2011,19(2):236-242(in Chinese with English abstract)] |
| [17] | 杜军志,张会梅,杨绒会. 环境条件对西瓜生长发育的影响[J]. 中国西瓜甜瓜,2004(5):15-17 [Du J Z,Zhang H M,Yang R H. Effect of environmental condition on watermelon growth and development[J]. China Watermelon and Melon,2004(5):15-17(in Chinese)] |
| [18] | Cheong J J,Choi Y D. Methyl jasmonate as a vital substance in plants[J]. Trends in Genetics,2003,19(7):409-413 |
| [19] | Bona E,Marsano F,Cavaletto M,et al. Proteomic characterization of copper stress response in Cannabis sativa roots[J]. Proteomics,2007,7:1121-1130 |
| [20] | Turóczy Z,Kis P,Török K,et al. Overproduction of a rice aldo-keto reductase increases oxidative and heat stress tolerance by malondialdehyde and methylglyoxal detoxification[J]. Plant Molecular Biology,2011,75(4/5):399-412 |
| [21] | 郑建树,喻春明,陈平,等. 苎麻谷氨酰胺合成酶BnGS2等位基因的克隆及其转基因烟草特性[J]. 中国农业科学,2014,47(17):3348-3358 [Zheng J S,Yu C M,Chen P,et al. Cloning of glutamine synthetase BnGS2 allele genes from ramie(Boehmeria nivea L.)and study on gene-transforming tobacco[J]. Scientia Agricultura Sinica,2014,47(17):3348-3358(in Chinese with English abstract)] |
| [22] | Jan A,Nakamura H,Handa H,et al. Gibberellin regulates mitochondrial pyruvate dehydrogenase activity in rice[J]. Plant and Cell Physiology,2006,47(2):244-253 |
| [23] | 王丽,王芹芹,王幼群. 蚕豆叶片小叶脉不同发育时期ATP酶和酸性磷酸酶的细胞化学超微结构定位[J]. 植物学报,2014,49(1):78-86 [Wang L,Wang Q Q,Wang Y Q. Cytochemical localization of ATPase and acid phosphatase in minor veins of the leaf of Vicia faba during different developmental stages[J]. Chinese Bulletin of Botany,2014,49(1):78-86(in Chinese with English abstract)] |
| [24] | Hu L X,Li H Y,Pang H C,et al. Responses of antioxidant gene,protein and enzymes to salinity stress in two genotypes of perennial ryegrass(Lolium perenne)differing in salt tolerance[J]. Journal of Plant Physiology,2012,169:146-156 |
| [25] | 李强,吴建明,梁和,等. 高等植物赤霉素生物合成及其信号转导途径[J]. 生物技术通报,2014(10):16-22 [Li Q,Wu J M,Liang H,et al. Gibberellins biosynthesis and signaling transduction pathway in higher plant[J]. Biotechnology Bulletin,2014(10):16-22(in Chinese with English abstract)] |
| [26] | Baldi P,Long A D. A Bayesian framework for the analysis of microarray expression data:regularized t-test and statistical inferences of gene changes[J]. Bioinformatics,2001,17:509-519 |
 2015, Vol. 38
2015, Vol. 38


