文章信息
- 郑尧, 张永泉, 陈家长, 邴旭文, 尹家胜, 王在照. 2015.
- ZHENG Yao, ZHANG Yongquan, CHEN Jiazhang, BING Xuwen, YIN Jiasheng, WANG Zaizhao. 2015.
- 彭泽鲫F1和F2代雌、雄鱼激素含量及芳香化酶活力差异研究
- Analysis on the difference of steroid hormone levels and aromatase activities between male and female Pengze crucian carp in F1and F2offspring
- 南京农业大学学报, 38(5): 864-868
- Journal of Nanjing Agricultural University, 38(5): 864-868.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.05.024
-
文章历史
- 收稿日期:2015-07-09
2. 中国水产科学研究院淡水渔业研究中心/农业部长江下游渔业资源环境科学观测实验站/ 中国水产科学研究院内陆渔业生态环境和资源重点开放实验室, 江苏 无锡 214081;
3. 西北农林科技大学动物科技学院/陕西省农业分子生物学重点实验室, 陕西 杨凌 712100
2. Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences/Scientific Observing and Experimental Station of Fishery Resources and Environment in the Lower Reaches of the Yangtze River, Ministry of Agriculture/Key Open Laboratory of Ecological Environment and Resources of Inland Fisheries, Chinese Academy of Fishery Sciences, Wuxi 214081, China;
3. College of Animal Science and Technology, Northwest A&F University/Shaanxi Key Laboratory of Molecular Biology for Agriculture, Yangling 712100, China
目前在鱼类性别分化机制研究中,比较成熟的学说有平衡假说和缺失假说。前者认为鱼类性别分化取决于哪一种性类固醇占优势,性腺分化早期,如果雄激素合成水平比雌激素高,则发育成精巢,外源激素能破坏这种平衡,进而完全改变遗传因素决定的分化通路;后者只强调雌激素在性腺分化中的作用。研究者认为内源性雌激素是卵巢发育的天然诱导物,一旦有雌激素合成都将发育成卵巢,若发育早期缺乏类固醇合成则性腺分化进入雄性通路,这种观点最近通过TALENS和CRISPR/Cas9技术在罗非鱼上得到了证实[1]。高水平的雌二醇(17β-estradiol,E2)能促进雌雄同体石斑鱼的卵巢分化,低水平E2及高水平睾酮(testosterone,T)能促进精巢分化;在雄性先熟黑鲷上的研究表明,E2在雄性向雌性性腺反转中起着重要作用[2];而对于雌核发育的银鲫来说,Zhou等[3]认为其存在双重生殖方式(有性生殖和雌核发育生殖)。彭泽鲫跟银鲫同是3倍体,在进化上相近[4],但在银鲫、彭泽鲫等种群中又存在少量的雄鱼[5],因而在自然水体中发现不同倍性的鲫鱼[6]。雌核发育方式产生的鱼类大多性腺比较小,肝胰脏比较大,且在经雌核发育方式获得的后代中检测到较高的激素水平(紊乱)[7]。这些事实都说明鱼类的性别分化跟激素水平密切相关。
性腺是雌鱼激素合成的主要部位,脑是雄鱼激素合成的主要部位[8]。内源性E2与芳香化酶基因(cyp 19a1a)表达密切相关,其又被证明与卵巢发育相关[9]。在鱼类中存在2种芳香化酶基因,卵巢型和脑型[10]。芳香化酶(脑部)能参与脑—垂体—性腺轴上的反馈调控,能够通过芳香化酶调节体内内生激素的平衡[11]。雌核发育彭泽鲫后代理论上应为全雌群体,但本实验室前期将彭泽鲫(Pengze crucian carp,Pcc)F1代仔鱼分批在实验室和野外养殖,后又在繁殖F2代时设置高、低密度养殖组进行验证(前者放置鱼苗密度为后者的2倍),发现实验室养殖彭泽鲫F1代(相比池塘养殖)和实验室高密度养殖F2代组中均出现了高比例的雄鱼。从营养角度看,池塘和实验室养殖都喂以同批次商品化饲料,但池塘中还存在浮游动植物等活饵,并且实验室养殖较拥挤,养殖密度也会对鱼类的生理学指标造成不同程度的影响,如生长和消化、免疫酶指标[12]。Davey等[13]发现在日本鳗鲡(Anguilla japonica)中高密度的养殖会导致较高的雄性比例。此外,前期组织学鉴定结果表明池塘养殖彭泽鲫雄鱼(约380 g)精巢中存在成熟精子和初、次级精母细胞以及空泡状组织,雌鱼(约450 g)卵巢发育处于Ⅴ期;实验室养殖条件下F1/F2代雄、雌鱼(约8 g)均以各自发育阶段的Ⅰ~Ⅱ期为主。有研究表明鲫鱼在不同发育时期激素含量不同[14],且水质指标和营养条件能改变鲫鱼体内的激素水平从而影响性别比例[15],环境条件也能通过影响体内芳香化酶的活力来改变鱼类性别分化的方向[16]。因此,要想分析造成雄鱼较多的可能原因,仅比较不同养殖环境下雄(雌)鱼生理学指标可能欠妥。本试验将从激素含量及芳香化酶活力方面对同一养殖环境下和同一发育时期的雌、雄鱼进行比较,以探究雌、雄鱼差异的分子生物学机制,为研究雌核发育鱼类的性腺分化机制提供参考依据。
1 材料与方法 1.1 试验材料人工雌核发育彭泽鲫(Pcc)F1代操作于2011年4月20日在湖北荆州窑湾养殖基地进行(水温18 ℃),选择基地养殖池中3~5龄兴国红鲤(C.carpio var.red style)(1 600±175)g为父本,选择2龄经雌核发育繁殖的(450±15)g成鱼(n=300)为母本。雌、雄鱼采用腹部检查法分辨,本试验中采用1雄1雌进行繁殖并重复2次,人工催产雌鱼采用人工注射hCG(400 IU · kg-1)、LRH-A(6 μg · kg-1)和鲤垂体干粉(1 mg · kg-1,用7 mg · mL-1 NaCl溶液溶解)进行,雄鱼减半。人工雌核发育Pcc F2代操作按文献[17]的方法于2013年4月10日进行,母本选择2龄Pcc F1代雌鱼,父本的选择、催产与Pcc F1代操作相同。彭泽鲫的受精卵是以红鲤的精子来激活彭泽鲫成熟卵细胞得到的,然后转入20 ℃左右的孵化桶中。子代约3~4 d出膜。将半月龄Pcc F2代带回实验室采用125 L大玻璃缸养殖(120 cm×40 cm×80 cm)。将F2代分2个密度组进行养殖,分别在低、高密度养殖组各放置80、160尾Pcc F2代。养殖时间直到能镜检分出雌、雄为止。1月龄内喂食蛋黄,1~2月龄按1 g · kg-1喂食卤虫(Artemia naupli),之后选择商品化的鱼用饲料。卤虫孵化方法按水体盐度10~15 mg · L-1,pH值7.5~8.5,水温28 ℃,充氧培养,第2天收卵,喂食之前用清水洗净。彭泽鲫养殖条件:水温(25±1)℃,光周期14 h/10 h(光/暗),pH(7.1±0.5),溶解氧(7.16±0.16)mg · L-1,总磷(2.16±0.17)mg · L-1,总氮(0.52±0.15)mg · L-1,氨氮(0.44±0.06)mg · L-1,总硬度(194.3±13.0)mg · L-1(按CaCO3算)。
1.2 Pcc F1代雌、雄鱼激素含量和芳香化酶活力测定采取池塘养殖F1代每尾鱼性腺、脑组织用于激素(E2、T)含量和芳香化酶活力测定;而实验室养殖F1代因个体小取全鱼组织进行测量。用于激素含量和芳香化酶活力测定试验组织先称质量后置于-80 ℃冰箱中冻存,第2天按照1 ∶ 9(质量体积比)添加0.1 mol · L-1 PBS缓冲液(pH 7.4),用塑料研磨棒在冰上研磨充分,3 000 r · min-1 4 ℃离心10 min,取上清液分装后1份待检测,其余于-80 ℃冰箱中冻存备用。标准曲线绘制、样品检测均按照上海恒远生物科技有限公司试剂盒说明书进行。T和E2检测范围分别为10~300 ng · mL-1和1~45 ng · L-1,芳香化酶活力检测限为2~80 IU · L-1。
1.3 Pcc F2代雌、雄鱼激素含量和芳香化酶活力测定选择F2代高密度养殖组中的雄鱼,低密度养殖组的雌鱼,取每尾鱼性腺、脑组织,用于E2、T、11-酮基睾酮(11-KT)含量和芳香化酶活力测定。其中11-KT检测范围为2~80 ng · mL-1。
1.4 数据分析 应用SPSS 18.0统计学分析软件对试验数据进行整理分析,数据结果均用 x±SD表示。激素含量和芳香化酶活力数据差异显著性检测分析使用t测验。 2 结果与分析 2.1 彭泽鲫F1代雌、雄鱼激素含量及芳香化酶活力的差异彭泽鲫F1代雌、雄鱼T和E2含量的标准曲线分别为y=128.420x-15.003(R2=0.999),y=22.629x-3.589(R2=0.999),芳香化酶的标准曲线为y=44.839x-0.665(R2=0.998),R2均大于0.99,可以用于后续试验的计算。结果(图1)表明:Pcc F1代实验室养殖雌鱼全鱼组织中雌二醇(E2)水平极显著高于雄鱼(图1-A),而在睾酮(T)水平上没有差异(图1-B)。Pcc F1代池塘养殖雌鱼脑中E2和T含量极显著高于雄鱼(P < 0.01),而两者性腺中E2及T没有差异(图1-A,B)。Pcc F1代实验室养殖雌、雄鱼全鱼组织中的芳香化酶活力没有显著性的差异,而卵巢中的芳香化酶活力极显著低于雄鱼(图1-C)。
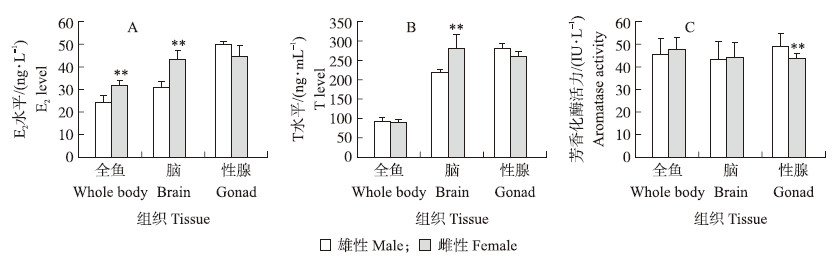 | 图 1 彭泽鲫F1代雌、雄鱼激素雌二醇(E2)(A)、睾酮(T)(B)含量及芳香化酶活力(C)(* *P < 0.01) Fig. 1 The steroid hormone 17β-estradiol(E2)(A),testosterone(T)(B)levels and aromatase activity(C) in triploid male and female F1 offspring of Pengze crucian carp |
彭泽鲫F2代雌、雄鱼11-KT、T和E2含量的标准曲线分别为y=45.039x-0.829(R2=0.998),y=134.030x-19.234(R2=0.997),y=22.699x-3.496(R2=0.998),芳香化酶的标准曲线为y=44.839x-0.665(R2=0.998),R2均大于0.99,可以用于后续试验的计算。Pcc F2代实验室低、高密度养殖雌、雄鱼激素水平及芳香化酶活力差异见图2。低密度养殖组中卵巢T含量极显著低于高密度养殖组精巢中的含量(图2-B)(P < 0.01);低密度养殖组雌鱼脑、性腺中E2含量均极显著高于高密度养殖组雄鱼中的含量(图2-C)(P < 0.01)。低密度养殖组雌鱼脑中的芳香化酶活力极显著低于雄鱼脑中的芳香化酶活力,但其卵巢中的芳香化酶活力极显著高于精巢中的芳香化酶活力(P < 0.01,图2-D)。
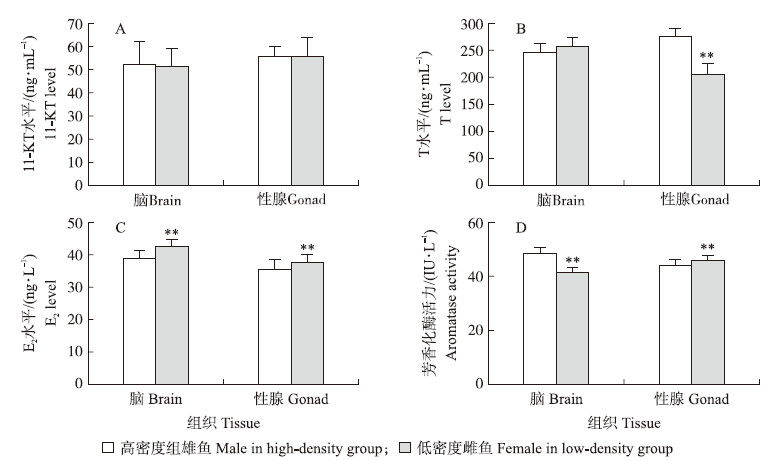 | 图 2 彭泽鲫F2代实验室低、高密度养殖雌、雄鱼脑和性腺组织中的激素水平(11-KT(A)、T(B) 和E2(C))及芳香化酶活力(D) Fig. 2 The steroid hormone 11-KT(A),T(B),E2(C)level and aromatase activity(D)in brain and gonad tissue of triploid male and female F2 offspring of Pengze crucian carp cultured in different densities for laboratory glass tanks |
E2被证明与卵巢发育相关[10, 11],内源性E2还与芳香化酶基因(cyp 19a1a)表达密切相关,cyp19a1 a编码的蛋白负责将体内的雄激素转化为雌激素,芳香化酶的活力也受到温度[16]、调节因子等诸多因素影响,所以血液中低水平的E2可能与雄激素转化为雌激素的效率有关。比如说核受体类固醇调控因子基因(nr 5 a)、抗缪勒氏管激素基因(amh)、DM结构域相关转录因子1基因(dmrt1 )及叉头框样蛋白2基因(foxl2)都能调控cyp19a1a的表达以及酶活力[11]。雌核发育鱼类常被检测出较高的雄激素水平(包括T、11-KT和雄烯二酮(androstenedione)),但在雌性虹鳟和牙鲆中却检查不到[7]。本试验中池塘养殖的F1代雌鱼脑中的E2和T含量极显著高于雄鱼,虽然脑中芳香化酶活力雌、雄鱼没有差别,但是卵巢中芳香化酶活力极显著低于精巢中的;在F2代中,实验室低密度养殖组F2代雌鱼卵巢、脑中的E2含量极显著高于雄鱼,对应卵巢中芳香化酶活力高于精巢,但雌鱼脑中芳香化酶活力极显著低于雄鱼脑中的。之前也有高密度养殖导致较高雄性比例的报道[13]。也有研究表明环境因素能够影响芳香化酶的活力从而改变鱼类性别[16]。众所周知,性腺是雌鱼激素合成的主要部位,脑是雄鱼激素合成的主要部位[8]。这些结果表明激素合成不仅受到调控芳香化酶的转录因子的调节[11],同时还受到“脑—垂体—性腺轴”这一反馈系统的调节。脑和性腺中的芳香化酶共同维持体内激素水平的平衡,雄鱼存在原因可能与实验室和池塘养殖F1代,高、低密度实验室养殖F2代雌、雄鱼激素含量和芳香化酶活力差异表达有关。“脑—垂体—性腺轴”中有诸如性腺分化、核受体、类固醇合成酶及卵母细胞结构类基因,其均能通过调控鱼类内生激素的合成 影响性腺分化过程[18],本试验将为进一步找寻调控芳香化酶基因及酶活力的转录调控因子提供理论支撑。
国内外关于11-KT精确功能的研究还较少。首先T和11-KT是硬骨鱼类占优势的雄性激素,前者主要在雄性性别分化和维持第二性征中发挥功能。精巢产生11-KT和滤泡分泌产生E2分别诱导精子和卵母细胞的生长发育。在精巢中,睾酮被11β羟化酶(cyp11b1,P450-11β-hydroxylase)和11β-HSD 催化成雄鱼特有的11-KT[19],最后合成可以被利用的E2等激素,且后者对精子的作用更大。也有学者[20]认为11-KT和T在硬骨鱼中能发挥各自作用(non-overlapping function),且11-KT在卵黄发生前期作用更大[21]。由本试验结果可以看出,F2代鱼在11-KT水平上没有差异,池塘养殖F1代雌、雄鱼性腺中E2、T差异不明显,这可能与两者在特定时间段发挥的功效不同所致。此外,血浆中性激素结合球蛋白(sex hormone-binding globulin,SHBG)含量对于游离雄激素的浓度有重要的影响[22]。本试验测定了实验室养殖F1代采用幼鱼全鱼组织中的激素含量,但是循环在血液中的激素是可以转运到全身各个组织器官中去的,反推出血液中雌、雄鱼在激素水平平衡上肯定出现了不一致,从而导致了性腺发育上出现差别。有学者曾分别利用黑眼虾虎鱼(Coryphopterus nicholsii)和虾虎鱼(Gobiodon histrio)[23]体部(body trunk)来研究激素和性腺分化的关系,本试验中因为鱼小没法分离组织而采用全鱼进行激素含量测定,在方法上虽是可行的,但是分离组织后再进行激素含量测定可能会更准确。
| [1] | Li M,Yang H,Zhao J,et al. Efficient and heritable gene targeting in tilapia by CRISPR/Cas9[J]. Genetics,2014,197(2):591-599 |
| [2] | Lee Y H,Wu G C,Du J L,et al. Estradiol-17β induced a reversible sex change in the fingerlings of protandrous black porgy,Acanthopagrus schlegeli Bleeker:the possible roles of luteinizing hormone in sex change[J]. Biol Reprod,2004,71(4):1270-1278 |
| [3] | Zhou L,Gui J F. Molecular mechanisms underlying sex change in hermaphroditic groupers[J]. Fish Physiol Biochem,2010,36(2):181-193 |
| [4] | Yang R,Li B,Feng H,et al. Cytogenetic analysis of chromosome number and ploidy of Carassius auratus variety Pengze[J]. Acta Zoologica Sinica,2003,49:104-109 |
| [5] | Jiang F F,Wang Z W,Zhou L,et al. High male incidence and evolutionary implications of triploid form in northeast Asia Carassius auratus complex[J]. Mol Phylogenet Evol,2013,66(1):350-359 |
| [6] | Xiao J,Zou T,Chen Y,et al. Coexistence of diploid,triploid and tetraploid crucian carp(Carassius auratus)in natural waters[J]. BMC Genet,2011,2:20 |
| [7] | Sun P,You F,Liu M,et al. Steroid sex hormone dynamics during estradiol-17β induced gonadal differentiation in Paralichthys olivaceus(Teleostei)[J]. Chin J Oceanol Limnoly,2010,28:254-259 |
| [8] | Hiraki T,Takeuchi A,Tsumaki T,et al. Female-specific target sites for both oestrogen and androgen in the teleost brain[J]. Endocrinology,2012,153(12):6003-6011 |
| [9] | 郑路程,苏娟,房蕊,等. 促性腺激素抑制激素在公猪下丘脑—垂体—睾丸轴的分布定位研究[J]. 南京农业大学学报,2014,37(5):101-105. doi:10.7685/j.issn.1000-2030.2014.05.016 [Zheng L C,Su J,Fang R,et al. Distribution and locanzation of gonadotropin-inhibitory hormone(GnIH)in the hypothalamus-pituitary-testis axis of boars[J]. Journal of Nanjing Agricultural University,2014,37(5):101-105(in Chinese with English abstract)] |
| [10] | 邵康,周杰,吴小雪,等. 猪卵巢中脂联素受体与FSHR和CYP19基因表达的发育变化及其相关性研究[J]. 南京农业大学学报,2013,36(4):141-144. doi:10.7685/j.issn.1000-2030.2013.04.023 [Shao K,Zhou J,Wu X X,et al. The developmental patterns and correlation of adiponectin receptors,FSHR and CYP19 mRNA expression in ovary of Wannanhua pigs[J]. Journal of Nanjing Agricultural University,2013,36(4):141-144(in Chinese with English abstract)] |
| [11] | Wang D S,Kobayashi T,Zhou L Y,et al. Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with ad4 binding protein/steroidogenic factor 1[J]. Mol Endocrinol,2007,21:712-725 |
| [12] | 赵霞. 不同养殖密度对两种鲆鲽鱼类生长及免疫指标的影响[D]. 青岛:中国海洋大学,2010 [Zhao X. Effect of stoeking density on growth and immune in flounder reared in re-circulating and flow through rearing systems[D]. Qingdao:Ocean University of China,2010(in Chinese with English abstract)] |
| [13] | Davey A,Jellyman D. Sex determination in freshwater eels and management options for manipulation of sex[J]. Rev Fish Biol Fish,2005,15(1):37-52 |
| [14] | Liasko R,Liousia V,Vrazeli P,et al. Biological traits of rare males in the population of Carassius gibelio(Actinopterygii:Cyprinidae)from Lake Pamvotis(north-west Greece)[J]. J Fish Biol,2010,77(3):570-584 |
| [15] | Sinha A K,Liew H J,Diricx M,et al. Combined effects of high environmental ammonia,starvation and exercise on hormonal and ion-regulatory response in goldfish(Carassius auratus L.)[J]. Aquat Toxicol,2012,114/115:153-164 |
| [16] | Karube M,Fernandino J I,Strobl-Mazzulla P,et al. Characterization and expression profile of the ovarian cytochrome P-450 aromatase(cyp19A1)gene during thermolabile sex determination in pejerrey,Odontesthes bonariensis[J]. J Exp Zool A Ecol Genet Physiol,2007,307A(11):625-636 |
| [17] | Zheng Y,Wang L,Li M,et al. Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to 17α-ethinylestradiol and 17α-methyltestosterone[J]. Gen Comp Endocrinol,2013,191:113-122 |
| [18] | 郑尧,王在照,陈家长. 调控鱼类性腺分化基因的研究进展[J]. 水生生物学报,2015,39(4):798-810 [Zheng Y,Wang Z Z,Chen J Z. Progresses on the study of sex differentiation genes in fish[J]. Acta Hydrobiologica Sinica,2015,39(4):798-810(in Chinese with English abstract)] |
| [19] | Baker M E. 11β-Hydroxysteroid dehydrogenase-type 2 evolved from an ancestral 17β-hydroxysteroid dehydrogenase-type 2[J]. Biochem Biophys Res Commun,2010,394:215-220 |
| [20] | Aguila S,Castillo-Briceño P,Sánchez M,et al. Specific and non-overlapping functions of testosterone and 11-ketotestosterone in the regulation of professional phagocyte responses in the teleost fish gilthead seabream[J]. Environ Sci Technol,2012,46(17):9673-9680 |
| [21] | Kohn Y Y,Symonds J E,Lokman P M. The effects of 11-ketotestosterone on ovarian physiology of previtellogenic captive hapuku(Polyprion oxygeneios)[J]. Endocrinology,2013,154(8):2881-2890 |
| [22] | Bobe J,Guiguen Y,Fostier A. Diversity and biological significance of sex hormone-binding globulin in fish,an evolutionary perspective[J]. Mol Cell Endocrinol,2011,316(1):66-78 |
| [23] | Kroon F J,Munday P L,Pankhurst N W. Steroid hormone levels and bidirectional sex change in Gobiodon histrio[J]. J Fish Biol,2003,62:153-167 |
 2015, Vol. 38
2015, Vol. 38


