文章信息
- 张晓柯, 韩絮, 马薇薇, 张雪, 张轩瑞, 段亚冰, 周明国, 陈长军. 2015.
- ZHANG Xiaoke, HAN Xu, MA Weiwei, ZHANG Xue, ZHANG Xuanrui, DUAN Yabing, ZHOU Mingguo, CHEN Changjun. 2015.
- 江苏省草莓灰霉病菌对氟吡菌酰胺敏感性基线的建立及抗性风险评估
- Baseline sensitivity of fluopyram and its resistance risk assessment against Botrytis cinerea from strawberry in Jiangsu Province
- 南京农业大学学报, 38(5): 810-815
- Journal of Nanjing Agricultural University, 38(5): 810-815.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.05.016
-
文章历史
- 收稿日期:2014-09-23
由灰葡萄孢菌(Botrytis cinerea)引起的灰霉病是最重要的世界性病害之一,该菌寄主广泛,可侵染蔬菜、水果、花卉等200余种植物,造成严重的产量损失[1]。由于缺少有效的抗病品种,灰霉病的防控仍以化学药剂为主。然而,灰霉病菌是一种高风险的病原真菌,具有产孢量大、繁殖速度快、易产生遗传变异等特点,极易产生抗药性。目前,在国外田间已检测到该病原菌对苯并咪唑类、二甲酰亚胺类、苯胺基嘧啶类、甲氧基丙烯酸酯类(QoIs)及琥珀酸脱氢酶抑制剂类(SDHIs)杀菌剂的抗性菌株,这些抗性菌株可能与靶标位点的改变或多药抗药性机制有关[2, 3, 4, 5]。
氟吡菌酰胺隶属于琥珀酸脱氢酶抑制剂(SDHIs),是由拜耳公司开发、2012年在我国获得登记的一种新型广谱杀菌剂,可用于70多种作物病害的防治,其中对灰霉病菌、白粉病菌、核盘菌和丛梗孢属病菌引起的病害有特效[6, 7],已经成为控制灰霉病菌抗性治理的主要药剂。该药剂主要作用机制是抑制菌体琥珀酸脱氢酶(SDH)活性,阻碍其能量代谢,进而抑制病原菌的生长,达到控制病害的目的[8, 9]。
本研究采用菌丝生长速率法测定了氟吡菌酰胺对草莓灰霉病菌的毒力,建立了其敏感性基线,分析了抗、感菌株的生物适合度及对不同种类杀菌剂之间的交互抗性,为氟吡菌酰胺的推广应用提供科学支撑,同时,评估其在防治灰霉病中的抗性风险。
1 材料与方法 1.1 供试菌株2012至2013年,在江苏省不同地区采集100株未施用过琥珀酸脱氢酶类杀菌剂的草莓灰霉病菌株(Botrytis cinerea),经单孢分离后,置于PDA斜面试管中,4 ℃保存待用。
根据氟吡菌酰胺对灰霉病菌抗性区分标准,抗性因子(RF)=单菌株EC50/野生型菌株的平均EC50,RF值小于2为敏感菌株,在2~10之间为低抗,10~100之间为中抗,大于100为高抗[10]。
D8、B29、F3、F44为监测到的田间氟吡菌酰胺低抗菌株,抗性因子RF值均在2~10之间,均采集于自2010年起使用啶酰菌胺的草莓田地里。
1.2 供试药剂与培养基96%氟吡菌酰胺(fluopyram)原药由拜耳作物科学公司提供; 95%啶酰菌胺(boscalid)原药由巴斯夫(中国)投资有限公司提供; 97.8%嘧菌酯(azoxystrobin)和96%咯菌腈(fludioxonil)原药由先正达提供; 98%氟啶胺(fludioxonil)原药由江阴苏利化工股份有限公司提供; 99%水杨肟酸(SHAM)购自Sigma公司。上述原药除嘧菌酯用丙酮制备104μg·mL-1的母液外,其余均用甲醇制成104μg·mL-1的母液,4 ℃保存备用。
PDA培养基: 200 g马铃薯,20 g葡萄糖,16 g琼脂粉,用去离子水定容至1 L;AEA培养基:5 g酵母提取物,6 g NaNO3,1.5 g KH2PO4,0.5 g KCl,0.25 g MgSO4,20 mL甘油,20 g琼脂粉,用去离子水定容至1 L。PDB培养液除不含有琼脂外,其他组分同PDA。
1.3 灰霉病菌对氟吡菌酰胺的敏感性测定采用菌丝生长抑制法测定氟吡菌酰胺对灰霉病菌的毒力。将灰霉病菌接种到PDA平板,培养3 d后,用打孔器(Φ=5 mm)打制菌碟,分别接种于含氟吡菌酰胺(0、0.062 5、0.125、0.25、0.5、2、4、8和16 μg·mL-1)的PDA平板中央;每皿1菌碟。最后,将接菌后的平板倒置于25 ℃恒温培养箱中培养,3 d后采用十字交叉法测量菌落直径。每个处理3次重复。利用DPS 7.05计算毒力回归曲线方程、EC50及其95%置信限。试验重复3次。
抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-5)×100%。
1.4 氟吡菌酰胺抗、感菌株生物学特性分析由于在室内通过氟吡菌酰胺药剂诱导灰霉病菌的抗性菌株中没有获得抗性稳定菌株,故本研究采用田间抗性菌株进行一系列试验。
1.4.1 交互抗性采用菌丝生长速率法测定氟吡菌酰胺抗、感菌株对不同药剂的敏感性。其中,嘧菌酯在AEA平板上测定[11, 12],其余均在PDA平板上测定。
1.4.2 菌丝生长、菌丝质量及致病性测定将上述用于测定交互抗性的菌株进行菌丝生长速率、菌丝质量及致病性测定。菌丝生长测定主要是用在PDA平板上生长3 d的灰霉病菌制备菌碟,然后将菌碟放在PDA平板中央,置于25 ℃恒温培养箱于黑暗条件下培养,3 d后计算平均每天的生长速率。每个菌株 3个重复;试验重复3次[11]。测定菌丝质量时,挑取5个菌碟置于含有100 mL PDB液体培养基的三角瓶中,以120 r·min-1、25 ℃条件下摇床培养,3 d后收集菌丝,烘干,称质量。每个菌株3个重复;试验重复3次[12]。致病性测定时,挑选生长周期、生长位置及大小相似的番茄叶片进行致病性试验,将刚制备的菌碟置于叶片上,在相对湿度为85%、22 ℃条件下光周期12 h/12 h的培养箱中培养3 d后测量病斑直径。每个菌株7个重复;试验重复3次[13]。
1.4.3 抗、感菌株琥珀酸脱氢酶4个亚基的克隆及序列比对分析分别将灰霉病菌抗、感氟吡菌酰胺菌株菌 碟接种到铺有玻璃纸的PDA平板上培养3 d后,刮取适量气生菌丝,采用CTAB方法提取基因组DNA[14]。
以抗、感灰霉病菌株为模板,运用4对引物(表 1)分别扩增含有SDHA、SDHB、SDHC和SDHD 4个亚基的DNA片段。采用25 μL反应体系:0.125 μL rTaq聚合酶,2.5 μL 10×PCR Buffer,0.15 mmol·L-1 MgCl2,0.2 mmol·L-1 dNTP,0.2 μmol·L-1上、下游引物,1 μL DNA模板(100 ng),用dH2O(灭菌蒸馏水)补足至25 μL。扩增条件:94 ℃ 10 min;94 ℃ 35 s,52~56 ℃ 3 min,72 ℃ 20 s,35个循环;72 ℃ 15 min。扩增后的PCR产物在10 g ·L-1琼脂糖凝胶上进行电泳,可获得预期长度分别为3 065、1 077、1 208及854 bp的PCR产物。胶回收纯化后克隆至pEASYTM-T3载体,测序。
| 基因名称 Gene name |
引物名称 Primer |
序列(5′→3′) Sequence |
序列长度/bp Size |
退火温度/℃ Annealing temperature |
| SDHA | SdhaF SdhaR |
ATTTGGAAACGCCCTTGGAC CATTACCGAACAATCCCGCA |
3 065 | 54 |
| SDHB | SdhbF SdhbR |
ACCTACTCGCCCTATCCAAT AGACTTAGCAATAACCGCCC |
1 077 | 54 |
| SDHC | SdhcF SdhcR |
GCCAGATTTCCTTAGTCAG GCTGGACTCTGAATGTGAT |
1 208 | 52 |
| SDHD | SdhdF SdhdR |
AGCCAATCAAATCCGTTCCG CAAACTCCTCCCTGCCCTCT |
854 | 56 |
采用菌落速率法,建立了2012至2013年江苏省草莓灰霉病菌对氟吡菌酰胺的敏感性基线。测定结果(图 1)显示:草莓灰霉病菌对氟吡菌酰胺的EC50范围为0.05~5.98 μg·mL-1,平均EC50为(1.94±1.55)μg·mL-1,所得曲线呈现一个单峰曲线,接近正态分布,故可以作为敏感性基线用于评价当前田间草莓灰霉病菌的整体情况。
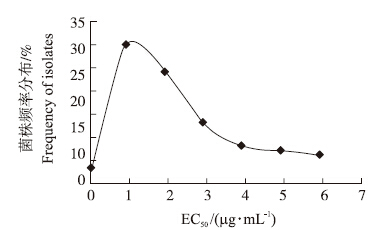 | 图 1 2012至2013年江苏省100株草莓灰霉病菌对氟吡菌酰胺的敏感性基线 Fig. 1 The baseline sensitivity of fluopyram against Botrytis cinerea which collected from strawberry in Jiangsu Province during 2012-2013 |
测定灰霉病菌氟吡菌酰胺抗、感菌株对不同杀菌剂的交互抗性。从图 2可以看出:灰霉病菌对氟吡菌酰胺与同类型杀菌剂啶酰菌胺之间不存在正交互抗性,其R2仅为0.248 4;与其他不同类型药剂之间也不存在交互抗性。这说明:氟吡菌酰胺作为新一代的SDHI杀菌剂,具有良好的应用前景。
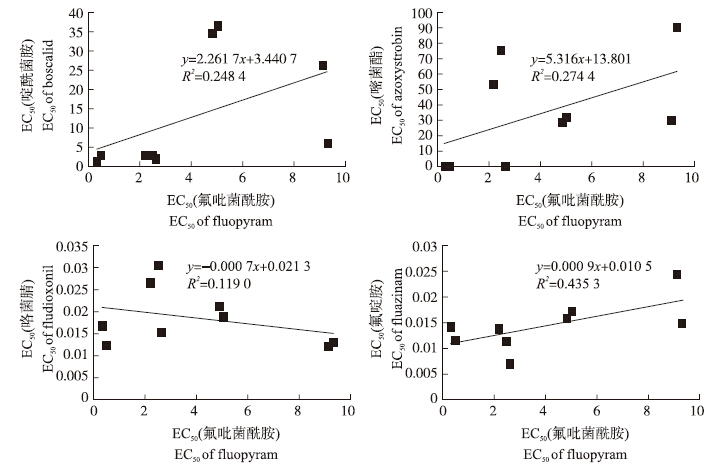 | 图 2 氟吡菌酰胺抗、感菌株对不同杀菌剂间的交互抗性测定 Fig. 2 Cross resistance analysis for fluopyram-sensitive and-resistant B.cinerea isolates to different fungicides |
将上述用于交互抗性测定的菌株进行菌丝生长、菌丝质量和致病性试验测定。结果(表 2)显示:抗、感菌株之间菌丝干质量存在显著性差异,敏感菌株的菌丝生长速率显著高于抗性菌株,且致病力显著强于抗性菌株(图 3)。这说明:在相同环境下,氟吡菌酰胺抗性菌株的生长适合度明显低于敏感菌株,即其生存竞争力相对较低。
| 菌株/敏感性* Isolates/Sensitivity |
生长速率/(cm·d-1) Growth rate |
菌丝干质量/g Mycelial dry weight |
病斑直径/mm Lesion diameter |
| BT9-8/S | 2.59±0.02a | 0.19±0.06b | 16.5±0.5a |
| BT8-13/S | 2.60±0.03a | 0.32±0.04a | 16.4±0.2a |
| BT4-1/S | 2.69±0.07a | 0.15±0.04b | 15.5±0.6ab |
| NJ5-1/S | 2.28±0.04c | 0.27±0.07ab | 15.2±0.2ab |
| BT13-15/S | 2.46±0.01b | 0.23±0.06ab | 15.5±0.3ab |
| D10/LR | 2.24±0.05c | 0.24±0.01ab | 14.0±0.3b |
| B29/LR | 2.20±0.03c | 0.22±0.01ab | 14.2±0.2b |
| F3/LR | 2.23±0.03c | 0.25±0.02ab | 11.2±0.8c |
| F44/LR | 2.25±0.02c | 0.18±0.03b | 11.7±0.6c |
| 注: 根据LSD检测方法,菌丝生长速率、菌丝干质量和病斑直径每列后不同字母表示差异显著(P<0.05)。*S和LR分别表示敏感菌株和低抗菌株。 Note: Within each column of radial growth rate,dry weight of mycelia and diameter of lesion means followed by a common letter show no difference between them according to Fisher's LSD test(P < 0.05). *S and LR represent sensitiveness and low resistance to fluopyram,respectively. The same as follows. |
|||
 | 图 3 灰霉病菌氟吡菌酰胺抗、感菌株之间的致病力比较 Fig. 3 Comparison of pathogenicity of fluopyram-sensitive and resistant B.cinerea isolates |
分别对抗、感菌株的SDHA、SDHB、SDHC和SDHD 4个亚基进行测序分析,比对结果(表 3)显示:9株供试菌株的SDHA和SDHD亚基序列上与已知测序菌株B05.10完全一致;在SDHB亚基序列分析中,有3株菌株在272位发生点突变,由组氨酸(His)变为精氨酸(Arg),即H272R。同时,发现部分敏感菌株及抗性菌株B29在C亚基也发生了一系列突变,在85位由甘氨酸(Gly)变为丙氨酸(Ala),93位由异亮氨酸(Ile)变为缬氨酸(Val),158位由甲硫氨酸(Met)变为缬氨酸(Val),168位由缬氨酸(Val)变为异亮氨酸(Ile),即G85A、I93V、M158V、V168I。这说明:抗性可能主要是由B亚基的272位突变引起的,C亚基的突变与抗药性无关,C亚基多态性的生物学功能有待进一步研究。
| 菌株/敏感性 Strains/Sensitivity |
变化Alteration | |||
| A亚基SDHA | B亚基SDHB | C亚基SDHC | D亚基SDHD | |
| BT9-8/S | — | — | G85A,I93V,M158V,V168I | — |
| BT8-13/S | — | — | — | — |
| BT4-1/S | — | — | — | — |
| NJ5-1/S | — | — | G85A,I93V,M158V,V168I | — |
| BT13-15/S | — | — | G85A,I93V,M158V,V168I | — |
| D10/LR | — | — | — | — |
| B29/LR | — | H272R | G85A,I93V,M158V,V168I | — |
| F3/LR | — | H272R | — | — |
| F44/LR | — | H272R | — | — |
| 注:“—”表示没有突变发生。“—”indicated no mutation occurred. | ||||
本文采用菌丝生长法测定了江苏省不同地区2012至2013年100株草莓灰霉病菌对氟吡菌酰胺的敏感性,建立了氟吡菌酰胺对草莓灰霉病菌的敏感性基线。该曲线是个接近正态分布的单峰曲线,平均EC50为(1.94±1.55)μg·mL-1,故可用于评价当前田间灰霉病菌株对氟吡菌酰胺的敏感性情况。由于灰霉病菌严重危害蔬菜、水果和经济作物,且对多种药剂产生抗性,而氟吡菌酰胺作为一类新型琥珀酸脱氢酶抑制剂,它的引进对田间灰霉病的防控具有极其重要的意义。
尽管氟吡菌酰胺与啶酰菌胺都属于琥珀酸脱氢酶抑制剂,具有相似的作用机制,但是交互抗性试验结果显示,氟吡菌酰胺的活性优于啶酰菌胺,它们之间没有交互抗性,这与已有的报道[15, 16, 17]是一致的,这可能是药剂分子结构与琥珀酸脱氢酶的结合方式有关。此外,氟吡菌酰胺与其他不同类型药剂之间也不存在交互抗性,这说明可以应用氟吡菌酰胺去防控由灰葡萄孢引起的灰霉病,还可以治理因其他作用机制杀菌剂引起的抗药性。
通过分析氟吡菌酰胺抗、感菌株琥珀酸脱氢酶4个亚基之间的差异,发现灰霉病菌同时具备氟吡菌酰胺低抗及啶酰菌胺中抗的菌株在B亚基上发生H272R(表 3),氟吡菌酰胺低抗且啶酰菌胺低抗的菌株没有发生点突变,这可能与田间施用啶酰菌胺有关。在已有的研究报道中[17],C亚基发生点突变很少,且均没有出现多位点同时变化的。在本研究中我们发现C亚基同时出现4个氨基酸替换,这在敏感菌株及抗性菌株中均有发生,这说明C亚基出现的多态性可能与SDHIs药剂无关,B亚基H272R会产生氟吡菌酰胺低抗菌株且啶酰菌胺中抗菌株,这与已有的研究报道是一致的[15]。
此外,生物适合度测定表明:抗性菌株的致病性及生长速率明显低于敏感菌株,故其生物适合度明显低于敏感菌株,即抗性菌株在田间不具有竞争优势。田间SDHIs抗性菌株在国内研究报道的非常少,国外研究报道啶酰菌胺田间抗性菌株SDH抗性突变位点存在多态性[18],且氟吡菌酰胺与啶酰菌胺没有交互抗性,而本研究表明氟吡菌酰胺具有低至中等的抗药性风险。因此,可以建议在田间使用氟吡菌酰胺去防治灰霉病,且尽量用不同种类的杀菌剂轮替使用,以延长杀菌剂的使用年限。
| [1] |
Elad Y,Williamson B,Tudzynski P,et al. |
| [2] |
Banno S,Yamashita K,Fukumori F,et al. Characterization of QoI resistance in |
| [3] |
Kretschmer M,Leroch M,Mosbach A,et al. Fungicide-driven evolution and molecular basis of multidrug resistance in field populations of the grey mould fungus |
| [4] |
Leroux P,Gredt M,Leroch M,et al. Exploring mechanisms of resistance to respiratory inhibitors in field strains of |
| [5] |
Myresiotis C K,Karaoglanidis G S,Tzavella-Klonari K. Resistance of |
| [6] | Bayer CropScience. New fungicidal active ingredient fluopyram strengthens product portfolio[EB/OL]. [http://news.agropages.com/News/NewsDetail---1251.htm]. [2009-05-13] |
| [7] | Fought L,Musson G H,Bloombergl J R,et al. Fluopyram:a new active ingredient from Bayer CropScience[J]. Phytopathology,2009,99:S36 |
| [8] | Cecchini G. Function and structure of complex Ⅱ of the respiratory chain[J]. Annual Review of Biochemistry,2003,72:77-109 |
| [9] | 李良孔,袁善奎,潘洪玉,等. 琥珀酸脱氢酶抑制剂类(SDHIs)杀菌剂及其抗性研究进展[J]. 农药,2011,50(3):165-169 [Li L K,Yuan S K,Pan H Y,et al. Progress in research on SDHIs fungicides and its resistance[J]. Agrochemicals,2011,50(3):165-169(in Chinese with English abstract)] |
| [10] |
Veloukas T,Leroch M,Hahn M. Detection and molecular characterization of boscalid-resistant |
| [11] |
Wu D X,Zhang X K,Wang J,et al. Baseline sensitivity of |
| [12] |
Zhang X K,Wu D X,Duan Y B,et al. Biological characteristics and resistance analysis of the novel fungicide SYP-1620 against |
| [13] |
Duan Y B,Ge C Y,Liu S M,et al. A two-component histidine kinase |
| [14] |
Sharp P J,Kreis M,Shewry P R,et al. Location of |
| [15] |
Veloukas T,Karaoglanidis G S. Biological activity of the succinate dehydrogenase inhibitor fluopyram against |
| [16] |
Ishii H,Miyamoto T,Ushio S,et al. Lack of cross-resistance to a novel succinate dehydrogenase inhibitor,fluopyram,in highly boscalid-resistant isolates of |
| [17] |
Laleve A,Gamet S,Walker A S,et al. Site-directed mutagenesis of the P225,N230 and H272 residues of succinate dehydrogenase subunit B from |
| [18] |
Avenot H F,Thomas A,Gitaitis R D,et al. Molecular characterization of boscalid- and penthiopyrad-resistant isolates of |
 2015, Vol. 38
2015, Vol. 38


