文章信息
- 李海梅, 沈佳, 赵娟, 娄群峰, 李季, 陈劲枫. 2015.
- LI Haimei, SHEN Jia, ZHAO Juan, LOU Qunfeng, LI Ji, CHEN Jinfeng. 2015.
- 黄瓜线粒体基因组SSR标记开发及其在种子纯度鉴定中的应用
- Development of mtSSR markers in cucumber(Cucumis sativus L.) and their application in the identification of seed purity
- 南京农业大学学报, 38(5): 764-771
- Journal of Nanjing Agricultural University, 38(5): 764-771.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.05.010
-
文章历史
- 收稿日期:2014-12-01
黄瓜(Cucumis sativus L.)属葫芦科甜瓜属一年生蔓生草本植物。一般认为,黄瓜起源于印度,中国是黄瓜的次生起源中心之一,可分为华北型、华南型、欧洲温室型、欧美加工型等类型[1]。随着我国农业经济的发展和种植业的调整,蔬菜生产的重要性越来越受到重视[2],对蔬菜种子质量的关注也日益提升。而种子纯度是种子质量的核心指标,由于种子繁育复杂、有限的亲本资源及新杂交种F1的不断增加,其制种过程中形成的假杂种会给黄瓜生产及农民经济收入造成重大损失。传统检验种子纯度的方法主要包括种子形态鉴定和田间小区种植表型鉴定,其检验费时费力且易受环境、人为等影响,也不能有效区分遗传关系较近的杂交种[3];同工酶鉴定的结果可靠性较差,受环境影响大。
近年来,DNA分子标记技术日趋完善并广泛用于农作物和蔬菜种子的真实性检测和纯度鉴定[4, 5, 6]。其中,SSR(simple sequence repeat)标记因具有数量丰富、多态性高、操作简便、结果稳定可靠等优点,成为当前最经济、最有效的分子标记技术,也为种子纯度鉴定提供了一种更为快速、高效、简便、可靠的方法[2]。目前,SSR标记广泛地被应用于大豆[7]、玉米[8]及水稻[9]等农作物的杂交种纯度鉴定。在瓜类作物上也有一些相关研究,周胜军等[10]利用SSR标记对黄瓜杂交种‘浙秀1号’进行纯度鉴定,鉴定结果与田间鉴定结果基本一致;艾呈祥等[11]和李菊芬等[12]成功利用SSR标记对甜瓜杂交种‘东方蜜1号’‘01-31’和‘东方蜜2号’进行纯度鉴定;Ai等[13]和李菊芬等[14]也开展了利用SSR分子标记鉴定西瓜杂交种纯度的研究,筛选出了杂交种鉴定的引物,鉴定结果与田间鉴定结果非常相近;韩小霞等[15]研究结果证实了SSR标记技术应用于南瓜杂交种纯度鉴定工作的可行性与可靠性。SSR分子标记在黄瓜杂交种子纯度鉴定中的应用将对黄瓜种子产业的规范以及在促进农业增产和农民增收方面具有重要意义。
不同于绝大多数植物细胞器的母系遗传规律,黄瓜种内及种间杂交研究结果表明黄瓜线粒体为父系遗传[16, 17],且短的分散重复序列占黄瓜线粒体基因组的13%[18],理论上为线粒体标记开发和应用奠定了基础。由于线粒体基因组在种属间具有很高的保守性,因此,线粒体基因组SSR不仅具有SSR标记固有的特点,而且还具有很好的种属通用性,已被广泛应用于物种的起源、进化及种质资源多样性分析等研究领域[19]。本研究根据已有的黄瓜线粒体基因组序列信息开发SSR标记,在探索黄瓜种内线粒体DNA的多态性的同时,根据黄瓜线粒体父系遗传的特点筛选mtSSR引物,并将筛选出的多态性mtSSR标记应用于黄瓜F1种子的快速纯度鉴定,建立一套稳定可靠、简单快速的黄瓜种子纯度鉴定方法。
1 材料与方法 1.1 材料以南京农业大学黄瓜课题组提供的30份不同生态类型的黄瓜品种为试验材料,包括6份华北型黄瓜:‘北京截头’‘长春密刺’‘北京小刺’‘P01(G)’‘新泰密刺’和‘朝优3号’;3份华南型黄瓜:‘平望’‘L8’和‘平望(G)’;8份欧洲温室型:‘EC1’‘Amir’‘8419s’‘欧美佳’‘蔬春美雅’‘EC5’‘Hazerd’和‘戴多星’;10份加工型黄瓜:‘410 Marketmore 97FF’‘407 Beit Alpha’‘401 Marketmore 2000’‘Poinsett 76’‘627(G)’‘JC1’‘JC3’‘Boothbyls Blonde’‘Homenmade Pickles’和‘宁佳7号’;2份野生型黄瓜:Cucumis sativus var.xishuangbannanesis和C.sativus var.hardwickii;1份甜瓜属野生种C.hystrix。mtSSR标记筛选出的有多态性的黄瓜杂交(正反杂交F1)后代:‘Amir’ב407 Beit Alpha’‘407 Beit Alpha’בAmir’、‘北京截头’בAmir’和‘Amir’ב北京截头’。以上材料于2014年种植在南京农业大学江浦实验基地。PCR扩增试剂由宝生物工程(大连)有限公司提供,其他试剂均为分析纯。
1.2 mtSSR的开发及引物设计黄瓜线粒体基因组中有3个环化染色体,其中所有可辨的完整线粒体基因都在1 556 kb长的染色体1上[18]。从GenBank公共数据库(http://www.ncbi.nlm.nih.gov/)中以FASTA格式下载黄瓜线粒体基因组染色体1全序列(HQ860792.1),使用搜索工具SSRIT(http://www.gramene.org/db/searches/ssrtool)对上述黄瓜线粒体基因组数据进行SSR位点的搜索,筛选标准为:二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸重复类型的最少重复次数分别设置为5、4、3、3和3次及以上。
基于所获得的线粒体微卫星序列,利用在线引物设计软件Primer 3(http://primer3.ut.ee/)设计mtSSR引物,引物配对序列避免微卫星的出现。引物设计主要参数为:引物长18~22 bp,以20 bp为最佳;引物退火温度50~60 ℃,前后引物退火温度之差避免超过2 ℃;GC含量40%~60%,最适50%;PCR预期产物长100~300 bp。避免错配、引物二聚体或发夹结构的出现。研究发现,黄瓜线粒体基因组中含有丰富的从叶绿体和细胞核中转移而来的序列[19],反之亦然。因此文中使用序列比对检索工具BLAST搜索,剔除与黄瓜核基因组及叶绿体基因组相匹配的引物。最后,引物由英潍捷基(上海)贸易有限公司合成。
1.3 黄瓜基因组DNA提取及检测用改良的CTAB法对黄瓜基因组DNA进行提取,经2 μL RNase(10 μg·mL-1)消化后,用10 g·L-1的琼脂糖凝胶电泳检测DNA质量,-20 ℃冰箱保存备用。
1.4 mtSSR引物筛选以30份黄瓜高代自交系材料的DNA为模板,采用以下反应体系和PCR程序进行扩增。SSR反应体系总体积为25 μL:灭菌ddH2O 17.3 μL,10×PCR Buffer(MgCl2)2.5 μL,2 mmol·L-1 dNTP 2 μL,正反向SSR引物(10 μmol·L-1)各1 μL,模板DNA(30 ng·μL-1)1 μL,5 U·μL-1 Taq DNA聚合酶0.2 μL。线粒体SSR扩增程序参照核基因组SSR扩增程序,优化后确定为:94 ℃ 5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 30 s,35个循环;72 ℃ 7 min,4 ℃保存。用每对引物分别对30份黄瓜高代自交系样品的DNA进行PCR扩增。PCR扩增结束后,采用80 g·L-1聚丙烯酰胺凝胶电泳对扩增产物进行分离,银染检测引物的多态性,拍照采集电泳图像。对呈现多态性的标记带型进行回收测序,并对测序后的序列进行分析并与核基因组和叶绿体基因组进行比对,得到具有线粒体基因组多态性的黄瓜品种,为杂种一代种子纯度验证提供亲本。
1.5 杂种一代群体验证挑选‘Amir’‘407 Beit Alpha’和‘北京截头’3个黄瓜品种,通过人工授粉进行正反杂交试验,获得 4个黄瓜杂交组合F1种子(‘Amir’ב407 Beit Alpha’、‘407 Beit Alpha’בAmir’、‘Amir’ב北京截头’和‘北京截头’בAmir’)。每个组合随机抽取F1 60株(包括杂交种、母本自交种及其他花粉来源的假杂种)、父母本材料各1株。提取黄瓜基因组DNA,利用多态性的2对线粒体特异性引物进行种子纯度鉴定,试验重复3次。将鉴定结果与田间形态鉴定结果进行比较,分析两种方法的一致性,验证黄瓜mtSSR分子标记在种子纯度鉴定上的可行性。
2 结果与分析 2.1 黄瓜基因组DNA的提取由电泳检测结果可以看出:提取的DNA条带清晰完整,纯度较高,没有明显降解,完全满足SSR反应的要求,可用于下一步PCR扩增。部分检测结果见图 1。
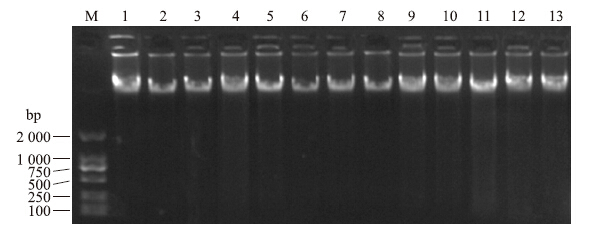 | 图 1 DNA质量的电泳检测Fig. 1 Quality analysis of DNA by electrophoresis M:Marker;1:北京截头Beijingjietou;2:长春密刺Changchunmici;3:P01(G);4:平望Pingwang;5:L8;6:EC1;7:Amir;8:8419s;9:410 Marketmore 97FF;10:407 Beit Alpha;11:JC1;12:Cucumis hystrix;13:C.sativus var.hardwickii |
采用软件Primer 3设计并合成了72对黄瓜线粒体基因组SSR特异引物。利用72对mtSSR引物对30份不同生态型的黄瓜高代自交系样品进行PCR扩增和聚丙烯酰胺凝胶电泳分离,以检测引物扩增的多态性,并对扩增片段进行克隆测序。 结果表明:72对mtSSR引物中有4对引物(表 1)在30份材料中呈现出多态性,其中引物mtSSR4扩增出102和107 bp的多态性片段(图 2-A),引物mtSSR10扩增出196、224和242 bp的多态性片段(图 2-B),引物mtSSR29扩增出227、238和280 bp的多态性片段(图 2-C),引物mtSSR44扩增出184和194 bp的多态性片段(图 2-D)。
| 引物对名称Primer pairs name | 引物对序列(5′→3′) Primer pairs sequence | SSR重复基元 | 产物大小/bpProducts size |
| mtSSR4 | GTCTCAGTGCCTGGTCTGT/ACCACTTACAAGGGCGAGAC | TATAT | 107 |
| mtSSR10 | GCGTCTTGCCCAAATTCCC/ATGGACAGGTGACGGGGA | TAG | 224 |
| mtSSR29 | GCCGGGAAATAGCAAGGC/TTCTTTGCACCGTCCGGA | TTCTT | 245 |
| mtSSR44 | GTGGAAGGCAGCTGGGTT/GACTCCAAACGCGGGTGA | GAAAA | 194 |
 | 图 2 多态性mtSSR引物筛选Fig. 2 Screening of polymorphic mtSSR primers M:Marker;1:北京截头Beijingjietou;2:长春密刺Changchunmici;3:北京小刺Beijingxiaoci;4:P01(G);5:新泰密刺Xintaimici;6:朝优3号Chaoyou 3;7:平望Pingwang;8:L8;9:平望(G) Pingwang(G);10:EC1;11:Amir;12:8419s;13:欧美佳Oumeijia;14:蔬春美雅Shuchunmeiya;15:EC5;16:Hazerd;17:戴多星Daiduoxing;18:410 Marketmore 97FF;19:407 Beit Alpha;20:401 Marketmore 2000;21:Poinsett 76;22:627(G);23:JC1;24:JC3;25:Boothbyls Blonde;26:Homenmade Pickles;27:宁佳7号Ningjia 7;28:C.hystrix;29:C.sativus var.xishuangbannanesis;30:C.sativus var.hardwickii |
在黄瓜杂交组合种子中,人为掺入本组合的母本自交系种子和其他花粉来源的杂交种种子,为了防止原样品本身含杂,影响结果的准确性,将原样本种子和掺入的种子进行了单粒编号(图 3和图 4)。很明显,引物mtSSR4对黄瓜杂交种F1(‘Amir’ב407 Beit Alpha’、‘407 Beit Alpha’בAmir’)及其相应的亲本能利用黄瓜线粒体父系遗传特性(正反杂交后代F1的条带与父本的是一致的)进行有效区分,图 3-A泳道11、28、45、57和图 3-B泳道9、17、35、45为人为掺入的母本自交系种子。同样,利用引物mtSSR10能将黄瓜杂交种F1(‘Amir’ב北京截头’、‘北京截头’בAmir’)及其相应的亲本有效区分,泳道11、28、45、57(图 4-A)和泳道9、17、35、45(图 4-B)为人为掺入的母本自交系种子,泳道 12、29、46、58(图 4-A、B)为人为掺入的其他花粉来源的假杂种。这与我们掺杂的情况是一致的。
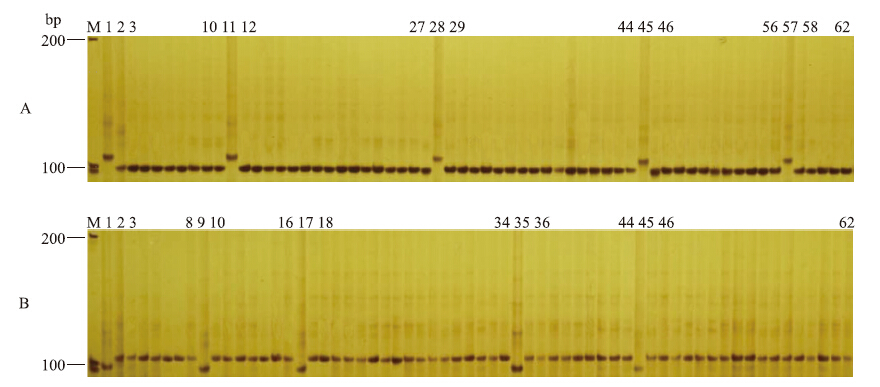 |
图 3 引物mtSSR4对杂交种F1的纯度检测Fig. 3 Purity identification of F1 hybrids with primer mtSSR4
M:Marker;A.1:母本‘407 Beit Alpha’;2:父本‘Amir’;11,28,45,57:‘407 Beit Alpha’;其他条带:‘407 Beit Alpha’בAmir’;B.1:母本‘Amir’;2:父本‘407 Beit Alpha’;9,17,35,45:‘Amir’;其他条带:‘Amir’ב407 Beit Alpha’ M:Marker;A.1:Female‘407 Beit Alpha’;2:Male‘Amir’;11,28,45,57:‘407 Beit Alpha’;The other lane:‘407 Beit Alpha’בAmir’;B.1:Female‘Amir’;2:Male‘407 Beit Alpha’;9,17,35,45:‘Amir’;The other lane:‘Amir’ב407 Beit Alpha’ |
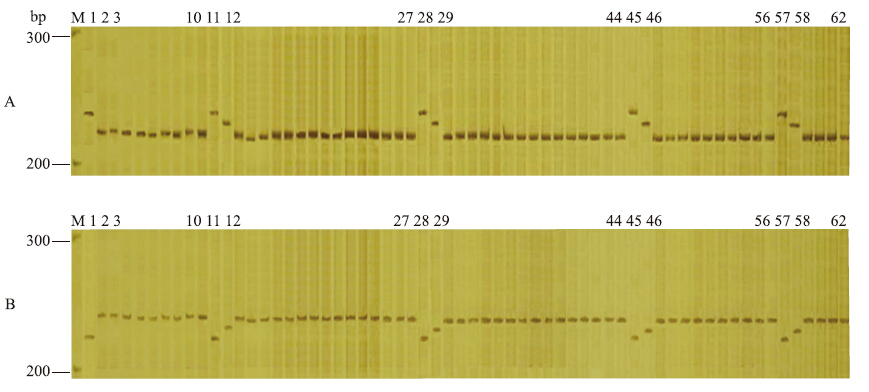 |
图 4 引物mtSSR10对杂交种F1的纯度检测Fig. 4 Purity identification of F1 hybrids with primer mtSSR10
M:Marker;A.1:母本‘北京截头’;2:父本‘Amir’;11,28,45,57:‘北京截头’;12,29,46,58:‘北京截头’×C.sativus var.xishuangbannanesis;其他条带:‘北京截头’בAmir’;B.1:母本‘Amir’;2:父本‘北京截头’;11,28,45,57:‘Amir’;12,29,46,58:‘Amir’×C.sativus var.xishuangbannanesis;其他条带:‘Amir’ב北京截头’ M:Marker;A.1:Female‘Beijingjietou’;2:Male‘Amir’;11,28,45,57:‘Beijingjietou’;12,29,46,58:‘Beijingjietou’×C.sativus var.xishuangbannanesis;The other lane:‘Beijingjietou’בAmir’;B.1:Female‘Amir’;2:Male‘Beijingjietou’;11,28,45,57:‘Amir’;12,29,46,58:‘Amir’×C.sativus var.xishuangbannanesis;The other lane:‘Amir’בBeijingjietou’ |
田间种植鉴定上述4份F1种子,并将统计结果与SSR鉴定结果相比较(表 2)。经过田间观察发现:F1代植株与果实性状多数表现一致,其中混杂的母本自交系植株和其他花粉来源的假杂种植株的表型与F1的不一致。从表 2可以看出:60株‘Amir’ב北京截头’中有1株可能是由于环境影响导致表型鉴定误差,SSR标记能鉴定出母本自交种和其他花粉来源的假杂种,分子标记方法检测结果与田间鉴定结果基本一致,说明利用线粒体基因组开发出来的SSR标记检测黄瓜杂交种子纯度的方法是完全可行的。
| 杂交组合 Cross combination | 田间形态鉴定Field morphological identification | SSR鉴定SSR identification | 差异/% Difference | ||||
| 检测数 No.of plants identified | 假杂种数 No.of false hybrids | 纯度/% Purity | 检测数 No.of plants identified | 假杂种数 No.of false hybrids | 纯度/% Purity | ||
| ‘Amir’ב407 Beit Alpha’ | 60 | 4 | 93.3 | 60 | 4 | 93.3 | 0 | |
| ‘407 Beit Alpha’בAmir’ | 60 | 4 | 93.3 | 60 | 4 | 93.3 | 0 | |
| ‘Amir’ב北京截头’ ‘Amir’בBeijingjietou’ | 60 | 9 | 85.0 | 60 | 8 | 86.7 | 1.7 | |
| ‘北京截头’בAmir’ ‘Beijingjietou’בAmir’ | 60 | 8 | 86.7 | 60 | 8 | 86.7 | 0 | |
| 平均差Mean difference | 0.43 |
与其他真核生物相比,植物线粒体基因组的结构和大小是高度变化的。在不同作物中差异很大,一般在200 kb(油菜)至2 500 kb(香瓜)之间[20]。地钱和拟南芥线粒体基因组测序工作阐明了线粒体DNA的编码冗余及外来片段重组是高等植物线粒体基因组高度变异的原因[21]。几乎所有植物线粒体基因组中都检测到可发生重组的活跃重复序列,另外还有一种不活跃的短序列,能在基因内部发生重组,形成新的开放读码框架[22]。高等植物线粒体存在母系、父系和双亲遗传现象,其大多数为母系遗传。随着DNA分子标记技术在细胞质遗传研究中的应用,黄瓜线粒体DNA父系遗传得到了证实[16, 17]。研究表明:黄瓜线粒体基因组序列大小为1 685 kb,所有可辨的完整线粒体基因都在1 556 kb长的主染色体上;基因组中含丰富的重复DNA,所有重复DNA序列占全基因组的36%(约605 kb)[18, 23]。本研究探索到一种新的方法,利用黄瓜线粒体父系遗传特性,基于线粒体基因组序列信息开发SSR标记,以期区分母本黄瓜上其他花粉来源的假杂种和自交种,对品种鉴定的研究具有重要的意义。
杂种优势的利用是提高作物产量的有效途径之一,且杂交种已广泛应用于黄瓜作物生产。随着黄瓜产业的发展和生产的需求,越来越多的优质、抗病新品种涌入市场,但同时也存在劣种、假种的现象。因此在植物育种和种子生产中,黄瓜品种纯度的鉴定是一项很重要的任务。随着分子标记技术的不断发展和杂交新品种的不断涌现,SSR技术在品种纯度鉴定等方面得到了广泛应用[24]。周胜军等[10]在黄瓜杂交种‘浙秀1号’699对供选SSR引物中筛选出3对特异引物,其带型为双亲的互补带型,且与田间鉴定结果非常相近。本试验基于黄瓜线粒体基因组序列开发了72对SSR标记,利用筛选出的特异性分子标记用于F1种子纯度检测,结果显示杂交种F1条带与父本的带型是一致的;通过将分子标记结果与田间形态学鉴定结果进行比较,发现SSR鉴定与田间鉴定结果基本一致,说明线粒体基因组所开发的分子标记鉴定具有可靠性和准确性。原有的SSR标记是通过核基因组开发出来的,本研究是通过线粒体基因组开发出来的,基于黄瓜线粒体父系遗传特点的优势,探索到了该类标记的一种应用。mtSSR技术作为一种新型分子标记,既具有线粒体基因组分子质量小、多拷贝、结构简单、保守性、单亲遗传等特点,又具有微卫星操作简单、高多态性、易于检测等优点。此外,基于线粒体基因组建立的品种谱,F1制种纯度检测仅检测父本标记即可,方法简便快捷,具有很大的应用价值,甜瓜核基因组上已有这方面的报道[25]。通过收集生产上主要推广杂交种的亲本材料,筛选出特异性线粒体分子标记,可以实现种子纯度的快速、准确鉴定。
目前,黄瓜核基因组SSR分子标记已用于基因定位、遗传图谱构建、系统进化研究及种质鉴定等方面[26, 27],其细胞器基因组方面的研究较少。本研究利用黄瓜线粒体基因组特异性标记进行种子纯度的鉴定,一方面将分子标记技术与传统育种方法相结合,可快速、准确地对杂交种纯度进行检测,对于保证种子质量和优良品种推广具有重要意义;另一方面寻找黄瓜种内的线粒体多态性,为追踪杂交过程中父系/母系线粒体基因组做技术准备。
| [1] | 胡丽芳,刘世强. 黄瓜重要性状相关分子标记研究进展[J]. 中国农学通报,2014,30(1):289-297 [Hu L F,Liu S Q. Research progress in cucumber molecular markers related to important agronomic character[J]. Chinese Agricultural Science Bulletin,2014,30(1):289-297(in Chinese with English abstract)] |
| [2] | 李巧英. SSR标记技术在种子纯度鉴定中的研究进展[J]. 中国种业,2009(11):22-24 [Li Q Y. The research of SSR markers in identification of seed purity[J]. China Seed Industry,2009(11):22-24(in Chinese)] |
| [3] | Salgado K C P C,Vieira M G G C,Pinho E V R V,et al. Genetic purity certificate in seeds of hybrid maize using molecular markers[J]. Revista Brasileira de Sementes,2006,28(1):169-175 |
| [4] | 盖树鹏,孟祥栋. 分子标记技术及其在作物育种中的应用[J]. 中国农学通报,2003,19(6):12-15 [Gai S P,Meng X D. Applicating of molecular markers in plant breeding[J]. Chinese Agricultural Science Bulletin,2003,19(6):12-15(in Chinese with English abstract)] |
| [5] | 柳李旺,侯喜林,龚义勤,等. 分子标记技术在蔬菜作物品种鉴定与纯度检测中的应用[J]. 分子植物育种,2004,2(4):563-568 [Liu L W,Hou X L,Gong Y Q,et al. Application of molecular marker in variety identification and purity testing in vegetable crops[J]. Molecular Plant Breeding,2004,2(4):563-568(in Chinese with English abstract)] |
| [6] | Yashitola J,Thirnmnrngan T,Sundaram R M,et al. Assessment of purity of rice hybrid using microsatellite and STS markers[J]. Crop Science,2002,42(4):1369-1373 |
| [7] | 关荣霞,刘燕,刘章雄,等. 利用SSR方法鉴定大豆品种纯度[J]. 分子植物育种,2003,1(3):357-360 [Guan R X,Liu Y,Liu Z X,et al. Purity identification of soybean varieties with SSR technique[J]. Molecular Plant Breeding,2003,1(3):357-360(in Chinese with English abstract)] |
| [8] | 李艺,铁双贵,朱位红,等. 鉴定玉米杂交种‘郑单958’种子纯度的SSR标记筛选[J]. 玉米科学,2008,16(1):40-43 [Li Y,Tie S G,Zhu W H,et al. Selection of SSR markers for‘Zhengdan 958’maize hybrid seed purity identification[J]. Journal of Maize Sciences,2008,16(1):40-43(in Chinese with English abstract)] |
| [9] | Hashemi S H,Mirmohammadi-Maibody S A M,Nematzadeh G A,et al. Identification of rice hybrids using microsatellite and RAPD markers[J]. African Journal of Biotechnology,2009,8(10):2094-2101 |
| [10] | 周胜军,张鹏,朱育强,等. 黄瓜‘浙秀1号’种子纯度的SSR鉴定[J]. 分子植物育种,2013,11(5):557-561 [Zhou S J,Zhang P,Zhu Y Q,et al. Application of SSR markers in‘Zhexiu 1’hybrid seed purity test of cucumber[J]. Molecular Plant Breeding,2013,11(5):557-561(in Chinese with English abstract)] |
| [11] | 艾呈祥,陆璐,马国斌,等. SSR标记技术在甜瓜杂交种纯度检验中的应用[J]. 园艺学报,2005,32(5):902-904 [Ai C X,Lu L,Ma G B,et al. Application of SSR markers in hybrid seed purity test of melon[J]. Acta Horticulturae Sinica,2005,32(5):902-904(in Chinese with English abstract)] |
| [12] | 李菊芬,许玲,马国斌. 应用SSR分子标记鉴定甜瓜杂交种纯度[J]. 农业生物技术学报,2008,16(3):494-500 [Li J F,Xu L,Ma G B. Identification of melon hybrid purity by SSR markers[J]. Journal of Agricultural Biotechnology,2008,16(3):494-500(in Chinese with English abstract)] |
| [13] | Ai C X,Yu X M,Liu Q Z,et al. Seed purity test of hybrid varieties of watermelon by SSR marker[J]. Acta Botanica Boreali-Occidentalia Sinica,2006,26(10):2006-2010 |
| [14] | 李菊芬,许玲,马国斌. 利用分子标记技术鉴定西瓜杂交种纯度[J]. 上海农业学报,2009,25(1):72-75 [Li J F,Xu L,Ma G B. Identification of watermelon hybrid purity by molecular markers[J]. Acta Agriculturae Shanghai,2009,25(1):72-75(in Chinese with English abstract)] |
| [15] | 韩小霞,胡新军,袁祖华,等. 利用SSR标记技术鉴定南瓜杂交种纯度的研究[J]. 分子植物育种,2014,12(1):112-117 [Han X X,Hu X J,Yuan Z H,et al. The research of the Cucurbita moschata hybrids purity identification by SSR makers[J]. Molecular Plant Breeding,2014,12(1):112-117(in Chinese with English abstract)] |
| [16] | Calderon C I,Yandell B S,Havey M J. Genetic mapping of paternal sorting of mitochondria in cucumber[J]. Theoretical and Applied Genetics,2012,125(1):11-18 |
| [17] | Shen J,Kere M G,Chen J F. Mitochondrial genome is paternally inherited in Cucumis allotetraploid(C.hytivus)derived by interspecific hybridization[J]. Scientia Horticulturae,2013,155:39-42 |
| [18] | Alverson A J,Rice D W,Dickinson S,et al. Origins and recombination of the bacterial-sized multichromosomal mitochondrial genome of cucumber[J]. The Plant Cell,2011,23:2499-2513 |
| [19] | 杨新泉,宋星,杜金昆,等. 六倍体小麦(AABBDD)及其近缘种属野生二粒小麦和粗山羊草叶绿体SSR遗传差异研究[J]. 中国农业科学,2007,40(7):1324-1330 [Yang X Q,Song X,Du J K,et al. Genetic diversity revealed by chloroplast genomic microsatellite markers in hexaploid wheat,wild emmer and Aegilops tauschii[J]. Scientia Agricultura Sinica,2007,40(7):1324-1330(in Chinese with English abstract)] |
| [20] | Kubo T,Newton K J. Angiosperm mitochondrial genomes and mutations[J]. Mitochondrion,2008,8:5-14 |
| [21] | 曹庆芹,伊华林,邓秀新. 两种柑橘线粒体DNA的获得与AFLP分析[J]. 园艺学报,2003,30(4):389-393 [Cao Q Q,Yi H L,Deng X X. Obtaining mtDNA of two types of Citrus and the AFLP analysis[J]. Acta Horticulturae Sinica,2003,30(4):389-393(in Chinese with English abstract)] |
| [22] | Andre C,Levy A,Walbot V. Small repeated sequences and the structure of plant mitochondrial genomes[J]. Trends Genet,1992,8(4):128-132 |
| [23] | Lilly J W,Havey M J. Small,repetitive DNAs contribute significantly to the expanded mitochondrial genome of cucumber[J]. Genetics,2001,159:317-328 |
| [24] | 程保山,万志兵,洪德林. 35个粳稻品种SSR指纹图谱的构建及遗传相似性分析[J]. 南京农业大学学报,2007,30(3):1-8. doi:10.7685/j.issn.1000-2030.2007.03.001 [Cheng B S,Wan Z B,Hong D L. Establishment of SSR fingerprintmap and analysis of genetic smiilarity among 35 varieties in japonica rice(Oryza sativa L.)[J]. Journal of Nanjing Agricultural University,2007,30(3):1-8(in Chinese with English abstract)] |
| [25] | Gao P,Ma H Y,Luan F S,et al. DNA fingerprinting of Chinese melon provides evidentiary support of seed quality appraisal[J]. PLoS ONE,2012,7(12):1-10 |
| [26] | Li Y H,Wen C L,Weng Y Q. Fine mapping of the pleiotropic locus B for black spine and orange mature fruit color in cucumber identifies a 50 kb region containing a R2R3-MYB transcription factor[J]. Theor Appl Genet,2013,126(8):2187-2196 |
| [27] | Hu J B,Li J W,Liang F F,et al. Genetic relationship of a cucumber germplasm collection revealed by newly developed EST-SSR markers[J]. Journal of Genetics,2013,89:28-32 |
 2015, Vol. 38
2015, Vol. 38


