文章信息
- 朱政, 王迟早, 高炯, 丁雨龙, 蒯本科. 2015.
- ZHU Zheng, WANG Chizao, GAO Jiong, DING Yulong, KUAI Benke. 2015.
- 水稻PBZ1基因启动子对烯丙异噻唑的诱导响应性分析
- Analysis of the responsiveness of rice PBZ1 promoter to probenazole
- 南京农业大学学报, 38(5): 720-726
- Journal of Nanjing Agricultural University, 38(5): 720-726.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.05.004
-
文章历史
- 收稿日期:2015-03-04
2. 南京林业大学生物与环境学院, 江苏 南京 210037;
3. 复旦大学生命科学学院/遗传工程国家重点实验室, 上海 200438;
4. 南京林业大学竹类研究所, 江苏 南京 210037
2. College of Biology and Environment, Nanjing Forestry University, Nanjing 210037, China;
3. State Key Laboratory of Genetic Engineering/School of Life Sciences, Fudan University, Shanghai 200438, China;
4. Bamboo Research Institute, Nanjing Forestry University, Nanjing 210037, China
烯丙异噻唑(3-allyloxy-1,2-benzisothiazole-1,1-dioxide,PBZ)是一种有效防治水稻稻瘟病(Magnaporthe grisea)的高效抗病性诱导剂,由于其低毒、安全的特性,属于一种环境友好型农药,已经成为东南亚稻区使用面积最广的化学诱抗剂[1, 2, 3]。PBZ可以引起水稻体内多种与免疫防御有关酶类的积累,如过氧化物酶、多酚氧化酶和苯丙氨酸裂解酶等[4]。另外,PBZ处理还可以诱导包括PBZ 1和RPR 1 在内的防御基因的表达,从而提高水稻对稻瘟病的抗性[5, 6, 7]。水稻PBZ 1 基因是第1个被鉴定到的响应PBZ诱导的基因,该基因能被包括稻瘟病在内的多种因素诱导,其转录水平与一定范围内的PBZ的剂量正相关,表明其可能与PBZ诱导的水稻稻瘟病抗性密切相关[5]。PBZ 1 基因编码的蛋白具有与水稻PR10蛋白相类似的序列,故又被命名为OsPR 10 a[8]。PBZ 1 已成为像PR 1 一样的抗病反应标记基因,被广泛用于水稻的抗病研究。
随着对植物抗病机制的深入研究,越来越多的与抗病相关的基因被鉴定和克隆,人们开始尝试通过转基因技术来提高植物的抗病性[9, 10, 11]。转基因工作必然涉及到启动子和功能基因的选择和使用。在前期的研究中,人们主要采用35S组成型启动子,驱动外源功能基因的表达。然而,一些转基因植物在抗病性提高的同时,大量异源蛋白或代谢产物的积累使其生长发育平衡也受到了一定程度的影响[12]。因此,如何实现对转基因表达水平严格和精细的调控,应是目前转基因育种面临的首要问题。
相比组成型启动子,诱导型启动子可以根据需要在转基因植物特定的发育阶段或生长环境下,诱导基因转录的开启与关闭[13]。化学诱导外源基因表达的模式在作物转基因遗传改良中具有显而易见的优势,通过引入化学诱导启动子和人为施加诱导剂,可以实现目的基因表达的适时和适量的“开”与“关”。但是,目前广泛应用于植物转基因研究的地塞米松诱导的GR系统和雌二醇诱导的ER系统[14, 15],显然都不适合大田条件下的应用。相比之下,杀虫剂诱导的EeR系统[16]是一个很好的便于大田使用的例子,但是,杀虫剂的毒性高,对环境的负面影响较大,因此也不适用于长期施用。PBZ作为一种环境友好型化学诱抗剂,具备田间化学诱导剂的理想特点,因而可以被开发为诱导作物转基因表达的新型化学诱导剂。本研究利用植物瞬时和稳定转化体系,检测了水稻PBZ 1 基因启动子对PBZ的诱导响应性,为评估其作为一种新型化学诱导启动子的潜力提供了初步的研究依据。
1 材料与方法 1.1 植物材料在长日照(16 h光照,8 h黑暗)条件下,于22 ℃植物培养室中生长5周的烟草(Nicotiana tabacum L.‘k326’)被用于叶片瞬时转化试验。选用粳稻品种‘日本晴’(Oryza sativa L.‘Nipponbare’),以其成熟种子诱导的愈伤组织作为水稻转基因受体材料。2周大小的‘日本晴’幼苗被用来制备水稻原生质体。
1.2 载体构建以水稻叶片基因组DNA为模板,设计1对引物P1和P2(表 1),扩增1 942 bp的PBZ 1 启动子目的片段,用限制性内切酶Pst和NcoⅠ分别双酶切目的片段和植物表达载体pCAMBIA1301,连接后获得重组质粒PPBZ 1-1942 bp-1301。以构建好的质粒DNA PPBZ 1-1942 bp-1301为模板,设计4对引物(表 1),分别扩增ATG上游1 942、1 053、608和285 bp 4个不同长度的PBZ 1 启动子片段,然后分别将上述4个启动子片段构建到双荧光报告基因载体pGreenII0800-LUC上[17],获得相应重组质粒PPBZ 1-1942 bp-0800、PPBZ 1-1053 bp-0800、PPBZ 1-608 bp-0800和PPBZ 1-285 bp-0800。
| 载体Plasmids | 引物序列Primer sequences |
| PPBZ1-1942bp-1301 | P1:5′-ATACTGCAGGCGAGGTAACAAAAAAGATTTCAAA-3′P2:5′-ATACCATGGCACTGAAGATATAATCTAACTAGCT-3′ |
| PPBZ1-1942bp-0800 | P3:5′-ATACTCGAGGCGAGGTAACAAAAAAGATTTCAAA-3′P4:5′-ATAGGATCCCACTGAAGATATAATCTAACTAGCT-3′ |
| PPBZ1-1053bp-0800 | P5:5′-ATACTCGAGGTTTTTCGGACGTCCTGTAG-3′P6:5′-ATAGGATCCCACTGAAGATATAATCTAACTAGCT-3′ |
| PPBZ1-608bp-0800 | P7:5′-ATACTCGAGCGATAAAGGGTATTTGTTTAGACC-3′P8:5′-ATAGGATCCCACTGAAGATATAATCTAACTAGCT-3′ |
| PPBZ1-285bp-0800 | P9:5′-ATACTCGAGGATTATTCTCCCAACCGTCC-3′P10:5′-ATAGGATCCCACTGAAGATATAATCTAACTAGCT-3′ |
将重组质粒PPBZ 1-1942 bp-1301转入农杆菌EHA105,参考Wydro等[18]方法进行烟草叶片瞬时转化试验。
1.4 水稻稳定转化及转基因PCR鉴定参照Hiei等[19]建立的农杆菌介导的粳稻高效转化体系,进行水稻转化和组织培养,获得转基因T0代植株。以再生水稻植株叶片DNA为模板,根据表达载体pCAMBIA1301多克隆插入位点上游序列和下游GUS序列设计特异性引物P1301-S(5′-CAGGTTTCCCGACTGGAAA-3′)和P1301-A(5′-GGGTCCTAACCAAGAAAATG-3′),检测T0代转基因阳性植株。
1.5 实时定量PCR分析采用Trizol法提取水稻叶片总RNA,经DNaseⅠ消化处理,去除DNA污染。参照TaKaRa PrimeScript RT Master Mix说明,取1 μg总RNA进行反转录,获得实时定量PCR(qRT-PCR)模板。以水稻OsUBQ 5 为内参基因,设计特异性引物(UBQ-S:5′-GGACACAATGATTAGGGATCA-3′,UBQ-A:5′-GTGGTGGCCAGTAAGTCCTC-3′;PBZ1-S:5′-CATCAGTGGTCAGTAGAGTG-3′,PBZ1-A:5′-CTCTAGGTGGGATATACTGG-3′;GUS-S:5′-AGTGGCAGTGAAGGGCGAACAGT-3′,GUS-A:5′-TCAGCGTAAGGGTAATGCGAGGT-3′),检测PBZ 1 和GUS基因表达量。
1.6 水稻原生质体制备和转化使用2.5%纤维素酶Cellulase R-10和0.5%离析酶Macerozyme R-10配制的酶解液酶解水稻幼苗的茎和叶鞘,具体的原生质体分离和转化过程参照Chen等[20]的方法。
2 结果与分析 2.1 PBZ 1 启动子在烟草叶片瞬时表达系统中的诱导响应性为了解PBZ 1 启动子是否可以作为一种具备应用潜力的化学诱导型启动子,以水稻基因组DNA为模板,通过PCR扩增方法,获得PBZ 1 起始密码子ATG上游1 942 bp的启动子序列,并将经PstⅠ和NcoⅠ双酶切后的启动子目的片段与同样经过双酶切的表达载体pCAMBIA1301连接,构建了PBZ 1 启动子驱动GUS的报告载体PPBZ 1-1942 bp::GUS(图 1-A)。本实验室前期的研究表明[21]:在经PBZ处理3 d后的转基因烟草中,拟南芥AtNPR 1 基因的启动子可以有效响应PBZ的诱导而驱动GUS报告基因的表达。因此,本试验将PPBZ 1-1942 bp::GUS通过农杆菌EHA105介导,瞬时转化经0.5 mmol · L-1 PBZ和水根灌处理3 d的烟草叶片(同时转化空载体pCAMBIA1301作为对照),2 d后进行叶片GUS染色分析。结果显示:转化空载体的烟草叶片呈现明显的GUS染色,且PBZ处理与水处理对照无显著差异;而转化PPBZ 1-1942 bp::GUS的烟草叶片经PBZ处理后呈现非常明显的GUS染色,水处理对照则仅有较弱的背景染色(图 1-B),这说明1 942 bp的PBZ 1 启动子序列具有PBZ诱导响应性。
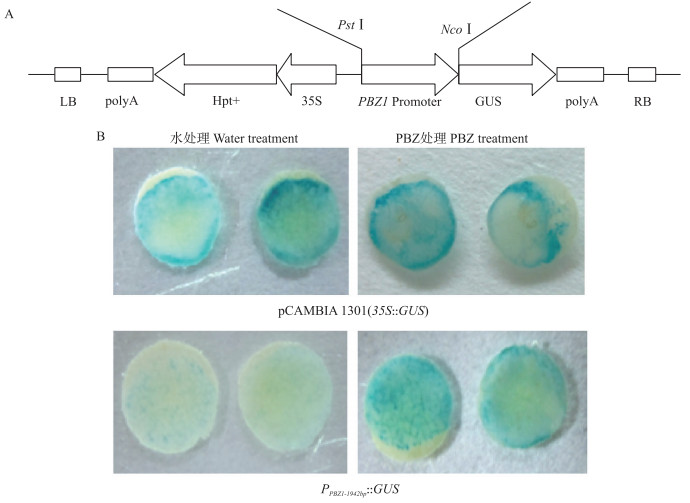 |
图 1 PBZ 1 启动子在烟草叶片瞬时表达系统中的诱导响应性
Fig. 1 The PBZ responsiveness of PBZ 1 promoter in transient expression system of tobacco leaves
A.重组报告载体PPBZ 1-1942 bp::GUS结构示意图;B.烟草叶片GUS组织化学染色结果 A.Scheme of the construct PPBZ 1-1942 bp::GUS;B.GUS staining in tobacco leaves |
本研究随后将构建的报告载体PPBZ 1-1942 bp::GUS通过农杆菌EHA105介导转入水稻愈伤组织,经潮霉素B抗性筛选,共获得具有潮霉素抗性的转基因T0代水稻27株。从各株系叶片中提取DNA作为模板,用特异性检测引物进行PCR鉴定,其中21株可以明显扩增出约2 300 bp的特异性产物,确定为转基因阳性株系(图 2)。
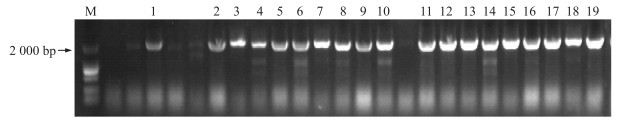 |
图 2 转基因水稻T0代株系的PCR鉴定
Fig. 2 PCR analyses of T0 transgenic rice lines
M.DL2000 Marker;1~19.能明显扩增出约2 300 bp特异产物的转基因阳性植株 1-19.The transgenic lines containing the 2 300 bp specific DNA fragment |
为检测PPBZ 1-1942 bp对PBZ的诱导响应性,选取部分转基因株系Line 3、Line 8、Line 9、Line 13和Line 14进行PBZ根灌处理。通过qRT-PCR检测各处理株系中PBZ 1 基因的表达情况,发现经PBZ根灌处理10 d后,其PBZ 1 基因的表达量均显著升高(图 3-A),这说明该处理方式可以真实反映PBZ诱导系统的有效性。同时,检测了各株系中GUS基因的表达量,结果显示:除了Line 9,其余各株系中GUS基因表达水平在处理后均显著上调(图 3-B),这表明PPBZ 1-1942 bp在转基因水稻中可以有效响应PBZ的诱导。
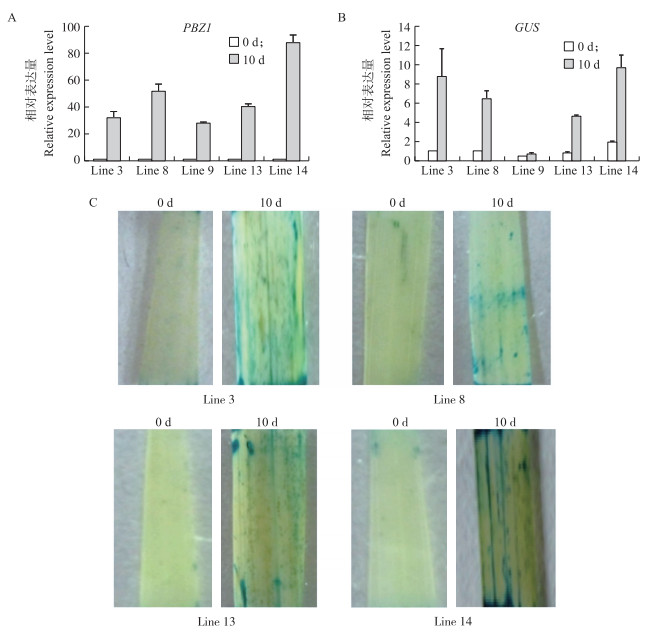 |
图 3 转基因水稻T0代株系中PBZ 1 启动子的诱导响应性
Fig. 3 The responsiveness of PBZ 1 promoter in T0 transgenic rice lines
A.各株系中PBZ 1 基因受PBZ诱导表达情况;B.PBZ处理前后,各株系中GUS基因表达量变化;C.PBZ处理前后,水稻叶片GUS组织化学染色结果 A.PBZ 1 gene expression in different lines treated with PBZ;B.GUS gene expression in different lines treated with PBZ;C.GUS staining in the leaves of different lines treated with PBZ |
为进一步确定转基因水稻中PPBZ 1-1942 bp的诱导响应,对转基因株系Line 3、Line 8、Line 13和Line 14叶片进行了GUS组织化学染色。结果显示:经PBZ处理后,水稻叶片中呈现非常明显的GUS染色(图 3-C),而未处理的叶片几乎观察不到染色现象。综合上述结果,认为PBZ 1 启动子具有作为一种基于PBZ诱导系统的新型化学诱导启动子的潜力。
2.3 不同长度PBZ 1 启动子片段的诱导响应性Lee[22]等研究表明:在水稻原生质体体系中,PBZ 1 基因的表达不受PBZ、水杨酸(SA)和脱落酸(ABA)的诱导,但可以响应茉莉酸(JA)诱导,因此PBZ诱导系统并不适用于水稻原生质体中的PBZ 1 启动子响应性分析。本实验室前期的研究结果表明:PBZ可以触发植物体内包括SA、JA和乙烯(ET)在内的多条信号通路[23, 24]。本研究通过对水稻JA信号通路关键受体基因COI 1 的RNAi转基因材料进行PBZ处理,发现其PBZ 1 基因的诱导表达水平相比野生型(WT)显著下调(图 4)。这些结果表明PBZ 1 基因受PBZ诱导表达很大程度上依赖于JA信号途径。因此,在后续试验中,我们利用MeJA在水稻原生质体系统中进行瞬时诱导表达分析。
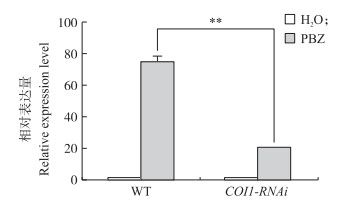 | 图 4 水稻茉莉酸(JA)信号通路的阻断对PBZ 1 基因 响应PBZ诱导表达的影响 Fig. 4 Effect of the deficiency of jasmonic acid(JA)signaling pathway on PBZ responsiveness of PBZ 1 in rice |
在确定1 942 bp长度的PBZ 1 启动子序列能够响应PBZ的诱导后,我们对其进行了5′端序列截短试验,分别获得了1 942 bp(2 kb)、1 053 bp(1 kb)、608 bp(0.6 kb)和285 bp(0.3 kb)4个不同长度的启动子片段(图 5-A),以期利用水稻原生质体体系获得具有更好响应性的PBZ 1 启动子序列。将上述4个不同长度的启动子片段构建到双荧光报告基因表达载体pGreenII0800-LUC上,获得相应的重组报告载体PPBZ 1 ::LUC(图 5-A)。利用萌发后生长2周的水稻苗幼茎和叶鞘制备原生质体,并将PPBZ 1 ::LUC通过PEG介导,瞬时转化水稻原生质体。转化后的水稻原生质体经100 μmol · L-1 MeJA处理6 h后,检测LUC相对酶活力的变化。结果表明:4个不同长度的启动子片段均可以有效响应MeJA的诱导,但1.0和0.6 kb 2个启动子片段的诱导表达活性要显著高于2.0和0.3 kb的启动子片段(图 5-B)。因此,后期研究可以考虑使用较短的1.0或0.6 kb启动子序列进行更进一步的应用潜力分析。
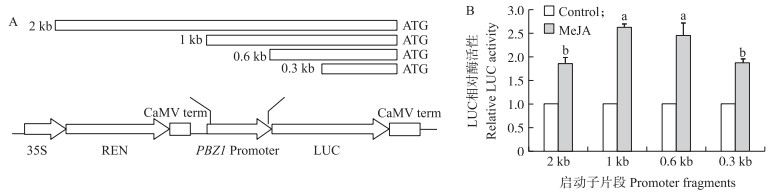 |
图 5 不同长度PBZ 1 启动子片段的诱导响应性
Fig. 5 The responsiveness of different PBZ 1 promoter fragments
A.重组报告载体PBZ 1 promoter::LUC结构示意图;B.水稻原生质体中不同长度PBZ 1 启动子片段对MeJA的响应情况[Control,未施加茉莉酸甲酯(MeJA)诱导,Control的LUC酶活性被设定为1] A.Scheme of the construct PBZ 1 promoter::LUC;B.The responsiveness of different PBZ 1 promoter fragments to MeJA in rice protoplast[Control:No methyl jasmonate(MeJA)treatment,the relative LUC activity of Control was set to 1] |
随着遗传工程技术的发展,转基因技术为解决影响农作物产量和品质的病虫害问题提供了有效的解决途径,以BT抗虫棉为代表的转基因农作物早已得到广泛认可。但是,如何严格控制外源基因的表达仍是转基因技术应用中面临的一个重要挑战,化学诱导剂和化学诱导启动子的引入将为此提供解决策略。在未来的转基因作物中,植物化学诱抗剂在触发植物自身免疫防御反应的同时,有效激活外源抗病相关基因的表达,将为转基因作物提供一种双重防御机制,并且可以在停止施加诱导剂后关闭外源基因的表达,以减轻外源基因过度表达可能给作物生长发育带来的负面影响。PBZ作为一种被广泛使用的防治水稻稻瘟病的环境友好型诱导剂,可用来建立一种新型的转基因诱导表达系统。除了抗病相关基因外,若将PBZ响应启动子与其他外源抗逆基因进行融合,如抗虫、抗旱基因等,即可通过施加PBZ来实现转基因作物的多重抗逆性。本研究通过构建水稻PBZ 1启动子与GUS报告基因的重组表达载体,分别采用瞬时和稳定转化的途径,检测了PBZ1启动子对PBZ的诱导响应性,初步分析了其作为一种新型化学诱导启动子的应用潜力。结果显示:无论是在瞬时还是稳定转化体系中,PBZ 1 启动子均能有效响应PBZ的诱导,暗示其具备作为一种基于PBZ诱导系统的化学诱导型启动子的应用潜力。目前,本实验室正在尝试构建响应性较好的1 kb PBZ 1 启动子片段与BT基因融合的重组表达载体,并通过稳定转化途径,在转基因作物中分析PBZ诱导系统调控BT毒蛋白表达的可行性,进一步明确PBZ 1 启动子的实际应用价值。
本研究中,我们利用水稻JA信号途径缺失的转基因材料COI 1 -RNAi,证明PBZ对PBZ 1 基因的诱导很大程度上依赖于JA信号途径,而在PBZ 1 启动子上也确实存在一些已知的与JA响应性相关的顺式作用元件,如TGACG元件、GCC-box等。因此,我们在水稻原生质体系统中,通过施加MeJA检测不同长度启动子片段的诱导表达活性,既可以有效反映其PBZ的诱导响应性,又克服了PBZ诱导系统不适用于原生质体体系的缺点,为PBZ 1 启动子响应性分析提供了一种更加高效的手段。1.0和0.6 kb的启动子片段表现出更好的诱导响应性,可能是因为较长的2 kb启动子片段具有更高的本底表达,而较短的0.3 kb启动子片段缺失更多的响应元件。由此可见,选择合适长度的启动子片段,可进一步优化对PBZ 1 启动子应用潜力的分析,构建基于PBZ的新型转基因表达调控系统。
中国科学院上海生命科学研究院植物生理生态研究所何祖华研究员慷慨提供OsCOI 1 -RNAi转基因水稻种子,谨致谢意。
| [1] | Watanabe T. Effects of probenazole(Oryzemate®)on each stage of rice blast fungus(Pyricularia oryzae Cavara)in its life cycle[J]. Journal of Pesticide Science,1977,2:395-404 |
| [2] | Watanabe T,Sekizawa Y,Shimura M,et al. Effects of probenazole(Oryzemate®)on rice plants with reference to controlling rice blast[J]. Journal of Pesticide Science,1979,4:53-59 |
| [3] | Yi X,Lu Y. Residues and dynamics of probenazole in rice field ecosystem[J]. Chemosphere,2006,65(4):639-643 |
| [4] | Iwata M,Suzuki Y,Watanabe T,et al. Effect of probenazole on the activities of enzymes related to the resistant reaction in rice plant[J]. Ann Phytopathol Soc Japan,1980,46:297-306 |
| [5] | Midoh N,Iwata M. Cloning and characterization of a probenazole-inducible gene for an intracellular pathogenesis-related protein in rice[J]. Plant and Cell Physiology,1996,37(1):9-18 |
| [6] | Midoh N,Iwata M. Expression of defense-related genes by probenazole or 1,2-benzisothiazole-3(2h)-one 1,1-dioxide[J]. Journal of Pesticide Science,1997,22(1):45-47 |
| [7] | Sakamoto K,Tada Y,Yokozeki Y,et al. Chemical induction of disease resistance in rice is correlated with the expression of a gene encoding a nucleotide binding site and leucine-rich repeats[J]. Plant Molecular Biology,1999,40(5):847-855 |
| [8] | Hwang S H,Lee I A,Yie S W,et al. Identification of an OsPR 10 a promoter region responsive to salicylic acid[J]. Planta,2008,227:1141-1150 |
| [9] | Hammond-Kosack K E,Parker J E. Deciphering plant-pathogen communication:fresh perspectives for molecular resistance breeding[J]. Current Opinion in Biotechnology,2003,14(2):177-193 |
| [10] | Campbell M A,Fitzgerald H A,Ronald P C. Engineering pathogen resistance in crop plants[J]. Transgenic Res,2002,11:599-613 |
| [11] | Michelmore R W. The impact zone:genomics and breeding for durable disease resistance[J]. Curr Opin Plant Biol,2003,6:397-404 |
| [12] | Gurr S J,Rushton P J. Engineering plants with increased disease resistance:How are we going to express it?[J]. Trends Biotechnol,2005,23(6):283-290 |
| [13] | 路静,赵华燕,何奕昆,等. 高等植物启动子及其应用研究进展[J]. 自然科学进展,2004,14(8):856-862[Lu J,Zhao H Y,He Y K,et al. Higher plant promoter and research progress on its application[J]. Progress in Natural Science,2004,14(8):856-862(in Chinese)] |
| [14] | Aoyama T,Chua N H. A glucocorticoid-mediated transcriptional induction system in transgenic plants[J]. The Plant Journal,1997,11(3):605-612 |
| [15] | Zuo J R,Niu Q W,Chua N H. An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants[J]. The Pant Journal,2000,24(2):265-273 |
| [16] | Unger E,Cigan A M,Trimnell M,et al. A chimeric ecdysone receptor facilitates methoxyfenozide-dependent restoration of male fertility in ms45 maize[J]. Transgenic Research,2002,11:455-465 |
| [17] | Hellens R P,Allan A C,Friel E N,et al. Transient expression vectors for functional genomics,quantification of promoter activity and RNA silencing in plants[J]. Plant Methods,2005,1:13 |
| [18] | Wydro M,Kozubek E,Lehmann P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana[J]. Acta Biochimica Polonica,2006,53(2):289-298 |
| [19] | Hiei Y,Ohta S,Komari T,et al. Efficient transformation of rice(Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA[J]. The Plant Journal,1994,6(2):271-282 |
| [20] | Chen S B,Tao L Z,Zeng L R,et al. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice[J]. Molecular Plant Pathology,2006,7(5):417-427 |
| [21] | Yu J,Wang X Y,Wei Q,et al. Identification of regulatory cis-elements upstream of AtNPR 1 that are responsive to probenazole treatment in transgenic tobacco plants[J]. Journal of Plant Biology,2010,53(4):282-290 |
| [22] | Lee M W,Qi M,Yang Y N. A novel jasmonic acid-inducible rice myb gene associates with fungal infection and host cell death[J]. Molecular Plant-Microbe Interactions,2001,14(4):527-535 |
| [23] | Yu J,Gao J,Wang X Y,et al. The pathway and regulation of salicylic acid biosynthesis in probenazole-treated arabidopsis[J]. Journal of Plant Biology,2010,53(6):417-424 |
| [24] | Zhu Z,Gao J,Yang J X,et al. Synthetic promoters consisting of defined cis-acting elements link multiple signaling pathways to probenazole-inducible system[J]. Journal of Zhejiang University:Science B,2015,16(4):253-263 |
 2015, Vol. 38
2015, Vol. 38


