文章信息
- 戴婷婷, 陆辰晨, 郑小波. 2015.
- DAI Tingting, LU Chenchen, ZHENG Xiaobo. 2015.
- 环介导等温扩增技术在病原物检测上的应用研究进展
- Application research progress of Loop-mediated isothermal amplification in the pathogenic microorganism
- 南京农业大学学报, 38(5): 695-703
- Journal of Nanjing Agricultural University, 38(5): 695-703.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.05.001
-
文章历史
- 收稿日期:2014-12-01
2. 南京农业大学植物保护学院, 江苏 南京 210095
2. College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China
核酸扩增技术是分子生物学领域的一项重要的研究手段,核酸扩增技术主要包括常规PCR为基础的变温扩增技术以及等温扩增技术两大类。目前,变温扩增技术主要包括普通PCR、巢式PCR、多重PCR、实时荧光定量PCR等,这些技术在病原微生物的检测中发挥着重要的作用。由于核酸的变温扩增技术需要精密变温设备和高级复杂的分析仪器,或者对操作人员的熟练度和专业水平要求比较高,且检测所需的时间偏长或操作过程较繁琐,不利于在基层推广;而病害的防控需要对病原微生物进行快速、准确、及早的检测并确诊。因此,建立一种快速、准确、灵敏、操作简便的新型的等温扩增技术对于植物病原物的检测显得尤为重要。等温扩增成为核酸扩增技术的一个研究热点,环介导等温扩增技术就是其中的一种。环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是日本学者Notomi等[1]于21世纪初建立的一种新的核酸等温扩增技术。自LAMP检测技术建立以来,该技术已经广泛应用于对病毒、细菌、寄生虫、菌物等病原菌的检测研究。随着该技术体系的完善与发展,其在分子检测领域的应用也必将越来越广泛与深入。本文就该技术的原理、方法及应用研究进展综述如下。
1 环介导等温扩增技术简介 1.1 LAMP技术特点及原理环介导等温扩增技术是Notomi等[1]报道的一种等温核酸扩增技术。该技术依赖于识别保守序列DNA的6个特异性片段的4条引物(2条外引物和2条内引物)和一种链置换DNA聚合酶(Bst DNA polymerase)。反应体系一般包括4条引物、Bst DNA聚合酶缓冲液、具有链置换特性的Bst DNA聚合酶、dNTP、模板DNA、甜菜碱、Mg2SO4等。LAMP检测体系中基因的扩增和产物的检测可一步完成,扩增效率高,可在30~60 min扩增109~1010倍,特异性较高;同时反应过程中,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物焦磷酸镁——乳白色沉淀。LAMP技术的主要原理是DNA在65 ℃左右可以处于动态平衡状态,DNA在此温度下利用4条特异性引物依靠一种链置换DNA聚合酶,使链置换DNA的合成不停地自我循环[1]。
1.2 LAMP技术的引物设计LAMP技术对引物设计的要求非常高,LAMP的2对引物分别称为FIP和BIP、F3和B3,可识别靶基因的6个不同的区域。F3:正向外引物,F3区与靶基因的F3c区域互补;B3:反向外引物,B3区域与靶基因的B3c区域互补;FIP:正向内引物,由F2区和F1c区域组成,F2区与靶基因3′端的F2c区域互补,F1c区与靶基因5′端的F1c区域序列相同;BIP:反向内引物,由B1c和B2区域组成,B2区与靶基因3′端的B2c区域互补,B1c区域与靶基因5′端B1c区域序列相同。内引物的两段DNA短片段可通过TTTT序列连接,也有研究结果认为在内部引物之间不加TTTT序列也并不影响等温扩增的结果,说明TTTT序列在内部引物上的连接并不是必需的。Nagamine等[2]的研究发现:在LAMP反应中加入环引物(正向环引物FLB、反向环引物BLP)能够明显加快等温扩增的速度,大大提高了检测效率,检测效率相对于没有加入环引物时高出7个数量级。
LAMP技术的关键点是靶标基因的选择与引物的筛选。靶标基因的选择要求其序列在种内的不同菌株间高度保守,而在种间有足够的差异。一般是选取靶基因的一段约130~200 bp(最长300 bp,不可超过500 bp)的保守序列,同时要考虑引物之间的距离、引物退火温度值的高低、引物长度和GC/AT含量等综合因素。整个LAMP扩增过程是等温的不需要变性的,为链置换和延伸的过程,因此扩增产物大小也随着链置换反应的进行而改变,从而在电泳图上表现为大小不一的阶梯状的条带。引物设计需要遵循以下原则:要保持引物的退火温度约55~66 ℃,其中F3和B3退火温度最低(55~60 ℃);F2和B2的退火温度次之(59~61 ℃);F1c和B1c的退火温度最高(64~66 ℃)。GC含量高者或者GC含量正常时,取退火温度范围的较高值;而AT含量高者取退火温度范围的较低值。F2的前端与F3及B2的前端与B3相距为0~20 bp,F2的前端与F1c及B2的前端与B1c相距为40~60 bp,F2的前端与B2相距为120~180 bp。设计引物时要防止引物二聚体的产生,特别是引物的3′端不应存在富AT区,不能与其他引物互补。引物设计可采用PrimerExplorer V4(http://venus.net-laboratory.com/partner/lamp/index.html)软件,并结合DNAstar的MegAlign模块和Primer Premier 5.0进行引物设计。对于引物的特异性验证可通过GenBank中的BLAST进行序列比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),即将设计好的4条引物分别在GenBank中的BLAST进行比对和初步筛选;更重要的试验环节是将设计的引物对目标病原生物同种不同地域、不同寄主来源的多个菌株,同属不同种的目标病原生物和其他相关微生物进行特异性验证,结果需均为阴性,才能确保LAMP引物的特异性,最后还需对所选择的特异性引物进行灵敏度试验,通常要求达到pg级水平。
1.3 LAMP反应结果的判定 1.3.1 肉眼观察法在LAMP反应过程中,能够产生副产物焦磷酸镁白色沉淀为阳性,所以可以通过用肉眼直接进行观察来判断扩增反应是否进行。
1.3.2 染色检测法通过肉眼直接观察白色沉淀来检测LAMP扩增反应的结果有时会存在一定的误差,所以可采用颜色变化目测的方式来判断检测结果,主要通过添加染料和金属离子指示剂来实现。目前使用的染料包括PicoGreen、SYBR GreenⅠ、钙黄绿素、羟基萘酚蓝(HNB)。其中以SYBR GreenⅠ和HNB的检测灵敏性最高,是钙黄绿素的10倍[3]。SYBR GreenⅠ在LAMP反应结束后加入,其LAMP反应溶液颜色在白光下由橙色变成黄绿色,在紫外光下阳性荧光量明显增强[4],但由于SYBR GreenⅠ染料在反应结束开管后加入,反应产物形成的气溶胶可能会增加LAMP扩增产物的污染。相对于SYBR GreenⅠ染料,HNB于扩增反应前加入,减少LAMP反应的污染,其溶液颜色由紫色变为天蓝色[5],阳性结果和阴性结果颜色差别明显,易于判断。染色检测法是LAMP反应结果判定最常用的方法。
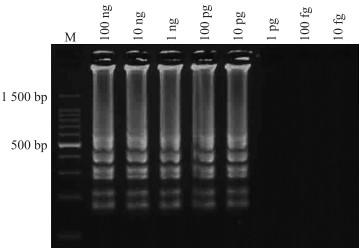
1.3.3 琼脂糖凝胶电泳法LAMP反应的最终扩增产物是茎环DNA组成的混合物,即有若干倍茎长度的茎环结构和类似花椰菜的结构。因此,LAMP扩增产物在经过20 g · L-1的琼脂糖凝胶电泳和EB染色后呈现典型的梯型状条带(图 1),可以看出,LAMP反应的灵敏度达到10 pg · μL-1。在大多数情况下,对反应产物进行电泳检测不是必须的。
日本荣研株式会社利用LAMP反应过程中产生焦磷酸镁白色沉淀,专门研制出用于LAMP检测的实时终点浊度仪LA-320C,以实现对LAMP扩增过程的实时监控,浊度仪通过每隔6 s测定反应管的浊度并绘制成曲线来判断反应结果。Dai等[6]对大豆疫霉进行了LAMP扩增,为了验证LAMP反应所设计的引物的种内通用性,采用疫霉属其他种的菌株作为对照,并用水作为阴性对照以检测LAMP引物的特异性。当发生LAMP扩增反应时,产生大量的焦磷酸镁白色沉淀,反应液的浊度上升,供试大豆疫霉的样本都产生了浊度曲线,而疫霉属其他种及阴性对照的曲线均没有变化,表明设计的引物具有种特异性。该检测法的优点是可以直接实时观测扩增过程,缺点是配套设备终点浊度仪LA-320C价格昂贵,检测成本高。
1.4 LAMP技术的优缺点LAMP检测技术最主要的优势在于等温扩增条件下进行扩增反应,相对于普通PCR技术具有以下优点:1)在等温条件下(60~65 ℃)就能进行扩增反应,反应时间短,仅需60 min左右;2)因没有变性的过程,所以不需要热循环仪器,一个普通水浴锅或者等温保温瓶即可进行LAMP反应;3)特异性较高,4条内外引物与靶序列的6个结合区完全匹配的情况下才能够进行LAMP扩增反应;4)反应结果可以通过肉眼观察判定。LAMP检测技术主要缺点是:1)扩增片段过小,靶序列长度要控制在300 bp以下;2)LAMP体系靶标选择和引物筛选较为繁琐;3)LAMP反应体系有时会产生非特异性扩增;4)反应过程中产生的气溶胶可能产生污染导致结果出现假阳性;5)利用LAMP技术的同一套特异性引物难以区分具有单核苷酸差异的不同菌株型或同一株型的病原菌,对于单碱基核苷酸位点的鉴定适用性较差;6)相对于Real-time PCR技术,LAMP反应体系不能对反应结果进行定量分析。
2 LAMP技术在病原微生物检测中的应用 2.1 病毒的检测 2.1.1 流感病毒的检测流感病毒是引起人类流感的病原之一,属于正黏病毒科,其分甲型、乙型和丙型流感病毒。流感病毒感染可导致一系列呼吸道疾病,临床症状从轻微的上呼吸道症状至急性呼吸窘迫综合征和多器官功能衰竭,甚至死亡。近年来已建立了针对季节性流感病毒、禽流感病毒和猪流感病毒的LAMP技术。Poon等[7]建立了基于流感病毒基质蛋白基因的LAMP法,可同时特异性检测季节性H1、H2和H3亚型,其检测灵敏性也较高。聂凯等[8]针对人甲型H1N1流感病毒HA序列中8个基因区段设计了6条特异引物,在等温条件下进行核酸扩增反应1.5 h,通过HNB的颜色变化做为结果判定标准并经琼脂糖凝胶电泳验证,建立了逆转录环介导等温核酸扩增技术应用于人甲型H1N1流感病毒的检测。Imai等[9]利用RT-LAMP技术建立了针对H5亚型高致病性禽流感病毒的检测方法,该方法简便快速、成本低、不需要特殊试剂,灵敏度比普通RT-PCR技术高100倍,而且可以从15个血凝素亚型HA中检测出H5亚型,具有很高的特异性,在对高致病性禽流感的病原监测应用中具有很高的实用价值。李启明等[10]建立了RT-LAMP检测技术用于H5N1亚型禽流感病毒的检测,该技术对51份感染标本的H5N1亚型的HA和NA基因区进行了RT-LAMP技术检测,并以SYBR Green作为反应指示剂,同时对反应进行实时浊度监控,证明RT-LAMP技术具有较高的特异性;灵敏性结果也显示RT-LAMP技术与Real-time PCR技术灵敏度一致。
2.1.2 SARS冠状病毒的检测导致严重急性呼吸综合征(SARS)世界性爆发流行的病原体是一种新型的冠状病毒——SARS冠状病毒(SARS-CoV),这是一种RNA单链正链病毒,可以导致人体以呼吸系统症状为主要表现的全身疾病。Poon等[11]采用LAMP技术开发了SARS-冠状病毒检测试剂盒,并对检测试剂盒进行了临床实验的评估,评估结果显示LAMP技术在疾病发生的前3天检测效率稍逊于RT-PCR检测,但LAMP技术的简单化、可视化、高灵敏度等优点使其具有临床诊断领域的潜在能力。Thai等[12]也报道了SARS冠状病毒的LAMP检测技术,其设计的LAMP特异性引物具有较好的特异性,同时灵敏度是普通RT-PCR灵敏度的100倍。
2.1.3 猪类病毒的检测Anne-Lie等[13]应用RT-LAMP法可在30~60 min内检测出猪水疱病毒(SVDV),对收集的28株SVDV检测呈阳性,而其他病毒仍然是阴性;同时利用血清学的临床样本进行灵敏度的试验,结果发现RT-LAMP检测法的灵敏度与Real-time PCR相同;利用粪便样本进行灵敏度的试验,结果发现RT-LAMP检测法的灵敏度比普通PCR技术更加灵敏。Chen等[14]基于猪细小病毒(PPV)非结构蛋白1的4条特异性引物建立了PPV的LAMP检测方法,试验证明LAMP是一种简便、敏感、快速、可靠的PPV检测方法。何逸民等[15]通过对LAMP反应体系和反应条件的优化,LAMP技术能在63 ℃、60 min内成功检测猪圆环病毒2型基因。Chen等[16]利用RT-LAMP技术检测猪繁殖与呼吸综合征病毒(PRRSV),研究选用10个参考株、122个阳性标本和临床分离株进行了测试,结果表明这种检测技术较普通RT-PCR技术更可靠、更方便、更快速灵敏地诊断出高致病性PRRSV感染。除此之外,LAMP技术还成功应用于非洲猪瘟病毒(ASFV)[17]、猪瘟病毒(CSFV)[18]等猪类病毒。
2.1.4 伪狂犬病毒的检测伪狂犬病是由伪狂犬病毒引起的家畜和多种野生动物的一种以发热、奇痒、呼吸和神经系统疾病为特征的急性传染。伪狂犬病毒(PRV)是一种RNA弹状病毒,伪狂犬病的临床症状和呼吸、肠道疾病很类似,因此临床诊断伪狂犬病很困难。En等[19]建立了一种快速、简便和可靠的伪狂犬病毒(PRV)检测系统,针对PRV DNA结合蛋白基因利用RT-LAMP技术成功设计了特异性引物检测PRV。
2.1.5 其他病毒的检测口蹄疫病毒(FMDV)属于小RNA病毒科,单股正链RNA病毒。Dukes等[20]建立了检测FMDV的RT-LAMP方法,针对病毒的3D蛋白聚合酶区设计引物进行RT-LAMP反应,其能在22 min内检测出10个拷贝的FMDV。传染性造血器官坏死病毒(IHNV)是一种棒状RNA病毒,感染一些特异性的鱼种,侵染野生和饲养的蛙鱼时能够引起其大量死亡。Gunimaladevi等[21]利用RT-LAMP也建立了IHNV的快速检测体系,通过和巢式PCR技术进行灵敏度的比较,发现RT-LAMP检测技术的灵敏度是巢式PCR检测技术的10倍,并且操作简便、成本低,比其他分子检测方法更适合用于检测IHNV,对控制和防止鱼类传染病具有重要意义。此外,LAMP技术也成功应用于流行性乙型脑炎病毒[22]、牛病毒性腹泻病毒[23]、丙型肝炎病毒[24]、腮腺炎病毒[25]、新城疫病毒[26]等病毒的检测。
2.2 细菌的检测 2.2.1 沙门菌属的检测沙门菌属(Salmonella)广泛分布于自然界中,是包括人类在内的所有脊椎动物肠道中的常见寄生菌[27]。人只要经口摄入足够量的细菌,克服胃酸等机体保护屏障定位于小肠,即能引起沙门氏菌感染性疾病;沙门氏菌亦被列入化妆品中微生物的控制指标。因此,沙门氏菌病的防治备受畜牧兽医、公共卫生和检验检疫等有关部门的关注,均将沙门氏菌列为重要的检测和控制对象。传统的检测方法是采用沙门氏菌的分离培养与鉴定,其使用的是肠道鉴别培养基或者选择性培养基的方法,所需时间较长,通常需要5~6 d。用PCR检测沙门氏菌需要设计特异性的引物,使用最多的引物则来源于沙门氏菌属侵袭性抗原保守基因invA,通过普通PCR的快速检测,其具有较好的特异性与灵敏度,但PCR技术需要琼脂糖凝胶电泳和热循环仪器。Hara-Kudo等[28]采用LAMP检测技术建立了肠炎沙门氏菌的检测体系,同时比较了LAMP检测体系与普通PCR检测体系的灵敏度,结果显示LAMP方法检测灵敏度比PCR方法有所提高,且具有良好的特异性。张宏伟等[29]针对沙门氏菌特异性基因invA,设计了4条沙门氏菌属的LAMP检测特异性引物,建立了食品中沙门氏菌的LAMP检测方法;该方法特异性好、灵敏度高、与传统方法相比可节省大量时间且对实验仪器和操作人员的要求低,非常适于在实际工作中推广。
2.2.2 副溶血弧菌的快速检测副溶血弧菌(Vibrio parahaemolyticus )是我国一种重要的食源性病原菌,可引起急性肠胃炎,少数情况还能引发败血病,危及生命。副溶血弧菌引发食物中毒的规模呈明显的上升趋势,目前已超过沙门氏菌食物中毒,跃居首位。因此需要从多方面加强检测,以防止该菌对食品造成的大面积污染,保证人的身体健康。传统鉴定副溶血性弧菌的方法是分离培养、镜检、观察、生化鉴定等,这些检测手段不仅需要专业技术人员,同时鉴定过程耗时、灵敏度低、操作复杂;随着核酸分子检测技术不断发展,基于PCR的方法已经成功用于检测副溶血性弧菌[30, 31, 32],虽然PCR法在特异性和敏感性上有较大的提高,但是检测时间仍然比较长,需要4~5 h,不能满足快速检测的需求;同时PCR方法依赖精密的温度循环装置。目前针对副溶血弧菌的环介导等温扩增检测技术在国内外的报道是非常多的,足以证明这一技术在副溶血弧菌的检测中起到非常重要的作用。王虹玲等[33]以副溶血弧菌具有种特异性的gyrB基因为靶基因设计了LAMP引物,建立了环介导等温扩增方法检测贝肉中的副溶血弧菌,结果表明LAMP体系具有很高的特异性和敏感性;应用于61份贝类海产品的现场检测,阳性率为100%,与实时荧光定量PCR方法的检测结果相符,阳性率高于传统的培养鉴定方法。徐芊等[34]针对副溶血弧菌不耐热溶血毒素基因(tlh)设计4条特异性引物(2条内引物和2条外引物)建立了LAMP扩增技术。刘威等[35]也针对副溶血弧菌特异基因(tlh)设计并筛选出了4条特异性的LAMP引物,通过识别tlh基因上的6个独立区域来快速检测副溶血弧菌,具有较好的特异性,且LAMP检测法灵敏度是普通PCR法的10倍。由于LAMP方法用于快速检测副溶血弧菌检测过程简单、特异性强、灵敏度高、鉴定方便,所以特别适合用于现场和基层检疫及医疗单位的快速诊断。
2.2.3 志贺菌属的检测志贺菌属细菌是最为常见的导致细菌性痢疾的病原菌,是引起食物中毒的常见致病菌之一,引起食物中毒的食品多为肉类、乳制品等蛋白质含量较多的食物。与沙门氏菌属和副溶血弧菌相同,最初也采用传统的方法,其操作繁琐,检测时间长,通常需要3~5 d。随着检测技术的不断发展,志贺菌属也建立了环介导等温扩增技术。易海华等[36]基于志贺菌侵袭性质粒抗原H基因(ipaH)的保守序列设计并筛选出1套LAMP引物,对21株志贺菌和非志贺菌进行特异性检测以确定其特异性,并使用LAMP和普通PCR技术对ipaH基因重组质粒倍比稀释液进行检测以确定其灵敏度,结果显示LAMP技术可以在1 h内完成扩增技术,特异性也较好,灵敏度是普通PCR的10倍以上。
2.2.4 分枝杆菌属的检测结核分枝杆菌(Mycobacterium tuberculosis),俗称结核杆菌,是引起结核病的病原菌。其可侵犯全身各器官,但以肺结核最为多见。结核分枝杆菌生长比较缓慢,所以临床上一直在寻找快速准确的鉴别方法诊断分枝杆菌。Iwamoto等[37]根据16S核糖体DNA保守序列和gyrB基因序列设计了LAMP反应的特异性引物,采用LAMP体系成功地从痰标本中鉴定出结核分枝杆菌、禽分枝杆菌和胞内分枝杆菌。黄帆等[38]也以结核分枝杆菌作为研究对象,设计了4种LAMP引物以特异地识别结核分枝杆菌中gyrB基因的6个特殊区域,通过LAMP检测技术可以在几种常见的致病分枝杆菌中快速、特异地检测出结核分枝杆菌。
2.2.5 大肠杆菌O157:H7的检测大肠杆菌O157:H7是肠出血型大肠杆菌(enterohemorrhagic E.coli,EHEC)的一个主要血清型,是最为常见的食源性致病菌,被污染的食品是其主要的传染源,而猪、鸡、牛、羊等家禽是次要的传染源。Maruyama等[39]将LAMP技术和原位杂交技术相结合,用于检测携带stx 2 基因的大肠埃希菌O157:H7。易海华等[40]利用LAMP核酸扩增基因技术针对编码O157:H7脂多糖的rfbE基因和编码H7鞭毛抗原的fliC基因设计了LAMP检测的特异性引物。
2.2.6 其他细菌的检测LAMP技术还成功用于特异性检测单增李斯特菌的肌动蛋白诱导蛋白聚集因子基因(actA)和空肠弯曲茵的促旋酶基因(gyrA),超级细菌的β-内酰胺酶-新德里金属-β-内酰胺酶-1基因(NDM- 1 ),肺炎链球菌的lytA基因(lytA),假结核耶尔森菌基因(inv),耐甲氧西林金黄色葡萄球菌耐药基因(mecA)和特异性基因(femA),以及小肠结肠炎耶尔森氏菌和创伤弧菌等[41, 42, 43, 44]细菌病原物。
2.3 寄生虫的检测非洲锥虫病亦称睡眠病,系由罗得西亚锥虫或冈比亚锥虫所致的中枢神经系统感染性疾病,借舌蝇传播,流行于非洲南北纬20°之间。早期临床表现为长期不规则发热,全身淋巴结肿大、皮疹;晚期以神经系统症状为主,有严重头痛、肌肉震颤、反应迟钝、昏睡以至昏迷死亡。Kuboki等[45]采用LAMP法建立了非洲锥虫病的检测技术。尾蚴是日本血吸虫的感染期,因此检测水体尾蚴的有无可为安全用水提供好的依据。杨秋林等[46]采用LAMP法建立了一种检测日本血吸虫尾蚴的方法,此法检测尾蚴电泳后阳性呈典型的特征性梯状条带,其灵敏度能达到1条尾蚴。传统的线虫检测方法主要通过贝尔曼氏漏斗法和显微镜进行形态学鉴定,检测所需时间长且效率低。Niu等[47]采用LAMP法建立了大豆根结线虫的检测法;Kikuchi等[48]利用LAMP检测法建立了松材线虫的快速检测法,大大缩短了检测时间。
2.4 菌物的检测LAMP已广泛应用于病毒、细菌及寄生虫等检验检测中,但是对菌物检测的研究相对较少,已有论文证明LAMP法同样适用于病原菌物的检测中。南美芽生菌病是由巴西类球孢子菌引起的皮肤黏膜、淋巴结和内脏器官的真菌性疾病,高发于拉丁美洲国家,而在非流行地区,南美芽生菌病的诊断比较困难。传统检测需经过真菌培养才能确诊;采用PCR技术从真菌细胞内检测出巴西类球孢子菌的特异性基因gp 43和gp 27 需要5~6 h,如果是血液或组织标本则需要12 h以上才能检测出来;Endo等[49]和Tatibana等[50]用LAMP检测gp 43 基因只需要3 h即可特异性地检出巴西类球孢子菌;Lucas等[51]基于CAP 59 靶标序列建立了隐球菌的LAMP检测技术,用于鉴定隐球菌复合种的不同血清分型。大豆枯萎病又称萎蔫病、黄叶病、根腐病,是一种分布较广、危害较重、防治困难的世界性土传病害。近年来,随着大豆种植面积不断扩大,大豆枯萎病的发生呈扩大蔓延、加重危害的趋势,对大豆生产造成很大威胁。为了阻止大豆枯萎病传播范围的不断扩大,使大豆枯萎病得到控制,Lu等[6]分析了大豆尖镰孢CYP 51 C基因和其他镰孢菌在序列上的差异,设计了4条特异性的LAMP引物和2条环引物,在此基础上建立了检测大豆尖镰孢的LAMP体系。Niessen等[52]基于半乳糖氧化酶基因(gaoA)建立了禾谷镰刀菌的LAMP检测体系;同时Abd-Elsalam等[53]采用Niessen等[52]建立的LAMP检测体系将其应用到谷物类感染镰刀菌的检测,从而为镰刀菌的检测提供了快速、灵敏的检测方法。Duan等[54, 55]将LAMP检测技术应用于禾谷镰刀菌β2-微管蛋白的点突变检测中,同时还建立了葡萄灰霉菌的快速LAMP检测技术体系。Ohori等[56]建立了奔马赭霉菌的LAMP检测方法,有助于肺部暗色丝孢霉病的诊断。Sun等[57]建立了马尔尼菲青霉病菌的LAMP检测技术。在卵菌的应用中,Dai等[6]分析了大豆疫霉菌和其他疫霉菌在A 3 aPro序列上的差异,设计了LAMP的特异性引物,在此基础上建立了检测大豆疫霉菌的LAMP体系,结果表明整个检测过程仅需1 h,即可通过肉眼直接目测试验结果;同时,戴婷婷等[5]应用LAMP技术建立了一种基于颜色判定的简单、快速和灵敏的橡树疫霉菌的检测方法。因此,LAMP技术在菌物检测中可望替代已相对落后的普通PCR技术。
3 展望LAMP技术作为一种等温核酸扩增技术,其优点在于反应速度快、特异性高、设备简单、反应结果易于判别鉴定,适用于人、畜和植物等病原生物检测和监控领域。“TB-LAMP肺结核快速检测系统”是一种新型分子诊断技术,其利用LAMP技术快速、高效、特异性检测结核分枝杆菌复合群,可在10 min之内完成对痰液样本的处理过程。全套设备和试剂可在常温常压条件下保存运输,通过将反应试剂干粉化浓缩到反应试管盖中,极大地简化了肺结核基层现场检测的流程和难度。RT-LAMP技术在循环肿瘤细胞和埃博拉病毒检测等方面得到了极大的应用;在食源性致病菌检测应用中,利用LAMP技术建立了高效快速准确的食源性致病菌检测方法;LAMP技术在动植物检验检疫工作中具有广泛的应用前景,目前已有多项基于LAMP法的快速检测法用于出入境检验检疫的工作中。LAMP试剂盒的国产化和商业化使检测成本大大降低,促进了LAMP技术的推广和普及。但目前常规的LAMP技术只能检测1~2种病原菌,随着生物技术的不断发展,近年来新发展起来的LAMP与芯片的整合技术,如μL-LAMP、μmL-LAMP技术等可实现多个基因、多个样本的同时检测,从而实现病原菌高通量的检测方法,在人、畜和植物等病原生物检测和监控领域具有广阔的应用前景。
| [1] | Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):e63 |
| [2] | Nagamine K,Hase T,Notomi T. Accelerated reaction by Loop-mediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes,2002,16(3):223-229 |
| [3] | Gao H,Lei Z,Jia J,et al. Application of Loop-mediated isothermal amplification for detection of Yersinia enterocolitica in pork meat[J]. Journal of Microbiological Methods,2009,77(2):198-201 |
| [4] | Lu C C,Dai T T,Zhang H F,et al. Development of a Loop-mediated isothermal amplification assay to detect Fusarium oxysporum[J]. Journal of Phytopathology,2015,163(1):63-66 |
| [5] | 戴婷婷,陆晨辰,沈浩,等. 基于环介导等温扩增技术检测橡树疫霉[J]. 南京农业大学学报,2013,36(3):23-28. doi:10.7685/j.issn.1000-2030.2013.03.004[Dai T T,Lu C C,Shen H,et al. Rapid diagnostic methods for Phytophthora ramorum using LAMP[J]. Journal of Nanjing Agricultural University,2013,36(3):23-28(in Chinese with English abstract)] |
| [6] | Dai T T,Lu C C,Lu J,et al. Development of a Loop-mediated isothermal amplification assay for detection of Phytophthora sojae[J]. FEMS Microbiology Letters,2012,334(1):27-34 |
| [7] | Poon L L,Leung C S,Chan K H,et al. Detection of human influenza a viruses by Loop-mediated isothermal amplification[J]. Journal of Clinical Microbiology,2005,43(1):427-430 |
| [8] | 聂凯,王大燕,秦萌,等. 基于颜色判定的环介导逆转录等温扩增技术检测人甲型H1N1流感病毒基因[J]. 病毒学报,2010,26(2):81-87[Nie K,Wang D Y,Qin M,et al. Colorimetric detection of human influenza a H1N1 virus by reverse transcription Loop-mediated isothermal amplification[J]. Chinese Journal of Virology,2010,26(2):81-87(in Chinese with English abstract)] |
| [9] | Imai M,Ninomiya A,Minekawa H,et al. Development of H5-RT-LAMP(Loop-mediated isothermal amplification)system for rapid diagnosis of H5 avian influenza virus infection[J]. Vaccine,2006,24(44):6679-6682 |
| [10] | 李启明,马学军,高寒春,等. 逆转录环介导等温核酸扩增技术(RT-LAMP)在H5N1禽流感病毒基因检测中的应用[J]. 病毒学报,2008,24(3):178-184[Li Q M,Ma X J,Gao H C,et al. Evaluation of reverse transcription Loop-mediated isothermal amplification for detection of avian influenza a H5N1 virus[J]. Chinese Journal of Virology,2008,24(3):178-184(in Chinese with English abstract)] |
| [11] | Poon L L,Wong B W,Chan K H,et al. Evaluation of Real-time reverse transcriptase PCR and Real-time Loop-mediated amplification assays for severe acute respiratory syndrome coronavirus detection[J]. Journal of Clinical Microbiology,2005,43(7):3457-3459 |
| [12] | Thai H T C,Le M Q,Vuong C D,et al. Development and evaluation of a novel Loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndrome coronavirus[J]. Journal of Clinical Microbiology,2004,42(5):1956-1961 |
| [13] | Anne-Lie B,Mikhayil H,Scott M R,et al. A one-step reverse transcriptase Loop-mediated isothermal amplification assay for simple and rapid detection of swine vesicular disease virus[J]. Journal of Virological Methods,2008,147(1):188-193 |
| [14] | Chen C,Cui S. Detection of porcine parvo virus by Loop-mediated isothermal amplification[J]. Journal of Virological Methods,2009,155(2):122-125 |
| [15] | 何逸民,邹国秋,张得玉,等. 猪圆环病毒2型环介导等温扩增(LAMP)检测方法的研究[J]. 中国兽医杂志,2009,45(12):7-10[He Y M,Zou G Q,Zhang D Y,et al. Research of Loop-mediated isothermal amplification assay for the detection of Porcine Circovirus type 2[J]. Chinese Journal of Veterinary Medicine,2009,45(12):7-10(in Chinese with English abstract)] |
| [16] | Chen C M,Cui S,Zhang C F,et al. Development and validation of reverse transcription Loop-mediated isothermal amplification for detection of PRRSV[J]. Virus Genes,2010,40(1):76-83 |
| [17] | 王彩霞,刘建,林祥梅,等. 环介导恒温扩增技术快速检测非洲猪瘟病毒[J]. 动物医学进展,2010,10(2):15-19[Wang C X,Liu J,Lin X M,et al. Detection of african swine fever virus(ASFV)by Loop-mediated isothermal amplification method[J]. Progess in Veterinary Medicine,2010,10(2):15-19(in Chinese with English abstract)] |
| [18] | 李健,熊炜,方雪恩,等. 猪瘟病毒RT-LAMP检测方法的建立[J]. 中国兽医科学,2010,40(10):1033-1038[Li J,Xiong W,Fang X E,et al. Establishment of RT-LAMP system for rapid detection of classical swine fever virus[J]. Chinese Veterinary Science,2010,40(10):1033-1038(in Chinese with English abstract)] |
| [19] | En F X,Wei X,Jian L,et al. Loop-mediated isothermal amplification establishment for detection of pseudorabies virus[J]. Journal of Virological Methods,2008,151(1):35-39 |
| [20] | Dukes J,King D,Alexandersen S. Novel reverse transcription Loop-mediated isothermal amplification for rapid detection of foot-and-mouth disease virus[J]. Archives of Virology,2006,151(6):1093-1106 |
| [21] | Gunimaladevi I,Kono T,Lapatra S,et al. A Loop-mediated isothermal amplification(LAMP)method for detection of infectious hematopoietic necrosis virus(IHNV)in rainbow trout(Oncorhynchus mykiss)[J]. Archives of Virology,2005,150(5):899-909 |
| [22] | 杜鹃,宋永,刘立科,等. 流行性乙型脑炎病毒一步法RT-LAMP检测方法的建立[J]. 中国预防兽医学报,2010,32(10):773-776[Du J,Song Y,Liu L K,et al. Development of one step RT-Loop-mediated isothermal amplification assay for detection of Japanese encephalitis virus[J]. Chinese Jounal of Preventive Veterinary Medicine,2010,32(10):773-776(in Chinese with English abstract)] |
| [23] | 范晴,谢芝勋,刘加波,等. 牛病毒性腹泻病毒RT-LAMP检测方法的建立[J]. 生物技术通讯,2010,21(2):248-251[Fan Q,Xie Z X,Liu J B,et al. Establishment of Loop-mediated isothermal amplification for detection of bovine viral diarrhea virus[J]. Letters in Biotechnology,2010,21(2):248-251(in Chinese with English abstract)] |
| [24] | 李启明,马学军,周蕊,等. 环介导逆转录等温扩增技术(RT-LAMP)在丙型肝炎病毒基因检测中的应用[J]. 病毒学报,2006,22(5):334-338[LI Q M,Ma X J,Zhou R,et al. Detection of HCV gene by reverse transcription Loop-mediated isothermal amplification method[J]. Chinese Journal of Virology,2006,22(5):334-338(in Chinese with English abstract)] |
| [25] | 鲜思美,韦洪才,尹强军,等. 鹅副黏病毒环介导等温扩增快速检测方法的建立及应用[J]. 生物技术通报,2012(11):150-154[Xian S M,Wei H C,Yin Q J,et al. Establishmen and application of a Loop-mediated isothermal amplification method for rapid detection of gallinacean paramyxo virus[J]. Biotechnology Bulletin,2012(11):150-154(in Chinese with English abstract)] |
| [26] | 孔令辰,侯佳蕾,蒋文泓,等. 应用环介导逆转录等温扩增技术快速检测新城疫病毒[J]. 华南农业大学学报,2008,29(4):75-78[Kong L C,Hou J L,Jiang W H,et al. Reverse transcriptase Loop-mediated isothermal amplification technique for rapid detection of newcastle disease virus[J]. Journal of South China Agricultural University,2008,29(4):75-78(in Chinese with English abstract)] |
| [27] | Tirado C,Schmidt K. WHO surveillance programme for control of food borne infections and intoxications:preliminary results and trends across greater Europe[J]. The Journal of Infection,2001,43(1):80 |
| [28] | Hara-Kudo Y,Yoshino M,Kojima T,et al. Loop-mediated isothermal amplification for the rapid detection of Salmonella[J]. FEMS Microbiology Letters,2006,253(1):155-161 |
| [29] | 张宏伟,叶露萌,彭杨思,等. 利用环介导等温扩增技术对沙门氏菌进行检测[J]. 食品研究与开发,2009(5):115-118[Zhang H W,Ye L M,Peng Y S,et al. Development of LAMP detection of Salmonella in food[J]. Food Research and Development,2009(5):115-118(in Chinese with English abstract)] |
| [30] | Kaufman G,Blackstone G,Vickery M,et al. Real-time PCR quantification of Vibrio parahaemolyticus in oysters using an alternative matrix[J]. Journal of Food Protection,2004,67(11):2424-2429 |
| [31] | Takahashi H,Iwade Y,Konuma H,et al. Development of a quantitative Real-time PCR method for estimation of the total number of Vibrio parahaemolyticus in contaminated shellfish and seawater[J]. Journal of Food Protection,2005,68(5):1083-1088 |
| [32] | Ward L N,Bej A K. Detection of Vibrio parahaemolyticus in shellfish by use of multiplexed Real-time PCR with TaqMan fluorescent probes[J]. Applied and Environmental Microbiology,2006,72(3):2031-2042 |
| [33] | 王虹玲,朱水荣,梅玲玲,等. 副溶血弧菌的gyrB基因环介导的恒温扩增技术检测方法的研究[J]. 疾病监测,2009(8):27-28[Wang H L,Zhu S R,Mei L L,et al. Study on Loop-mediated isothermal amplification(LAMP)technique for detection of Vibrio parahaemolyticus based on the gyrB gene[J]. Disease Surveillance,2009(8):27-28(in Chinese with English abstract)] |
| [34] | 徐芊,孙晓红,赵勇,等. 副溶血弧菌LAMP检测方法的建立[J]. 中国生物工程杂志,2007,27(12):66-72[Xu Q,Sun X H,Zhao Y,et al. Development of Loop-mediated isothermal amplification(LAMP)method for detection of Vibrio parahaemolyticus[J]. China Biotechnology,2007,27(12):66-72(in Chinese with English abstract)] |
| [35] | 刘威,邹大阳,尹志涛,等. 基于颜色判定的环介导恒温扩增法快速检测副溶血性弧菌[J]. 中国科学:生命科学,2011,41(10):1037-1042[Liu W,Zou D Y,Yin Z T,et al. Colorimetric detection of Vibrio parahaemolyticus by Loop-mediated isothermal amplification method[J]. Science China(Life Sciences),2011,41(10):1037-1042(in Chinese with English abstract)] |
| [36] | 易海华,赵金伟,房超,等. 志贺菌环介导等温扩增检测方法建立[J]. 中国公共卫生,2011,27(3):380-382[Yi H H,Zhao J W,Fang C,et al. Development of genetic diagnostic method of Shigella based on Loop-mediated isothermal amplification[J]. Chinese Journal of Public Health,2011,27(3):380-382(in Chinese with English abstract)] |
| [37] | Iwamoto T,Sonobe T,Hayashi K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J]. Journal of Clinical Microbiology,2003,41(6):2616-2622 |
| [38] | 黄帆,李琳,林世平,等. DNA环介导恒温扩增技术快速检测结核分枝杆菌的研究[J]. 现代食品科技,2008,24(8):835-838[Huang F,Li L,Lin S P,et al. Application of Loop-mediated isothermal amplification(LAMP)in rapid detection of Mycobacterium tuberculosis[J]. Modern Food Science and Technology,2008,24(8):835-838(in Chinese with English abstract)] |
| [39] | Maruyama F,Kenzaka T,Yamaguchi N,et al. Detection of bacteria carrying the stx 2 gene by in situ Loop-mediated isothermal amplification[J]. Applied and Environmental Microbiology,2003,69(8):5023-5028 |
| [40] | 易海华,赵金伟,徐波,等. 使用环介导等温扩增技术快速检测食品中肠出血性大肠杆菌O157:H7的初步研究[J]. 中国食品卫生杂志,2010,22(3):206-213[Yi H H,Zhao J W,Xu B,et al. Rapid detection of enterohemorrhagic Escherichia coli O157:H7 in food by Loop-mediated isothermal amplification assay[J]. Chinese Journal of Food Hygiene,2010,22(3):206-213(in Chinese with English abstract)] |
| [41] | Seki M,Yamashita Y,Torigoe H,et al. Loop-mediated isothermal amplification method targeting the lytA gene for detection of Streptococcus pneumoniae[J]. Journal of Clinical Microbiology,2005,43(4):1581-1586 |
| [42] | Horisaka T,Fujita K,Iwata T,et al. Sensitive and specific detection of Yersinia pseudotuberculosis by Loop-mediated isothermal amplification[J]. Journal of Clinical Microbiology,2004,42(11):5349-5352 |
| [43] | Goto M,Honda E,Ogura A,et al. Short technical reports:colorimetric detection of Loop-mediated isothermal amplifcation reaction by using hydroxy naphthol blue[J]. Biotechniques,2009,46:167-172 |
| [44] | Han F,Ge B. Evaluation of a Loop-mediated isothermal amplification assay for detecting Vibrio vulnificus in raw oysters[J]. Foodborne Pathogens and Disease,2008,5(3):311-320 |
| [45] | Kuboki N,Inoue N,Sakurai T,et al. Loop-mediated isothermal amplification for detection of African trypanosomes[J]. Journal of Clinical Microbiology,2003,41(12):5517-5524 |
| [46] | 杨秋林,许丽芳,张愉快,等. 环介导等温扩增技术检测日本血吸虫尾蚴的实验研究[J]. 中国血吸虫病防治杂志,2008,20(3):209-211[Yang Q L,Xu L F,Zhang Y K,et al. Rapid detection of enterohemorrhagic Escherichia coli O157:H7 in food by Loop-mediated isothermal amplification assay[J]. Chinese Journal of Schistosomiasis Control,2008,20(3):209-211(in Chinese with English abstract)] |
| [47] | Niu J,Guo Q,Jian H,et al. Rapid detection of Meloidogyne spp.by LAMP assay in soil and roots[J]. Crop Protect,2011,30(8):1063-1069 |
| [48] | Kikuchi T,Aikawa T,Oeda Y,et al. A rapid and precise diagnostic method for detecting the pinewood nematode Bursaphelenchus xylophilus by Loop-mediated isotheisothermal amplification[J]. Phytopathology,2009,99(12):1365-1366 |
| [49] | Endo S,Komori T,Ricci G,et al. Detection of gp 43 of Paracoccidioides brasiliensis by the Loop-mediated isothermal amplification(LAMP)method[J]. FEMS Microbiology Letters,2006,234(1):93-97 |
| [50] | Tatibana B,Sano A,Uno J,et al. Detection of Paracoccidioides brasiliensis gp 43 gene in sputa by Loop-mediated isothermal amplification method[J]. Journal of Clinical Laboratory Analysis,2009,23(2):139-143 |
| [51] | Lucas S,da Luz Martins M,Flores O,et al. Differentiation of Cryptococcus neoformans varieties and Cryptococcus gattii using CAP59-based Loop-mediated isothermal DNA amplification[J]. Clinical Microbiology and Infection,2010,16(6):711-714 |
| [52] | Niessen L,Vogel R F. Detection of Fusarium graminearum DNA using a Loop-mediated isothermal amplification(LAMP)assay[J]. International Journal of Food Microbiology,2010,140(2):183-191 |
| [53] | Abd-Elsalam K,Bahkali A,Moslem M,et al. An optimized protocol for DNA extraction from wheat seeds and Loop-mediated isothermal amplification(LAMP)to detect Fusarium graminearum contamination of wheat grain[J]. International Journal of Molecular Sciences,2011,12(6):3459-3472 |
| [54] | Duan Y B,Ge C Y,Zhang X K,et al. Development and evaluation of a novel and rapid detection assay for Botrytis cinerea based on Loop-mediated isothermal amplification[J]. PLoS ONE,2014,9(10):e111094 |
| [55] | Duan Y B,Zhang X K,Ge C Y,et al. Development and application of Loop-mediated isothermal amplification for detection of the F 167 Y mutation of carbendazim-resistant isolates in Fusarium graminearum[J]. Scientific Reports,2014,9(4):7094 |
| [56] | Ohori A,Endo S,Sano A,et al. Rapid identification of Ochroconis gallopava by a Loop-mediated isothermal amplification(LAMP)method[J]. Veterinary Microbiology,2006,114(3):359-365 |
| [57] | Sun J,Li X,Zeng H,et al. Development and evaluation of Loop-mediated isothermal amplification(LAMP)for the rapid diagnosis of Penicillium marneffei in archived tissue samples[J]. FEMS Immunology and Medical Microbiology,2010,58(3):381-388 |
 2015, Vol. 38
2015, Vol. 38