文章信息
- 吕波, 张鸣, 卢爱民, 徐江艳, 梁剑茹, 周立祥, 徐峙晖. 2015.
- LYU Bo, ZHANG Ming, LU Aimin, XU Jiangyan, LIANG Jianru, ZHOU Lixiang, XU Zhihui. 2015.
- 响应曲面法优化黄钾铁矾/草酸体系光催化降解甲基橙
- Photocatalytic degradation of methyl orange by jarosite/oxalate system: optimization using a response surface methodology
- 南京农业大学学报, 38(4): 676-681
- Journal of Nanjing Agricultural University, 38(4): 676-681.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.023
-
文章历史
- 收稿日期:2014-09-08
2. 南京农业大学资源与环境科学学院, 江苏 南京 210095
2. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China
偶氮染料是一类重要的合成有机化合物,其特征是分子中含有偶氮键(—n N—),广泛应用于纺织、皮革印染、食品生产、化妆品、造纸印刷以及医药等行业[1]。据估计大约10%~15%的合成偶氮染料在生产和处理过程损失而进入排放废水中[2]。这些废水有颜色,且大多数染料有毒性和致癌性,对生态环境和人类健康造成了严重的威胁[3]。由于偶氮染料具有稳定的芳环结构,传统的物理、化学和生物方法很难有效地将这些偶氮染料除去[4]。因此,高级氧化过程(AOPs)正日益备受关注。其中,光催化降解废水中的有机污染物被认为是一种有发展前景的清洁和绿色技术[5, 6]。
Zuo等[7]报道了Fe(Ⅲ)-草酸复合物在光照条件下能产生H2O2,H2O2与Fe(Ⅱ)经过类photo-Fenton反应产生羟基自由基( · OH),而 · OH能无选择性地将偶氮染料降解为水和二氧化碳。李惠等[8]和李瑛等[9]也应用小分子有机酸分别协同TiO2和施氏矿物光催化降解水溶性染料孔雀石绿。黄钾铁矾[KFe3(SO4)2(OH)6]是酸性矿山废水中产生的一种羟基硫酸铁矿物,常用作建筑材料和有毒元素的吸附剂[10, 11]。我们的试验证明黄钾铁矾在没有外源供给H2O2时经紫外光照射能与草酸作用产生类芬顿效应降解偶氮染料,此方面研究在国内尚未见相关报道。另外,为了提高甲基橙废水的降解率,我们采用响应曲面法对试验条件进行优化。进一步的试验验证了本文所建立的拟合模型在类photo-Fenton反应中降解甲基橙的有效性。
1 材料与方法 1.1 催化剂制备参照柏双友等[12]报道的微生物氧化法合成黄钾铁矾。在240 mL 0.16 mol · L-1 FeSO4和53.3 mmol · L-1 K+溶液中(调节pH值为2.5)接种A.f-LX5休止细胞悬浮液,将盛有上述溶液的三角瓶置于180 r · min-1往复式摇床中28 ℃下振荡培养72 h。沉淀产物用中速定性滤纸收集,用酸化的去离子水(pH 2.0)洗涤3次,再用去离子水洗涤3次,60 ℃烘干4 h,保存在干燥箱中备用。
1.2 催化剂表征生物法制备黄钾铁矾进行X射线衍射(Bruker D8)、扫描电子显微镜(Hitachi S-3000N)和傅里叶变换红外光谱(Bruker Vector 22)表征。
1.3 光催化反应试验所有光催化反应试验均在XPA-7型光化学反应仪(南京胥江机电厂)中进行,中心光源采用300 W的中压汞灯(波长范围265~580 nm,其中紫外光能量占40%)。反应温度由循环水控制在(25±1)℃。开启光源灯同时开始计时,磁力搅拌反应悬浮液(600 r · min-1),每隔一定时间用塑料针筒取样2 mL,离心分离除去黄钾铁矾。然后用移液枪准确吸取1 mL过滤液并用去离子水稀释至10 mL,用UV-9100紫外可见分光光度计(北京瑞利仪器有限公司)于464 nm处测定甲基橙(MO)浓度。通过测定反应体系中达到吸脱附平衡时甲基橙的浓度(C0)和反应过程中甲基橙的浓度(Ct),用残留比(Ct/C0)来表示甲基橙的降解率。
1.4 试验设计、数据分析和过程优化采用中心组分设计法(CCD),力图以较少的试验次数获得最多的有关甲基橙降解过程中各反应条件及相互之间的作用信息。甲基橙降解率(MO removal rate,%)为因变量(Y),而黄钾铁矾装载量(jarosite loading)、草酸浓度(oxalic acid concentration)和初始pH(initial pH)选定为独立变量(X),其值及变化范围如表 1所示。
独立过程变量 Independent process variables | 代码 Code |
|
| 黄钾铁矾装载量/(g·L-1)Jarosite loading | X1 | 0.032 | 0.10 | 0.20 | 0.30 | 0.37 |
| 草酸浓度/(mmol·L-1)Oxalic acid concentration | X2 | 1.320 | 2.00 | 3.00 | 4.00 | 4.68 |
| 初始pH Initial pH | X3 | 2.320 | 3.00 | 4.00 | 5.00 | 5.68 |
用Design-Expert 8.0.6软件分析试验数据,进行过程优化并且用如下二次多项式方程拟合。
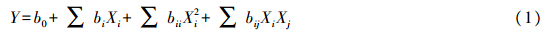
生物法制备黄钾铁矾的X射线衍射谱图(图 1)与笔者以前工作得到的矿物相[13]是一致的。其红外光谱如图 2所示。1 642 cm-1的吸收峰是由吸附水或结构中的O—H键振动引起的[14];波数位于512 cm-1的吸收峰是FeO6配位八面体的振动模式[12]。SO2-4的v4、v3、v2和v1振动模式分别位于631、1 191、1 090和1 006 cm-1[15]。生物法制备与化学法合成样品的红外谱图[16]非常相似。生物法制备黄钾铁矾的扫描电镜图如图 3所示,呈花状簇型。
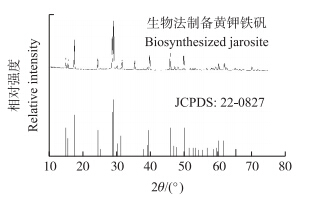 | 图 1 生物法制备黄钾铁矾的X射线衍射图谱 Fig. 1 X-ray diffraction(XRD)pattern of biosynthesized jarosite |
 | 图 2 生物法合成黄钾铁矾的特征傅里叶变换红外图谱 Fig. 2 Characteristic part of the Fourier transform infrared (FTIR)spectrum of biosynthesized jarosite |
 | 图 3 生物法合成黄钾铁矾的扫描电子显微图 Fig. 3 Scanning electron microscope image of biosynthesized jarosite | |
在不同条件下,甲基橙光催化降解的动力学过程如图 4所示。在没有加入黄钾铁矾和草酸时,紫外光(UV)照射40 min后,甲基橙几乎没有降解;仅加入黄钾铁矾或草酸,甲基橙在紫外光照射下的降解仍然不明显;然而,当黄钾铁矾和草酸同时加入到反应体系中,甲基橙在紫外光照射40 min后降解了96%。显然,黄钾铁矾和草酸的相互作用对甲基橙的降解产生了至关重要的影响。与铁氧化物和草酸形成的反应体系[17]类似,黄钾铁矾和草酸亦能在紫外光照射下形成类光芬顿体系产生高反应活性的 · OH,其机制如下所示[18, 19]:
 | 图 4 不同条件下甲基橙光催化降解效率 Fig. 4 Photocatalytic degradation of methyl orange(MO) under different conditions ρ(MO)=50 mg · L-1;Initial pH=4;c(Oxalic acid)=2 mmol · L-1;ρ(Jarosite loading)=0.4 g · L-1 | ||
首先,草酸吸附在黄钾铁矾表面形成≡Fe(Ⅲ)-草酸复合物(“≡”代表黄钾铁矾的表面结构);然后,部分高光化学活性的复合物在紫外光照射下溶解进入反应液中。反应液中的Fe(Ⅲ)-草酸复合物及黄钾铁矾表面的≡Fe(Ⅲ)-草酸复合物在紫外光辐射下都能通过配位体-金属电荷转移产生Fe(Ⅱ)和CO- · 2;CO- · 2和溶解氧反应产生负氧离子。负氧离子是铁循环反应中的重要中间产物,它能进一步产生 · OH;最终,甲基橙被羟基自由基氧化、降解。
2.3 试验设计结果及其方差分析试验设计矩阵对应的响应值和预测值见表 2。根据试验结果,拟合独立变量(试验条件)和响应值(甲基橙光催化降解率)之间经验联系的二次多项式方程,如下式所示:
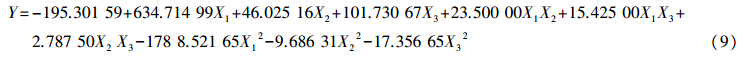
| 试验序号 No. |
|
|
| 1 | -1 | -1 | 1 | 21.33 | 18.61 | |
| 2 | -1 | 1 | -1 | 75.64 | 75.86 | |
| 3 | 1 | -1 | 1 | 24.63 | 27.30 | |
| 4 | 0 | 0 | 0 | 100.00 | 100.11 | |
| 5 | 1 | -1 | -1 | 79.49 | 81.14 | |
| 6 | 0 | 0 | 0 | 100.00 | 100.11 | |
| 7 | 0 | 0 | -1.682 | 93.85 | 94.19 | |
| 8 | 1 | 1 | 1 | 36.48 | 45.09 | |
| 9 | 0 | 0 | 0 | 99.98 | 100.11 | |
| 10 | 0 | 0 | 1.682 | 12.27 | 7.83 | |
| 11 | 0 | 0 | 0 | 100.00 | 100.11 | |
| 12 | 0 | 1.682 | 0 | 86.86 | 79.03 | |
| 13 | -1 | 1 | 1 | 25.76 | 27.00 | |
| 14 | 1 | 1 | -1 | 82.17 | 87.78 | |
| 15 | -1.682 | 0 | 0 | 35.32 | 40.86 | |
| 16 | 0 | 0 | 0 | 99.95 | 100.11 | |
| 17 | 0 | 0 | 0 | 100.00 | 100.11 | |
| 18 | 0 | -1.682 | 0 | 62.55 | 66.39 | |
| 19 | 1.682 | 0 | 0 | 67.81 | 58.18 | |
| 20 | -1 | -1 | -1 | 84.34 | 78.62 | |
| 注:辐射时间Irradiation time:40 min;响应值(Y)Response:甲基橙降解率(%)MO remomal rate. | ||||||
对应以代码表示的回归方程式为:

表 3是对回归方程的方差分析(ANOVA)。回归方程的P值小于0.05就被认为是充分和重要的,而 其值大于0.100 0则回归方程预测值误差较大[20]。本文得到甲基橙降解率回归方程的P值小于0.000 1,说明该方程的回归关系是显著的。另外,回归方程的相关系数是97.99%,这意味着97.99%的甲基橙降解率 的变化可以用选中的独立变量来解释。而相关系数大于80%就已说明回归方程对试验数据拟合得很好[20]。
| 项目 Item | 自由度 Degrees of freedom | 方差分析Analysis of variance | |||
| 平方和Sum of squares | 均方Mean square | F值F-value | P值P-value | ||
| 模型Model | 9 | 184 47.00 | 2 049.67 | 54.22 | <0.000 1 |
| 残差Residual | 10 | 378.03 | 37.80 | ||
| 失拟Lack of fit | 5 | 378.03 | 75.61 | ||
| 纯误差Pure error | 5 | 0.002 083 | 0.000 416 7 | ||
以甲基橙降解率为函数,以试验条件为变量的三维响应曲面图如图 5所示。从图 5可以看到:黄钾铁矾装载量和草酸浓度都有一个最佳值。黄钾铁矾装载量越小,反应体系中的活性位点就越少,从而导致甲基橙的降解率低;当催化剂(黄钾铁矾)装载量达到一定值,反应体系中会产生屏蔽效应[21]导致紫外光线透过率降低而使甲基橙降解下降。低浓度的草酸必然会导致反应体系中高光化学活性复合物的数量减少,此时甲基橙降解率不高。然而,过高浓度的草酸会淬灭羟基自由基[19],从而使甲基橙的降解率亦会下降。在试验的pH值范围内(2.32~5.68),甲基橙的降解率随着pH值的降低而升高。原因有如下几点:1)草酸吸附在黄钾铁矾矿物表面是甲基橙降解的一个关键步骤,而反应液的pH值会影响黄钾铁矾表面电荷的分布及草酸的解离程度。生物制备黄钾铁矾的零电荷点是5.6[13]。这意味着反应液pH值小于5.6时,黄钾铁矾表面带正电荷,且pH值越低,其表面正电荷越多。草酸的解离常数pK1和pK2分别是1.25和3.81[13],在pH值2.32~5.68范围内,草酸主要是以HC2O-4和C2O2-4两种型体存在。因此,反应液pH越低,越有利于≡Fe(Ⅲ)-草酸复合物的形成。2)低pH值反应液中,黄钾铁矾容易溶解[22]从而有利于Fe(Ⅲ)-草酸复合物的形成。3)反应液pH值越高,将会使Fe(Ⅲ)生成没有活性氢氧化物沉淀,同时也阻止了(≡)Fe(Ⅲ)-草酸复合物的形成而使甲基橙降解率下降。这与Zuo等[7]的结果是一致的,此外,他们还指出Fe(Ⅲ)-草酸复合物在光照条件下产生H2O2速率受反应液pH影响甚大;在pH值1.5~4.0范围内,H2O2生成速率很快且基本维持恒定,但pH值高于4.0后,H2O2生成速率随pH值升高而显著降低。
 | 图 5 甲基橙降解率为函数的响应曲面图 Fig. 5 Response surface plots of MO removal as a function a:黄钾铁矾装载量和草酸浓度Jarosite loading and oxalic acid concentration(pH=4);b:黄钾铁矾和pH Jarosite loading and pH(草酸浓度Oxalic acid concentration=3 mmol · L-1);c:草酸浓度和pH Oxalic acid concentration and pH(黄钾铁矾装载量Jarosite loading=0.2 g · L-1) |
在黄钾铁矾/草酸/UV体系中,设定甲基橙降解率最大,优化得到的最佳试验条件为:黄钾铁矾装载量0.2 g · L-1,草酸浓度3 mmol · L-1,pH 4。我们按此条件进行试验,甲基橙降解率随时间变化曲线如图 6所示。可以看到:反应25 min时,甲基橙就已经完全降解(100%)。这说明依据响应面分析法得到的二次多项式模型准确地拟合了各影响因子(试验条件)与响应值(甲基橙降解率)之间的函数关系,据此优化得到的黄钾铁矾/草酸/UV体系降解甲基橙的最佳试验条件是可靠的。
 | 图 6 在最佳条件下甲基橙降解率随时间变化图 Fig. 6 Evolution of the MO removal along time under optimum conditions |
生物法制备黄钾铁矾/草酸体系在紫外光照射下能显著加快甲基橙的降解速率。在黄钾铁矾表面生成≡Fe(Ⅲ)-草酸复合物是光催化循环中非常重要的步骤,它进一步反应产生羟基自由基降解目标污染物。试验条件(黄钾铁矾装载量、草酸浓度和初始pH)对甲基橙降解有显著的影响。应用响应曲面法拟合的二次多项式模型准确地反映了各影响因子与响应值之间的函数关系。进行过程优化得到甲基橙降解的最优条件为:黄钾铁矾装载量0.2 g · L-1,草酸浓度3 mmol · L-1,pH 4。这为含甲基橙等偶氮染料废水处理提供新的选择和应用前景。
| [1] | Sleiman M,Vildozo D,Ferronato C,et al. Photocatalytic degradation of azo dye Metanil Yellow:optimization and kinetic modeling using a chemometric approach[J]. Applied Catalysis B:Environmental,2007,77(1/2):1-11 |
| [2] | Shu H Y,Chang M C. Decolorization effects of six azo dyes by O3,UV/O3 and UV/H2O2 processes[J]. Dyes and Pigments,2005,65(1):25-31 |
| [3] | Cicek F,Özer D,Özer A,et al. Low cost removal of reactive dyes using wheat bran[J]. Journal of Hazardous Materials,2007,146(1/2):408-416 |
| [4] | Dutta K,Mukhopadhyay S,Bhattacharjee S,et al. Chemical oxidation of methylene blue using a Fenton-like reaction[J]. Journal of Hazardous Materials,2001,84(1):57-71 |
| [5] | Liu C S,Li F B,Li X M,et al. The effect of iron oxides and oxalate on the photodegradation of 2-mercaptobenzothiazole[J]. Journal of Molecular Catalysis A:Chemical,2006,252(1/2):40-48 |
| [6] | Zhou K B,Li Y D. Catalysis based on nanocrystals with well-defined facets[J]. Angewandte Chemie International Edition,2012,51(3):602-613 |
| [7] | Zuo Y G,Holgné J. Formation of hydrogen peroxide and depletion of oxalic acid in atmospheric water by photolysis of iron(Ⅲ)-oxalato complexes[J]. Environmental Science and Technology,1992,26(5):1014-1022 |
| [8] | 李惠,宋丽芳,王亚君,等. 酒石酸协同下TiO2光催化降解水溶性染料孔雀石绿的研究[J]. 南京农业大学学报,2011,34(3):127-130. doi:10.7685/j.issn.1000-2030.2011.03.023 [Li H,Song L F,Wang Y J,et al. Photocatalytic degradation of malachite green by TiO2 assisted with tartaric acid[J]. Journal of Nanjing Agricultural University,2011,34(3):127-130(in Chinese with English abstract)] |
| [9] | 李瑛,吴振禹,周立祥,等. 施氏矿物和有机酸共存体系中孔雀石绿的多相光催化降解[J]. 南京农业大学学报,2012,35(3):127-130. doi:10.7685/j.issn.1000-2030.2012.03.022 [Li Y,Wu Z Y,Zhou L X,et al. Heterogeneous photocatalytic degradation of malachite green in the presence of schwertmannite and organic acids[J]. Journal of Nanjing Agricultural University,2012,35(3):127-130(in Chinese with English abstract)] |
| [10] | Asokan P,Saxena M,Asolekar S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J]. Journal of Hazardous Materials,2006,137(3):1589-1599 |
| [11] | Asta M P,Cama J,Martínez M,et al. Arsenic removal by goethite and jarosite in acidic conditions and its environmental implications[J]. Journal of Hazardous Materials,2009,171(1/2/3):965-972 |
| [12] | 柏双友,梁剑茹,周立祥. FeSO4-K2SO4-H2O体系中Fe/K摩尔比对生物成因羟基硫酸铁矿物质量的影响及环境意义[J]. 环境科学学报,2010,30(8):1601-1607 [Bai S Y,Liang J R,Zhou L X. Effects of iron/potassium molar ratio on mass of biogenic Fe(Ⅲ)hydroxysulfate precipitates in the FeSO4-K2SO4-H2O system and their environmental implications[J]. Acta Scientiae Circumstantiae,2010,30(8):1601-1607(in Chinese with English abstract)] |
| [13] | Xu Z H,Bai S Y,Liang J R,et al. Photocatalytic reduction of Cr(VI)by citric and oxalic acids over biogenetic jarosite[J]. Materials Science and Engineering C,2013,33(4):2192-2196 |
| [14] | Wei C Z,Nan Z D. Effects of experimental conditions on one-dimensional single-crystal nanostructure of β-FeOOH[J]. Materials Chemistry and Physics,2011,127(1/2):220-226 |
| [15] | Shao H F,Qian X F,Yin J,et al. Controlled morphology synthesis of β-FeOOH and the phase transition to Fe2O3[J]. Journal of Solid State Chemistry,2005,178(10):3130-3136 |
| [16] | Xu Z H,Liang J R,Zhou L X. Photo-Fenton-like degradation of azo dye methyl orange using synthetic ammonium and hydronium jarosite[J]. Journal of Alloys and Compounds,2013,546:112-118 |
| [17] | Balmer M E,Sulzberger B. Atrazine degradation in irradiated iron/oxalate systems:effects of pH and oxalate[J]. Environmental Science and Technology,1999,33(14):2418-2424 |
| [18] | Casado J,Fornaguera J,Galán M I. Mineralization of aromatics in water by sunlight-assisted Electro-Fenton technology in a pilot reactor[J]. Environmental Science and Technology,2005,39(6):1843-1847 |
| [19] | Wu Y,Guo J,Jiang D J,et al. Heterogeneous photocatalytic degradation of methyl orange in schwertmannite/oxalate suspension under UV irradiation[J]. Environmental Science and Pollution Research,2012,19(6):2313-2320 |
| [20] | Olmez T. The optimization of Cr(Ⅵ)reduction and removal by electrocoagulation using response surface methodology[J]. Journal of Hazardous Materials,2009,162(2/3):1371-1378 |
| [21] | 徐峙晖,吴静雨,梁剑茹,等. β-FeOOH的无模板水热合成及其光催化降解偶氮染料甲基橙的研究[J]. 南京农业大学学报,2013,36(2):132-136. doi:10.7685/j.issn.1000-2030.2013.02.022 [Xu Z H,Wu J Y,Liang J R,et al. Study of template-free hydrothermal synthesis of β-FeOOH and its catalytic degradation for azo dye methyl orange[J]. Journal of Nanjing Agricultural University,2013,36(2):132-136(in Chinese with English abstract)] |
| [22] | Blodau C,Gatzek C. Chemical controls on iron reduction in schwertmannite-rich sediments[J]. Chemical Geology,2006,235(3/4):366-376 |




