文章信息
- 郭帅帅, 肖红梅. 2015.
- GUO Shuaishuai, XIAO Hongmei. 2015.
- 加工过程对转Bt抗虫水稻内、外源基因的降解研究
- Study on degradation of endogenous and exogenous genes in Bt transgenic rice during food processing
- 南京农业大学学报, 38(4): 667-675
- Journal of Nanjing Agricultural University, 38(4): 667-675.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.022
-
文章历史
- 收稿日期:2014-09-12
1983年世界首例转基因作物诞生,11年后,世界首例转基因作物被批准商业化,转基因作物从实验室转向田间大规模生产[1]。相较于传统农作物,转基因作物具有很多优势,但转基因作物及其加工品的安全性也一直受到公众的质疑。检测是监管的保障,目前PCR方法是主流的转基因产品检测方法。食品加工过程中转基因产品的DNA片段在高温、高压、酸碱处理、酶解、发酵和剪切力等物理、化学及生物变化的影响下,会随着基因组DNA的降解而降解[2, 3, 4],从而影响转基因加工产品的检测,靶序列的减少可能导致检测结果假阴性[5]。
目前,国内外对转基因作物加工过程中的降解规律研究主要集中在转基因玉米和转基因大豆上。Anklam等[6]和Yamaguchi等[7]研究转基因大豆和玉米发现:酸性pH值条件会破坏DNA的磷酸键,从而造成DNA的降解;加工过程中发酵、热处理、酶处理也会导致DNA链的破坏[8]。Vijayakumar等[1]模拟高温高压环境加工转基因大豆,结果表明高温高压会使DNA严重降解,可检测到的DNA数量大幅减少。Chen等[9]研究发现:豆腐、豆奶、豆粉不同加工工艺对DNA的降解影响不同,物理过程如磨浆等能使大豆凝集素基因(Lectin)长度降解至原来的一半(约1 000 bp左右);高温处理的DNA片段并未受到破坏,但更高温度及更长时间的杀菌使豆奶及豆粉中Lectin片段大小仅为400 bp以下;蛋白质变性过程同时也是DNA降解加剧的过程,豆腐的蛋白质变性使Lectin片段从800 bp降至200~400 bp左右。
而对转基因水稻内、外源基因在加工过程中的变化规律研究还很少。沈立明等[10]研究表明:潮霉素标记基因(hpt)在转基因大米加工食品中均已不同程度地发生了降解,不同加工方式对hpt片段降解影响显著。Zhang等[11]研究了蒸煮大米、米粉、米果加工过程以及米酒加工过程对转基因BtCry 1 Ab水稻内源基因(SPS)和外源基因(Pubi、NOS和Cry 1 Ab)的影响,表明不同的加工方法对转基因水稻内、外源基因的降解产生了不同影响。苏云金芽孢杆菌毒蛋白基因(Bt基因)是目前得到应用最为广泛的抗虫基因之一[12],华中农业大学将Bt基因(Cry 1 Ac/Cry 1 Ab融合基因)导入到优良水稻恢复系‘明恢63’中,培育了转基因抗虫品系‘华恢1号’,并于2009年得到了农业部颁发的转基因水稻安全证书。本文以转Bt抗虫水稻‘华恢1号’为原料,采取不同加工方法,针对各个基因及元件设计多对引物,研究转基因水稻加工过程中内、外源基因的变化规律,为我国转基因水稻的监管提供理论和技术支持。
1 材料与方法 1.1 材料与试剂转Bt基因抗虫水稻‘华恢1号’(TT51-1)和阴性对照‘明恢63’由华中农业大学惠赠。蔗糖、土豆淀粉、食盐购买于当地市场,经过验证均不含有转基因成分。Wizard magnetic DNA purification system for food DNA提取试剂盒购于Promega公司;GoTaq Green Master Mix预混液(2x)购于Promega公司;DM2000 Marker购于北京康为世纪有限公司。
1.2 仪器与设备TGL-16G型高速台式离心机购于上海安亭科学仪器厂;SG403A型生物安全柜购于Baker公司;9902型基因扩增仪购于Applied Biosystems公司;DY602S型稳流稳压电泳仪购于生兴生物技术有限公司;Universal HoodⅡ型凝胶成像仪购于BIO-RAD公司;NANODROP-2000核酸蛋白分析仪购于Thermo Scientific公司。
1.3 方法 1.3.1 大米加工方法1)煮制样品的制作:200 g转基因大米,加入适量水,煮制30 min,分别在10、15、20、25和30 min时取样。2)高温高压处理样品的制作[13, 14]:取20 g转基因大米,放入200 mL烧杯中,加入50 mL清水,121 ℃下高压处理20、25和30 min。3)米果的制作方法[15]:190 g大米与3 g蔗糖、9 g土豆淀粉、1 g盐混合,加适量水,煮制30 min,室温冷却、揉练、成型(1 mm厚度的饼坯);将饼坯放入80 ℃恒温干燥箱中煮制2.5 h,放于室温下均质24 h,再放入80 ℃恒温干燥箱中干燥2 h;将干燥处理后的饼坯,分别微波(700 W、2 min)、焙烤(230 ℃、3 min)、油炸(180 ℃、30 s)。分别在一次干燥、二次干燥、微波、焙烤和油炸处理后取样。4)甜米酒的制作方法[16]:将250 g转基因大米首先煮制30 min,然后用清洁冷水淋洗蒸熟的米饭,使其降温至35 ℃左右,同时使饭粒松散。之后将饭装入保鲜盒内,将1 g酒药均匀拌入饭内,搭成凹形圆窝,面上洒少许酒药粉,盖上保鲜盒于30 ℃发酵4 d,每天取1次样。
1.3.2 DNA提取与检测方法用Wizard magnetic DNA purification system for food DNA提取试剂盒提取样品DNA。采用Thermo Scientific NANODROP-2000分光光度计检测提取的DNA模板浓度和纯度。其中DNA纯度取决于A260/A280的大小;DNA浓度由DNA模板在260 nm的吸光值决定,A260=1相当于DNA质量浓度为50 ng · μL-1[17]。
1.3.3 引物设计以水稻内源基因SPS基因、外源基因或元件actin1启动子、NOS终止子、Bt基因Cry 1 Ab/Ac以及外源基因3′端接合序列(NCBI登录号:EU880444.1)[18, 19],采用Primer Premier 5.0软件设计引物(表 1)。每个基因设计的引物的扩增片段最短的为100 bp左右,最长的片段长度接近各基因的全长(SPS基因除外)。引物由上海生工生物工程有限公司合成。各基因的引物设计策略如图 1。
|
引物 Primer | 引物序列(5′→3′) Primer sequences | 长度/bp Length | 产物GC含量/% GC of amplicons |
| SPS1-F/R[20] | TCAATCCGACGCACTACT/GAGACCGAAAGGCTCAAC | 3 148 | 44.3 |
| SPS2-F/R[20] | TCAATCCGACGCACTACT/CATCAAAGCCATCATACAG | 1 952 | 45.9 |
| SPS3-F/R[20] | TCAATCCGACGCACTACT/CCTTCTCGCCTTCAAACA | 916 | 43.6 |
| SPS4-F/R[20] | TCAATCCGACGCACTACT/CTAGCCCTACACGACAAT | 456 | 45.6 |
| SPS-F/R[21] | TTGCGCCTGAACGGATAT/GGAGAAGCACTGGACGAGG | 277 | 62.5 |
| SPSy-F/R[20] | TGGATGACGCACGGAC/CGGGTTTGGAGGAGTT | 168 | 64.3 |
| actin1-F/R | CGCCATGCTAAACAAGATCA/ACCGATGAACAATGCTGAGG | 151 | 39.7 |
| actin2-F/R | GTCTCGGTCTCGATCTTTGG/AGCACATCTAAGCCTGACGAA | 300 | 58.0 |
| actin3-F/R | GTTGCAGCGCATGGGTAT/ACCAAGGCCAAAGATCGAG | 584 | 56.2 |
| actin4-F/R | TTGCAGCGCATGGGTATT/CCGATGAACAATGCTGAGG | 914 | 55.6 |
| actin5-F/R | GCTTGAGAAGAGAGTCGGGATA/ACCGATGAACAATGCTGAGG | 1 323 | 47.8 |
| Cry1Ab/Ac1-F/R | ACTTGCCATCCGCTGTTTAC/ACCTGTGGGAGAATCCTTGC | 105 | 51.4 |
| Cry1Ab/Ac2-F/R | ATTCACTTCCCATCCACATC/TAAAAGCATTGGCACTTTCA | 187 | 42.8 |
| Cry1Ab/Ac3-F/R | TGCTTCGAGACGTTAGCGTGTT/TCGATACCTTGGGCAGAACCAC | 352 | 48.6 |
| Cry1Ab/Ac4-F/R | ACTGGCTTGGAGCGTGTCTG/TTCTGTGGTGGGATTTCGTC | 614 | 54.7 |
| Cry1Ab/Ac5-F/R | CGACCTTACTAGGCTGATTG/GTAGATGTGGATGGGAAGTG | 993 | 52.8 |
| Cry1Ab/Ac6-F/R | TGGAGAACGCATTGAAACC/GATAATCACTCCAGCAGTCCC | 1 726 | 48.1 |
| Event 1-F/R | GCGGCCATTGATTTGTAGAG/GAGTGGTAGCGTCCAGAAGG | 148 | 54.7 |
| Event 2-F/R | ATGCGGCCATTGATTTGTAG/CCTCGTTGGATTTCTTACATGA | 218 | 46.8 |
| Event 3-F/R | TATGCGGCCATTGATTTGTA/TCCATGATTTGCTACAGTGATG | 423 | 41.1 |
| Event 4-F/R | TGTTATGCGGCCATTGATT/ACCAACATGCACAAATGCAG | 751 | 39.5 |
| NOS-F/R[22] | GAATCCTGTTGCCGGTCTTG/TTATCCTAGTTTGCGCGCTA | 180 | 32.8 |
| NOS2-F/R[20] | AAGATTGAATCCTGTTGCCG/TAGTAACATAGATGACACCG | 217 | 34.1 |
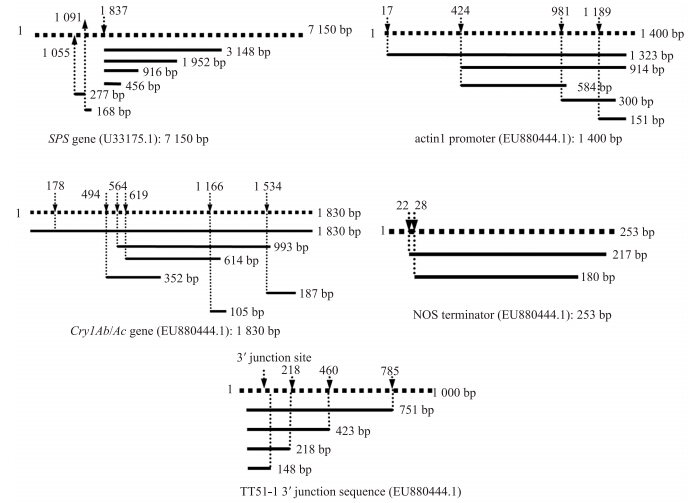 |
图 1 引物设计策略 Fig. 1 The design strategies of primers applied in the experiments
虚线表示基因全长;箭头指示引物在扩增模板上的起始位置。TT51-1:‘华恢1号’ The sash lines represent complete length of genes.Arrows indicate the start sites of upper primers in complete length of genes. TT51-1:‘Huahui 1’. The same as follows. |
25 μL反应体系:12.5 μL PCR预混液,10 μmol · L-1的上、下游引物各1 μL,DNA模板约50 ng,加入无菌水补齐至25 μL。扩增产物通过20 g · L-1琼脂糖凝胶电泳在80 V条件下电泳40 min,进行检测。
引物Cry 1Ab/Ac1 -F/R、Cry 1Ab/Ac2-F/R、Cry1Ab/Ac3 -F/R、SPS-F/R、SPSy-F/R、NOS-F/R、actin1-F/R、actin2-F/R、actin3-F/R、Event 1-F/R的PCR扩增程序为:94 ℃ 5 min;94 ℃ 15 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 7 min。引物Event 2-F/R和Event 3-F/R的PCR扩增程序为:94 ℃ 5 min;94 ℃ 15 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 7 min。引物SPS 4 -F/R、Cry 1Ab/Ac4 -F/R、NOS2-F/R、Event 4-F/R的PCR扩增程序为:94 ℃ 5 min;94 ℃ 15 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 7 min。引物SPS 1-F/R、SPS2-F/R、SPS3 -F/R、Cry 1Ab/Ac5-F/R、Cry1Ab/Ac6 -F/R、actin4-F/R和actin5-F/R的PCR扩增程序为:94 ℃ 5 min;94 ℃ 15 s,60 ℃ 30 s,72 ℃ 3 min,35个循环;72 ℃ 7 min。
2 结果与分析 2.1 各引物的琼脂糖电泳检测结果由图 2可知:所用引物均可扩增出对应长度的片段,水稻内源基因SPS及来自水稻基因的actin1启动子可以在转基因水稻及其阴性对照非转基因水稻中被检测出,Cry 1 Ab/Ac基因、NOS终止子、外源基因3′端接合序列基因的引物扩增片段仅能在转基因水稻中被检测到,在阴性对照及空白样品中均检测不到。
 | 图 2 各引物扩增产物的琼脂糖凝胶电泳图 Fig. 2 Agarose gel electrophoresis of PCR products amplified from primers M:DM2000 marker;C:非转基因水稻Non-genetically modified rice;N:空白Blank |
由图 3-A可知:在煮制及高温高压加工过程中,SPS基因3 148、1 952和916 bp的片段均未被检测出。 SPS基因的456 bp片段在煮制以及高温高压处理20 min后均可以被检测出,但在高温高压处理25 min 后未检测出。SPS基因277和168 bp片段在煮制及高温高压加工过程中均能被检测出,稳定性较好。
 |
图 3 煮制和高温高压处理(A)、米果(B)以及米酒(C)加工过程中SPS基因的降解情况 Fig. 3 Degradation of the SPS gene during the processing of boiled and autoclaving treated rice(A), rice crackers(B)and sweet rice wine(C)
A.煮制及高温高压处理(M:DM2000 marker;1:空白;2:TT51-1;3~7:普通煮制10、15、20、25和30 min;8~10:高温高压处理20、25和30 min);B.米果加工(M:DM2000 marker;1:空白;2:TT51-1;3:一次干燥;4:二次干燥;5:微波;6:焙烤;7:油炸);C.米酒(M:DM2000 marker;1:空白;2:TT51-1;3~6:发酵1~4 d)。引物扩增片段按照大小从上到下依次排列。 A.Boiled and autoclaving treated rice(M:DM2000 marker;1:Blank control;2:TT51-1;3-7:Boiling for 10,15,20,25,30 min;8-10:Autoclaving for 20,25,30 min);B.Rice crackers(M:DM2000 marker;1:Blank control;2:TT51-1;3:1st drying;4:2nd drying;5:Microwaving;6:Baking;7:Frying);C.Sweet rice wine(M:DM2000 marker;1:Blank control;2:TT51-1;3-6:Fermentation for 1-4 day). Amplified fragments were arranged from top to bottom on size.The same as follows. | |
由图 3-B可知:在米果加工过程中,SPS基因3 148、1 952以及916 bp的片段均未检测出。SPS基因456、277和168 bp片段在米果加工过程中均能被检测出,稳定性较好。
在米酒发酵的4 d里,SPS基因3 148、1 952和916 bp的片段均未检测出。SPS基因456、277和168 bp片段在米酒发酵的4 d里均能被检测出,具有较好的稳定性(图 3-C)。
2.3 转Bt水稻加工品中actin1启动子的PCR检测结果由图 4-A可知:在煮制及高温高压加工过程中,actin1启动子1 323、914和584 bp的片段均未检测出。actin1启动子300和151 bp片段在煮制及高温高压加工过程中均能被检测出,稳定性较好。
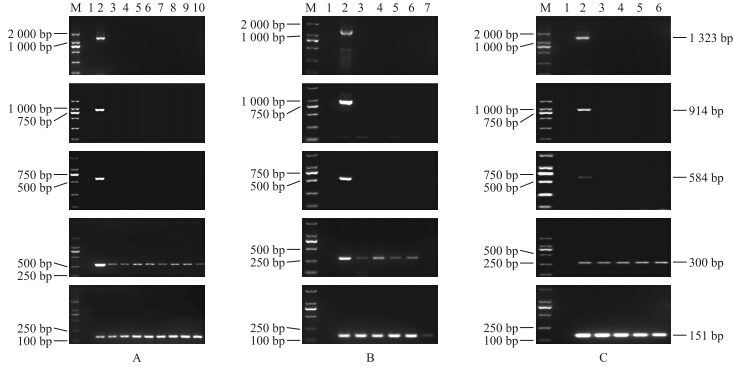 | 图 4 煮制和高温高压处理(A)、米果(B)以及米酒(C)加工过程中actin1的降解情况 Fig. 4 Degradation of the actin1 promoter during the processing of boiled and autoclaving treated rice(A), rice crackers(B)and sweet rice wine(C) | ||
由图 4-B可知:在米果加工过程中,actin1启动子1 323、914和584 bp的片段均未被检测出,actin1启动子300 bp片段在一次干燥、二次干燥、微波、焙烤的样品中均能被检测出,但在油炸样品中则未被检测出,说明油炸对大米中的actin1启动子降解作用最大。actin1启动子151 bp片段在整个米果加工过程中均能被检测出,最为稳定。
由图 4-C可知:在米酒发酵的4 d里,actin1启动子1 323、914和584 bp的片段均未被检测出。actin1启动子300和151 bp片段在米酒发酵的4 d里均能被检测出,具有较好的稳定性。
2.4 转Bt水稻加工品中Cry 1 Ab/Ac基因的PCR检测结果 由图 5-A可知:在煮制及高温高压加工过程中,Cry 1 Ab/Ac基因1 726和993 bp的片段均未被检测出。Cry 1 Ab/Ac基因614 bp的片段在煮制的全过程均可以被检测出,但在高温高压处理中则未被检测出,说明相对于煮制,高温高压处理对转基因大米内、外源基因的降解作用更大。Cry 1 Ab/Ac基因352、187和105 bp片段在煮制及高温高压加工过程中均能被检测出,稳定性较好。  | 图 5 煮制和高温高压处理(A)、米果(B)以及米酒(C)加工过程中Cry 1 Ab/Ac基因的降解情况 Fig. 5 Degradation of the Cry 1 Ab/Ac gene during the processing of boiled and autoclaving treated rice(A), rice crackers(B)and sweet rice wine(C) | |||
由图 5-B可知:在米果加工过程中,Cry 1 Ab/Ac基因1 726和993 bp的片段均未被检测出,Cry 1 Ab/Ac基因614 bp片段在一次干燥、二次干燥、微波的样品中均可以被检测出,但在焙烤、油炸样品中则未被检测出,说明焙烤和油炸对大米中的Cry 1 Ab/Ac基因降解作用大于干燥、微波。Cry 1 Ab/Ac基因352 bp片段在一次干燥、二次干燥、微波、焙烤的样品中均可以被检测出,但在油炸样品中则未被检测出,说明油炸对大米中的Cry 1 Ab/Ac基因降解作用最大。Cry 1 Ab/Ac基因187和105 bp片段在整个加工过程中均能被检测出,具有较好的稳定性。
由图 5-C可知:在米酒发酵的4 d里,Cry 1 Ab/Ac基因1 726和993 bp的片段均未被检测出。Cry 1 Ab/Ac 基因614、352、187和105 bp片段在米酒发酵的4 d里均能被检测出,稳定性较好。
2.5 转Bt水稻加工品中NOS终止子的PCR检测结果由图 6-A可知:在煮制及高温高压加工过程中,NOS终止子的217和180 bp片段均能被检测出,稳定性较好。
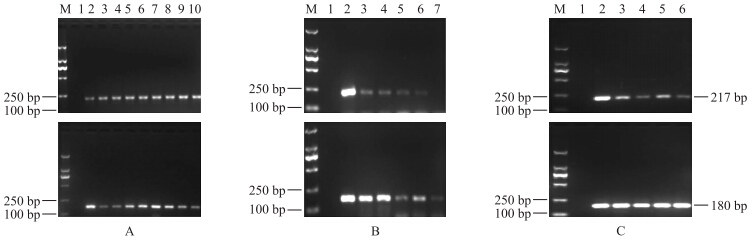 | 图 6 煮制和高温高压处理(A)、米果(B)以及米酒(C)加工过程中NOS终止子的降解情况 Fig. 6 Degradation of the NOS terminator during the processing of boiled and autoclaving treated rice(A), rice crackers(B)and sweet rice wine(C) |
由图 6-B可知:在米果加工过程中,NOS终止子的217 bp片段在一次干燥、二次干燥、微波、焙烤的样品中均可以被检测出,但在油炸样品中则未被检测出,说明油炸对大米中的NOS终止子降解作用最大。NOS终止子180 bp片段在整个加工过程中均能被检测出,稳定性最好。
由图 6-C可知:在米酒发酵的4 d里,NOS终止子217和180 bp片段在米酒发酵的4 d里均能被检测出,具有较高的稳定性。
2.6 转Bt水稻加工品中3′端接合序列的PCR检测结果由图 7-A可知:在煮制过程中,3′端接合序列的751和423 bp的片段均可以被检测出,但是在高温高压加工过程中则均未被检测到。3′端接合序列218和148 bp片段在煮制及高温高压加工过程中均能被检测出,稳定性较好。
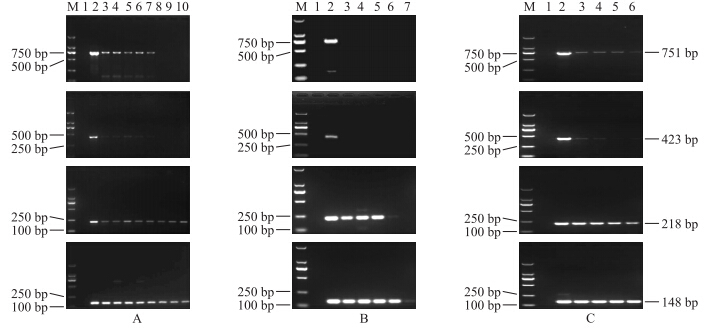 | 图 7 煮制和高温高压处理(A)、米果(B)以及米酒(C)加工过程中3′端接合序列的降解情况 Fig. 7 Degradation of the 3′junction sequence during the processing of boiled and autoclaving treated rice(A), rice crackers(B)and sweet rice wine(C) |
由图 7-B可知:在米果加工过程中,3′端接合序列的751和423 bp的片段均未被检测出,3′端接合序列218 bp片段在一次干燥、二次干燥、微波、焙烤的样品中均可以被检测出,但在油炸样品中则未被检测出,说明油炸对大米中的3′端接合序列降解作用最大。3′端接合序列148 bp片段在5个加工过程中均能被检测出,具有最好的稳定性。
由图 7-C可知:在米酒发酵的4 d里,3′端接合序列的751、423、218和148 bp片段均能被检测出,稳定性较好。
3 结论与讨论比较煮制和高温高压处理后SPS、actin1启动子、Cry 1 Ab/Ac、3′端接合序列、NOS终止子可以被检测到最长的片段情况,可以看出,相对于煮制,高温高压处理对转基因水稻内、外源基因的降解作用更大,这与邱良焱等[13]的研究结论不同,他们发现煮制和高温高压处理对转基因水稻内、外源基因的降解作用没有差别。
SPS基因是转基因水稻研究中常用的水稻内源基因,本试验与Song等[20](转Br水稻)、邱良焱等[13](转Bar、Bt双抗水稻)、Zhang等[11](转BtCry 1 Ab水稻)的研究使用了相同的SPS引物,以及相似的米果加工方法,将本试验结果与以上几位学者试验结果进行对比:本试验内源基因SPS 916 bp扩增片段在米果加工全过程中均检测不到,456 bp的扩增片段在米果加工全过程中均可以检测到;在Song等[20]的研究中,SPS基因916和456 bp扩增片段仅可在煮制、干燥、微波过程后检测到;在邱良焱等[13]的研究中,内源基因SPS 916 bp扩增片段仅可在煮制过程后检测到,456 bp的扩增片段仅可在煮制、微波加工后检测到;在Zhang等[11]的研究中,内源基因SPS 916 bp扩增片段仅可在煮制过程后检测到,456 bp的扩增片段在米果加工全过程中均可以检测到。表明:即使拥有同一基因,采用相同的加工方法,不同品种的转基因水稻,其基因降解情况也可能是不同的。
在米酒发酵过程中,发酵过程没有使转基因水稻的内、外源基因产生进一步的降解。相比于米果加工,米酒发酵对转基因水稻的内、外源基因降解作用更小。这与Song等[20]的研究结论相似。但是Zhang等[11]的研究得出了与此相反的结论,其发现米酒发酵过程对转基因水稻的降解作用大于米果加工过程。
2009年,农业部发布了对转基因抗虫水稻TT51-1定性PCR检测的标准,其中,根据外源基因3′端接合序列设计的引物扩增片段大小为274 bp[23]。而本试验中,油炸米果加工后,3′端接合序列218 bp以上的扩增片段均已检测不到。如果使用国家标准方法来检测油炸米果,则可能得出假阴性的分析结果。试验中所有小于200 bp的片段在所有加工过程中均可以检测到,可以确保检测结果的准确性。
有研究指出,高温条件下具有相近长度的DNA片段,GC含量越高,稳定性也越高[24]。本试验中,引物SPS 4 -F/R的扩增片段长度为456 bp,GC含量为45.6%,引物Event 3的扩增片段为423 bp,GC含量为41.1%,在米果加工过程中,SPS 4 片段比Event 3的扩增片段稳定,符合上述研究的结论;但是,Song等[20]和Zhang等[11]的研究中均发现了与此相反的结论。因此可以看出,一段序列的GC含量与其稳定性并无直接联系。食品加工是一个非常复杂的过程,其中包含物理和化学的变化、生物反应,不同加工食品中DNA的数量,以及DNA降解变化程度等都因其加工工艺的不同而不同。因此,全面了解各类食品加工工艺对转基因作物内、外源基因及表达产物的降解变化规律,是十分必要的。
| [1] | Vijayakumar K R,Martin A,Gowda L R,et al. Detection of genetically modified soya and maize:impact of heat processing[J]. Food Chemistry,2009,117(3):514-521 |
| [2] | Bergerová E,Hrn Dčírová Z,Stankovská M,et al. Effect of thermal treatment on the amplification and quantification of transgenic and non-transgenic soybean and maize DNA[J]. Food Analytical Methods,2010,3(3):211-218 |
| [3] | Gryson N. Effect of food processing on plant DNA degradation and PCR-based GMO analysis:a review[J]. Analytical and Bioanalytical Chemistry,2010,396(6):2003-2022 |
| [4] | Bergerová E,Godalova Z,Siekel P. Combined effects of temperature,pressure and low pH on the amplification of DNA of plant derived foods[J]. Czech Journal of Food Sciences,2011,29(4):337-345 |
| [5] | 王林,韩飞,李爱科,等. 干热和湿热工艺对大豆转基因成分及调控元件影响的比较研究[J]. 中国粮油学报,2011,26(10):44-50 [Wang L,Han F,Li A K,et al. Comparative study on degradation of transgenic ingredients and non-target gene components of generally modified soybean with dry-heating and sticky-heating processing[J]. Journal of the Chinese Cereals and Oils Association,2011,26(10):44-50(in Chinese with English abstract)] |
| [6] | Anklam E,Gadani F,Heinze P,et al. Analytical methods for detection and determination of genetically modified organisms in agricultural crops and plant-derived food products[J]. European Food Research and Technology,2002,214(1):3-26 |
| [7] | Yamaguchi H,Sasaki K,Umetsu H,et al. Two detection methods of genetically modified maize and the state of its import into Japan[J]. Food Control,2003,14(3):201-206 |
| [8] | 张兴敏,于洪敏,魏健,等. 转基因食品中外源DNA降解和代谢的研究进展[J]. 中国农业科技导报,2008,10(1):52-57 [Zhang X M,Yu H M,Wei J,et al. Research progress on degradation and metabolism of foreign DNA in genetically modified food(GMF)[J]. Journal of Agricultural Science and Technology,2008,10(1):52-57(in Chinese with English abstract)] |
| [9] | Chen Y,Wang Y,Ge Y,et al. Degradation of endogenous and exogenous genes of Roundup-Ready soybean during food processing[J]. Journal of Agricultural and Food Chemistry,2005,53(26):10239-10243 |
| [10] | 沈立明,吴永宁,张建中,等. 不同加工条件下转基因大米潮霉素标记基因(hpt)稳定性研究[J]. 卫生研究,2006,35(4):431-434 [Shen L M,Wu Y N,Zhang J Z,et al. Stability of hpt marker gene in transgenic rice in different foodmatrices and under varying food-processing conditions[J]. Journal of Hygiene Research,2006,35(4):431-434(in Chinese with English abstract)] |
| [11] | Zhang W,Xing F,Selvaraj J N,et al. Degradation of endogenous and exogenous genes of genetically modified rice with Cry1Ab during food processing[J]. Journal of Food Science,2014,79(5):T1055-T1065 |
| [12] | 王继磊,刘迪秋,丁元明,等. Bt转基因抗虫植物研究进展[J]. 生物学杂志,2010,27(4):75-78 [Wang J L,Liu D Q,Ding Y M,et al. Research advances in Bt transgenic anti-insect plants[J]. Journal of Biology,2010,27(4):75-78(in Chinese with English abstract)] |
| [13] | 邱良焱,李湘玲,吴婕,等. 转Bar、Bt基因双抗大米内源基因在食品加工过程中的降解研究[J]. 食品科技,2013,38(9):132-135 [Qiu L Y,Li X L,Wu J,et al. Degradation of endogenous gene in transgenic rice with Bar and Bt gene during food processing[J]. Science and Technology,2013,38(9):132-135(in Chinese with English abstract)] |
| [14] | 邱良焱,刘梅,肖红梅. 转Bar、Bt基因双抗大米外源基因在食品加工过程中稳定性的研究[J]. 食品工业科技,2013,34(20):125-129 [Qiu L Y,Liu M,Xiao H M. Study on stability of exogenous genes in transgenic rice with Bar and Bt gene during food processing[J]. Science and Technology of Food Industry,2013,34(20):125-129(in Chinese with English abstract)] |
| [15] | 傅晓如. 米制品加工工艺与配方[M]. 北京:化学工业出版社,2008 [Fu X R. Processing Technology and Formula of Rice Product[M]. Beijing:Chemical Industry Press,2008(in Chinese)] |
| [16] | 刘小翠,赵思明,王莲. 籼米甜酒的发酵动力学及工艺优化[J]. 食品科学,2007,28(12):263-267 [Liu X C,Zhao S M,Wang L. Fermentation kinetic and technical optimize of indica sweet rice wine[J]. Food Science,2007,28(12):263-267(in Chinese with English abstract)] |
| [17] | Hapela M J,Sotelo C G,Perez R I,et al. Comparison of DNA extraction methods from muscle of canned tuna for species identification[J]. Food Control,2007,18:1211-1215 |
| [18] | Lu C M. The first approved transgenic rice in China[J]. GM Crops,2010,1(3):113-115 |
| [19] | Wu G,Wu Y,Nie S,et al. Real-time PCR method for detection of the transgenic rice event TT51-1[J]. Food Chemistry,2010,119(1):417-422 |
| [20] | Song S,Zhou G,Gao F,et al. Degradation of transgene DNA in genetically modified herbicide-tolerant rice during food processing[J]. Food and Chemical Toxicology,2011,49(12):3174-3182 |
| [21] | Jiang L,Yang L,Zhang H,et al. International collaborative study of the endogenous reference gene,sucrose phosphate synthase(SPS),used for qualitative and quantitative analysis of genetically modified rice[J]. Journal of Agricultural and Food Chemistry,2009,57:3525-3532 |
| [22] | Oliveri C,Frequin M,Malferrari G,et al. A simple extraction method useful to purify DNA from difficult biologic sources[J]. Cell Preservation Technology,2006,4:51-54 |
| [23] | 中华人民共和国农业部. 农业部1193号公告-3—2009 转基因植物及其产品成分检测抗虫水稻TT51-1及其衍生品种定性PCR方法[S]. 北京:中国农业出版社,2009 [Ministry of Agriculture. Detection of genetically modified plants and derived products qualitative PCR method for insect-resistant rice TT51-1 and its derivates[S]. Beijing:China Agriculture Press,2009(in Chinese)] |
| [24] | Kakihara Y,Matsufuji H,Chino M,et al. Detection of recombinant DNA of genetically modified(GM)soybeans in heat-treated GM soybeans and commercial natto[J]. Food Control,2007,18(10):1289-1294 |




