文章信息
- 沈婷, 张园园, 王辰, 王世梅. 2015.
- SHEN Ting, ZHANG Yuanyuan, WANG Chen, WANG Shimei. 2015.
- 白刺链霉菌(Streptomyces albospinus)CT205菌株固体发酵及防控草莓根腐病的研究
- Study on solid fermentation of Streptomyces albospinus CT205 and biocontrol effect against strawberry root rot
- 南京农业大学学报, 38(4): 596-601
- Journal of Nanjing Agricultural University, 38(4): 596-601.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.011
-
文章历史
- 收稿日期:2014-11-17
草莓连作障碍在草莓种植区普遍存在,对草莓种植业危害严重,而根腐病是草莓连作障碍中最主要的病害之一,已成为制约草莓产业快速发展的主要障碍[1]。目前,报道的最常见的引起草莓根腐病病原菌有立枯丝核菌(Rhizoctonia solani)、尖孢镰刀菌(Fusarium oxysporum)、疫霉(Phytoqhthora fragariae)及大丽轮枝菌(Verticillium dahliae)等[2, 3]。农业生产上防治草莓根腐病一般采用轮作[4]、土壤消毒[5]等措施。轮作效果较好,但难以适应集约化设施农业种植模式的要求;利用溴甲烷等化学药剂对土壤进行消毒,可有效降低草莓根腐病的发病率,但对土壤环境污染较大,易产生药物残留等问题,并且已被世界大多数国家禁止使用[6]。因此,寻找更安全高效的生防制剂防治草莓根腐病具有重要的意义。
近年来,国内外科技工作者对草莓根腐病的生物防治已有研究报道,已分离获得有一定生防效果的细菌、放线菌及真菌[7, 8, 9]。徐淑华等[10]从草莓种植土壤中筛选出1株生防细菌,盆栽试验显示其对草莓根腐病的防治效果为51.75%,并能显著促进草莓的生长发育;王占武等[11]研究发现枯草芽孢杆菌B501对草莓枯萎病(Fusaruim oxysporum f.sp.fragriae)有广谱杀菌的作用,而且也能够很好地在草莓根际定殖;申光辉等[12]从草莓根域土壤中筛选出了对草莓根腐病有拮抗作用的真菌HF3和HF7,盆栽试验表明其对草莓有很好的促生效果,能有效地提高草莓的生物量,对根腐病的防效为53.0%和46.9%。目前,生物防治植物病害最传统的做法是将生防菌制成活菌制剂直接应用,但液体制剂存在不易保存、活性不稳定等问题。而通过固体发酵生产的活菌菌剂,其孢子数量大,活性强,便于贮藏和运输,且发酵设备简单,成本低廉,易于在生产中推广应用[13]。本实验室前期筛选到1株生防效果优良的白刺链霉菌(Streptomyces albospinus)CT205,对多种植物病原真菌均有较强的抑制作用[14]。本研究尝试从草莓病株根茎部位分离出高致病的病原菌,对其进行初步鉴定及柯赫氏法则验证,进而研究拮抗菌CT205的固体发酵制剂对草莓根腐病的防控效果,以期为放线菌固体发酵制剂用于草莓连作障碍的修复提供科学依据。
1 材料与方法 1.1 供试菌株Streptomyces albospinus CT205由本实验室分离保存。
1.2 供试培养基马铃薯葡萄糖琼脂培养基(PDA培养基):马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,pH自然。
马丁氏培养基:葡萄糖10 g,蛋白胨5 g,KH2PO4 1 g,MgSO4 · 7H2O 0.5 g,孟加拉红30 mg,琼脂20 g,蒸馏水1 L,pH自然,115 ℃灭菌30 min后加入0.03 mg链霉素。
CT205种子培养基:葡萄糖45 g,黄豆粉30 g,酵母粉5 g,CaCO3 5 g,蒸馏水1 L,pH 7.5,121 ℃灭菌20 min。
CT205固体基础发酵培养基:麦麸500 g · kg-1,小米粉120 g · kg-1,黄豆粉60 g · kg-1,米糠120 g · kg-1,稻壳200 g · kg-1,CaCO3 3 g · kg-1,料和水质量比1 ∶ 0.8,起始pH 7.5,121 ℃灭菌20 min。
1.3 草莓根腐病病原菌的分离鉴定 1.3.1 病原菌Y3的分离从南京麒麟镇后村草莓种植大棚中,采集草莓根腐病发病植株,采用常规组织分离法[15],先用自来水冲洗植株根系表面泥沙,再用吸水纸吸去表面多余水分,剪去须根,在病健交界处切取适当大小的组织块,用75%(体积分数)乙醇表面消毒30 s,再用0.1%(体积分数)升汞浸泡1 min,最后用无菌水浸洗3~4次,置于马丁氏培养基上30 ℃恒温培养4~5 d,挑取病斑组织边缘长出的菌丝接种于PDA培养基上进行纯化。
1.3.2 病原菌Y3的形态特征观察观察、记录病原菌Y3的菌落形态和气生菌丝生长状况等培养特征。显微镜下观察分生孢子形态等形态特征。
1.3.3 病原菌Y3基因组DNA的提取及rDNA-ITS的PCR扩增采用OMEGA公司的试剂盒提取菌株基因组DNA,真菌通用引物ITS1(5′-AGAAGTCGTAACAAGGTTTCCGTAGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行rDNA-ITSPCR扩增,PCR扩增产物由上海美吉有限公司进行纯化并测序,测序结果登录GenBank数据库,利用BLAST(http://blast.ncbi.nlm.nih.gov/)与GenBank数据库中的序列进行比对,获得最相近菌株rDNA-ITS序列,采用MEGA 4.0软件绘制系统发育树。
1.4 病原菌柯赫氏法则验证采用伤根法接种菌株Y3的孢子悬液在健康草莓的根系周围,观察发病症状,从发病植物根部分离病原菌,并进行初步鉴定。
1.5 菌株CT205对病原菌Y3的拮抗作用采用平板对峙法,将培养好的病原菌Y3及生防菌CT205用打孔器(Φ=5 mm)打块,将其分别置于PDA平板上,对峙培养,30 ℃培养5~7 d,观察抑菌效果。
1.6 菌株CT205固体发酵 1.6.1 CT205种子液的制备菌株CT205在PDA培养基斜面上活化,28 ℃培养5~7 d,待分生孢子丰满,挑取3环孢子,接种于50 mL种子培养基中(装于250 mL三角瓶),30 ℃、170 r · min-1振荡培养48 h,备用。
1.6.2 CT205固体发酵在250 mL三角瓶中,装入20 g固体基础发酵培养基,料和水质量比为1 ∶ 0.8,121 ℃灭菌20 min。接种15%(体积分数)的种子液,28 ℃培养6 d,每天用无菌玻璃棒翻动2次混匀。发酵结束后,用稀释涂布法测定制剂中菌含量。
1.7 草莓盆栽试验 1.7.1 盆栽试验设计选取长势较好且大小一致的健康草莓幼苗(红颊),移栽到装有1.5 kg草莓连作土的盆钵中,每盆1株,常规管理。试验设3个处理:固体发酵菌剂处理、菌悬液处理和对照。固体发酵菌剂处理为1%(质量分数)固体发酵菌剂(15 g)提前与盆栽土混合拌匀装入盆钵中,菌悬液处理为1%(体积分数)菌悬液(15 mL)用水稀释后沿根灌注。对照为草莓连作土,不加任何处理。病原菌Y3用PDA液体培养基摇瓶培养5 d后,收获分生孢子并调整其孢子浓度为105 mL-1。在草莓移栽缓苗1周后,采用灌注法接种在草莓根系周围,接种量为每盆5 mL,每个处理10盆。于2014年3月14日进行盆栽试验,定期观察记录草莓生长情况,2个月后结束盆栽试验,挖取植株,统计发病程度及生物量。
1.7.2 病情指数测定草莓根腐病发病程度采用Vestberg等[16]的方法分为6级:0级为根系未发病;1级为根系发病率小于等于30%,叶片正常;2级为根系发病率大于30%小于等于60%,叶片正常;3级为根系发病率大于60%小于等于80%,叶片变黄;4级为根系发病率80%以上,叶片枯萎;5级为整株死亡,叶片干枯。病情指数[17]和生防效果分别按照下列公式计算。
病情指数=[∑(病级株数×代表数值)/(株数总和×发病最重级的代表数值)]×100%;
生防效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
2 结果与分析 2.1 病原菌Y3的初步鉴定 2.1.1 病原菌Y3培养特征与形态特征观察菌株Y3在PDA培养基上30 ℃培养7 d后,菌落特征及分生孢子形态如图 1所示。Y3菌落正面中心脐状突起,有细微同心环纹,气生菌丝茂盛,絮状,菌落白色,随着培养时间的延长,基内菌丝分泌褐色色素。在光学显微镜下观察其气生菌丝及分生孢子形态发现,Y3菌丝分隔,分化形成的分生孢子呈圆柱状或镰刀状,稍弯。
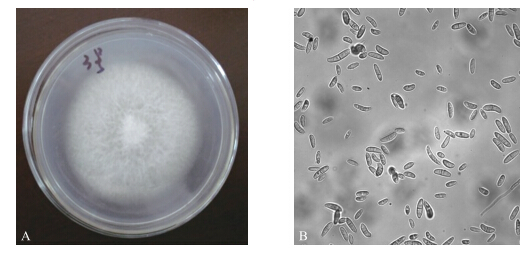 | 图 1 菌株Y3的菌落(A)及分生孢子(B)形态(10×40) Fig. 1 Morphology of colony(A)and spore(B)of strain Y3 |
提取菌株Y3的基因组rDNA,扩增其rDNA-ITS序列,得到1条525 bp 左右的条带,在GenBank上进行同源性比对,发现与其一致性较高的菌株均属于镰刀菌属(Fusarium),与多株尖孢镰刀菌(F.oxysporum)的同源性为97%,根据菌株的形态特征并结合rDNA-ITS序列分析,将菌株Y3初步鉴定为尖孢镰刀菌,构建的系统发育树见图 2。
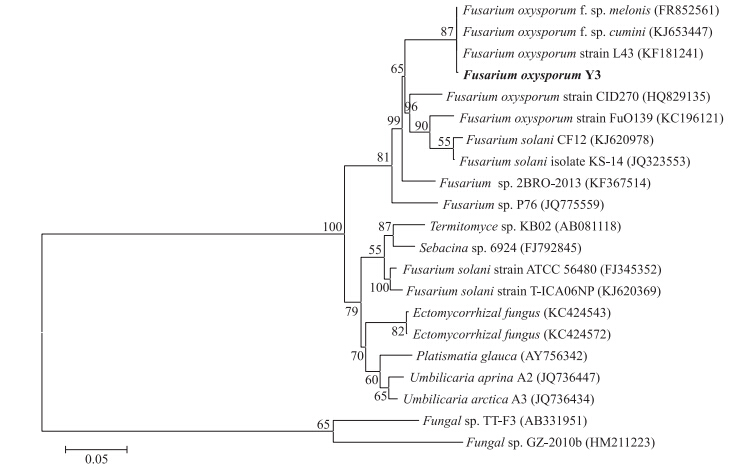 | 图 2 菌株Y3的rDNA-ITS序列同源性系统发育树 Fig. 2 Phylogenetic tree of strain Y3 based on rDNA-ITS sequences homology |
通过致病性回接试验发现,病原菌Y3接种3周后草莓发病,植株中柱变红,并且能够从接种发病的草莓植株根部重新分离得到该病菌,符合柯赫氏法则,证明其是草莓根腐病的病原菌。
2.3 拮抗菌CT205对病原菌Y3的拮抗作用从图 3可以看出:菌株CT205对病原菌Y3有较强的抑制作用。病原菌Y3与拮抗菌CT205对峙培养后,在显微镜下观察到Y3菌丝体中的分隔增多,并出现明显扭曲及褶皱现象。
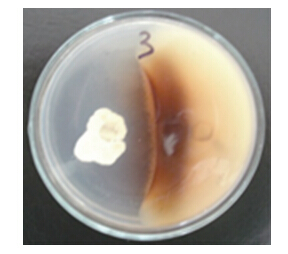 | 图 3 白刺链霉菌CT205对Fusarium oxysporum Y3 的拮抗作用 Fig. 3 Antagonistic effect of Strepomyces albospinus CT205 on the growth of Fusarium oxysporum Y3 | |
拮抗菌CT205在固体基础发酵培养基中发酵,接种3 d后,菌丝在基质中旺盛生长,瓶壁及基质布满白色的菌丝体,并散发出放线菌特有的“土腥味”,发酵6 d后,镜检发现大量的分生孢子,菌含量可达到2.2×109 CFU · g-1,之后略有波动,涨幅不大(图 4)。因此,确定固体发酵的终点时间为6 d,发酵结束后测定制剂的含水量为57%。S.albospinus CT205固体发酵制剂形态见图 5。
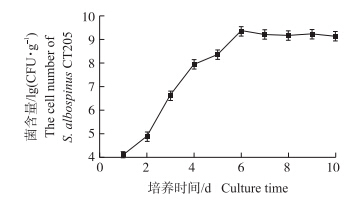 | 图 4 S.albospinus CT205固体发酵过程中菌含量变化 Fig. 4 The change of cell number of S.albospinus CT205 during the solid fermentation | ||
 | 图 5 S.albospinus CT205固体发酵制剂形态 Fig. 5 The change of cell number of S.albospinus CT205 during the solid fermentation | |||
施用CT205固体发酵菌剂和CT205菌悬液处理与对照相比,茎叶鲜质量分别增加21.11%和12.21%,根鲜质量分别增加42.36%和32.76%,说明菌种CT205对草莓生长有一定的促生作用,且固体发酵菌剂的促生作用更明显。CT205固体发酵菌剂与CT205菌悬液处理中,草莓病情指数均明显下降,生防效果达到61.18%和55.22%(表 1)。
|
处理 Treatment | 茎叶鲜质量/g Shoot fresh weight | 根鲜质量/g Root fresh weight | 病情指数/% Disease index | 生防效果/% Control efficiency |
| 对照CK | 12.79±0.67c | 4.06±0.41b | 53.24 | — |
| 菌悬液Liquid agents | 14.29±1.81ab | 5.39±0.14ab | 23.84 | 55.22 |
| 固体发酵菌剂Solid agents | 15.49±0.54a | 5.78±0.11a | 20.67 | 61.18 |
草莓根腐病主要症状是中柱发红,由内向外腐烂,后期植株全株萎焉枯死,是一种难以防治的根部毁灭性病害[18]。笔者从草莓病株分离出多株病原真菌,经回接试验验证,1株致病性最强,编号为Y3,故选择Y3为研究材料。经形态观察和分子生物学鉴定,初步鉴定其为尖孢镰刀菌属。
放线菌具有适应环境能力强,在植物根表和根围土壤中有较强的定殖能力,能产生抗生素,分泌多种胞外水解酶,能产生丰富的分生孢子,且孢子存活时间长,有利于工业化生产及应用等优点,故研制放线菌生防制剂具有更重要的意义。拮抗菌CT205是本课题组前期筛选到的1株生防效果优良的放线菌,对多种植物病原真菌均有较强的抑制作用。张园园[19]采用单因素试验确定了CT205固体发酵最合适的碳源、氮源以及无机盐组合,并在此基础上,运用L16(45)正交设计优化了固体发酵条件(如最佳接种量、料水比、起始pH、发酵温度和发酵终点等)。本研究采用其优化好的培养基配方及发酵条件,进行CT205固体发酵,发酵6 d,镜检发现大量的分生孢子,活菌计数菌含量达到2.2×109 CFU · g-1。
目前国内外用于草莓根腐病的生防菌有芽孢杆菌[11]、木霉[20, 21]、丛枝菌根(AM)真菌[22, 23]等,亦有较多用放线菌制剂克服草莓连作障碍的报道[8, 24, 25],但尚未有用白刺链霉菌防治草莓根腐病的研究报道,本试验将白刺链霉菌CT205作为生防菌,为草莓根腐病害生物防控提供新的生防材料。生防菌剂能够保护植物根系免受病原菌侵染,其作用机制包括产生特有的抗生素,抑制病原菌菌丝生长,与病原菌竞争生存空间与营养物质,同时活菌制剂接入土壤可调控根际微生物区系,减少病原菌的数量,提高土壤对土传病原真菌的抑制能力,进而促进作物根系生长,提高抗病能力。后续将对CT205的作用机制进行深入研究。本试验研究CT205对草莓根腐病的防病促生作用是在盆栽条件下进行,盆栽试验表明CT205制剂对草莓根腐病有较好的防控作用,但盆栽试验与大田试验存在一定差异,故其实际的生防效果仍需田间试验验证。
| [1] | Fang X L,Phillips D,Li H,et al. Comparisons of virulence of pathogens associated with crown and root diseases of strawberry in western Australia with special reference to the effect of temperature[J]. Scientia Horticulturae,2011,131:39-48 |
| [2] | 陈瑶,王树雪,魏艳敏,等. 草莓根腐病菌C16-4的分离鉴定及生物学特性研究[J]. 果树学报,2012,29(4):638-643 [Chen Y,Wang S X,Wei Y M,et al. Studies on isolation,identification and biological characteristics of pathogenic fungus strain C16-4 of strawberry root rot[J]. Journal of Fruit Science,2012,29(4):638-643(in Chinese with English abstract)] |
| [3] | Chamorro M,Miranda L,Domínguez P,et al. Evaluation of biosolarization for the control of charcoal rot disease(Macrophomina phaseolina)in strawberry[J]. Crop Protection,2015,60:279-286 |
| [4] | Avilés M,Castillo S,Bascon J,et al. First report of Macrophomina phaseolina causing crown and root rot of strawberry in Spain[J]. Plant Pathology,2008,57:382 |
| [5] | Benlioglu S,Boz O,Yildiz A,et al. Alternative soil solarization treatments for the control of soil-borne diseases and weeds of strawberry in the western Anatolia of Turkey[J]. Journal of Phytopathology,2005,153(7/8):423-430 |
| [6] | Belova A,Narayan T,Olkin I. Methyl bromide alternatives for strawberry and tomato pre-plant uses:a meta-analysis[J]. Crop Protection,2013,54:1-14 |
| [7] | Dias A C F,Costa F E C,Andreote F D,et al. Isolation of micropropagated strawberry endophytic bacteria and assessment of their potential for plant growth promotion[J]. World Journal of Microbiology and Biotechnology,2009,25(2):189-195 |
| [8] | 孙敬祖,薛泉宏,唐明,等. 放线菌制剂对连作草莓根区微生物区系的影响及其防病促生作用[J]. 西北农林科技大学学报:自然科学版,2009,37(12):153-158 [Sun J Z,Xue Q H,Tang M,et al. Study on the effect of actinomycetes on microflora of replanted strawberry's root domain and the bio-control effectiveness[J]. Journal of Northwest A&F University:Natural Science Edition,2009,37(12):153-158(in Chinese with English abstract)] |
| [9] | Kakvan N,Heydari A,Zamanizadeh H R,et al. Development of new bioformulations using Trichoderma and Talaromyces fungal antagonists for biological control of sugar beet damping-off disease[J]. Crop Protection,2013,53:80-84 |
| [10] | 徐淑华,蒋继志,姚克文,等. 两株拮抗细菌对草莓根腐病的抑制作用[J]. 河北农业大学学报,2005,28(3):81-83 [Xu S H,Jiang J Z,Yao K W,et al. Inhibition effect of two strains of antagonistic bacteria against Pestalotiops photiniae[J]. Journal of Hebei Agricultural University,2005,28(3):81-83(in Chinese with English abstract)] |
| [11] | 王占武,李晓芝,刘彦利,等. 枯草芽孢杆菌B501在草莓根际的定殖及其动态变化[J]. 植物病理学报,2003,33(2):188-189 [Wang Z W,Li X Z,Liu Y L,et al. Colonization and population dynamics of Bacillus subtilis B501 in the rhizosphere of strawberry[J]. Acta Phytopathologica Sinica,2003,33(2):188-189(in Chinese with English abstract)] |
| [12] | 申光辉,薛泉宏,张晶,等. 草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J]. 中国农业科学,2012,45(22):4612-4626 [Shen G H,Xue Q H,Zhang J,et al. Screening,identification and bio-control potential of antagonistic fungi against strawberry root rot and plant growth promotion[J]. Scientia Agricultura Sinica,2012,45(22):4612-4626(in Chinese with English abstract)] |
| [13] | 田晓丽,赵红杰,唐彩乐,等. 生防放线菌153固态发酵条件的优化及其耐热力检测[J]. 西北农林科技大学学报:自然科学版,2010,38(7):181-186 [Tian X L,Zhao H J,Tang C L,et al. Optimization of the fermentation of solid state medium for bio-control actinomycetes 153 and its heat tolerance ability[J]. Journal of Northwest A&F University:Natural Science Edition,2010,38(7):181-186(in Chinese with English abstract)] |
| [14] | 梁银,张谷月,王辰,等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报,2013,50(4):174-180 [Liang Y,Zhang G Y,Wang C,et al. Identification and bio-control effect of a strain of actinomycete antagonistic to wilt disease of cucumber[J]. Acta Pedologica Sinica,2013,50(4):174-180(in Chinese with English abstract)] |
| [15] | 方中达. 植病研究方法[M]. 北京:中国农业出版社,1998 [Fang Z D. Plant Pathology and Entomology Research Methods[M]. Beijing:China Agriculture Press,1998:122-126(in Chinese)] |
| [16] | Vestberg M,Kukkonen S,Saari K,et al. Microbial inoculation for improving the growth and health of micropropagated strawberry[J]. Applied Soil Ecology,2004,27(3):243-258 |
| [17] | 向发云,韩永超,曾祥国,等. 湖北省草莓育苗期炭疽病病害调查[J]. 湖北农业科学,2012,51(24):5651-5653 [Xiang F Y,Han Y C,Zeng X G,et al. A survey on the strawberry anthracnose disease in Hubei Province[J]. Hubei Agricultural Sciences,2012,51(24):5651-5653(In Chinese with English abstract)] |
| [18] | Manici L M,Caputo F,Baruzzi G. Additional experiences to elucidate the microbial component of soil suppressiveness towards strawberry black root rot complex[J]. Annals of Applied Biology,2005,146(4):421-431 |
| [19] | 张圆圆. 白刺链霉菌CT205固体发酵条件优化及其应用初探[D]. 南京:南京农业大学,2014:21-27 [Zhang Y Y. Optimization of solid state fermention conditions of Streptomyces albospinus CT205 and its preliminary application[D]. Nanjing:Nanjing Agricultural University,2014:21-27(in Chinese with English abstract)] |
| [20] | 杜安楠,马跃,李贺,等. 木霉菌剂对草莓微繁苗生长和抗病性的影响[J]. 中国果树,2009(3):20-23 [Du A N,Ma Y,Li H,et al. Trichoderma micropropagation of strawberry seedlings and disease resistance[J]. China Fruit,2009(3):20-23(in Chinese with English abstract)] |
| [21] | 张雪,张志宏,刘月学,等. 木霉菌剂提高'红颜’草莓炭疽病抗性的效应[J]. 西北农业学报,2010,19(8):153-156 [Zhang X,Zhang Z H,Liu Y X,et al. Effect of Trichodermaon improving resistance of strawberry to anthracnose[J]. Acta Agriculturae Boreali-occidentalis Sinica,2010,19(8):153-156(in Chinese with English abstract)] |
| [22] | Tahmatsidou V,O'Sullivan J,Cassells A C,et al. Comparison of AMF and PGPR inoculants for the suppression of Verticillium wilt of strawberry(Fragaria×ananassa cv.Selva)[J]. Applied Soil Ecology,2006,32(3):316-324 |
| [23] | 李明月,常敏,张庆华,等. 木榄内生真菌菌株ZD6及其代谢产物的抑菌活性[J]. 菌物学报,2010,29(5):739-745 [Li M Y,Chang M,Zhang Q H,et al. The endophytic fungus strain ZD6 isolated from the stem of Bruguiera gymnorrhiza and the antibacterial activity of its metabolites[J]. Mycosystema,2010,29(5):739-745(in Chinese with English abstract)] |
| [24] | 陈宏州,庄义庆,杨敬辉. 黄麻链霉菌NF0919菌株对草莓枯萎病的生防活性初探[J]. 江西农业学报,2014,26(11):54-57 [Chen H Z,Zhuang Y Q,Yang J H. A primary study on biocontrol activity of Streptomyces corchorusii strain NF0919 to strawberry Fusarium wilt[J]. Acta Agriculturae Jiangxi,2014,26(11):54-57(in Chinese with English abstract)] |
| [25] | 赤国彤,李亚宁,李星,等. 链霉菌水剂对草莓连作障碍的控制效果[J]. 贵州农业科学,2012,40(3):127-129 [Chi G T,Li Y N,Li X,et al. Control effects of Streptomyces as on replant disease of strawberry[J]. Guizhou Agricultural Sciences,2012,40(3):127-129(in Chinese with English abstract)] |




