文章信息
- 李鸿, 顾建锋, 李红梅, 赵立荣, 何洁. 2015.
- LI Hong, GU Jianfeng, LI Hongmei, ZHAO Lirong, HE Jie. 2015.
- 台湾地区输入木质包装材料中吉拉尼伞滑刃线虫的鉴定
- Identification of Bursaphelenchus gillanii intercepted from imported wood packaging
- 南京农业大学学报, 38(4): 575-583
- Journal of Nanjing Agricultural University, 38(4): 575-583.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.008
-
文章历史
- 收稿日期:2014-09-19
2. 宁波出入境检验检疫局, 浙江 宁波 315012;
3. 广东出入境检验检疫局, 广东 广州 510623
2. Ningbo Entry-Exit Inspection and Quarantine Bureau, Ningbo 315012, China;
3. Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China
随着我国对外开放不断深入,进出口贸易不断增长,每年进出境木质包装材料呈快速增长的趋势,而木质包装常是国际公认的携带诸多检疫性有害生物的途径之一,其中松材线虫(Bursaphelenchus xylophilus)是全球关注的重要植物检疫性线虫,我国口岸多次截获[1]。目前,松材线虫已给中国(包括台湾和香港地区)、日本、韩国、墨西哥、葡萄牙和西班牙的林业造成巨大损失[2],正严重威胁着世界森林生态安全。为阻止松材线虫的跨境传播,国际植物保护公约(IPPC)专门制定相关国际标准,要求各国对进出境木质包装材料实施检疫措施[3]。
1937年Fuchs创立伞滑刃线虫属(Bursaphelenchus)[4],直到该属的松材线虫被证实是松树萎蔫病的病原[5],该属的分类研究才受到关注,特别是1998年松材线虫从亚洲传入欧洲的葡萄牙[6, 7]以后,更引起了世界范围内的线虫学者广泛关注。伞滑刃属线虫隶属线虫门(Nematoda)、色矛纲(Chromadorea)、小杆目(Rhabditida)、滑刃科(Aphelenchoididae)、寄生滑刃亚科(Parasitaphelenchinae),是一类由鞘翅目昆虫传播的食菌或植物寄生线虫[8]。迄今为止,伞滑刃线虫属中仅松材线虫和椰子红环腐线虫(B.cocophilus)被证实具有致病性,后者是椰子红环腐病的病原,而该属其他成员的致病性尚不明确[8]。然而,在新的生态环境、寄主、气候条件、天敌、传播媒介等诸多因素的作用下,一些在原产地无危害或危害较小的物种,一旦被扩散到新区域,是否会对林业生产与生态安全造成危害,一直是学者关注与争论的焦点。
广东出入境检验检疫局从我国台湾地区输入的木质包装材料中截获到一种伞滑刃属线虫,通过形态学特征鉴定、核糖体DNA(rDNA)的ITS PCR-RFLP图谱和分子系统发育分析,将其鉴定为松材线虫组成员之一的吉拉尼伞滑刃线虫[9]。由于该线虫群体为全国口岸首次截获,国内尚无相关报道,因此本文详细描述了其形态鉴定特征并进行了分子特征分析,旨在为我国口岸检疫提供理论依据,以防止该类有害生物随木质包装传播入境。
1 材料与方法 1.1 取样与线虫分离现场检疫时选取有蓝变或虫蛀孔的松木包装,锯取3~5块,编号后用塑料袋密封,送实验室检测。用改良漏斗法分离线虫,将木样劈成宽约1 cm左右的薄片,置于漏斗中,加入适量水(以淹没薄片为宜),25 ℃恒温培养24 h后,用表面皿接取5~10 mL线虫分离液,在体视显微镜下镜检。
1.2 形态学鉴定将线虫制成临时玻片,在光学显微镜下观察、拍照。挑取适量线虫,经表面消毒后,接种在长满灰葡萄孢(Botrytis cinerea)的PDA平板上,置于25 ℃培养14 d[10]。采用甘油-乙醇快速脱水法对杀死固定后的线虫进行脱水[11],将脱水后的线虫用蜡圈法制成永久玻片。用Zeiss Imager Z1自动显微镜和Zeiss Axio Cam MRm数码相机进行形态观察、拍照,并根据de Man公式对成虫进行测计[12]。
1.3 分子生物学鉴定单条线虫的DNA提取参照王江岭等[13]的方法。rDNA的18S、28S和ITS基因片段的扩增引物及PCR程序参照Gu等[14]的方法。ITS的扩增产物分别用5种限制性内切酶RsaⅠ、Hae Ⅲ、MspⅠ、HinfⅠ和AluⅠ进行酶切。10 μL酶切体系中包含8 μL PCR产物、0.5 μL ddH2O、1 μL限制性内切酶对应的Buffer和0.5 μL限制性内切酶。37 ℃酶切3 h,将ITS扩增产物和酶切产物在15 g · L-1琼脂糖凝胶上电泳(5 V · cm-1,50 min),溴化乙锭染色后在紫外灯下观察并拍照,获得线虫的ITS-RFLP图谱。同时将18S、28S和ITS扩增产物送南京金思瑞公司直接测序,测序结果用MEGA 4.0的ClustalW程序进行序列拼接、比对,采用邻接法(Neighbor-joining Method)以及Tajima-Nei距离选项制作系统进化发育树,用Bootstrap值分析聚类可靠性。同时采用BioEdit软件对ITS序列进行上述5种限制性内切酶的位点及片段大小分析。
2 结果与分析 2.1 截获伞滑刃线虫群体的测计值从台湾地区输入的木质包装中分离得到的伞滑刃线虫群体密度约为每100 g木片200条线虫,雄虫、雌虫及幼虫均有发现。成虫测计值见表 1。
|
测计特征值 Morphometric character |
|
|
n | 15 | 15 | 15 | 15 |
L/μm | 665.0±30.1(595~726) | 853.5±45.0(769~922) | 698.0±53(596~794) | 797.0±78(607~890) |
a | 31.6±0.8(30.3~33.5) | 31.0±1.8(28.4~34.6) | 33.0±1.9(29~36) | 30.6±1.8(28~34) |
b | 7.7±0.7(6.8~9.3) | 9.2±0.6(8.5~10.4) | 8.7±0.5(7.8~9.7) | 10.0±1.0(8.1~12.3) |
b′ | 5.5±0.4(4.8~6.2) | 6.8±0.6(5.9~8.0) | ||
c | 19.1±1.8(16.1~22.8) | 25.5±2.7(20.5~30.3) | 20.0±1.8(17.4~24.0) | 23.2±2.2(19.6~27.8) |
c′ | 2.2±0.2(2.0~2.5) | 3.9±0.6(3.3~5.0) | 2.1±0.2(1.7~2.5) | 3.8±0.4(3.2~4.5) |
V | 76.4±1.2(74.4~79.1) | 75.0±0.9(73~77) | ||
T | 62.5±3.3(56.0~66.8) | |||
| 最大体宽/μm Body width | 21.0±0.9(18.8~22.6) | 27.6±1.5(25.5~30.0) | 21.0±1.6(19~24) | 26.0±3.2(22~31) |
| 口针长/μm Stylet length | 12.6±1.0(11.0~14.2) | 12.8±1.0(11.0~15.0) | 15.0±0.7(13~16) | 15.0±0.7(14~16) |
| 头前端至排泄孔距离/μm Excretory pore from anterior end | 74.0±5.0(67.7~83.7) | 77.4±3.6(69.4~83.4) | ||
| 交合刺直线长/μm Spicule length(chord) | 25.3±1.8(22.1~27.7) | 27.0±1.4(25~30) | ||
| 交合刺中弧线长/μm Spicule length(curved median line) | 30.4±1.8(25.8~32.4) | 34.0±1.8(31~37) | ||
| 卵巢长/μm Ovary length | 528.9±57.4(448~604) | |||
| 后阴子宫囊长/μm Length of post-vulval uterine sac | 79.1±15.3(57.1~102.5) | 108.0±13.0(82~133) | ||
| 精巢长/μm Testis length | 422.2±26.2(346~449) | |||
| 尾长/μm Tail length | 35.1±3.3(29.3~39.5) | 33.8±4.0(29.1~42.6) | 35.0±2.9(32~41) | 34.0±2.2(30~38) |
| 注: n代表样本数;L为体长;a为体长与最大体宽的比值;b为体长与头端至食道与肠连接处长度的比值;b′为体长与头端至食道腺末端长度的比值;c为体长与尾长的比值;c′为尾长与肛门处体宽的比值;V为阴门至头端的长度与体长的比值×100;T为泄殖腔口至精巢末端的长度与体长的比值×100;交合刺直线长为交合刺基顶到末端的直线长度;交合刺中弧线长为交合刺基顶到末端的中弧线长度。 Note: n=Number of specimens;L=Total body length;a=Body length/body width;b=Body length/distance from anterior end to junction of oesophagus and intestine;b′=Body length/distance from anterior end to oesophagus end;c=Body length/tail length;c′=Tail length/body width at anus;V=Distance of vulva from anterior end/body length×100;T=Distance of cloaca orifice from testis end/body length×100;Spicule length(chord)=Distance of straight line from spicule condylus tip to distal end;Spicule length(curved median line)=Distance of median line from spicule condylus tip to distal end. | ||||
雄虫:虫体细长,热杀死后,尾部强烈向腹部弯曲,末端呈爪状(图 1-A)。唇区缢缩显著,高约4 μm,宽约8 μm;口针长约13 μm,基部球很小,锥部占口针长的1/3(图 1-B)。中食道球圆形,瓣门发达;食道腺背面覆盖于肠端,长约2~3倍体宽(图 1-C)。神经环紧邻中食道球,排泄孔位于中食道球对应处或其后约10 μm(图 1-C)。侧区宽约3 μm,侧线4条(图 1-D)。精巢前伸,约占体长的1/2(图 1-A);精母细胞2行排列。尾末端的交合伞呈铲状,末端平截或不规则;尾乳突7个(图 1-E)。交合刺的直线长22~28 μm,中弧线长26~32 μm,交合刺轮廓后1/4处腹弯,冠状体(capitulum)长约9 μm,与交合刺杆部(spicule shaft axis)几乎平行;基顶(condylus)小而圆,喙突(pointed rostrum)长而尖,远端有盘状突(cucullus),宽约2 μm;盘状突和喙突、基顶呈一直线(图 1-F~G)。
 | 图 1 截获的吉拉尼伞滑刃线虫群体雄虫形态图 Fig. 1 Morphological figure of male from intercepte population of B.gillanii A.整体Entire body;B.体前端Head region;C.食道Oesophagus;D.侧线Lateral lines;E.尾端腹面观(箭头示交合伞)Ventral side of male terminus(arrow showing bursa);F-G.尾部Tails(A图标尺=50 μm,其余图标尺=10 μm。Scar bar in figure A=50 μm,scar bar in other figures=10 μm) |
雌虫:虫体细长,热杀死后向腹部弯曲(图 2-A)。体前部(图 2-B)、食道(图 2-C)等结构与雄虫相似。侧区侧线4条(图 2-D)。卵巢约占体长的1/2,卵母细胞2行排列(图 2-A);受精囊长卵形。阴道与虫体垂直,阴门位于虫体的76%处,阴门盖长约12~15 μm(图 2-E),后阴子宫囊占肛阴距的2/3到4/5。肛门处略突起膨大,高约2 μm,呈半球形(图 2-F~G)。尾锥形,腹面较背面更显著弯曲;尾长约为肛门处体宽的3~5倍;尾尖突长约5~7 μm,与尾连续逐渐变细,形如鸟喙(图 2-F~G)。
 | 图 2 截获的吉拉尼伞滑刃线虫群体雌虫形态图 Fig. 2 Morphological figure of female from intercepted population of B.gillanii A.整体Entire body;B.体前端Head region;C.食道Oesophagus;D.侧线Lateral lines;E.阴门处侧面观(箭头示阴门盖)Lateral side of vulva(arrow showing vulval flap);F-G.尾部Tails(A图标尺=50 μm,其余图标尺=10 μm。Scar bar in figure A=50 μm,scar bar in other figures=10 μm) |
伞滑刃属线虫的主要形态特征是:口针纤细短小,基部轻微膨大,或有基部球;中食道球显著膨大,大于体宽的2/3甚至接近体宽;侧区一般有2~4条侧线;雌虫阴门唇略突出,或阴门前唇后伸形成阴门盖,有发育不全的后阴子宫囊;雄虫尾部具有短小的端生交合伞,无引带。截获线虫群体具有纤细口针、大中食道球、侧线4条、雌虫有阴门盖及雄虫有端生交合伞等特征,都与该属形态特征相符。
Braasch等[15]和顾建锋等[1]依据侧线数、雄虫尾乳突数量和排列方式、交合刺形状、雌虫有无阴门盖、后阴子宫囊长度、雌虫尾部形态、测计值(a、c和c′)以及排泄孔位置等,将伞滑刃属线虫分为14个组。其中,松材线虫组(xylophilus group)的主要鉴定特征是:侧线4条;典型的雄虫交合刺形状(较长,弓形,喙突明显,远端一般有盘状突,均与松材线虫交合刺形态相似);尾乳突7个,P4明显,P3和P4邻近且位于交合伞起始处;雌虫阴门盖较长,后阴子宫囊较长。弓形交合刺和长阴门盖是该组成员的最重要鉴定特征[1]。
通过形态观察,发现截获的伞滑刃线虫群体具有典型的弓形交合刺以及明显的阴门盖,该线虫应归为松材线虫组,依据松材线虫组成员检索表[16],其对应的是吉拉尼伞滑刃线虫(B.gillanii)。通过与原始文献描述[9]中的形态特征和测计值进行仔细比较与核对,发现该线虫群体的雄虫交合刺(中弧线)(25.8~32.4 μm)比原始群体(31~37 μm)偏小,雌虫的后阴子宫囊(57.1~102.5 μm)比原始群体(82~133 μm)偏小,其他测计值以及形态特征与原始文献的描述基本一致,因此将该截获群体初步鉴定为吉拉尼伞滑刃线虫。吉拉尼伞滑刃线虫的主要鉴定特征为:1)虫体较细(a值:雌虫28~35,雄虫30~34);2)侧线4条,排泄孔位于中食道球对应处或略后;3)阴门位于虫体的76%处,阴门盖显著,长12~15 μm;4)后阴子宫囊占肛阴距的2/3到4/5;5)雌虫尾锥形,长约为肛门处体宽的3~5倍,尾尖突与尾部连续;6)交合刺弓形,中弧线长为26~32 μm,基顶和喙突明显;7)尾乳突7个。
目前,松材线虫组有14个成员,分别是松材线虫、鲍嘉伞滑刃线虫(B.baujardi)、锥尾伞滑刃线虫(B.conicaudatus)、豆伞滑刃线虫(B.doui)、日本冷杉伞滑刃线虫(B.firmae)、伪伞滑刃线虫(B.fraudulentus)、吉拉尼伞滑刃线虫(B.gillanii)、韩国伞滑刃线虫(B.koreanus)、灰黄锦天牛伞滑刃线虫(B.luxuriosae)、大尖尾伞滑刃线虫(B.macromucronatus)、拟松材线虫(B.mucronatus)、拟灰黄锦天牛伞滑刃线虫(B.paraluxuriosae)、杨伞滑刃线虫(B.populi)和新加坡伞滑刃线虫(B.singaporensis)[16]。其中,松材线虫可分为M型和R型株系[17],拟松材线虫存在东亚亚种(B.mucronatus mucronatus)和欧洲亚种(B.mucronatus kolymensis)[18]。
在松材线虫组14个成员中,根据交合刺有盘状突、交合刺长度和c′值等特征,发现吉拉尼伞滑刃线虫与松材线虫、拟松材线虫、日本冷杉伞滑刃线虫和大尖尾伞滑刃线虫在形态上较相似[16]。
吉拉尼伞滑刃线虫与松材线虫R型(圆尾型)的主要区别为:前者雌虫的尾锥形,尾尖突与尾几乎连续,长5~7 μm;后者雌虫的尾圆柱形,末端钝圆,无尾尖突(有时少数个体有微小的尾尖突,一般不超过2 μm)。与松材线虫M型(尖尾型)的区别为:后者雌虫的尾亚圆柱形,尾尖突与尾缢缩明显,平均长度小于3 μm[17]。与拟松材线虫欧洲亚种的区别为:后者的雌虫尾亚圆柱形,尾尖突与尾缢缩明显,平均长度为4 μm[18]。与拟松材线虫东亚亚种的主要区别为:1)前者虫体(雌虫/雄虫a值=31/32)比后者(雌虫/雄虫a值=41/44)略粗壮;2)前者交合刺基顶缢缩,而后者交合刺基顶多数缢缩不明显[18]。与日本冷杉伞滑刃线虫的主要区别为:1)前者雌虫的尾锥形,尾尖突长5~7 μm,末端锐尖,而后者雌虫的尾圆柱形,尾尖突长3~5 μm,末端钝圆;2)前者交合刺中弧线长26~32 μm,而后者长21~24 μm[19]。与大尖尾伞滑刃线虫的主要区别为:1)前者雌虫尾略腹弯,背部腹弯更显著,而后者尾较直,腹部和背部弯曲不显著;2)前者雌虫阴门盖长12~15 μm,而后者雌虫阴门盖长5~7 μm[20]。
2.4 分子生物学特征分析
由于伞滑刃线虫松材线虫组内各个种形态特征差别不显著,近似种之间有时很难区别,因此对截获的伞滑刃线虫群体的分子特征进行了分析。ITS-RFLP图谱是伞滑刃线虫形态鉴定的一种可靠辅助性手段,采用该方法可以准确区分松材线虫和拟松材线虫等近似种[21]。截获群体的rDNA-ITS区扩增片段产物经测序,大小为902 bp,根据BioEdit软件进行限制性酶切分析,RsaⅠ酶切后的片段大小为307、250、223、100和22 bp,Hae Ⅲ酶切后的片段大小仍为902 bp,MspⅠ酶切后的片段大小为350、282和270 bp,HinfⅠ酶切后的片段大小为283、247、147、109、86、25和5 bp,AluⅠ酶切后的片段大小为540、349和13 bp(表 2)。该伞滑刃线虫群体的ITS-RFLP酶切图谱见图 3。种类 Species | ITS产物大小/bp ITS products size |
| 分析方法 Analysis method |
| The population in this study | 902 | 307、250、223、 100、22 | 902 | 350、282、270 | 283、247、147、 109、86、25、5 | 540、349、13 | 序列测算 Sequences computation |
| B.gillanii[9] | 950 | 300、240、100 | 950 | 330、280、? | 280、150、 110、? | 540、370 | 凝胶估读 Gel estimation |
| B.xylophilus[22] | 950 | 500、420 | 730、200 | 570、380 | 270、260、140 | 460、250、 140、100 | 凝胶估读 Gel estimation |
| B.mucronatus mucronatus[22] | 950 | 500、410 | 620、310 | 370、310、280 | 410、250、 130、90 | 700、250 | 凝胶估读 Gel estimation |
| B.mucronatus kolymensis[22] | 950 | 410、290、230 | 620、220、110 | 370、310、280 | 410、250、 130、90 | 700、250 | 凝胶估读 Gel estimation |
| B.firmae[16] | 955 | 491、442、22 | 347、312、296 | 570、385 | 412、235、233、 50、25 | 797、145、13 | 序列测算 Sequences computation |
| B.macromucronatus[20] | 967 | 525、420、22 | 468、245、95、 89、70 | 360、254、 243、110 | 300、254、 243、110 | 967 | 序列测算 Sequences computation |
 | 图 3 截获的吉拉尼伞滑刃线虫群体ITS-RFLP酶切图谱 Fig. 3 ITS-RFLP pattern of intercepted population of B.gillanii M.DNA marker(DL100);1.PCR产物PCR product;2~6.分别为RsaⅠ、Hae Ⅲ、MspⅠ、HinfⅠ和AluⅠ的酶切产物Products digested by RsaⅠ,Hae Ⅲ,MspⅠ,HinfⅠ and AluⅠ,respectively |
将截获群体的ITS-RFLP图谱与吉拉尼伞滑刃线虫原始描述群体[9]以及近似种的ITS-RFLP图谱片段大小进行比较(表 2)。可以看出:由于采用了序列测算和凝胶估读两种不同的分析方法,截获群体与原始描述群体的ITS区扩增产物大小存在一些差异,相应的5种限制性内切酶酶切片段大小也存在一些差异。截获群体的RFLP片段大小是由软件分析ITS序列后得到的精确值,而原始文献群体的RFLP片段大小,是根据凝胶片段人为估计的值。通过对原始文献中提交至GenBank的ITS序列(登录号KC347020)进行分析,发现ITS片段的实际长度为902 bp,与本文群体的序列长度(GenBank登录号:KJ653444)一致,而与原始文献中的人工凝胶估值950 bp之间存在较大差异(表 2)。因此,通过软件分析发现,截获群体与原始描述群体不仅ITS序列完全一致,而且5种限制性内切酶酶切后的片段大小也是一致的。此外,该截获群体与松材线虫、拟松材线虫欧洲亚种及东亚亚种、冷杉伞滑刃线虫和大锥尾伞滑刃线虫,在ITS区扩增产物大小上也存在一些差异,经上述5种酶酶切后,截获群体的各酶切片段大小,都与这些近似种的对应酶切片段大小不同,因此,根据ITS-RFLP图谱也可以明确将截获伞滑刃线虫群体与其形态近似种相区分。
对截获的伞滑刃线虫群体rDNA的18S基因(GenBank登录号为KJ653442)、28S基因(KJ653443)和ITS区(KJ653444)序列进行系统发育分析。从基于18S序列构建的系统发育树(图 4)可以看出:截获群体与日本冷杉伞滑刃线虫(B.firmae)、拟松材线虫东亚亚种(B.mucronatus mucronatus)以及拟松材线虫欧洲亚种(B.mucronatus kolymensis)聚类在同一个进化分支上,它们的序列相似度达98%~99%,但是形态上存在明显的差别。从28S序列的系统发育树(图 5)可以看出:截获群体与松材线虫、冷杉伞滑刃线虫、拟松材线虫东亚亚种以及欧洲亚种聚在一个分支上,它们的序列相似度达96%~98%,但它们之间在形态上亦存在明显的区别。从ITS序列的系统发育树(图 6)可以看出:截获群体与原始文献描述群体(KC347020)聚在一个独立进化分支上,二者亲缘关系最近,序列相似度达100%;吉拉尼伞滑刃线虫和松材线虫组其他成员聚类在一个大分支上,它们之间的序列相似度在76%~81%。
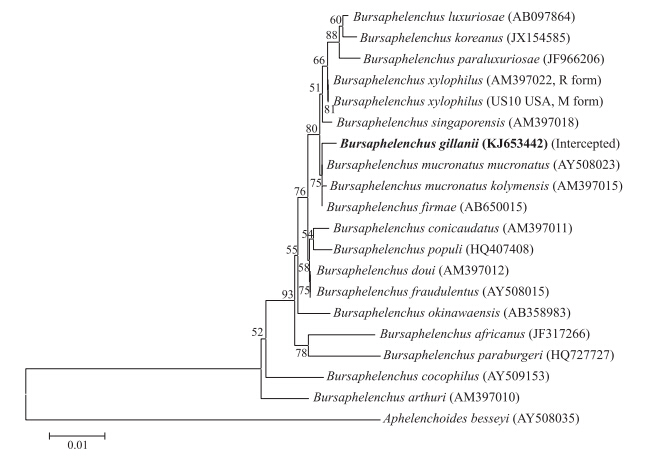 | 图 4 基于rDNA-18S序列构建的松材线虫组系统进化树 Fig. 4 Phylogeny tree of species belong to xylophilus group based on partial rDNA-18S sequences |
 | 图 5 基于28S-D2/D3区序列构建的松材线虫组系统进化树 Fig. 5 Phylogeny tree of species belong to xylophilus group based on partial 28S-D2/D3 sequences |
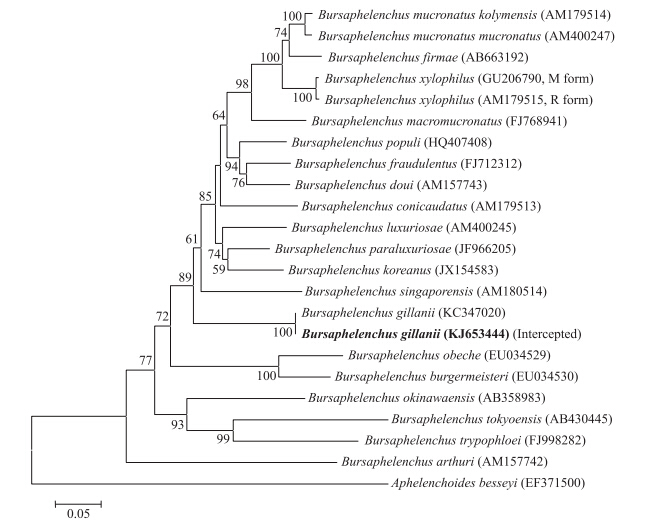 | 图 6 基于rDNA-ITS区序列构建的松材线虫组系统进化树 Fig. 6 Phylogeny tree of species belong to xylophilus group based on full length rDNA-ITS sequences |
综合形态学和分子生物学特征的比较与分析结果,从广东口岸输入的台湾地区木质包装材料中截获的线虫群体鉴定为吉拉尼伞滑刃线虫。
3 讨论目前世界各国都加强了对进境木质包装材料的检疫,从进境木质包装材料中发现并报道的伞滑刃线虫属新种数量,占其报道种类总数量的比例已从2007年Li[10]统计的7%增长到目前统计的15%。到目前为止,伞滑刃线虫属种类达107种[16]。我国各口岸已从进境木质包装材料中共截获36种伞滑刃线虫,其中有17种被描述为新种[1, 16],且松材线虫组(xylophilus group)成员有10种[1, 16]。本文对从我国台湾地区输入的木质包装材料中截获的一个伞滑刃线虫群体进行了形态学与分子生物学特征鉴定,确认其为吉拉尼伞滑刃线虫(B.gillanii),也是松材线虫组成员之一,系我国口岸首次截获。
吉拉尼伞滑刃线虫是德国学者从来自我国深圳的松木包装材料中截获并描述的[9],而本文所描述的线虫群体截获自从我国台湾地区输入的木质包装材料,由于木质包装材料可在世界范围内运输和重复利用,因此我们尚未能确认该线虫群体的起源国家和具体的寄主种类等。伞滑刃属线虫常发现于媒介昆虫或病死松木,在我国马尾松、黑松、黄山松、华山松、湿地松等松属植物上报道有多种伞滑刃线虫的发生[1]。其中,只有松材线虫引起的松树萎蔫病已给我国林业造成了难以估计的损失,其他的伞滑刃线虫包括拟松材线虫和豆伞滑刃线虫(B.doui)等松材线虫组成员,是否对松属植物有致病性,还需进一步的试验证实。作为松材线虫组成员之一的吉拉尼伞滑刃线虫,其致病性目前尚不能确定,但我们不能忽略对该线虫的检疫与监控。
由于伞滑刃属线虫在自然状态下的传播扩散距离相对有限,主要是通过木材和木质包装的国际运输进行远距离传播。目前我国各口岸已截获的伞滑刃线虫种类中,除松材线虫外,其他种类尚未在我国林木上有分布报道,但这些危险性有害生物被截获,表明我国的农林生态安全随时面临着巨大威胁。因此,加强对进境木材、木质包装材料等的检疫监管,提高我国各口岸局的植物线虫检疫鉴定水平,对我国林业及生态环境安全至关重要。
| [2] | Futai K. Pine wood nematode,Bursaphelenchus xylophilus[J]. Annual Review of Phytopathology,2013,51:61-83 |
| [3] | Gu J F,Braasch H,Burgermeister W,et al. Records of Bursaphelenchus spp.intercepted in imported packing wood at Ningbo,China[J]. Forest Pathology,2006,36:323-333 |
| [4] | Fuchs A G. Neue parasitische und halbparasitische nematoden bei borkenkäfern und einige andere nematoden.Ⅰ. Teil[J]. Zoologische Jahrbücher,Abteilung für Systematik,Ökologie und Geographie der Tiere,1937,70:291-380 |
| [5] | Kiyohara T,Tokushige Y. Inoculation experiments of a nematode,Bursaphelenchus sp.,onto pine trees[J]. Journal of the Japanese Forestry Society,1971,53:210-218 |
| [6] | Mota M,Braasch H,Bravo M A,et al. First report of Bursaphelenchus xylophilus in Portugal and in Europe[J]. Nematology,1999,1(7/8):727-734 |
| [7] | Valadas V,Laranjo M,Barbosa P,et al. The pine wood nematode,Bursaphelenchus xylophilus,in Portugal:possible introductions and spread routes of a serious biological invasion revealed by molecular methods[J]. Nematology,2012,14(8):899-911 |
| [8] | Perry R N,Moens M. Plant Nematology[M]. Wallingford,UK:CABI Publishing,2006:27-31 |
| [9] | Schönfeld U,Braasch H,Riedel M,et al. Bursaphelenchus gillanii sp.n.(Nematoda:Aphelenchoididae)—a new species of the xylophilus group in packaging wood imported from China[J]. Nematology,2014,16(1):53-62 |
| [10] | Li H M. Identification and pathogenicity of Bursaphelenchus species(Nematoda:Parasitaphelenchidae)[D]. Ghent,Belgium:Ghent University,2008:16-21 |
| [11] | 顾建锋,赵立荣,陈先锋,等. GB/T 24829—2009毛刺线虫属(传毒种类)检疫鉴定方法[S]. 北京:中国标准出版社,2010 [Gu J F,Zhao L R,Chen X F,et al. GB/T 24829-2009 Identification of Trichodorus species as virus vectors for import and export quarantine[S]. Beijing:Standards Press of China,2010(in Chinese)] |
| [12] | 谢辉. 植物线虫分类学[M]. 2版. 北京:高等教育出版社,2005:30 [Xie H. Taxonomy of Plant Nematode[M]. 2nd ed. Beijing:Higher Education Press,2005:30(in Chinese)] |
| [13] | 王江岭,张建成,顾建锋. 单条线虫DNA提取方法[J]. 植物检疫,2011,25(2):32-35 [Wang J L,Zhang J C,Gu J F. Method of extract DNA from a single nematode[J]. Plant Quarantine,2011,25(2):32-35(in Chinese)] |
| [14] | Gu J F,Wang J L,Zheng J W. Description of Bursaphelenchus arthuroides n.sp.(Nematoda:Aphelenchoididae):a second parthenogenesic species among Genus Bursaphelenchus Fuchs,1937[J]. Nematology,2012,14(1):51-63 |
| [15] | Braasch H,Burgermeister W,Gu J F. Revised intra-generic grouping of Bursaphelenchus Fuchs,1937(Nematoda:Aphelenchoididae)[J]. Journal of Nematode Morphology and Systematics,2009,12:65-68 |
| [16] | 顾建锋. 松材线虫及其近似种的鉴定技术[M]. 厦门:厦门大学出版社,2014:3-9 [Gu J F. Identification of Bursaphelenchus xylophilus and Taxonomy-related Species[M]. Xiamen:Xiamen University Press,2014:3-9(in Chinese)] |
| [17] | Gu J F,Wang J L,Braasch H,et al. Morphological and molecular characterisation of mucronate isolates("M"form)of Bursaphelenchus xylophilus(Nematoda:Aphelenchoididae)[J]. Russian Journal of Nematology,2011,19(2):103-119 |
| [18] | Braasch H,Gu J F,Burgermeister W. Bursaphelenchus mucronatus kolymensis comb.n.—new definition of the"European type"of B.mucronatus[J]. Journal of Nematode Morphology and Systematics,2011,14(2):77-90 |
| [19] | Kanzaki N,Maehara N,Aikawa T,et al. Bursaphelenchus firmae n.sp.(Nematoda:Aphelenchoididae),isolated from Monochamus grandis Waterhouse that emerged from dead firs,Abies firma Sieb.et Zucc.[J]. Nematology,2012,14(4):395-404 |
| [20] | Gu J F,Zheng W,Braasch H,et al. Description of Bursaphelenchus macromucronatus sp.n.(Nematoda:Parasitaphelenchidae)in packaging wood from Taiwan and India—a new species of the 'xylophilus’ group[J]. Journal of Nematode Morphology and Systematics,2008,11:31-40 |
| [21] | Burgermeister W,Braasch H,Metge K,et al. ITS-RFLP analysis—an efficient tool for differentiation of Bursaphelenchus species[J]. Nematology,2009,11:649-668 |
| [22] | Li H M,Trinh P Q,Waeyenberge L,et al. Characterization of Bursaphelenchus spp.isolated from packaging wood imported at Nanjing,China[J]. Nematology,2009,11(3):375-408 |




