文章信息
- 王春红, 武志海, 孙合美, 于亭, 张婷婷, 刘晶晶, 汲添, 杨美英. 2015.
- WANG Chunhong, WU Zhihai, SUN Hemei, YU Ting, ZHANG Tingting, LIU Jingjing, JI Tian, YANG Meiying. 2015.
- 大豆根际溶无机磷细菌Klebsiella sp.wj6的分离鉴定与溶磷特性分析
- Screening,identification and solubilizing properties of the inorganic phosphate-solubilizing bacteria Klebsiella sp.wj6 isolated from soybean rhizosphere soil
- 南京农业大学学报, 38(4): 560-567
- Journal of Nanjing Agricultural University, 38(4): 560-567.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.006
-
文章历史
- 收稿日期:2014-10-18
2. 吉林农业大学农学院, 吉林 长春 130118
2. College of Agriculture, Jilin Agricultural University, Changchun 130118, China
磷是植物生长发育所需的营养元素之一,也是植物体内有机化合物的重要组成成分[1]。因此,为了增加农作物产量、提高品质,磷肥被广泛地应用到农业生产中,而由于吸附、沉淀和微生物固持等作用,磷素被土壤固定、积累[2],75%~90%的磷再次被迅速转化成不能被植物吸收的难溶性磷,导致作物对磷肥的利用率降低,即使加上后效,其利用率一般也不超过25%[3]。
土壤中难溶性磷大部分以有机态和无机态形式存在,这些难溶性磷占土壤总磷量的95%以上[4]。研究表明,植物根际存在着大量的溶磷菌,包括细菌、放线菌和真菌,能够将植物难以吸收的无机磷酸盐转化为可直接吸收利用的形式[5]。溶磷菌通过代谢作用溶解根际难溶性磷化物,补充植物所需磷矿营养的同时,还有利于植物对N、K、Ca、Mg、Fe、Zn等其他营养元素的吸收,提高生物量和产量[6, 7]。曾广勤等[8]研究表明,溶磷菌可以提高小麦的氮磷含量,从而改善产品质量,并提高小麦的抗旱抗寒能力。郝晶等[9]也报道不同溶磷菌群能大幅度提高豌豆产量。
不同微生物的溶磷能力差异较大。尹瑞龄[10]从土壤中分离出了265株具有分解摩洛哥磷矿粉能力的细菌,它们的溶磷能力平均为2~30 mg · g-1,其中巨大芽孢杆菌(Bacillus megaterium)、节杆菌(Arthrobacter)及假单胞菌(Pseudomonas)等的溶磷能力较强,为25~30 mg · g-1。Sundara等[1]利用Ca3(PO4)2作为磷源,发现几株芽孢杆菌释放的可溶性磷为56.80~70.52 μg · mL-1,埃希氏菌属(Escherichia)释放的可溶性磷为159.70~170.30 μg · mL-1。微生物的溶磷机制也因菌株的不同而有所不同。一般认为溶磷微生物的溶磷是由于分泌有机酸,这些酸既能降低pH值,又可与Fe、Al、Ca等离子螯合,从而使难溶磷转化为可溶性效磷[3]。但Illmer等[11]发现产生有机酸只是溶磷机制之一,有些溶磷菌可通过呼吸或同化过程中NH+4/H+的交换作用导致介质pH值下降,溶解难溶磷酸盐。
黑土是地球上最珍贵的土壤资源,它具有质地疏松、肥力高、供肥能力强的特点[12]。我国黑土区主要分布在东北地区,生物资源丰富,盛产大豆、春小麦、玉米、水稻,是重要的商品粮基地。本研究从吉林省黑土区的大豆根际土中分离到一株溶磷能力较强的菌株,命名为wj6。对该菌株进行Vitek 2和16S rDNA序列分析,鉴定为Klebsiella sp.。对其溶解难溶性Ca3(PO4)2、FePO4和AlPO4的特性进行分析,将为明确该菌株溶磷特征与机制的研究奠定基础,对于促进农业可持续发展具有重要意义。
1 材料与方法 1.1 菌株的分离本试验所用土壤取自吉林农业大学大豆试验地(东经125°19′、北纬43°43′)的大豆根际土壤。
溶无机磷细菌的分离培养基为NBRIP培养基[13],培养基成分如下:葡萄糖10 g,Ca3(PO4)2 5 g,MgCl2 · 6H2O 5 g,MgSO4 · 7H2O 0.25 g,KCl 0.2 g,(NH4)2SO4 0.1 g,蒸馏水1 000 mL,pH 7.0。取1 g大豆根际土加入50 mL无菌水,30 ℃摇床震荡30 min,取上清液逐级稀释后,分别取50 μL涂布于NBRIP培养基上,30 ℃培养48 h,挑取具有明显溶磷圈的菌落进行纯化。将纯化后的菌株于-80 ℃保存备用。
1.2 菌株的鉴定通过Vitek 2自动分析系统对菌株进行生化鉴定;按照标准方法[14]提取菌株的基因组DNA,进行16S rDNA基因扩增。PCR所用引物分别对应于大肠杆菌16S rDNA基因(GenBank序列号为J01859)的7~26位和1491~1512位[15, 16]。PCR产物送上海生工生物工程有限公司进行测序。测序序列利用GenBank数据库进行BLAST同源性比较。利用Mega 5.0软件构建菌株16S rDNA序列的系统发育树。
1.3 菌株溶磷培养条件优化以分离培养基NBRIP为基础,对碳源(10 g · L-1)、氮源(0.5 g · L-1)及pH值,采用L25(53)正交设计试验进行优化,供试因素及水平见表 1。种子液按1%接种量接种于培养基中,于30 ℃、150 r · min-1培养36 h,上清液用钼蓝比色法测定可溶性磷的含量,详细方法参照文献[17]。数据采用SPSS 16.0统计软件、DPS 7.5及Microsoft Office Excel 2003进行分析。
| 水平 Level |
|
| 1 | 葡萄糖Glucose | 硝酸铵Ammonium nitrate | 5 |
| 2 | 蔗糖Sucrose | 硫酸铵Ammonium sulfate | 6 |
| 3 | 麦芽糖Maltose | 尿素Urea | 7 |
| 4 | 乳糖Lactose | 蛋白胨Peptone | 8 |
| 5 | 甘露糖Mannose | 牛肉膏Beef extract | 9 |
采用钼蓝比色法测定供试菌株的溶磷量[17]。分别以Ca3(PO4)2、FePO4和AlPO4为唯一磷源(pH 8)接种等量灭活菌液为对照。由于以Ca3(PO4)2为唯一磷源时,灭菌前后对培养基pH值没有影响,而以FePO4和AlPO4为唯一磷源时,灭菌后,培养基pH值变化较大,从灭菌前的pH 8分别下降到5.50和5.10。为了明确培养基的pH值是否影响菌株对FePO4和AlPO4的溶解,本试验对灭菌后的培养基原液(pH 3)及再次调pH值至8的培养基接入wj6种子液后的溶磷量及溶液pH值进行测定。在150 mL的三角瓶中加入50 mL液体培养基。按1%的接种量接种供试菌株,重复3次,30 ℃、150 r · min-1培养96 h,每隔6 h取2 mL发酵液于10 000 r · min-1离心5 min,取1 mL上清液加水至3 mL,加入3 mL定磷试剂,测定上清液的含磷量,计算供试菌株的溶磷量;用PHS-3C pH计测定菌液的pH值。
1.5 菌株磷酸酶活性及葡萄糖脱氢酶活性测定将菌株在以Ca3(PO4)2为唯一磷源优化的NBRIP液体培养基中培养。磷酸酶属于胞外酶,菌液经10 000 r · min-1离心5 min后,取上清液检测磷酸酶活性,详细步骤参照文献[18]。以该菌株每小时1 L发酵液中酶作用于底物所释放出产物的物质的量作为酶活力单位,记为μmol · L-1 · h-1。
葡萄糖脱氢酶活性测定方法参照文献[19]。菌液培养参见磷酸酶活性测定中培养条件。将菌液10 000 r · min-1离心10 min,收集菌体,加入10 mL 0.01 mol · L-1磷酸缓冲液(pH 6.0),再加入2-巯基乙醇至1 mmol · L-1,于冰浴中,超声破碎30 min(50%功率,工作10 s,间歇20 s)。4 ℃浸提3 h,离心得上清液,沉淀加2倍体积磷酸缓冲液(pH 6.0)得破碎细胞悬浊液。在破碎细胞悬浊液中加入Triton-X100至终浓度为1%,在0 ℃轻轻搅拌3 h,4 ℃浸提过夜,12 000 r · min-1离心10 min,上清液即为葡萄糖脱氢酶粗酶液。 25 ℃条件下,向比色皿中加入1 mL 50 mmol · L-1 Tris-HCl缓冲液(pH 8.75),然后分别加入20 mmol · L-1 吩嗪硫酸甲酯(PMS)、6.7 mmol · L-1 2,6-二氯靛酚(DCIP)以及1 mol · L-1葡萄糖各100 μL,混合均匀,加入适量的酶液,最后定容至3 mL,测定每分钟600 nm下吸光值的变化。酶活性单位(U)定义为:25 ℃条件下,在1 min内能够使1 μmol的葡萄糖氧化(或1 μmol DCIP还原)的酶量。
2 结果与分析 2.1 菌株的分离与鉴定 2.1.1 菌株的分离利用NBRIP固体培养基分离大豆根际土壤中的溶磷细菌,经过多次分离与纯化得到1株具有明显溶磷圈(图 1)的细菌,表明这株细菌具有较强的溶解Ca3(PO4)2的能力,并将其命名为wj6。
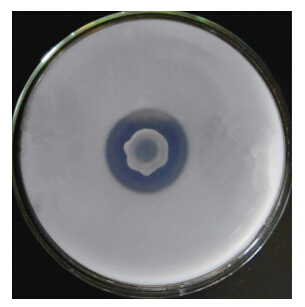 | 图 1 菌株wj6溶磷效果 Fig. 1 Effect on solubilizing phosphate by strain wj6 |
wj6菌株在NBPIP分离培养基上培养,菌落呈圆形,边缘平整,不透明,颜色为乳白色,初步确定该菌株为革兰氏阴性菌。Vitek 2生化鉴定结果为Klebsiella sp.。其中吡咯烷基芳胺酶、D-纤维二糖、β-半乳糖苷酶、β-N-乙酰葡萄糖苷酶、D-葡萄糖、γ-谷氨酰转移酶、葡萄糖发酵、β-葡萄糖苷酶、D-麦芽糖、D-甘露醇、D-甘露糖、β-木糖苷酶、L-脯氨酸芳胺酶、古老糖、酪氨酸芳胺酶、D-山梨醇、蔗糖、D-海藻糖、柠檬酸盐(钠)、丙二酸盐、5-酮-葡萄糖苷、乳酸盐产碱、琥珀酸盐产碱、α-半乳糖苷酶、磷酸酶、氨基乙酸芳胺酶、赖氨酸脱羧酶、O129R耐受等反应呈阳性。丙氨酸-苯丙氨酸-脯氨酸芳胺酶、侧金盏花醇、H2S产生、谷氨酰芳胺酶、β-丙氨酸芳胺酶、脂酶、尿素酶、D-塔格糖、α-葡萄糖、N-乙酰-β-半乳糖氨酶、鸟氨酸脱羧酶、组氨酸同化、COURMARATE、β-葡萄糖苷酸、谷氨酸-甘氨酸-精氨酸芳胺酶、L-苹果酸盐同化、ELLMAN、L-乳酸盐同化等反应呈阴性。
2.1.3 菌株wj6的16S rDNA鉴定及进化树分析以菌株wj6的基因组DNA为模板,利用细菌16S rDNA引物进行PCR扩增,得到长度约为1.5 kb的扩增产物。将测序序列利用GenBank数据库进行BLAST同源性比较,结果表明该菌株基因序列与Klebsiella pneumoniae 342(GenBank登录号为CP000964.1)、K.pneumoniae strain XH209(CP009461.1)、K.pneumoniae strain PMK1(CP008929.1)有较高的同源性,相似度均为98%,因此进一步证实该菌株为Klebsiella sp.。菌株wj6的系统发育树见图 2。
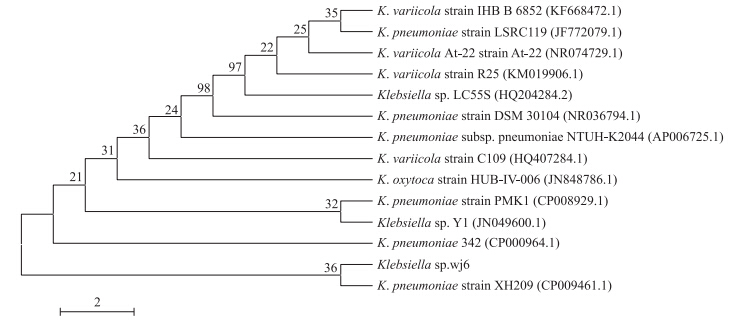 | 图 2 基于16S rDNA序列同源性构建的系统发育树 Fig. 2 Phylogenetic tree based on 16S rDNA sequences homology |
从碳源、氮源、pH值的3因素5水平正交试验结果(表 2)及方差分析(表 3)可见:碳源、氮源、pH值对试验结果均有影响。碳源是溶磷菌溶磷能力的主要影响因素,菌株在以葡萄糖为碳源时溶磷量最大,以甘露糖为碳源时溶磷量略低于前者。氮源不同菌株的溶磷量明显不同,菌株在以蛋白胨为氮源时溶磷量最高,硝酸铵、牛肉膏为氮源时溶磷量略低于前者。培养基的初始pH值也影响菌株的溶磷量,初始pH值为8时溶磷量最大。正交结果与方差分析结果表明,影响供试菌株溶磷量的主次顺序从大到小依次为碳源、氮源、pH值,菌株wj6溶磷最优培养条件为:葡萄糖为碳源,蛋白胨为氮源,pH值8。
序号No. | 碳源C source | 氮源N source | pH值pH value | 溶磷量/(μg·mL-1)Phosphate released P |
| 1 | 5 | 2 | 1 | 204.87 |
| 2 | 4 | 2 | 5 | 14.06 |
| 3 | 5 | 3 | 2 | 390.27 |
| 4 | 2 | 2 | 3 | 61.09 |
| 5 | 3 | 1 | 3 | 224.87 |
| 6 | 3 | 3 | 5 | 56.22 |
| 7 | 3 | 2 | 4 | 191.90 |
| 8 | 1 | 1 | 1 | 447.57 |
| 9 | 2 | 5 | 1 | 38.38 |
| 10 | 3 | 4 | 1 | 281.09 |
| 11 | 5 | 5 | 4 | 385.95 |
| 12 | 1 | 4 | 4 | 471.36 |
| 13 | 4 | 1 | 4 | 17.84 |
| 14 | 1 | 2 | 2 | 434.06 |
| 15 | 5 | 1 | 5 | 204.87 |
| 16 | 2 | 1 | 2 | 115.68 |
| 17 | 5 | 4 | 3 | 313.52 |
| 18 | 1 | 5 | 5 | 448.11 |
| 19 | 4 | 5 | 3 | 38.38 |
| 20 | 2 | 3 | 4 | 9.19 |
| 21 | 4 | 4 | 2 | 43.79 |
| 22 | 4 | 3 | 1 | 27.03 |
| 23 | 1 | 3 | 3 | 195.14 |
| 24 | 2 | 4 | 5 | 4.87 |
| 25 | 3 | 5 | 2 | 68.65 |
| K1 | 399.25 | 202.17 | 199.79 | |
| K2 | 45.84 | 181.19 | 210.49 | |
| K3 | 164.54 | 135.57 | 166.60 | |
| K4 | 28.22 | 222.92 | 215.25 | |
| K5 | 299.90 | 195.90 | 145.63 | |
| 极差R | 371.02 | 87.35 | 69.62 |
|
方差来源 Source | 平方和 Sum of squares | 自由度 DF | 方差估计值 Mean square | F值 F-value | P值 P-value | 显著性 Significance |
| 碳源C source | 517 168.78 | 4 | 129 292.20 | 16.370 89 | 0.009 561 | * |
| 氮源N sources | 21 383.47 | 4 | 5 345.87 | 0.676 89 | 0.642 724 | |
| pH值pH value | 18 198.90 | 4 | 4 549.72 | 0.576 08 | 0.104 000 | |
| 误差效应Effect of error | 94 772.26 | 12 | 7 897.68 | |||
| 总和Sum | 651 523.43 | |||||
| Note:*P<0.05 | ||||||
从图 3-A可知:以FePO4、AlPO4为唯一磷源的溶磷培养基pH值下降到6.5时,不再有明显变化。而以Ca3(PO4)2为唯一磷源的培养基pH值基本保持不变(pH 8)。
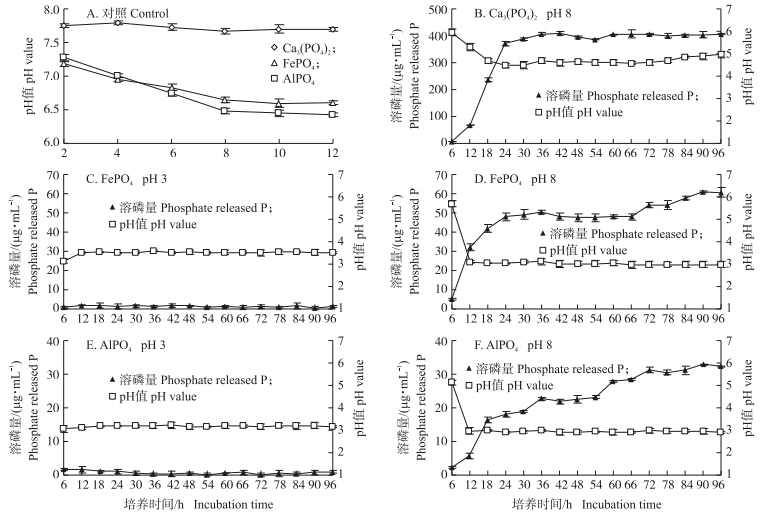 | 图 3 菌株wj6溶解Ca3(PO4)2、FePO4和AlPO4的特性分析 Fig. 3 Characteristics of solubilizing Ca3(PO4)2,FePO4,AlPO4 by strain wj6 |
以Ca3(PO4)2为唯一磷源时,96 h内菌株的溶磷量呈先升高后平稳的趋势,溶磷量在24 h之前变化明显,一直呈增加的趋势,从7.91 μg · mL-1增加到370.22 μg · mL-1,24 h以后溶磷量变化缓慢,当溶磷量达到409.28 μg · mL-1时便不再增加;96 h内,菌株的pH值呈下降趋势,在30 h后pH值下降至5时趋于稳定(图 3-B)。
以FePO4为唯一磷源时,96 h内菌株在pH 3溶磷培养基中溶磷量为零,培养液中pH值变化也不明显(图 3-C)。96 h菌株在pH 8的溶磷培养基中,36 h内溶磷量增加较快,之后缓慢增加,最大溶磷量达到60.59 μg · mL-1;培养液pH值呈下降趋势,18 h以后pH值下降至3时保持不变(图 3-D)。
以AlPO4为唯一磷源时,96 h内菌株在pH 3溶磷培养基中没有溶磷量,培养液中pH值变化也不明显(图 3-E)。菌株在pH 8的溶磷培养基中,72 h内溶磷量逐渐增加,最大溶磷量为32.90 μg · mL-1,之后变化不明显;溶液pH值呈下降趋势,18 h之后,pH值下降至2.9时趋于平稳(图 3-F)。
2.4 菌株wj6磷酸酶活性及葡萄糖脱氢酶活性分析由表 4可知:12~48 h内酸性磷酸酶活性逐渐增加,每隔12 h的差异达到显著水平;48 h时酶活性达到最大,为1 015.02 μmol · L-1 · h-1,60~96 h随时间的变化酶活性差异不显著。碱性磷酸酶活性在12~24 h内逐渐增加,24 h时酶活性达到最大,为1 140.86 μmol · L-1 · h-1,差异显著;36 h之后随时间的变化酶活差异不显著。96 h内,葡萄糖脱氢酶活性在12~36 h,差异不显著;48~96 h内酶活差异不显著。
|
培养时间/h Incubation time | 酸性磷酸酶活性/(μmol·L-1·h-1) Acid phosphatase activity | 碱性磷酸酶活性/(μmol·L-1·h-1) Alkaline phosphatase activity | 葡萄糖脱氢酶活性/(U·mL-1) Glucose dehydrogenase activity |
| 12 | 225.30±29.14e | 226.40±41.31f | 782.35±27.26a |
| 24 | 599.78±62.91c | 1 140.86±7.68a | 789.11±65.09a |
| 36 | 877.89±41.60b | 992.99±4.70b | 796.90±36.53a |
| 48 | 1 015.02±59.03a | 660.09±24.70c | 660.61±71.39bc |
| 60 | 429.61±26.35d | 333.51±21.56d | 642.46±9.68bc |
| 72 | 164.72±12.72e | 326.90±25.72d | 671.51±58.57b |
| 84 | 180.96±37.37e | 341.50±1.65d | 587.52±1.61c |
| 96 | 230.53±23.15e | 273.76±20.45e | 594.04±28.53c |
| 注: 同一列数字后不同的小写字母表示在0.05水平差异显著。Data followed by different small letters within a row indicate significant difference at 0.05 level. | |||
继前苏联研究者蒙基娜1935年首先从土壤中分离到一种溶磷巨大芽孢杆菌以来,溶磷菌的研究一直受到科研人员的关注[20]。研究发现溶磷细菌主要有芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、欧文氏菌(Erwinia)、土壤杆菌(Agrobacterium)、黄杆菌(Flavobacterium)、微球菌(Micrococcus)、固氮菌(Azotobacter)、洋葱伯克霍尔德菌(Burkholderia cepacia)、色杆菌(Clromobacterium)、产碱菌(Alcaligenes)、节细菌(Arthrobacter)和硫杆菌(Thiobacillus)等[21]。本研究从大豆根际土壤中分离得到1株具有较强溶磷能力的溶磷菌wj6,该菌在分离固体培养基中有明显的溶磷圈,在以Ca3(PO4)2为唯一磷源液体培养基中培养36 h 后溶磷量达到409.28 μg · mL-1,溶磷能力高于赵小蓉等[22]报道的溶磷菌的溶磷量。本研究利用Vitek 2自动分析系统对wj6进行鉴定,结果表明该菌株为Klebsiella sp.。16S rDNA序列分析结果进一步证实了Vitek 2的鉴定结果。
王小妹[23]对土生肺炎克雷伯氏菌的溶磷能力以及溶磷机制进行了初步研究,此后一直未有更深入的报道。本试验在此基础上对分离到的溶磷菌wj6进行了系统的研究。Reyes等[24]认为培养基中碳源和氮源可以通过影响产生有机酸的种类和浓度进而影响溶磷量。本试验发现葡萄糖和蛋白胨分别是wj6菌株溶磷过程中较好的碳源和氮源,而且单糖溶磷效果优于二糖。培养液pH值与溶磷量存在一定的相关性[25]。本研究也发现wj6随着溶磷量的增加,pH值下降明显。同时,该菌株能降解Ca3(PO4)2、FePO4和AlPO4 3种磷酸盐,且菌株在溶解FePO4和AlPO4磷酸盐时受培养环境pH值的影响。这说明wj6菌株在一定的pH值培养基中才能溶解磷酸盐,过低的pH值抑制菌株的溶磷。不同形态的磷酸盐由于结构和成分差异,导致微生物对其溶解能力的差异很大。孙珊等[26]发现一些溶磷菌对不同磷酸盐的溶解能力从大到小依次为Ca3(PO4)2、AlPO4、FePO4。但本研究中wj6对3种难溶性磷酸盐的溶解能力从大到小依次为Ca3(PO4)2、FePO4、AlPO4。由于大多数溶磷菌主要通过分泌质子和有机酸使磷酸盐溶解,Ca-P较易溶解可能是由于质子和有机酸络合双重作用的结果,而Al-P和Fe-P的溶解可能只通过络合和螯合作用[27]。
溶磷菌在生长、繁殖过程中能够通过酶解吸收难溶性磷[28]。钟传青等[18]研究表明溶磷菌以难溶性磷酸盐为唯一磷源时提高磷酸酶活性,这些磷酸酶促进菌体繁殖与死亡菌体的分解,并将死亡菌体中的有机磷转化为无机磷,进而解决环境中磷缺乏的问题。本试验中,wj6菌株在12~48 h溶磷时磷酸酶活性呈上升趋势,之后溶磷量达到稳定状态,磷酸酶活性也逐渐下降,这与钟传青等[18]的观点一致。Liu等[29]研究发现,一些溶磷能力较好的革兰氏阴性菌在壁膜空间中存在着直接氧化途径。溶磷细菌通过直接氧化途径向胞外释放强酸,从而酸化难溶性磷化合物中的磷,该氧化途径的第一步是葡萄糖在葡萄糖脱氢酶的作用下被氧化成葡糖酸,进而生成葡糖酮酸,参与这个途径的酶都定位于细胞膜外侧。本试验对wj6菌株葡萄糖脱氢酶测定结果发现,在溶磷36 h内酶活性较高,之后略有下降,36 h内葡萄糖脱氢酶活性与其他时间酶活性的差异达到显著水平。这可能是因为溶磷36 h后,溶液pH值下降明显,而导致酶活性下降。但酶活性在96 h内能一直保持在587.52 U · mL-1的水平,这也说明葡萄糖脱氢酶与酸性磷酸酶及碱性磷酸酶在wj6菌株溶磷过程中均起着重要作用。
| [1] | Sundara R,Sinha M K. Phosphate-dissolving microorganisium in the rhizosphere and soil[J]. India Journal of Agricultural Sciences,1963,33(4):272-278 |
| [2] | 杨珏,阮晓红. 土壤磷素循环及其对土壤磷流失的影响[J]. 土壤与环境,2001,10(3):256-258 [Yang J,Ruan X H. Soil circulation of phosphosrus and its effects on the soil loss of phosphorus[J]. Soil and Environmental Sciences,2001,10(3):256-258(in Chinese with English abstract)] |
| [3] | 冯月红,姚拓,龙瑞军. 土壤解磷菌研究进展[J]. 草原与草坪,2003(1):3-7 [Feng Y H,Yao K,Long R J. Research progress of phosphate-dissolving microorganisms in plant rhizosphere[J]. Grassland and Turf,2003(1):3-7(in Chinese with English abstract)] |
| [4] | 宋春,韩晓增. 长期施肥条件下土壤磷素的研究进展[J]. 土壤,2009,41(1):21-26 [Song C,Han X Z. Advances in phosphorus in long-term fertilized soil[J]. Soils,2009,41(1):21-26(in Chinese with English abstract)] |
| [5] | 林启美,赵小蓉,孙焱鑫,等. 四种不同生态环境土壤中解磷细菌的数量及种群分布[J]. 土壤与环境,2000,9(1):34-37 [Lin Q M,Zhao X R,Sun Y X,et al. Community charaeters of soil phosphobaeteriain four ecosystems[J]. Soil and Environmental Sciences,2000,9(1):34-37(in Chinese with English abstract)] |
| [6] | Vassileva M,Azcon R,Barea J M,et al. Effect of encapsulated cells of Enterobacter sp.on plant growth and phosphate uptake[J]. Bioresource Technology,1999,67(3):229-232 |
| [7] | Zaidi A,Khan M S,Amil M. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea(Cicer arietinum L.)[J]. European Journal of Agronomy,2003,19(1):15-21 |
| [8] | 曾广勤,刘荣昌. 磷细菌剂在小麦上应用研究[J]. 河北省科学院学报,1997(3):25-28 [Zeng G Q,Liu R C. Study on the submergen culture of three kinds of large edible fungi[J]. Journal of Hebei Academy of Sciences,1997(3):25-28(in Chinese with English abstract)] |
| [9] | 郝晶,洪坚平,刘冰,等. 不同解磷菌群对豌豆生长和产量影响的研究[J]. 作物杂志,2006(1):73-76 [Hao J,Hong J P,Liu B,et al. Effect of different phosphate-solubilizing microorganisms on grow and yield of field-grown pea[J]. Crops,2006(1):73-76(in Chinese with English abstract)] |
| [10] | 尹瑞龄. 我国旱地土壤的溶磷微生物[J]. 土壤,1988,20(5):243-246 [Yin R L. The phosphate-dissolving microorganisium of upland soil in China[J]. Soils,1988,20(5):243-246(in Chinese with English abstract)] |
| [11] | Illmer P,Barbato A,Schinner F. Solubilisation of hardly-soluble AlPO4 with P-solubilizing microorganisms[J]. Soil Biology and Biochemistry,1995,27(2):265-270 |
| [12] | 王充,于东升,张海东,等. 典型黑土区农田土壤碳库及其影响因子显著性变化特征研究[J]. 土壤学报,2014,51(4):846-852 [Wang C,Yu D S,Zhang H D,et al. Soil carbon stocks and changes in significance of its impact factors in typical black soil region of northeast China[J]. Acta Pedologica Sinica,2014,51(4):846-852(in Chinese with English abstract)] |
| [13] | Nautiyal C S. An efficient microbiological growth medium for screening phosphate-solubilizing microorganisms[J]. FEMS Microbiology Letters,1999,170(1):265-270 |
| [14] | Habe H,Ashikawa Y,Yuko S. Sphingomonas sp.strain KA1,carrying a carbazole dioxygenase gene homologue,degrades chlorinated dibenzo-p-dioxins in soil[J]. FEMS Microbiol Letters,2002,211(1):43-49 |
| [15] | Bakermans C,Madsen E. Diversity of 16S rDNA and naphthalene dioxygenase genes from coal-tar-waste-contaminated aquifer waters[J]. Microb Ecol,2002,44(2):95-106 |
| [16] | 吴春敏,龚蜜. 定磷法测定复方制剂中核酸含量[J]. 中国生化药物杂志,1997,18(l):44-45 [Wu C M,Gong M. Determination of nucld acid composite prepation by phosphorus analysis[J]. Chinese Journal of Biochemical Pharmaceutics,1997,18(l):44-45(in Chinese with English abstract)] |
| [17] | 黄静,盛下放,何琳燕. 具溶磷能力的植物内生促生细菌的分离筛选及其生物多样性[J]. 微生物学报,2010,50(6):710-716 [Huang J,Sheng X F,He L Y. Biodiversity of phosphate-dissolving and plant growth-promoting endophytic bacteria of two crops[J]. Acta Microbiologica Sinica,2010,50(6):710-716(in Chinese with English abstract)] |
| [18] | 钟传青,黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J]. 土壤学报,2005,42(2):286-294 [Zhong C Q,Huang W Y. Comparison in P-solubilizing effects between different P-solubilizing microbes and variation of activities of their phosphatases[J]. Acta Pedologica Sinica,2005,42(2):286-294(in Chinese with English abstract)] |
| [19] | Hamamatsu N,Suzumura N,Nomiya Y,et al. Modified substrate specificity of pyrroloquinoline quinone glucose dehydrogenase by biased mutation assembling with optimized amino acid substitution[J]. Appl Microbiol Biotechnol,2006,73(3):600-607 |
| [20] | 王光华,赵英,杨谦. 解磷菌的研究现状与展望[J]. 生态环境,2003,12(1):99-100 [Wang G H,Zhao Y,Yang Q. Review of phosphate-solubilizing microorganisms[J]. Ecology and Environment,2003,12(1):99-100(in Chinese with English abstract)] |
| [21] | 张爱华,杨启银. 解磷细菌突变株PS-O1P菌株的选育及发酵条件的研究[J]. 安徽农业大学学报,2004,31(3):309-314 [Zhang A H,Yang Q Y. Breeding of p-decomposing strain and exploration for its fermentation condition[J]. Journal of Anhui Agricultural University,2004,31(3):309-314(in Chinese with English abstract)] |
| [22] | 赵小蓉,林启美. 微生物解磷的研究进展[J]. 土壤肥料,2001,56(3):7-11 [Zhao X R,Lin Q M. A review of phosphate dissolving microorganisms[J]. Soils and Fertilizers,2001,56(3):7-11(in Chinese with English abstract)] |
| [23] | 王小妹. 一株土生克雷伯氏杆菌(K.pneumoniae)溶磷能力的初步研究[J]. 土壤通报,2006,37(4):754-756 [Wang X M. Phosphate-dissolving ability of an isolated bacterium under pure culture condition[J]. Chinese Journal of Soil Science,2006,37(4):754-756(in Chinese with English abstract)] |
| [24] | Reyes I,Bernier L,Simard R R,et al. Effect of nitrogen source on the solubilization of different inorganic phosphates by an isolate of Penicillium rugulosum and two UV-induced mutants[J]. FEMS Microbiology Ecology,1999,28(3):281-290 |
| [25] | Seshadri S,Ignacimuthu S,Lakshminarasimhan C. Effect of nitrogen and carbon sources on the inorganic phosphate solubilizing by different Aspergillus niger strains[J]. Chemical Engineering Communications,2004,191(8):1043-1052 |
| [26] | 孙珊,黄星,范宁杰,等. 一株溶磷细菌的分离、鉴定及其溶磷特性研究[J]. 土壤,2010,42(1):117-122 [Sun S,Huang X,Fan N J,et al. Studies on phosphorus solubilizing activity of a strain isolated from corp rhizosphere[J]. Soils,2010,42(1):117-122(in Chinese with English abstract)] |
| [27] | 赵小蓉,林启美,李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报,2002,42(2):237-241 [Zhao X R,Lin Q M,Li B G. The solubilization of four insoluble phosphate by some microorganisms[J]. Acta Microbiologica Sinica,2002,42(2):237-241(in Chinese with English abstract)] |
| [28] | Hilda R,Reynaldo F. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances,1999,17(4):319-339 |
| [29] | Liu S T,Lee L Y,Tai C Y,et al. Cloning of an Erwinia herbicola gene necessary for gluconic acid production and enhanced mineral phosphate solubilization in Escherichia coli HB101[J]. Journal of Bacterialogy,1992,174(18):5814-5819 |




