文章信息
- 王玮, 朱业培, 范巧君, 孙月, 徐幸莲, 周光宏. 2015.
- WANG Wei, ZHU Yepei, FAN Qiaojun, SUN Yue, XU Xinglian, ZHOU Guanghong. 2015.
- 高静压降低食物致敏性的研究进展
- Research progress of reducing food allergenicity by high hydrostatic pressure
- 南京农业大学学报, 38(4): 525-531
- Journal of Nanjing Agricultural University, 38(4): 525-531.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.04.001
-
文章历史
- 收稿日期:2014-12-28
食物过敏通常是指食物中特异性蛋白导致机体自身免疫系统发生的变态反应,或是非毒性的食物不良反应[1]。据世界过敏组织(World Allergy Organization,WAO)统计,世界上约有2.2~2.5亿人患有食物过敏症,其中婴幼儿所占比例可达5%~8%[2]。联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)已将大豆、花生、小麦、坚果、牛奶、鱼、蛋类和甲壳类食物定义为最容易引起过敏反应的8种食物过敏原[3]。食物过敏至今尚无特效疗法,微量甚至痕量的过敏原即可造成严重的后果。要想预防和减少过敏原对消费者的不良影响,远离含有过敏原的食品不失为一种较好的方法。为此,很多国家和地区先后出台了相关的法律法规,要求明确标识食品中的过敏原成分。国际食品法典委员会(Codex Alimentarius Commission,CAC)在《预包装食品标签通则》和《为麸质不耐受的人准备的特殊膳食目的食品》中要求对于产品中所有可能引起过敏反应的配料或成分都应当给予明确标识[4]。加拿大《2003食品标签和广告指南》和《修改食品和药品条例(加强食品致敏原、麸质和添加的亚硫酸盐标签指南)》中要求对于含有过敏原的食物必须有特定的标识[4]。我国于2008年奥运会期间也编制了《奥运会食品安全食品过敏原表示标注》,首次出现对过敏原标识的要求[5]。2010年我国根据《食品安全法》规定和国务院有关部门建议,修订了现行《预包装食品中的致敏原成分》(GB/T 23779—2009),增加食品过敏原标识的要求[5]。2014年青奥会在南京圆满落幕,青奥会的成功与健康安全的食品供应也密不可分。青奥会期间,菜单上的每份菜都要求明确标识出营养信息和过敏原。
食品过敏已被世界卫生组织(World Health Organization,WHO)视为一种新的重要的食品安全问题和严重的国际性公共卫生问题。近年来,食物过敏发病率已呈现出明显上升趋势,随着食品工业的迅速发展,人们的饮食习惯和食品种类发生了巨大的变化,一些原来不是过敏体质的人群也逐渐演变成过敏性体质。由于传统的食品加工技术(油炸、蒸煮、烘焙等)均难以消除食品中的过敏原,因此开发低敏或脱敏食物的新加工技术,对于发展食品生产产业、保护消费者健康都具有重要的意义。本文重点介绍一种新型的食品脱敏技术——高静压技术(high hydrostatic pressure,HHP),阐述该技术在动植物过敏原消减方面的研究进展,以及HHP诱导下过敏原致敏性改变的结构变化机制。
1 食物过敏反应机制、高静压(HHP)技术及其脱敏机制过敏症属于炎症反应,是指当外源物质(过敏原)侵入人体时,人体免疫系统产生的过度反应。过敏原种类繁多,包括各种植物花粉、蜂毒、尘埃及各种动植物蛋白等。目前,研究者认为食物过敏原绝大多数是食物中的水溶性或盐溶性糖蛋白,相对分子质量为(10~70)×103,等电点大多在酸性范围内,倾向于耐热、耐酸和耐酶解(果蔬过敏原例外)[6]。
根据食物过敏反应发生的速度、发生机制和临床症状,可将过敏反应分为Ⅰ、Ⅱ、Ⅲ和Ⅳ型。Ⅰ型(即速发型)由免疫球蛋白E(IgE)介导;Ⅱ型(即细胞毒型)由免疫球蛋白G(IgG)、免疫球蛋白M(IgM)介导;Ⅲ型是免疫复合物型;Ⅳ型被称为迟发型或T细胞介导型[7]。典型的食物过敏主要涉及Ⅰ型超敏反应,其中IgE抗体起重要作用,其导致的过敏症状从摄入过敏原后几分钟到几小时内就会发生。过敏原进入体液后,可选择性诱导抗原特异性B细胞产生IgE抗体应答,活化浆细胞产生特异性IgE,后者与肥大细胞和嗜碱性粒细胞表面的IgE受体(FcεRI)结合,诱导细胞脱颗粒释放炎症介质(如组胺、前列腺素和白三烯等)而引发过敏反应[7]。
过敏原的致敏性、致敏稳定性及在IgE介导的过敏反应中抗原表位的确定与蛋白质结构有着重要的联系,尤其是高级结构对其致敏性起着关键的作用[8]。然而,目前根据过敏原分子结构特点及过敏反应机制的不同,主要采用热处理、辐照、超声波、酶解、基因改造等技术来降低或消除过敏原的致敏性,但以上方法中存在脱敏效果不理想,操作过程繁琐,对食品感官特性和营养成分均有不同程度破坏等弊端[9]。HHP作为一种新兴的食品非热处理技术,只作用于对生物大分子立体结构有贡献的氢键、离子键和疏水键等非共价键,使食品中的酶、蛋白质、核糖核酸和淀粉等改变活性、变性或糊化,同时杀死微生物,而食物的天然味道、风味和营养价值不受或受到很少影响[10]。据报道,HHP技术还能够控制食物过敏原的致敏性。研究者指出HHP处理可诱导过敏原蛋白变性,改变蛋白质的空间构象,促进过敏原提取或释放以及增强蛋白酶水解过敏原能力等,从而减少因肥大细胞和嗜碱性粒细胞表面过敏原特异性IgE交联而引起过敏性反应的危险,以达到脱敏效果(图 1)[9, 11]。近年来,HHP技术已经被逐渐应用于动植物等食物过敏原的脱敏技术研究。
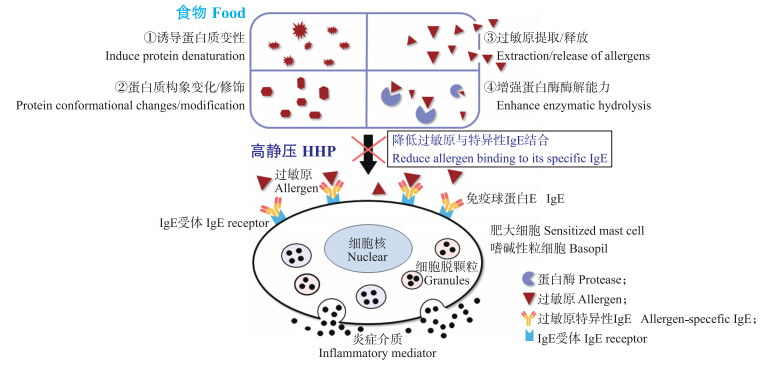 | 图 1 高静压降低食物过敏原致敏性的可能机制 Fig. 1 Possible mechanisms of high hydrostatic pressure(HHP)in reducing allergenicity of food allergens |
大米通常被认为是低致敏性的,但仍会诱发部分人群产生过敏反应。据报道,引起人体对大米过敏的过敏原主要是大米中相对分子质量约16×103的过敏蛋白,占整个胚乳蛋白的5%[12]。16×103的过敏蛋白是由半胱氨酸残基相互交联形成胱氨酸,热稳定性好且不易被酶解,但研究发现HHP对大米过敏原却有较好的脱敏效果,其机制可能是大米胚乳细胞在HHP作用下被破坏,中性盐提取液渗入到细胞里面,部分过敏原被溶解,随后释放到周围溶液中,从而降低大米过敏原的含量[13]。Kato等[14]报道,将大米置于蒸馏水中并在100~400 MPa压力下进行加压处理,当压力增至300 MPa时,大量过敏原释放出来(每克大米过敏原蛋白的释放量约为0.2~0.5 mg),并在300~400 MPa压力时,大米中蛋白质的释放量达到最大值。若将HHP技术与酶解相结合,大米中的过敏原几乎完全消失。
2.2 花生花生作为FAO报道的主要引起过敏反应的八大类食物之一,其过敏原具有较高致敏性和致死量,食物过敏人群中有10%~47%的人对花生过敏,且过敏病例数量逐年攀升,引起了医学界和食品界的广泛关注[15, 16]。花生主要过敏原是Ara h 1和Ara h 2,相对分子质量分别约为64.5×103和7.5×103,约90%的花生过敏患者对其过敏。Chung等[17]报道,花生过敏原很难被蛋白酶水解,表现出较强的难受作用,但在60~180 MPa压力下,Ara h 2致敏性降低,其蛋白质二级结构发生变化,紫外吸收强度增加,表面疏水性增强,推测蛋白质分子立体构象的改变与过敏原致敏性的降低有重要关系。
2.3 大豆大豆过敏比花生过敏的发生率要低,主要的过敏原蛋白分别为Gly m Bd 30K、Gly m Bd 28K和7S β-伴大豆球蛋白(Gly m Bd 60K),其相对分子质量分别为30×103、28×103和60×103[18, 19]。据估计,全世界将近0.5%的人口对大豆过敏[20]。Peñas等[21]报道,大豆中7S球蛋白和11S球蛋白在300~400 MPa压力下,两者均变性失活。此后他又进一步研究发现,HHP(200~300 MPa)协同蛋白酶可大幅度降低大豆过敏原蛋白Gly m1。此外,大豆蛋白的特性使其可替代牛奶成为对牛奶过敏婴儿的主要食物来源[22]。大豆分离蛋白经300 MPa压力处理15 min时,其致敏性降低了48.6%,这归因于HHP改变过敏原蛋白的二级结构,减弱了分子间的相互作用,从而提高了婴幼儿食品的安全系数[23]。
2.4 苹果苹果过敏症虽较为少见,但仍存在一定数量的过敏人群。苹果的主要过敏原为Mal d 1、Mal d 2、Mal d 3和Mal d 4[24]。Johnson等[25]报道,在温度为80 ℃的条件下,400、500、600、700和800 MPa压力分别处理10 min时,过敏原Mal d 3的α-螺旋就会展开成为自由环状结构,致敏性显著降低。Husband等[26]研究发现,在温度为20 ℃的条件下,Mal d 3经700 MPa压力处理10 min时,其致敏性降低了30%。Mal d 1对温度较为敏感,在压力、时间不变,将温度升高至115 ℃时,其致敏性降低50%。Meyer-Pittroff等[27]报道,若使患有苹果过敏症的病人每天3次服用经600 MPa压力处理的苹果片,21 d后发现通过这种系统脱敏疗法能使过敏患者产生免疫耐受性,达到脱敏目的。
2.5 芹菜芹菜是光敏性蔬菜,过量食用后,体内的光敏性物质达到一定浓度时,经过阳光照射,就容易导致光敏性物质代谢障碍,诱发植物日光性皮炎。芹菜的主要过敏原为Api g 1.01和Api g 1.02,次要过敏原为Api g 4和Api g 5[28],其引发的过敏反应会出现严重的过敏症状,并且热处理后芹菜仍会引发过敏反应[29]。据报道,芹菜过敏原Api g 1在温度为50 ℃条件下,500 MPa压力处理10 min时,过敏原结构会发生显著变化,但其致敏性却保持稳定[30]。但研究者发现HHP协同温度处理对于降低过敏原致敏性却有着积极的作用。Husband等[26]报道,在温度为118 ℃条件下,700 MPa压力处理10 min时,过敏原Api g 1的致敏性显著降低。与单纯的HHP技术相比,在协同温度的情况下,HHP对芹菜过敏原的脱敏效果更好。
3 HHP对动物性食物过敏原的影响 3.1 鱼类鱼是八大类主要过敏原之一,其引起的过敏反应较为常见。鱼类产品是仅次于花生、坚果引起IgE介导过敏反应最常见的过敏原。鱼类食品引起的过敏反应常发生于沿海人群中,但随着生活水平提高和交通运输业的发展,食用鱼类出现过敏反应的患者逐渐增多[31, 32]。对鱼的过敏不容易随着患者年龄的增长而消失,并且对鱼过敏的患者大多数不能食用其他鱼类。流行病学统计显示,全球海鲜过敏者已超过660万[33]。鱼类过敏原大部分为热稳定性、水溶性的糖蛋白,鱼类主要过敏原为小清蛋白(parvalbumin,PV),相对分子质量为12×103[34]。Liu等[35]报道,在温度为20 ℃的条件下,300 MPa压力处理60 min时,鲢鱼过敏原PV的相对分子质量和亚基组成不受影响,但过敏原的分子结构发生了一定变化,使其致敏性降低。
3.2 虾类虾是甲壳类动物中被消费量最多和范围最广的种类,因此也同样属于FAO所定义的最容易引起过敏反应的八大类食品之一,能导致严重的过敏反应。据报道美国对虾过敏的人约占总人口的0.6%~2.8%[32]。现已证实甲壳类过敏原主要是存在于肌纤维中的一种原肌球蛋白(tropomyosin,TM),相对分子质量约为(34~36)×103,等电点为4.5[36]。虾过敏原TM除具备食品过敏原的一些通性,如具有酸性等电点、水溶性、小的相对分子质量等,以及能穿透黏膜表面而容易被肌体吸收的特性外,还具有一定的热稳定性,然而HHP对于虾类过敏原却有较好的脱敏效果。董晓颖等[37]报道,虾过敏原TM经100~500 MPa压力分别处理45 min时,其相对分子质量大小未发生变化,但却能降低其致敏性,这可能是HHP不能使虾过敏原TM的四级结构发生解聚、交联或裂解,从而无法产生一些小颗粒的亚基单位或相对分子质量更大的蛋白。
3.3 牛乳牛乳及乳制品是八大类致敏食品之一。牛乳和人乳在蛋白质类型和同源性上的差异造成了人体免疫系统将牛乳蛋白判为外源异种蛋白。目前,人们了解到牛乳中有30种以上的蛋白质与过敏反应有关,包括酪蛋白、β-乳球蛋白、α-乳白蛋白等。β-乳球蛋白属于Lipocalin蛋白,是乳清中含量最多的蛋白,在鲜乳中以36×103的二聚体形式存在,其中单体由162个氨基酸残基组成。α-乳白蛋白成球状单体,相对分子质量为14.4×103,由123个氨基酸残基构成,有大约51%的牛乳过敏患者对其过敏。牛乳中的微量蛋白,如牛血清蛋白、免疫球蛋白、乳铁蛋白等也具有致敏作用[38, 39]。由于牛奶含有丰富的营养物质,可作为婴儿代替母乳的营养来源。因此,牛奶过敏在婴儿及儿童中较为常见,牛乳过敏在儿童中的发生率为0.1%~7.5%,一般是暂时性的,随着年龄的增长会自动消失。Kleber等[40]对乳清分离蛋白溶液和脱脂牛奶等富含β-乳球蛋白的溶液体系进行研究,在温度为30~68 ℃条件下,200、400和600 MPa压力分别处理30和60 min时,体系中β-乳球蛋白的致敏性随压力的升高而增加;然而,在脱脂牛奶的研究中,将样品置于室温下,600 MPa压力处理10 min时,发现其致敏性随温度增加而降低,但仍高于对照组。Mills等[41]提出以上结果可能是由于过敏原蛋白在HHP处理下分子结构展开,分子表面会产生一些新的抗原表位,原本包埋于分子内部的抗原决定簇也会暴露出来。HHP协同蛋白酶处理过敏原时,能改变蛋白质构象,暴露其免疫位点,经酶解处理后,过敏原能被更好地降解。Chicón等[42]提出,HHP可促进蛋白酶水解作用。将胰蛋白酶和胰凝乳蛋白酶加入含有β-乳球蛋白的缓冲液中后用HHP处理,过敏原与IgE的结合能力显著降低。
3.4 鸡蛋鸡蛋是FAO和WHO认定的导致人类食物过敏的八类食品之一,也是美国和欧盟食品标签法中规定必须标识的过敏原成分之一。对14岁以下的过敏人群调查发现,39%的人对鸡蛋过敏,且主要为7岁以下儿童。鸡蛋中主要过敏原为卵类黏蛋白(Gal d 1)、卵白蛋白(Gal d 2)、卵转铁蛋白(Gal d 3)和溶菌酶(Gal d 4)等,其相对分子质量分别为28×103、44.5×103、76×103和14.3×103,均可导致胃肠道的过敏反应[43]。Hildebrandt等[44]报道,将含有蛋粉的肉类产品分别进行热处理(70 ℃)和HHP处理(600 MPa,20 ℃),发现HHP处理对于过敏原致敏性的抑制作用是热处理的1.5倍;当HHP协同温度(70 ℃)处理样品时,对过敏原的抑制作用可达到热处理的8.9倍。López-Expósito等[45]还报道,HHP(400 MPa)协同胃蛋白酶处理鸡蛋蛋白,发现鸡蛋蛋白经蛋白酶水解后其IgE的免疫亲和力几乎完全被破坏,显著降低其致敏性。
3.5 肉类肉类食物引起的过敏反应虽然较为罕见,但最近研究显示,肉类食物过敏可能是一种新的重要的食品安全问题,过敏症患病率甚至高达8.2%[46]。其中,牛肉过敏尤其影响儿童的身体健康,儿童对牛肉过敏的发生率为3.3%~6.5%,约占总人口的0.3%[47]。目前,鲜有HHP降低肉类过敏原致敏性的报道,大多集中在对牛肉过敏原的脱敏研究上。现已证实引起牛肉过敏的主要过敏原是牛血清白蛋白(bovine serum albumin,BSA)和γ-球蛋白(bovine gamma globulin,BGG),其相对分子质量分别为67×103和140×103[48]。Nogami等[49]提出,采用300~600 MPa压力可降低BSA致敏性,分析认为BSA致敏性改变与其三级结构变化有关,但其二级结构不受影响。Yamamoto等[50]系统研究了HHP处理(100~600 MPa)降低BGG致敏性的机制,指出BGG经HHP处理后,蛋白质二级结构基本不变,但其三级结构却发生明显变化,导致B细胞抗原决定簇的结构发生变化,使IgE与受体难以结合,从而降低其致敏性。
4 展望随着全球化、工业化、城镇化进程不断加快,人们生活节奏、方式不断改变,生活压力不断加剧,以及食物种类、加工工艺越来越多,许多原来不过敏的人群逐渐演变成过敏性体质,潜在过敏人群不断扩大;同时,随着现代环境卫生条件的改善,儿童尤其是新生儿期发生感染及暴露于微生物的概率逐渐降低,引起机体免疫系统发育不成熟,出现免疫系统紊乱,从而导致食物过敏性疾病发生率呈逐年上升趋势。食物过敏已经成为全世界关注的公共卫生热点问题,而且这个问题正呈现出逐渐扩大的趋势。尽管当前对食物过敏原的研究主要集中在对过敏原成分的鉴定和检测上[51, 52, 53, 54],但对食物过敏原致敏性与其结构关系的研究却是建立高效、精确的食物过敏原检测技术的基础,也是研制低敏或脱敏食物的基础。HHP作为食品加工领域的一项新技术,在食物脱敏的研究方面已经展现出其巨大的潜力。HHP技术通过使过敏原蛋白变性、诱导蛋白构象变化、改变抗原表位等机制,在降低甚至是消除食物过敏原致敏性同时,最大程度地保留了食品原有的风味及营养物质,保持了食物的原有品质。因此,HHP技术有望为低敏或脱敏食物的开发提供一条新的探索途径,并展现出巨大的潜力。
| [1] | El-Agamy E I. The challenge of cow milk protein allergy[J]. Small Ruminant Research,2007,68(1):64-72 |
| [2] | Fiocchi A,Sampson H A,Bahna S L,et al. Food allergy[M]//Pawankar R,Canonica G W,Holgate S T,et al. WAO White Book on Allergy. Milwaukee,Wis:World Allergy Organization,2011:47-53 |
| [3] | Paschke A,Ulberth F. Allergens in foods[J]. Analytical and Bioanalytical Chemistry,2009,395:15-16 |
| [4] | 王文枝,温焕斌,靳淑敏,等. 世界各国食品过敏原种类及标识情况概述[J]. 食品工业科技,2011,32(4):419-422 [Wang W Z,Wen H B,Jin S M,et al. Summary of food allergens and labelling in various countries[J]. Science and Technology of Food Industry,2011,32(4):419-422(in Chinese with English abstract)] |
| [5] | 陈颖,王玮. 食物过敏原检测方法研究进展[J]. 检验检疫学刊,2011,21(3):4-19 [Chen Y,Wang W. Overview of the detection methods for food allergen[J]. Journal of Inspection and Quarntine,2011,21(3):4-19(in Chinese with English abstract)] |
| [6] | Lucas J S,Cochrane S A,Warner J O,et al. The effect of digestion and pH on the allergenicity of kiwifruit proteins[J]. Pediatric Allergy and Immunology,2008,19(5):392-398 |
| [7] | 陈红兵,高金燕. 食物过敏反应及其机制[J]. 营养学报,2007,29(2):105-109 [Chen H B,Gao J Y. Food allergy and its mechanism[J]. Journal of Nutrition,2007,29(2):105-109(in Chinese)] |
| [8] | 李欣,陈红兵. 食物过敏原构象性表位鉴别的研究进展[J]. 食品科学,2012,33(17):279-283 [Li X,Chen H B. Research progress in conformational epitopemapping approaches for food allergens[J]. Food Science,2012,33(17):279-283(in Chinese with English abstract)] |
| [9] | Huang H W,Hsu C P,Yang B B,et al. Potential utility of high-pressure processing to address the risk of food allergen concerns[J]. Comprehensive Reviews in Food Science and Food Safety,2014,13(1):78-90 |
| [10] | Choi L H,Nielsen S S. The effects of thermal and nonthermal processing methods on apple cider quality and consumer acceptability[J]. Journal of Food Quality,2005,28(1):13-29 |
| [11] | Taylor S L,Hefle S L. Food allergies and other food sensitivities[J]. Food Technology,2001,55(9):68-83 |
| [12] | Adachi T,Alvarez A M,Aoki N,et al. Screening of rice strains deficient in 16-kDa allergenic protein[J]. Bioscience,Biotechnology,and Biochemistry,1995,59(7):1377-1378 |
| [13] | 王文高,陈正行. 低过敏大米研究进展[J]. 粮食与油脂,2001(5):32-33 [Wang W G,Chen Z H. Advance of hypoallergenic rice[J]. Cereals and Oils,2001(5):32-33(in Chinese with English abstract)] |
| [14] | Kato T,Katayama E,Matsubara S,et al. Release of allergic proteins from rice grains induced by high hydrostatic pressure[J]. Journal of Agricultural and Food Chemistry,2000,48(8):3124-3126 |
| [15] | Sun X,Jia M,Ji J,et al. Enzymatic amplification detection of peanut allergen Ara h1 using a stem-loop DNA biosensor modified with a chitosan-mutiwalled carbon nanotube nanocomposite and spongy gold film[J]. Talanta,2015,131:521-527 |
| [16] | Sicherer S H,Muñoz-Furlong A,Sampson H A. Prevalence of peanut and tree nut allergy in the United States determined by means of a random digit dial telephone survey:a 5-year follow-up study[J]. Journal of Allergy and Clinical Immunology,2003,112(6):1203-1207 |
| [17] | Chung S Y,Kato Y,Champagne E T. Polyphenol oxidase/caffeic acid may reduce the allergenic properties of peanut allergens[J]. Journal of Agricultural and Food Chemistry,2005,85(15):2631-2637 |
| [18] | Helm R M,Cockrell G,Connaughton C,et al. Mutational analysis of the IgE-binding epitopes of P34/Gly m Bd 30K[J]. Journal of Allergy and Clinical Immunology,2000,105(2):378-384 |
| [19] | Mujoo R,Trinh D,Ng P K. Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J]. Food Chemistry,2003,82(2):265-273 |
| [20] | Besler M,Steinhart H,Paschke A. Stability of food allergens and allergenicity of processed foods[J]. Journal of Chromatography B:Biomedical Sciences and Applications,2001,756(2):207-228 |
| [21] | Peñas E,Gomez R,Frias J,et al. High hydrostatic pressure effects on immunoreactivity and nutritional quality of soybean products[J]. Food Chemistry,2011,125(2):423-429 |
| [22] | El-Agamy E I. The challenge of cow milk protein allergy[J]. Small Ruminant Research,2007,68(1):64-72 |
| [23] | Li H,Zhu K,Zhou H,Peng W. Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soybean protein isolate for infant formula[J]. Food Chemistry,2012,132(2):808-814 |
| [24] | Pagliarani G,Paris R,Tartarini S,et al. Cloning and expression of the major allergen genes in apple fruit[J]. Journal of Horticultural Science and Biotechnology,2009(Special issue):176-181 |
| [25] | Johnson P E,van der Plancken I,Balasa A,et al. High pressure,thermal and pulsed electric-field-induced structural changes in selected food allergens[J]. Molecular Nutrition and Food Research,2010,54(12):1701-1710 |
| [26] | Husband F A,Aldick T,van der Plancken I,et al. High-pressure treatment reduces the immunoreactivity of the major allergens in apple and celeriac[J]. Molecular Nutrition and Food Research,2011,55(7):1087-1095 |
| [27] | Meyer-Pittroff R,Behrendt H,Ring J. Specific immuno-modulation and therapy by means of high pressure treated allergens[J]. High Pressure Research,2007,27(1):63-67 |
| [28] | Wangorsch A,Ballmer-Weber B K,Rösch P,et al. Mutational epitope analysis and cross-reactivity of two isoforms of Api g 1,the major celery allergen[J]. Molecular Immunology,2007,44(10):2518-2527 |
| [29] | Ballmer-Weber B K,Hoffmann A,Wüthrich B,et al. Influence of food processing on the allergenicity of celery:DBPCFC with celery spice and cooked celery in patients with celery allergy[J]. Allergy,2002,57(3):228-235 |
| [30] | Houska M,Kminkova M,Strohalm J,et al. Allergenicity of main celery allergen rApi g1 and high-pressure treatment[J]. High Pressure Research,2009,29(4):686-694 |
| [31] | Kobayashi A,Tanaka H,Hamada Y,et al. Comparison of allergenicity and allergens between fish white and dark muscles[J]. Allergy,2006,61(3):357-363 |
| [32] | van Do T,Elsayed S,Florvaag E,et al. Allergy to fish parvalbumins:studies on the crossreactivity of allergens from 9 commonly consumed fish[J]. Journal of Allergy and Clinical Immunology,2005,116(6):1314-1320 |
| [33] | Sicherer S H,Muñoz-Furlong A,Sampson H A. Prevalence of seafood allergy in the United States determined by a random telephone survey[J]. Journal of Allergy and Clinical Immunology,2004,114(1):159-165 |
| [34] | Beale J E,Jeebhay M F,Lopata A L. Characterisation of purified parvalbumin from five fish species and nucleotide sequencing of this major allergen from Pacific pilchard,Sardinops sagax[J]. Molecular Immunology,2009,46(15):2985-2993 |
| [35] | Liu R,Xue W T. High-pressure treatment with silver carp(Hypophthalmichthys molitrix)protein and its allergic analysis[J]. High Pressure Research,2010,30(3):438-442 |
| [36] | Motoyama K,Suma Y,Ishizaki S,et al. Identification of tropomyosins as major allergens in antarctic krill and mantis shrimp and their amino acid sequence characteristics[J]. Marine Biotechnology,2008,10(6):709-718 |
| [37] | 董晓颖,高美须,潘家荣,等. 不同处理方法对虾过敏蛋白分子质量及抗原性的影响[J]. 核农学报,2010,24(3):548-554 [Dong X Y,Gao M X,Pan J R,et al. Effects of different treatments on molecular weight and antigenicity of shrimp allergenic protein[J]. Journal of Nuclear Agricultural Sciences,2010,24(3):548-554(in Chinese with English abstract)] |
| [38] | Monaci L,Tregoat V,van Hengel A J,et al. Milk allergens,their characteristics and their detection in food:a review[J]. European Food Research and Technology,2006,223(2):149-179 |
| [39] | Kaiser C,Reibisch H,Fölster-Holst R,et al. Cow's milk protein allergy-results of skin-prick test with purified milk proteins[J]. Zeitschrift für Ernährungswissenschaft,1990,29(2):122-128 |
| [40] | Kleber N,Maier S,Hinrichs J. Antigenic response of bovine β-lactoglobulin influenced by ultra-high pressure treatment and temperature[J]. Innovative Food Science and Emerging Technologies,2007,8(1):39-45 |
| [41] | Mills E N C,Mackie A R. The impact of processing on allergenicity of food[J]. Current Opinion in Allergy and Clinical Immunology,2008,8(3):249-253 |
| [42] | Chicón R,Belloque J,Alonso E,et al. Hydrolysis under high hydrostatic pressure as a means to reduce the binding of β-lactoglobulin to immunoglobulin E from human sera[J]. Journal of Food Protection,2008,71(7):1453-1459 |
| [43] | 佟平,高金燕,陈红兵. 鸡蛋清中主要过敏原的研究进展[J]. 食品科学,2007,28(8):565-568 [Tong P,Gao J Y,Chen H B. Research progress of major egg white allergens[J]. Food Science,2007,28(8):565-568(in Chinese with English abstract)] |
| [44] | Hildebrandt S,Schütte L,Stoyanov S,et al. In vitro determination of the allergenic potential of egg white in processed meat[J]. Journal of Allergy,2010,2010:1155-1159 |
| [45] | López-Expósito I,Chicon R,Belloque J,et al. Changes in the ovalbumin proteolysis profile by high pressure and its effect on IgG and IgE binding[J]. Journal of Agricultural and Food Chemistry,2008,56(24):11809-11816 |
| [46] | Klug C,Focke M,Hemmer W,et al. Identification and characterization of meat allergens for improved diagnosis of meat allergy[J]. Clinical and Translational Allergy,2013,3(3):174 |
| [47] | Fiocchi A,Restani P,Riva E. Beef allergy in children[J]. Nutrition,2000,16(6):454-457 |
| [48] | Fuentes Aparicio V,Sánchez Marcén I,Pérez Montero A,et al. Allergy to mammal's meat in adult life:immunologic and follow-up study[J]. Journal of Investigational Allergology and Clinical Immunology,2005,15(3):228-231 |
| [49] | Nogami N,Matsuno M,Hara T,et al. Elimination of the allergenicity of food protein by high pressure[J]. Review of High Pressure Science and Technology,2006,16(1):11-16 |
| [50] | Yamamoto S,Mikami N,Matsuno M,et al. Effects of a high-pressure treatment on bovine gamma globulin and its reduction in allergenicity[J]. Bioscience,Biotechnology,and Biochemistry,2010,74(3):525-530 |
| [51] | 王玮,韩建勋,袁飞,等. 多重PCR同时检测常见8种食物过敏原[J]. 中国食品学报,2011,11(6):152-157 [Wang W,Han J X,Yuan F,et al. Detection of eight food allergens with multiplex PCR[J]. Journal of Chinese Institute of Food Science and Technology,2011,11(6):152-157(in Chinese with English abstract)] |
| [52] | Wang W,Qi C,Kang T F,et al. Analysis of interaction between tropomyosin allergen and antibody using a biosensor based on imaging ellipsometry[J]. Analytical Chemistry,2013,85(9):4446-4452 |
| [53] | Wang W,Han J X,Wu Y J,et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agricultural and Food Chemistry,2011,59(13):6889-6894 |
| [54] | Wang W,Li Y Y,Zhao F Y,et al. Optical thin-film biochips for multiplex detection of eight allergens in food[J]. Food Research International,2011,44(10):3229-3234 |




