文章信息
- 黄雨薇, 叶元土, 蔡春芳, 刘汉超, 陈科全, 张宝彤, 萧培珍, 彭侃, 徐登辉. 2015.
- HUANG Yuwei, YE Yuantu, CAI Chunfang, LIU Hanchao, CHEN Kequan, ZHANG Baotong, XIAO Peizhen, PENG Kan, XU Denghui. 2015.
- 肠道损伤对草鱼胆固醇代谢通路基因表达的影响
- The effect of the gene expression in metabolism of cholesterol synthesis pathway after intestine injuried on Ctenopharyngodon idellus
- 南京农业大学学报, 38(3): 497-503
- Journal of Nanjing Agricultural University, 38(3): 497-503.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.022
-
文章历史
- 收稿日期:2014-06-18
2. 北京营养源研究所/水产动物系统营养研究开放实验室, 北京 100000
2. Beijing Institute of Nutrition Source/Aquatic Animal Nutrition Research Laboratory of Systems, Beijing 100000, China
胆固醇作为广泛存在于动物机体内的一种脂质分子,它不仅构成细胞膜的磷脂双分子层,还是合成类固醇激素、维生素D等生理活性物质的前体物,也是胆汁酸生物合成的原料[1, 2]。胆汁酸对于促进肠道对脂类物质的消化、吸收等方面具有重要作用。因此,保证动物组织细胞中胆固醇的供给和维持胆固醇在机体内的代谢平衡十分重要。在乙酰辅酶A→胆固醇的生物合成途径中[3],胆固醇的合成速度和合成量主要受到3-羟基-3-甲基辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMGCR)、甲羟戊酸激酶(farnesyl diphosphate synthase,MVK)、甲羟戊酸脱羧酶(diphospho mevalonate decarboxylase,MVD)、异戊二烯基二磷酸δ-异构酶(lisopentenyl-diphosphate delta-isomerase 1,IDI1)、法尼基二磷酸合成酶(farnesyl diphosphate synthase,FDPS)、羊毛甾醇合成酶(lanosterol synthase,LSS)、固醇调节元件结合蛋白裂解激活蛋白样(sterol regulatory element-binding protein cleavage-activating diphosphate synthase-like,SCAP)、甲羟戊酸脱羧酶(diphospho mevalonate decarboxylase,MVD)、异戊二烯基二磷酸δ-异构酶(lisopentenyl-diphosphate delta-isomerase 1,IDI1)、法尼基二磷酸合成酶(farnesyl diphosphate synthase,FDPS)、羊毛甾醇合成酶(lanosterol synthase,LSS)、血浆胆固醇酯转移蛋白(cholesteryl ester transfer protein,CETP)这8种酶的活性调节和胆固醇量的反馈调节。而以胆固醇为原料的胆汁酸合成代谢途径中[4],胆固醇7α羟化酶(cholesterol 7alpha-hydroxylase,CYP7A1)、固醇26-羟化酶(sterol 26-hydroxylase,CYP27A1)和法尼醇X受体(farnesoid X receptor,FXR)这3种酶在胆汁酸的合成途径上发挥着重要作用。目前,关于胆固醇代谢相关酶基因的研究主要集中在2个限速酶HMGCR[5]、CYP7A1[6]和少数几个调控酶如CETP[7]、FXR[8]上,对胆固醇代谢的整个基因通路缺少系统性研究。
草鱼(Ctenopharyngodon idellus)作为典型的草食性鱼类,是中国淡水养殖的四大家鱼之一,肠道作为其主要的消化吸收器官,在维持鱼体生理健康上发挥着重要作用。在我们前期对草鱼灌喂氧化鱼油、对肠道转录组分析的试验中发现,肠道黏膜组织中合成胆固醇的基因显著上调,表明胆固醇在肠道损伤的情况下是非常需要的,暗示胆固醇在草鱼肠道氧化损伤作用下可能具有我们目前还未知的重要作用。在豆粕替代鱼粉对鱼类胆固醇代谢的研究中发现,豆粕中的抗营养因子很可能通过破坏肠道对胆固醇、胆汁酸重吸收的方式影响机体胆固醇的合成与代谢[9]。这些研究结果显示,草鱼的肠道健康与胆固醇、胆汁酸的生物合成具有重要的关系,但目前关于肠道损伤对胆固醇代谢影响的研究相对匮乏。
本试验在对草鱼肠道损伤状况进行评价的基础上,从实际养殖生产中选取出肠道健康草鱼和肠道损伤草鱼,采用qRT-PCR方法,定量检测了肝胰脏和肠道中11种与胆固醇合成、分解、调节相关酶基因表达水平的差异,并结合血清生化指标,初步探讨草鱼肠道损伤对胆固醇代谢通路基因表达的影响,为阐明肠道损伤而导致胆固醇代谢变化的机制研究奠定基础。 1 材料与方法
1.1 试验鱼
养殖草鱼取自江苏省大丰市华辰渔业合作社,为常规生产性养殖池塘,采用草鱼、鲫鱼混养模式。取样期间养殖池塘水温(25±2)℃,溶解氧不小于3.5 mg · L-1,氨氮小于0.6 mg · L-1,亚硝酸盐小于0.2 mg · L-1,pH 7.5左右。试验鱼体质量(100±10)g,摄食普通配合饲料,采用投饵机投喂,正常情况每天投喂4次。采样时间为7至9月份。每次在固定时间的池塘饲料投喂台附近用手撒网捕捞,每月随机采集15条草鱼样本。 1.2 血清样品制备和分析
用一次性无菌注射器进行尾静脉采血,常温下放置0.5 h,待析出血清后,3 000 r · min-1离心10 min,取上层血清转入PT离心管中密封,液氮速冻后-80 ℃保存备用。血清甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆汁酸(TBA)和总胆固醇(TC)采用雅培C800全自动生化分析仪测定;血清二胺氧化酶(DAO)活性用二胺氧化酶试剂盒(南京建成科技有限公司)测定。 1.3 肠道组织切片的制备和观察
将鱼活体解剖,迅速取出肠道,从肠道自然卷曲的第一个拐点到最后一个拐点间肠段的1/2处,取一段1~2 cm肠管,剔除脂肪,用生理盐水冲洗后,于波恩试液中固定,作为冰冻组织切片样品。采用HE染色,中性树胶封片后,在油镜下进行观察和拍照。 1.4 肝胰脏、肠黏膜基因样品的采集
在肝胰脏中间部分取长1 cm、厚0.5 cm的一块组织置于冰上,用PBS清洗干净后装于EP管中,液氮速冻后-80 ℃保存备用。
从中肠起始处向后截取一段3~4 cm的肠道置于冰上,剪开侧面,用PBS清洗干净,刮取肠黏膜于EP管中,液氮速冻后-80 ℃保存备用。 1.5 样品的筛选
通过肠道的外观形态、中肠的组织切片观察结果初步筛选出肠道健康和肠道损伤的草鱼,然后通过血清二胺氧化酶活力指标最终筛选出肠道健康和肠道损伤的草鱼。
1.6 胆固醇、胆汁酸合成调控相关酶基因的表达
对筛选出的草鱼肝胰脏和中肠组织提取总RNA,将反转录得到的cDNA分别稀释至适当浓度后作为荧光定量PCR反应模板。
根据本实验室草鱼肠道转录组测序结果[10],运用Prime Premier 5.0软件设计了参与胆固醇合成的一系列酶基因和内参基因β-actin(GenBank登录号:DQ211096)的荧光定量正、反向引物(表 1)。反应体系为20 μL:SYBR Premix Ex TaqTM Ⅱ(TaKaRa)10 μL,候选引物各1 μL,cDNA 2 μL,灭菌水6 μL。PCR反应采用两步法,反应条件为:95 ℃预变性30 s、95 ℃变性5 s、60 ℃退火30 s,共40个循环,最后进行熔解曲线分析。用CFX96荧光定量PCR仪和SYBR Premix Ex TaqTM Ⅱ(TaKaRa)荧光染料进行荧光定量,用比较阈值法进行测定。健康组和损伤组各7尾鱼作为样本。
|
基因名称
Gene name |
引物对序列(5′→3′)
Primer pairs sequence(5′→3′) |
| FDPS | GATTGGTTCTTTACGGGAGTTG/CCCCTTCTTGTCACGGATG |
| HMGCR | CATCAGTGTCCCAAAGTACAAGAG/CGGCAGAGCGTCATTCAGT |
| LSS | CTGTCCGCCGATGAAGAT/TAAGCGATAGTAAGCAGGGTG |
| MVD | GTTGTGGTGCCCTGTCGT/ATATGGGTGGGTAGGTGTCC |
| SCAP | GGTTGCGTGTCATTTTGGG/CCTTGGGGCTGGTGTTT |
| MVK | ACGGGCATTTCAGATGATTC/GGGCAACTCCGACCACA |
| IDI1 | GCCACCTCAACGCAAACA/AAGCAGCCTGGAAAAGTGAT |
| CETP | TCCTCGCCTTTAACATTGAACC/CCTCCCAACTGACTGAGAACC |
| CYP7A1 | CAACAACCAGGACCAAACAA/GCTGAGGATAAAGAGCAACG |
| CYP27A1 | CCATTACCAGGGACAACAGG/CAAATAAAGAGCAGCCGAAC |
| FXR | AGTCTTGCCCTGTAGTCCCG/CAGTTCCTCGCCTTTGCT |
| β-actin | CGTGACATCAAGGAGAAG/GAGTTGAAGGTGGTCTCAT |
根据各基因的CT值计算扩增效率和分析熔解曲线,以确定模板和引物达到用荧光定量检测组织相对表达量的要求。用2-ΔΔCT法计算出草鱼肠道和肝胰脏组织FDPS、LSS、MVK、MVD、IDI 1、HMGCR、CETP、SCAP、CYP7A1、CYP27A1 、FXR与内参基因β-actin的相对表达丰度。每个样品重复3次后取平均值。通过SPSS 21.0进行One-way ANOVA分析,并进行LSD与Duncan′s多重比较,数据结果均以平均值±标准差(x±SD)表示。 2 结果与分析
2.1 肠道的形态变化和组织切片观察
通过对草鱼肠道形态观察发现,正常的肠道形态完整且充满食糜,剖开肠道后,肠黏膜色泽明亮(图 1-A);损伤的肠道整体红肿,肠道前段(即第1个拐弯处)已充血发炎,局部出现糜烂且几乎无食糜,剖开肠道可见黏膜淤血、水肿甚至化脓(图 1-B)
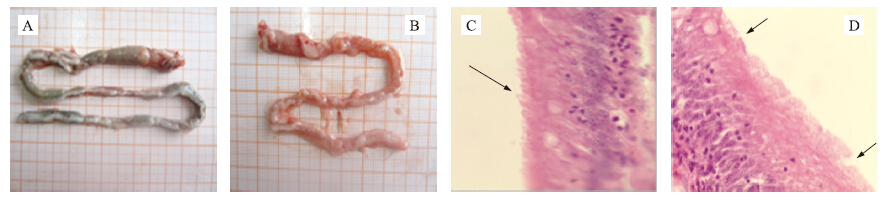 |
图 1 正常和损伤肠道外观形态(A、B)和肠道组织形态(C、D) Fig. 1 Normal and damaged intestinal morphology diagram(A,B)and intestinal tissue morphology(C,D)
A、C.正常肠道Normal intestine;B、D.损伤肠道Damaged intestine 箭头示肠微绒毛疏松,局部脱落。The arrows indicate the intestinal microvilli loose,partial loss. |
草鱼肠道组织结构分为黏膜层、黏膜下层、肌层和浆膜,黏膜层作为与肠腔直接接触的部位,决定着肠道的主要机能。黏膜层绒毛结构的完整性和微绒毛的数量经常作为判断肠道损伤的一个重要指标。
草鱼中肠的组织切片见图 1-C、D。正常的肠道,肠段黏膜微绒毛排列整齐,密度均匀(图 1-C);损伤的肠道,肠黏膜微绒毛分布不规整,密度不均,长短不一,多处微绒毛断裂(图 1-D)。通过对草鱼肠道的形态学和组织学观察,初步筛选出了肠道健康和肠道损伤草鱼各7尾。 2.2 血清二胺氧化酶(DAO)活性变化
DAO是特异性存在于肠黏膜上皮细胞胞质中的细胞内酶,当肠黏膜上皮细胞受损后才会被释放进入血液循环。通常血清中DAO活性的变化可作为判断肠道通透性改变的一个重要生化指标。
本试验结果(图 2)显示:肠道损伤草鱼血清中DAO活性显著高于肠道健康草鱼(P < 0.05),从而将初步筛选的7尾肠道健康草鱼和7尾肠道损伤草鱼确定为最终试验样本。
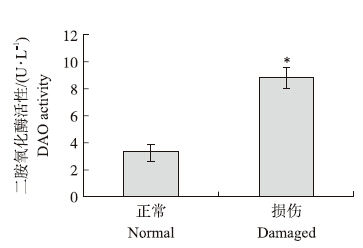 | 图 2 血清二胺氧化酶活性变化(*P < 0.05) Fig. 2 Changes of diomine oxidase(DAO) activity in serum |
采用qRT-PCR检测了肠道正常和损伤草鱼的肝胰脏、肠道中11个胆固醇合成代谢相关酶基因表达水平(表 2、3)。结果显示:参与胆固醇合成代谢的一系列酶在肝胰脏和肠道中都有表达,肝胰脏中的基因表达量明显多于肠道;在肠道损伤后,肝胰脏的6个胆固醇合成酶基因HMGCR、MVD、MVK、IDI 1 、FDPS、LSS和2个胆汁酸合成酶基因CYP 7A1、CYP27A1 的mRNA都出现了显著上调(P < 0.01),而参与胆固醇逆转运途径的转运蛋白CETP和胆汁酸调节元件FXR出现了极显著下调(P < 0.01),各基因的变化倍数为-0.94~67.54;而肠道组织除了HMGCR和MVK没有显著差异外,其他酶基因的变化和肝胰脏的情况一致,都出现了极显著差异(P < 0.01),各基因的变化倍数为-0.91~12.05。
| 基因
Gene |
肝胰脏Liver | 肠道Intestine | ||||
| 正常
Normal |
损伤
Damaged |
变化倍数
Fold change |
正常
Normal |
损伤
Damaged |
变化倍数
Fold change |
|
| CETP | 0.413 0±0.057 9 | 0.026 5±0.007 1 ** | -0.94 | 0.000 5±0.000 03 | 0.000 07±0.000 01 ** | -0.86 |
| SCAP | 0.002 1±0.000 3 | 0.002 4±0.000 4 | 0.14 | 0.000 7±0.000 30 | 0.000 80±0.000 10 | 0.14 |
| FXR | 0.033 2±0.011 3 | 0.010 1±0.003 4 ** | -0.70 | 0.008 9±0.002 50 | 0.000 80±0.000 10 ** | -0.91 |
| 注:变化倍数=(损伤组的数值-正常组的数值)/正常组的数值。
Note:Fold change=(the value of damage group-the value of normal group)/the value of normal group.The same as follows. | ||||||
| 基因
Gene |
肝胰脏Liver | 肠道Intestine | ||||
| 正常
Normal |
损伤
Damaged |
变化倍数
Fold change |
正常
Normal |
损伤
Damaged |
变化倍数
Fold change |
|
| HMGCR | 0.001 2±0.000 5 | 0.054 6±0.005 3 ** | 44.50 | 0.000 200±0.000 100 | 0.000 600±0.000 200 | 2.00 |
| MVK | 0.001 5±0.000 6 | 0.030 6±0.006 1 ** | 19.40 | 0.000 300±0.000 100 | 0.000 400±0.000 100 | 0.33 |
| MVD | 0.051 7±0.026 7 | 0.597 2±0.090 7 ** | 10.55 | 0.002 100±0.000 900 | 0.011 700±0.001 800 ** | 4.57 |
| IDI1 | 0.023 9±0.013 0 | 1.638 0±0.140 3 ** | 67.54 | 0.002 200±0.001 000 | 0.028 700±0.005 700 ** | 12.05 |
| FDPS | 0.037 7±0.009 7 | 0.586 7±0.067 2 ** | 14.56 | 0.001 000±0.000 200 | 0.003 900±0.000 900 * | 2.90 |
| LSS | 0.003 6±0.000 7 | 0.237 8±0.016 2 ** | 65.06 | 0.000 100±0.000 010 | 0.000 333±0.000 083 * | 2.33 |
| CYP7A1 | 0.001 9±0.000 7 | 0.018 6±0.008 0 ** | 8.79 | 0.000 003±0.000 001 | 0.000 030±0.000 010 ** | 9.00 |
| CYP27A1 | 0.049 7±0.012 1 | 0.334 4±0.066 2 ** | 5.73 | 0.001 400±0.000 200 | 0.005 400±0.025 000 * | 2.86 |
与肠道正常的草鱼相比,肠道损伤的草鱼血清中HDL、LDL、TC和TBA的含量均显著下降(P < 0.05),而TG的含量无显著变化(表 4)。
| mmol · L-1 | |||||
| 组别Groups | 甘油三酯TG | 高密度脂蛋白HDL | 低密度脂蛋白LDL | 总胆汁酸TBA | 总胆固醇TC |
| 正常肠道组Normal intestine group | 3.53±0.15 | 1.78±0.03 | 1.68±0.11 | 6.53±1.15 | 5.15±0.16 |
| 损伤肠道组Damaged intestine group | 3.37±0.21 | 1.59±0.03 * | 0.34±0.05 * | 0.51±0.11 * | 2.97±0.09 * |
| Note:TG:Triglyceride;HDL:High density lipoprotein;LDL:Low density lipoprotein;TBA:Total bile acid;TC:Total cholesterol | |||||
3.1 肠道损伤对草鱼肝胰脏和肠道的胆固醇合成能力的影响
对于一个细胞而言,胆固醇合成量,细胞外胆固醇逆转运进入细胞内的量,细胞内胆固醇向细胞外转运量三方面的协调是维持细胞内胆固醇稳定状态的基础。
肝胰脏和肠道是合成胆固醇的主要器官组织,胆固醇合成的原料为乙酰CoA,经过一系列酶促反应合成胆固醇。在此过程中,主要涉及到HMGCR、MVK、MVD、IDI、LSSF、FDPS 6个胆固醇合成酶和CETP、SCAP 2个调节控制酶。其中,胆固醇合成限速酶HMGCR[11]、调节控制酶SCAP[12]和CETP[13]在胆固醇的合成过程中起着至关重要的作用。
HMGCR是所有脊椎动物合成内源胆固醇的关键限速酶,其活性的高低决定了胆固醇的合成速度,并受胆固醇的反馈抑制[14]。郭少晨等[15]的研究发现,不同剂量的普洱茶会通过抑制大鼠HMGCR的表达和活性而减少胆固醇的合成量。汉雪梅等[9]在豆粕替代鱼粉对鱼类胆固醇代谢影响的研究进展中表明,高豆粕基础饲料中添加适量的外源胆固醇会显著降低HMGCR的活性,从而导致内源胆固醇合成的减少。本试验中,草鱼肠道损伤后,胆固醇合成关键限速酶HMGCR和其他胆固醇合成酶FDPS、LSS、MVK、MVD、IDI1的基因表达量都显著上调,表明肠道损伤增强了肝胰脏和肠道的内源胆固醇合成能力。
通过胆固醇的逆转运途径,可以将细胞外的胆固醇转运至细胞内,从而补充内源胆固醇合成的不足,其间依赖SCAP的调节和CETP的转运[16]。SCAP具有和HMGCR相似的胆固醇敏感区,通过与细胞内的固醇反应元件结合蛋白(sterol regulatory element-binding protein,SREBP)形成SCAP-SREBP复合物对胆固醇的转录水平进行调控。当细胞内胆固醇水平减少时,内质网上SCAP-SREBP复合物的固醇敏感区能感受到这一变化,SCAP通过护送SCAP-SREBP复合物进入高尔基复合体的方式间接促进HMGCR的转录;相反,当细胞内胆固醇水平升高时,SCAP的固醇敏感区会和胆固醇结合,通过阻止SCAP-SREBP复合物进入高尔基复合体的方式调节胞内胆固醇水平[17]。胆固醇脂转运蛋白CETP是一种重要的脂质转运蛋白,能将外周组织细胞膜上游离胆固醇的酯化产物胆固醇酯转移到肝细胞表面的LDL、HLDL受体上,以补充内源胆固醇合成的不足[18]。本试验中,CETP的基因表达水平在肝胰脏和肠道中分别下调了0.94和0.86倍,差异极显著(P < 0.01),而SCAP的基因表达水平无显著差异,可能与其还参与激活HMGCR有关。
本试验结果表明,草鱼肠道损伤后,肝胰脏和肠道的内源胆固醇合成能力得到显著增强,而通过CETP向外周组织胆固醇的转运能力下降,以保持细胞内胆固醇的动态平衡。 3.2 肠道损伤后,草鱼肝胰脏和肠道的胆汁酸合成能力加强
以胆固醇为原料合成胆汁酸是胆固醇主要代谢途径之一[19]。胆汁酸合成有“经典”和“替代”两条途径,前者合成占70%以上[20]。而经典途径中主要涉及到胆汁酸合成酶CYP7A1、CYP27A1和负调控酶FXR的参与。
CYP7A1是胆汁酸经典合成途径的限速酶,它的表达量和活性对胆汁酸的合成起着制约作用[21]。研究发现,在人原代肝细胞中转染CYP 7A1 基因22 h后,胆汁酸合成速率增加73%,48 h后增加393%[22]。FXR是核受体超家族成员之一,可以通过与胆汁酸直接结合的方式调节胆汁酸代谢,维持胆汁酸稳态平衡[23]。另外,CYP 7A1 也是FXR的主要靶基因之一,可以通过抑制CYP 7A1 的转录,减少胆汁酸的合成[24]。Cai等[25]用基因沉默法,敲除FXR后,CYP 7A1 的表达随之增加。在人原代肝细胞中,FXR可以通过促进FGF 19来抑制CYP7A1 [26]。
本试验中,在肠道损伤后,CYP 7A1、CYP27A1 基因表达水平显著上调,FXR的基因表达水平显著下调(P < 0.01),其中,CYP 7A1 在肝胰脏和肠道中分别上调了8.79和9.00倍,而FXR在肝胰脏和肠道中分别下调了-0.70和-0.91倍,结果表明,肠道损伤增强了肝胰脏和肠道的胆汁酸合成能力。 3.3 肠道损伤对草鱼血清脂质代谢相关指标的影响
血浆中的胆固醇大部分是以胆固醇酯的形式存在,当细胞内胆固醇的自身合成不足时,外周组织的胆固醇与高密度脂蛋白(high low-density lipoprotein,HLDL)结合经酯化后通过CETP转移给低密度脂蛋白(low density lipoprotein,LDL)运送到肝内予以补充。血浆中大部分胆固醇被LDL运送,由于LDL能同溶酶体融合发生降解,携带的胆固醇及其衍生物会从溶酶体中释放出来,抑制HMGCR酶活性[27, 28]。本试验中,肠道损伤后,草鱼血清中HDL、LDL、TC和TBA的含量显著下调(P < 0.05),也是草鱼肝胰脏和肠道的胆固醇、胆汁酸合成能力增强的另一原因。 3.4 肠道损伤对胆固醇代谢的影响
肠道作为草鱼主要的消化吸收器官,在维持鱼体生理健康上发挥着重要作用。在肠道中,日粮中的胆固醇、内源性胆固醇、胆酸盐和其他酯溶性物质一起被吸收,在肠绒毛细胞中与载脂蛋白形成脂蛋白微粒[29]。Kortner等[30]报道,随着大西洋鲑摄食豆粕日粮时间的延长,其血液中胆固醇及胆汁酸含量逐渐降低,而肝脏中的HMGCR和CYP 7A1 基因编码上调。由此推测,豆粕日粮对大西洋鲑胆固醇含量的影响可能是因为豆粕中抗营养因子破坏了胆固醇重吸收的主要器官——小肠。由于肠道损伤导致了胆固醇排出量的增加,而机体为了维持胆固醇的平衡,会增强内源胆固醇的合成能力。相关研究也发现,胆固醇的主要合成场所在肝脏,肝脏利用胆固醇合成胆汁酸,通过胆管进入肠道,肠道中的胆汁酸大部分被肠壁重吸收,再通过门静脉进入肝脏,此时,游离型胆汁酸转变为结合型胆汁酸,再随胆汁排入肠腔,这就是所谓胆汁酸的“肠—肝循环”[31]。
本试验中的草鱼为常规养殖草鱼,是以同一池塘打样的草鱼为试验样本,通过血清学指标、肠道形态学和组织学指标分为肠道损伤与肠道正常的两类试验样本,引起草鱼肠道损伤的原因不清楚,而肠道损伤的事实是客观的。所得结果显示了肠道损伤的草鱼鱼体胆固醇、胆汁酸生物合成能力的变化,得到“草鱼肠道损伤与其胆固醇、胆汁酸合成能力之间的一种联系”,对于后期研究鱼体胆固醇、胆汁酸代谢与肠道健康之间的关系具有重要的科学价值和实际指导意义。本试验结果显示:在肠道损伤后的草鱼肝胰脏和肠道中,胆固醇和胆汁酸的合成能力增强,而血清中的HDL、LDL、TC和TBA的含量显著下调,导致这一结果的原因可能是由于胆固醇、胆汁酸的排出量增加,而机体为了维持胆汁酸“肠—肝循环”的动态平衡,加大了胆固醇羟化为胆汁酸的量,从而增加了机体胆固醇的消耗。
| [1] | 倪楚民, 刘浩宇, 刘锡仪, 等. 胆固醇的研究进展[J]. 中华现代临床医学杂志, 2005, 3(4):316-318[Ni C M, Liu H Y, Liu X Y, et al. Progress of cholesterol[J]. Journal of Modern Clinical Medicine, 2005, 3(4):316-318(in Chinese with English abstract)] |
| [2] | Sheen S S. Dietary cholesterol requirement of juvenile mud crab Scylla serrata[J]. Aquaculture, 2000, 189(3):277-285 |
| [3] | 邹思湘. 动物生物化学[M]. 北京:中国农业出版社, 2005:201-205[Zou S X. Animal Biochemistry[M]. Beijing:China Agriculture Press, 2005:201-205(in Chinese)] |
| [4] | 时青云, 赵晋, 林宇庚, 等. 雌激素受体及胆汁酸代谢相关基因在胆汁淤积孕鼠胎鼠肝脏中的表达[J]. 首都医科大学学报, 2011, 32(2):272-275[Shi Q Y, Zhao J, Lin Y G, et al. Expression of estrogen receptor mRNA and genes related to regulation of bile acid metabolism in fetal rat liver of pregnant rats with intrahepatic cholestasis[J]. Journal of Capital Medical University, 2011, 32(2):272-275(in Chinese with English abstract)] |
| [5] | Gornati R, Papis E, Rimoldi S, et al. Molecular markers for animal biotechnology:sea bass(Dicentrarchus labrax L.)HMG-CoA reductase mRNA[J]. Gene, 2005, 344:299-305 |
| [6] | 杜雪, 李进军, 卢立志, 等. 胆固醇7α羟化酶基因研究进展[J]. 浙江农林大学学报, 2013, 30(5):755-760[Du X, Li J J, Lu L Z, et al. Research progresses on cholesterol 7α-hydroxylase gene[J]. Journal of Zhejiang A&F University, 2013, 30(5):755-760(in Chinese with English abstract)] |
| [7] | 刘桂芬, 王爱国, 傅金恋. 猪CETP基因表达变化及其对胆固醇合成的影响研究[J]. 中国畜牧杂志, 2008, 44(19):12-15[Liu G F, Wang A G, Fu J L. The expression profiling and its effect on cholesterol synthesis of CETP gene in swine[J]. Chinese Journal of Animal Science, 2008, 44(19):12-15(in Chinese with English abstract)] |
| [8] | Goodwin B, Jones S A, Price R R, et al. A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis[J]. Molecular Cell, 2000, 6(3):517-526 |
| [9] | 汉雪梅, 张曦, 陶琳丽, 等. 豆粕替代鱼粉对鱼类胆固醇代谢影响的研究进展[J]. 云南农业大学学报:自然科学, 2013, 28(5):734-741[Han X M, Zhang X, Tao L L, et al. The effects of replacing fish meal with soybean meal on cholesterol metabolism in fish:a review[J]. Journal of Yunnan Agricultural University:Natural Science, 2013, 28(5):734-741(in Chinese with English abstract)] |
| [10] | 许凡. 草鱼肠道紧密连接蛋白基因克隆与表达活性分析[D]. 苏州:苏州大学, 2013:1-35[Xu F. Cloning and initial function study of the intestinal tight junction protein genes of grass carp[D]. Suzhou:Soochow University, 2013:1-35(in Chinese with English abstract)] |
| [11] | Eisa-Beygi S, Hatch G, Noble S, et al. The 3-hydroxy-3-methylglutaryl-CoA reductase(HMGCR)pathway regulates developmental cerebral-vascular stability via prenylation dependent signaling pathway[J]. Developmental Biology, 2013, 373:258-266 |
| [12] | Yang T, Espenshade P J, Wright M E, et al. Crucial step in cholesterol homeostasis:sterols promote binding of SCAP to INSIG-1, a membrane protein that facilitates retention of SREBPs in ER[J]. Cell, 2002, 110(4):489-500 |
| [13] | 史连义, 姜玲玲. 外周组织细胞胆固醇的平衡途径及调控[J]. 医学综述, 2008, 14(24):4[Shi L Y, Jiang L L. Cholesterol metabolism balance in periphery histiocyte[J]. Medical Recapitulate, 2008, 14(24):4(in Chinese)] |
| [14] | 李文全, 王子花, 申瑞玲. HMG-CoA还原酶的结构和调节[J]. 动物医学进展, 2006, 27(2):38-40[Li W Q, Wang Z H, Shen R L. Structure and Regulation of HMG-CoA reductase[J]. Progress in Veterinary Medicine, 2006, 27(2):38-40(in Chinese with English abstract)] |
| [15] | 郭少晨, 刘洪娟, 朱迪娜, 等. 普洱茶对高脂血症大鼠胆固醇代谢的影响及作用机制[J]. 中国科学:生命科学, 2013, 42(11):883-892[Guo S C, Liu H J, Zhu D N, et al. Effects and mechanisms of Pu-erh tea on metabolism of cholesterol in hyperlipidemia rats[J]. Scientia Sinica Vitae, 2013, 42(11):883-892(in Chinese with English abstract)] |
| [16] | Moon Y A, Liang G, Xie X, et al. The Scap/SREBP pathway is essential for developing diabetic fatty liver and carbohydrate induced hypertriglyceridemia in animals[J]. Cell Metabolism, 2012, 15(2):240-246 |
| [17] | Edwards P A, Tabor D, Kast H R, et al. Regulation of gene expression by SREBP and SCAP[J]. Biochimica et Biophysica Acta(BBA), 2000, 1529(1):103-113 |
| [18] | Noto D, Cefalù A B, Averna M R. Beyond statins:new lipid lowering strategies to reduce cardiovascular risk[J]. Current Atherosclerosis Reports, 2014, 16(6):1-10 |
| [19] | 史连义, 姜玲玲. 胆固醇的跨膜外向转运及调控[J]. 医学研究生学报, 2009, 22(2):198-204[Shi L Y, Jiang L L. The transmembrane extroversion transport and regulation of cholesterol[J]. Journal of Medical Postgraduate, 2009, 22(2):198-204(in Chinese with English abstract)] |
| [20] | 李天平, 轩贵平, 庹勤慧. 胆固醇代谢调控的研究进展[J]. 临床与病理杂志, 2014, 34(1):71-75[Li T P, Xuan G P, Tuo Q H. Progress in study on the regulation of cholesterol metabolism[J]. Journal of International Pathology and Clinical Medicine, 2014, 34(1):71-75(in Chinese with English abstract)] |
| [21] | 杜雪. 太湖鹅胆固醇7α-羟化酶基因启动子的分子克隆及p53结合元件的初步鉴定[D]. 临安:浙江农林大学, 2013[Du X. Cloning in the 5'regulatory region of Taihu goose CYP7A1 gene and preliminary identification of p53 bingding site[D]. Lin'an:Zhejiang A&F University, 2013(in Chinese with English abstract)] |
| [22] | Pandak W M, Schwarz C, Hylemon P B, et al. Effects of CYP7A1 over-expression on cholesterol and bile acid homeostasis[J]. American Journal of Physiology Gastrointest Liver Physiology, 2011, 281(4):878-889 |
| [23] | Zollner G, Marschall H U, Wagner M, et al. Role of nuclear receptors in the adaptive response to bile acids and cholestasis:pathogenetic and therapeutic considerations[J]. Molecular Pharmaceutics, 2006, 3(3):231-251 |
| [24] | Shin D J, Osborne T F. FGF15/FGFR4 integrates growth factor signaling with hepatic bile acid metabolism and insulin action[J]. Journal of Biological Chemistry, 2009, 284(17):11110-11120 |
| [25] | Cai S Y, He H, Nguyen T, et al. Retinoic acid represses CYP7A1 expression in human hepatocytes and HepG2 cells by FXR/RXR-dependent and independent mechanisms[J]. Journal of Lipid Research, 2010, 51(8):2265-2274 |
| [26] | Wang Y D, Chen W D, Moore D D, et al. FXR:a metabolic regulator and cell protector[J]. Cell Research, 2008, 18(11):1087-1095 |
| [27] | 高艳, 李靖, 郭立新, 等. 他汀类药物在高龄高脂血症患者中应用的疗效及安全性[J]. 中华老年医学杂志, 2014, 33(5):481-483[Gao Y, Li J, Guo L X, et al. Effect and safety of Statins therapy in very old patients[J]. Chinese Journal of Geriatrics, 2014, 33(5):481-483(in Chinese with English abstract)] |
| [28] | 刘芳宏, 宋洁云, 马军, 等. SREBP2基因rs2228314多态性与儿童青少年血脂水平和肥胖的关系[J]. 北京大学学报:医学版, 2014, 46(3):355-359[Liu F H, Song J Y, Ma J, et al. Association of rs2228314 polymorphism in SREBP2 with serum lipid levels and obesity among children and adolescents[J]. Journal of Peking University:Medicine Edition, 2014, 46(3):355-359(in Chinese with English abstract)] |
| [29] | 汪仕奎, 佟建明. 蛋鸡的胆固醇代谢调控研究进展[J]. 动物营养学报, 2002, 14(3):7-11[Wang S K, Tong J M. Review in manipulation of cholesterol metabolism in laying hens[J]. Chinese Journal of Animal Nutrition, 2002, 14(3):7-11(in Chinese with English abstract)] |
| [30] | Kortner T M, Gu J, Krogdahl Å, et al. Transcriptional regulation of cholesterol and bile acid metabolism after dietary soyabean meal treatment in Atlantic salmon(Salmo salar L.)[J]. British Journal of Nutrition, 2013, 109(4):593-604 |
| [31] | 戴鑫, 吕宗舜. 肠道屏障功能在非酒精性脂肪性肝病发病机制中的作用[J]. 世界华人消化杂志, 2012, 20(8):656-661[Dai X, Lü Z S. Role of gut barrier function in the pathogenesis of nonalcoholic fatty liver disease[J]. World Chinese Journal of Digestology, 2012, 20(8):656-661(in Chinese with English abstract)] |




