文章信息
- 曹云, 张永辉, 李春梅. 2015.
- CAO Yun, ZHANG Yonghui, LI Chunmei. 2015.
- 4-硝基苯酚对大鼠肾上腺皮质孕酮分泌的影响
- Effect of 4-nitrophenol on adrenocortical function of progesterone secretion in immature male rats
- 南京农业大学学报, 38(3): 464-470
- Journal of Nanjing Agricultural University, 38(3): 464-470.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.017
-
文章历史
- 收稿日期:2014-07-23
4-硝基苯酚(4-nitrophenol,PNP)是一种重要的有机合成原料,也是大气污染物中柴油车尾气排放的颗粒物质中的主要活性成分之一[1, 2]。PNP已被证实为环境内分泌干扰物,能够扰乱机体正常内分泌活动。肾上腺是机体重要的一个内分泌器官,因其血流量大、亲脂性强、富含细胞色素P450酶系等特点,是最易受到侵害的内分泌器官之一[3, 4, 5, 6, 7],很多环境污染物可诱发肾上腺毒性[8]。由于PNP对植物、微生物、动物生长和人体健康产生巨大的危害,并在食物链中富集[9],其内分泌毒性作用的机制还未阐明,因此揭示和阐明其毒性作用机制以及建立其危险度评价法具有极大的紧迫性与必要性。笔者研究发现,PNP同系物3-甲基-4-硝基酚(3-methyl-4-nitrophenol,PNMC)能够降低未成熟大鼠肾上腺质量,血清促肾上腺皮质激素(ACTH)水平升高,皮质酮和孕酮含量降低;体外细胞试验结果证明,PNMC对垂体前叶细胞分泌的ACTH没有显著影响,但是能够抑制ACTH刺激的肾上腺细胞皮质酮和孕酮的合成,这说明PNMC诱导皮质酮降低可能是由于其对肾上腺的直接作用,而血清ACTH水平升高可能是因为皮质酮负反馈调节的降低[10]。另外,PNMC引起人H295R肾上腺皮质癌细胞株的睾酮、皮质醇和雌二醇17β分泌减少,孕酮分泌增加,促进17β-HSD4 mRNA以及抑制3β-HSD2 mRNA的表达[11]。迄今为止,PNP对机体危害的研究主要集中于动物生殖内分泌功能的影响,而对哺乳动物肾上腺内分泌功能影响的研究尚未见报道。由于性腺与肾上腺之间存在功能性联系,因此本试验拟通过动物体内试验和体外细胞原代培养方法研究PNP对大鼠肾上腺皮质孕酮分泌功能的影响。 1 材料与方法 1.1 主要材料
试验动物:体内试验选用21日龄雄性Sprague-Dawley(SD)大鼠(购自南京青龙山实验动物中心)24只;体外试验选用4周龄雄性SD大鼠8只。试验动物饲养于南京农业大学动物科技学院实验动物饲养中心,温度25 ℃,湿度(50±5)%,光/暗周期为12 h/12 h,自由采食和饮水。正式试验前饲养1周适应新环境。试验操作按照南京农业大学动物护理委员会编写的试验动物护理和使用指南进行。
主要试剂:4-硝基苯酚(PNP)单体干晶体(C6H5NO3,99.9%分析纯,CAS 100-02-7)购自四川成都科龙化学试剂有限公司;DNaseⅠ、胶原酶Ⅱ为Sigma公司产品;DMEM、新生牛血清、青霉素和链霉素为美国Gibco公司产品;RNeasy Mini®试剂盒购自中国Qiagen公司;Omniscript®反转录试剂盒和QuantiTectTM SYBR Green®PCR试剂盒购自TaKaRa公司。
主要仪器:组织包埋机YD-6D、展片机KD-P(浙江省金华市医疗设备厂);石蜡切片机RM2235(Leica);光学显微镜YS100(Nikon);细胞培养箱(日本SANYO);分光光度计(NanoDrop 8000®赛默飞世尔科技,美国)。 1.2 体内试验
采用完全随机化设计,将24只21日龄雄性SD大鼠随机分为4组,每组6只。PNP溶解于含体积分数为0.5% Tween 80的磷酸盐缓冲液(PBS)中,4 ℃保存,并每周更换1次,保证给药溶液的稳定性。试验组大鼠每日9:00皮下注射PNP(0.1、1.0和10.0 mg · kg-1),对照组大鼠注射缓冲液,连续注射14 d。每日准确记录体质量,观察大鼠的生长发育情况。最后一次注射24 h后称大鼠体质量并断头处死。迅速采取血样,3 500 r · min-1、4 ℃离心15 min,分离血清,分装,置于-20 ℃冰箱冻存,用于睾酮、孕酮和雌二醇水平的测定。左侧肾上腺置于体积分数为4%多聚甲醛中固定后,用于组织学检查;右侧肾上腺保存在液氮中,用于RT-PCR测定基因的表达。 1.3 肾上腺皮质细胞的分离及原代培养
肾上腺皮质细胞原代培养主要参照Gallo-Payet等[12]方法并加以改进。选用4周龄雄性SD大鼠8只,主要步骤如下:用体积分数为1%的戊巴比妥钠麻醉大鼠,无菌取出肾上腺。在含有100 U · mL-1青霉素/链霉素混合液的(penicillin/streptomycin,P/S)DMEM细胞培养液中剪成1 mm3的组织块,置于离心管中,吸去上层液体,加入含有100 U · mL-1 P/S、2 mg · mL-1胶原酶Ⅱ和200 U · mL-1 DNaseⅠ的DMEM细胞培养液5 mL,混匀,37 ℃消化裂解30 min后,1 500 r · min-1离心5 min,弃上清液;加入含有100 U · mL-1 P/S、2% FBS的DMEM 2 mL,1 500 r · min-1离心5 min,弃上清液,重复2次。加入含有100 U · mL-1 P/S、2% FBS的DMEM 1 mL。吸20 μL混合液,加20 μL台盼蓝,混合均匀后吸25 μL于血球计数板,显微镜计数。计算每培养孔蓝染(无活力的细胞)和未蓝染(有活力的细胞)的贴壁细胞数和细胞活率,每一样品计数的细胞为每个视野内100个细胞,任选10个视野,重复3次,确保细胞活率达到95%后,将其稀释至所需浓度,接种于96孔细胞板单层细胞培养(5×105 cells · mL-1)。细胞贴壁单层培养24 h后,更换新的培养液,用10-6~10-4 mol · L-1 PNP(每个浓度设12个复孔)继续培养24 h。吸取培养液,用于孕酮的测定。相同原代细胞培养试验平行进行3次。 1.4 MTT法测定细胞活率
原代肾上腺皮质细胞培养24 h后,在96孔细胞培养板中,每孔加入20 μL 5 mg · mL-1的MTT溶液,细胞继续培养4 h后终止培养,吸去孔内培养液,每孔加入150 μL二甲基亚砜(DMSO),各处理组均设12个复孔,置摇床上低速振荡10 min,使结晶物充分溶解,用酶标仪测定490 nm处各孔的吸光值(A490)[13]。同时设置调零孔(不同PNP浓度处理的细胞)、对照孔(相同浓度的药物溶解介质),测定A490。以对照组(0 μmol · L-1 PNP处理组)细胞活率为100%,各处理组细胞活率按下式计算:细胞活率=(处理组A490/对照组A490)×100%。 1.5 肾上腺组织学检查
将多聚甲醛固定好的肾上腺组织用石蜡包埋,制成6 μm切片,并用苏木精和伊红(HE)染色,分析肾上腺皮质形态。 1.6 放射免疫分析
血清睾酮、孕酮和雌二醇及细胞培养液孕酮水平由南京军区总医院血液科测定,采用125I-标记放射配体双抗体放射免疫法。放免试剂盒购自北京北方生物技术研究所。睾酮、孕酮和雌二醇检测批内和批间变异系数分别小于10%和15%。 1.7 总RNA提取、反转录和定量PCR测定
用RNeasy Mini®试剂盒提取总RNA,分光光度法在260和280 nm下测定提取的总RNA的浓度和纯度。用Omniscript®反转录试剂盒将总RNA(1 μg)反转录成cDNA,以cDNA为模板进行PCR扩增。PCR反应总体系为20 μL,包括:2 μL稀释过的cDNA模板、10 μL SYBR Green Master Mix、0.4 μL目的基因或内标基因的上下游引物(表 1)、7.2 μL灭菌三蒸水。在ABI 7300荧光定量分析仪上完成。反应条件如下:94 ℃ 4 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;绘制熔解曲线:95 ℃ 30 s,72 ℃ 20 s,95 ℃ 30 s。每个样本重复3次,并用2-ΔΔCT法对有效性数据进行统计分析[14]。
利用Primer 5.0软件,分别设计内参基因β-actin和目的基因StAR、P 450scc、P450c17和3 β-HSD引物。引物由上海英骏生物技术有限公司合成,引物序列见表 1。
| 基因名称及登录号Gene and GenBank accession No. | 引物序列Sequence(5′→3′) | 产物长度/bpProduct size | 反应条件PCR cycles |
| StAR(NM_031558.3) | F:GCAGCACTACCACAGAAAR:CTGGTTGTTGAGTATGCC | 296 | 95 ℃ 15 s,60 ℃ 30 s72 ℃ 30 s |
| P450scc(NM_017286.2) | F:GTGCCATTTCATAAAGGTTCR:TGCCTCCAGACTTATTTCG | 279 | 95 ℃ 15 s,60 ℃ 30 s72 ℃ 30 s |
| P450c17(NM_012753.2) | F:TCCGAGAAGTGCTGCGTATR:GCTCCGAAGGGCAAGTAAC | 241 | 95 ℃ 15 s,60 ℃ 30 s72 ℃ 30 s |
| 3β-HSD(NM_017265.4) | F:GAGCAGGAGGGTTTTTGGR:TCAGGCACTGGGTGTCAA | 180 | 95 ℃ 15 s,60 ℃ 30 s72 ℃ 30 s |
| β-actin(NM_031144) | F:CGTTGACATCCGTAAAGACCR:GGAGCCAGGGCAGTAATCT | 108 | 95 ℃ 15 s,60 ℃ 30 s72 ℃ 30 s |
所有数据表示为平均值±标准误(x±SE),采用单因素方差分析(ANOVA)以及Dunnett多重比较。采用GraphPad Prism Version 5.0统计软件进行数据分析。 2 结果与分析 2.1 PNP对大鼠生长发育的影响
各染毒组大鼠试验初始体质量、试验末体质量、日增质量以及各脏器绝对和相对质量(器官指数,器官质量/体质量×100%),与对照组相比均无显著性差异(P>0.05)(表 2)。表明在当前剂量下,PNP对大鼠生长发育没有显著影响。
| 项目Items | PNP剂量/(mg·kg-1) Dosage of PNP | |||
| 0(CK) | 0.1 | 1.0 | 10.0 | |
| 初始体质量/g Initial body weight | 60.280±4.460 | 60.280±4.200 | 59.580±4.210 | 59.240±4.500 |
| 体质量/g Body weight | 142.000±8.490 | 130.300±9.530 | 141.000±7.860 | 147.300±11.950 |
| 体增质量/g Gain body weight | 81.700±4.590 | 70.060±6.850 | 81.460±4.280 | 88.080±8.660 |
| 肝质量/g Liver weight | 7.860±0.460 | 6.320±0.280 | 8.010±0.300 | 7.760±0.610 |
| 肝指数/% Liver index | 5.540±0.050 | 5.110±0.160 | 5.760±0.220 | 5.390±0.160 |
| 睾丸质量/g Testes weight | 1.150±0.090 | 1.160±0.120 | 1.140±0.090 | 1.250±0.100 |
| 睾丸指数/% Testes index | 0.800±0.020 | 0.920±0.050 | 0.810±0.030 | 0.870±0.020 |
| 附睾质量/g Epididymis weight | 0.180±0.008 | 0.150±0.016 | 0.150±0.009 | 0.170±0.006 |
| 附睾指数/% Epididymis index | 0.130±0.006 | 0.120±0.008 | 0.110±0.005 | 0.120±0.009 |
| 肾质量/g Kidney weight | 1.460±0.110 | 1.490±0.110 | 1.460±0.100 | 1.470±0.100 |
| 肾指数/% Kidney index | 1.040±0.100 | 1.200±0.090 | 1.050±0.060 | 1.030±0.030 |
| 肾上腺质量/mg Adrenals weight | 50.780±3.850 | 47.340±3.490 | 51.500±3.620 | 55.740±6.850 |
| 肾上腺指数/% Adrenals index | 0.034±0.014 | 0.038±0.024 | 0.037±0.022 | 0.039±0.029 |
| 脾质量/g Spleen weight | 0.700±0.110 | 0.370±0.040** | 0.450±0.030* | 0.560±0.060 |
| 脾指数/% Spleen index | 0.510±0.110 | 0.290±0.010** | 0.310±0.010* | 0.410±0.070 |
| 注:与对照组比较,*P<0.05,* *P<0.01。*P<0.05,* *P<0.01 versus corresponding control. | ||||
光学显微镜下的组织学分析表明:与对照组(图 1-a~d)相比,注射不同剂量PNP组大鼠肾上腺未出现明显形态学异常,肾上腺皮质球状带、束状带和网状带细胞排列规则紧密(图 1-a1~d3)。
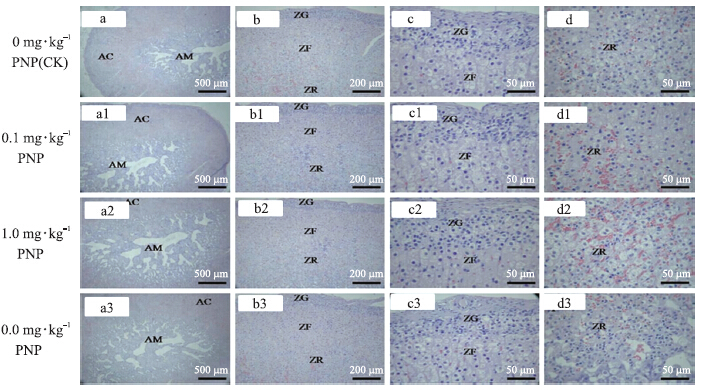 |
图 1 PNP对大鼠肾上腺组织形态学的影响(HE染色)
Fig. 1 Effects of PNP on adrenal histomorphology in rat(HE staining) AC.肾上腺皮质Adrenal cortex;AM.肾上腺髓质Adrenal medulla;ZG.球状带Zona glomerulosa;ZF.束状带Zona fasciculata;ZR.网状带Zona reticularis |
PNP处理2周后,大鼠血清睾酮、孕酮和雌二醇水平如图 2所示:与对照组相比,10.0 mg · kg-1组大鼠血清睾酮水平较对照组显著升高(P<0.05)(图 2-A),而孕酮水平显著降低(P<0.05)(图 2-B),雌二醇水平没有显著差异(P>0.05)(图 2-C)。
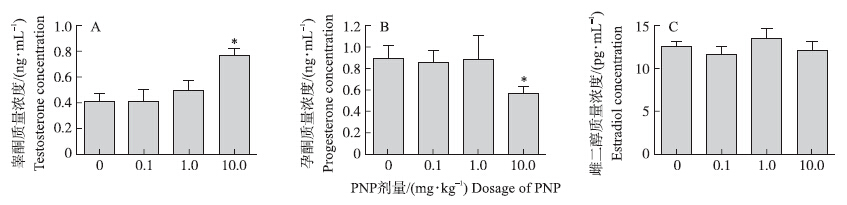 |
图 2 PNP对大鼠血清睾酮(A)、孕酮(B)和雌二醇(C)质量浓度的影响(n=5)
Fig. 2 Effects of PNP on serum concentrations of testosterone(A),progesterone(B)and estradiol(C)in rat *P<0.05,表示与对照组相比差异显著。*P<0.05,versus corresponding control. |
图 3结果显示:与对照组相比,10.0 mg · kg-1组大鼠肾上腺StAR mRNA和P 450c17 mRNA表达显著增加(P<0.05),而 3 β-HSD mRNA表达显著降低(P<0.05),P 450 scc mRNA差异不显著(P>0.05)。
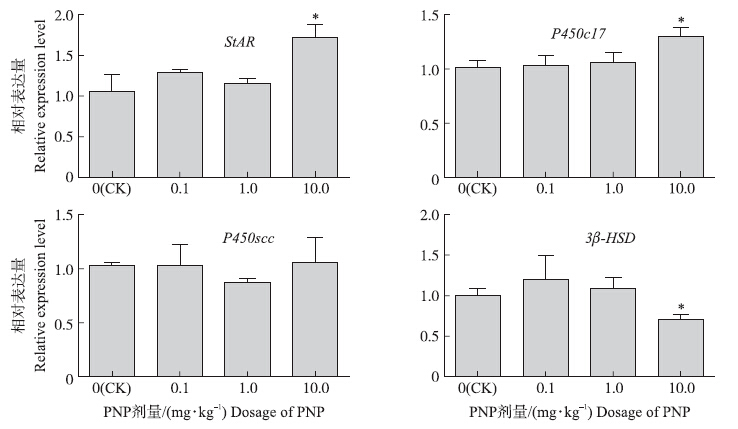 |
图 3 PNP对大鼠肾上腺StAR、P 450scc、P450c17和3 β-HSD基因mRNA表达的影响(n=5)
Fig. 3 Effects of PNP on the expression of adrenal StAR,P 450scc,P450c17 and 3 β-HSD mRNA in rat β-actin为内参,对照组标准化为1;*P<0.05,表示与对照组相比差异显著。 Each mRNA was normalized to the β-actin mRNA expression level in the same preparation,and the mean of each experimental control was assigned a value of 1. *P<0.05,versus corresponding control. |
MTT法检测PNP对肾上腺皮质细胞活率的影响,结果发现,试验组与对照组相比,细胞活率差异不显著(P>0.05)(图 4-A)。 2.6 PNP对原代大鼠肾上腺皮质细胞孕酮分泌的影响
PNP处理24 h后大鼠肾上腺皮质细胞分泌孕酮水平如图 4-B所示:10-4 mol · L-1 PNP处理组大鼠肾上腺皮质细胞培养液中孕酮水平比对照组显著降低(P<0.05)。
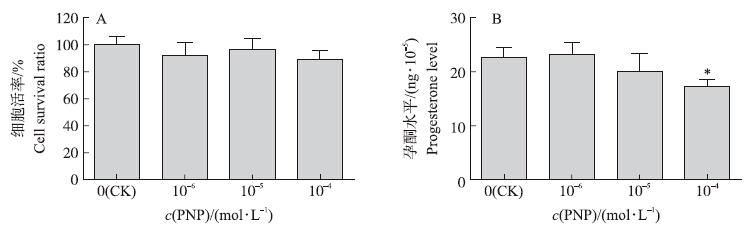 | 图 4 PNP对肾上腺皮质细胞活率及孕酮分泌的影响(n=12) Fig. 4 Effects of PNP on adrenal cell viability and progesterone secretion level in adrenal cells |
体质量变化是衡量动物生长发育是否正常的重要指标。在本试验的整个过程中,各染毒组大鼠的平均体质量与对照组相比没有显著性差异,肾上腺的相对和绝对质量也无明显改变,这些结果表明当前剂量的PNP并未影响大鼠的正常发育。
另外,本试验还发现,PNP染毒组大鼠的脾脏质量显著降低。脾脏是机体最大的淋巴器官,具有重要的免疫功能[15],而且去甲肾上腺素和肾上腺素可通过分布于脾脏的肾上腺素受体调节脾脏的收缩与舒张[16]。本试验结果表明,PNP可能通过影响肾上腺的内分泌功能间接地影响脾脏功能,从而降低机体的免疫调节能力。
前期研究已经证明PNP影响大鼠下丘脑-垂体-性腺轴功能,引起血清睾酮水平升高[17],本试验也得到相同的结果,PNP引起了大鼠血清睾酮水平的升高。在某些条件下,肾上腺自身可以合成一定量的睾酮[18],另外有研究表明,雌激素能够抑制人胚胎肾上腺皮质细胞类固醇的合成[19],而PNP已被证实具有类雌激素的作用[20]。前期研究发现,10 mg · kg-1 PNP引起大鼠睾丸中雌激素受体(ER-α)表达显著增加[21]。但也有研究表明,H295R细胞在10-7~10-5 mol · L-1浓度的PNMC中暴露48 h后会显著提高孕酮水平,而当PNMC的浓度提高到10-4 mol · L-1时,孕酮水平降低且低于10-7 mol · L-1时的水平[11]。本试验中,体内试验结果显示血清孕酮水平在PNP剂量为10.0 mg · kg-1时显著降低,同时体外原代细胞培养试验结果也显示PNP浓度为10-4 mol · L-1时,原代肾上腺皮质细胞培养液中孕酮水平显著降低。上述试验结果表明,PNP会扰乱肾上腺的内分泌功能,降低孕酮的分泌。因此血清中孕酮水平的改变可能主要源于PNP对肾上腺的直接作用,这与我们前期的研究结果一致[20]。
另外,肾上腺是内分泌系统中常见的毒性靶器官,药物诱导的人类肾上腺皮质毒性主要通过对多种酶不可预测的抑制所致[3]。本试验首次证明PNP影响大鼠肾上腺分泌功能。肾上腺皮质以胆固醇为原料,由6种细胞色素P450酶和2种羟类固醇脱氢酶参与,按细胞功能特异性,以不同途径合成多种类固醇激素。类固醇激素合成途径中任何一种酶的异常都可导致相应激素合成障碍和其前身物积聚,造成代谢紊乱[22]。类固醇合成调节酶StAR在类固醇激素的合成过程中起着极为关键的作用,主要负责将胆固醇从细胞质跨膜转运到线粒体。胆固醇在P 450scc的作用下转化为孕烯醇酮,孕烯醇酮可通过3β-HSD转化为孕酮,再被P450c17 转化为17α-羟基孕酮,随后被P 450c17 的裂解酶转化为雄烯二酮[23]。在本试验中,未见肾上腺皮质组织形态显著改变,但肾上腺中多种类固醇合成酶表达受到显著影响,如StAR和P 450c17表达升高,3 β-HSD表达降低。上述试验结果表明,PNP可能是通过影响类固醇合成酶来影响肾上腺孕酮分泌功能的。
综上所述,本试验中,PNP未对大鼠生长发育、肾上腺质量、肾上腺组织形态及肾上腺皮质细胞活力造成明显影响,而血清睾酮和孕酮水平发生显著改变,同时几种调节肾上腺内分泌功能的酶相关基因也有显著变化,因此PNP可能是通过影响肾上腺中多种类固醇合成酶的表达来影响肾上腺孕酮的分泌功能。
| [1] | Mori Y,Kamata K,Toda N,et al. Isolation of nitrophenols from diesel exhaust particles(DEP)as vasodilatation compounds[J]. Biological and Pharmaceutical Bulletin,2003,26(3):394-395 |
| [2] | Shinji T,Kazuyuki K,Hideyuki H,et al. Investigation of vasodilatory substances in diesel exhaust particles(DEP):isolation and identification of nitrophenol derivatives[J]. Journal of Health Science,2004,50(2):133-141 |
| [3] | Rosol T J,Yarrington J T,Latendresse J,et al. Adrenal gland:structure,function,and mechanisms of toxicity[J]. Toxicological Pathology,2001,29(1):41-48 |
| [4] | Hinson J P,Raven P W. Effects of endocrine-disrupting chemicals on adrenal function[J]. Clinical Endocrinology and Metabolism,2006,20(1):111-120 |
| [5] | Harvey P W,Everett D J. The adrenal cortex and steroidogenesis as cellular and molecular targets for toxicity:critical omissions from regulatory endocrine disrupter screening strategies for human health?[J]. Journal of Applied Toxicology,2003,23(2):81-87 |
| [6] | Harvey P W,Everett D J,Springall C J. Adrenal toxicology:a strategy for assessment of functional toxicity to the adrenal cortex and steroidogenesis[J]. Journal of Applied Toxicology,2007,27(2):103-115 |
| [7] | Hilscherova K,Jones P D,Gracia T,et al. Assessment of the effects of chemicals on the expression of ten steroidogenic genes in the H295R cell line using real-time PCR[J]. Toxicological Sciences,2004,81(1):78-89 |
| [8] | Zhang X,Yu R M,Jones P D,et al. Quantitative RT-PCR methods for evaluating toxicant-induced effects on steroidogenesis using the H295R cell line[J]. Environmental Science and Technology,2005,39(8):2777-2785 |
| [9] | Eckenfelder W W. Industrial Water Pollution Control[M]. New York:McGraw-Hill,1989 |
| [10] | Li C,Taneda S,Suzuki A K,et al. Effects of 3-methyl-4-nitrophenol on the suppression of adrenocortical function in immature male rats[J]. Biological and Pharmaceutical Bulletin,2007,30(12):2376-2380 |
| [11] | Furuta C,Noda S,Li C,et al. Nitrophenols isolated from diesel exhaust particles regulate steroidogenic gene expression and steroid synthesis in the human H295R adrenocortical cell line[J]. Toxicology and Applied Pharmacology,2008,229(1):109-120 |
| [12] | Gallo-Payet N,Payet M. Excitation-secretion coupling:involvement of potassium channels in ACTH-stimulated rat adrenocortical cells[J]. Journal of Endocrinology,1989,120(3):409-421 |
| [13] | 丁逍,刘琳,陈迪,等. 过氧化氢诱导原代大鼠睾丸间质细胞氧化损伤模型的建立[J]. 南京农业大学学报,2014,37(2):99-104. doi:10.7685/j.issn.1000-2030.2014.02.016[Ding X,Liu L,Chen D,et al. Establishment of an oxidative damage mod-el induced by H2O2 in primary rat Leydig cells[J]. Journal of Nanjing Agricultural University,2014,37(2):99-104(in Chinese with English abstract)] |
| [14] | 李艳,孙文星,徐春瑛,等. NCOA2核心启动子甲基化分析及其与肾周和皮下脂肪组织差异表达的关系[J]. 南京农业大学学报,2014,37(4):131-136. doi:10.7685/j.issn.1000-2030.2014.04.019[Li Y,Sun W X,Xu C Y,et al. NCOA2 core promotor methylation and its differential expression profile in perirenal and subcutaneous fat tissue[J]. Journal of Nanjing Agricultural University,2014,37(4):131-136(in Chinese with English abstract)] |
| [15] | 王辉,孙莉,韩耀辉. 束缚应激对小鼠脾脏重量的影响[J]. 大连大学学报,2003,24(2):87-88[Wang H,Sun L,Han Y H. The effect of restraint stress on spleen weight in mice[J]. Journal of Dalian University,2003,24(2):87-88(in Chinese with English abstract)] |
| [16] | 保庭毅,何泽生,吴金生. 大鼠脾脏收缩功能与A肾上腺素受体亚型的调节[J]. 心功能杂志,1999,11(2):95-99[Bao T Y,He Z S,Wu J S. Relationship between A-adrenoceptor subtypes and contraction of rat spleen[J]. Chinese Journal of Cardiac Function,1999,11(2):95-99(in Chinese with English abstract)] |
| [17] | Li X,Li C,Suzuki A K,et al. 4-Nitrophenol isolated from diesel exhaust particles disrupts regulation of reproductive hormones in immature male rats[J]. Endocrine,2009,36(1):98-102 |
| [18] | Rainey W E,Parker C R,Jr,Rehman K,et al. The adrenal genetic puzzle:how do the fetal and adult pieces differ?[J]. Endocrine Research,2002,28(4):611-622 |
| [19] | Mesiano S,Katz S L,Lee J Y,et al. Insulin-like growth factors augment steroid production and expression of steroidogenic enzymes in human fetal adrenal cortical cells:implications for adrenal androgen regulation[J]. The Journal of Clinical Endocrinology and Metabolism,1997,82(5):1390-1396 |
| [20] | Li C,Taneda S,Suzuki A K,et al. Estrogenic and anti-androgenic activities of 4-nitrophenol in diesel exhaust particles[J]. Toxicology and Applied Pharmacology,2006,217(1):1-6 |
| [21] | Zhang Y,Piao Y,Li Y,et al. 4-Nitrophenol induces Leydig cells hyperplasia,which may contribute to the differential modulation of the androgen receptor and estrogen receptor-alpha and-beta expression in male rat testes[J]. Toxicology Letters,2013,223(2):228-235 |
| [22] | 王子梅. 肾上腺皮质类固醇激素合成过程的研究进展[J]. 国外医学:内分泌学分册,1997,17(4):169-173[Wang Z M. The research progress of adrenal cortex steroid hormone synthesis process[J]. Foreign Medical Sciences:Section of Endocrinology,1997,17(4):169-173(in Chinese)] |
| [23] | 于祥国. 尼罗罗非鱼类固醇激素合成关键基因 3 β-HSD和StAR的相关研究[D]. 重庆:西南大学,2013:5-7[Yu X G. Study on key genes 3 β-HSD and StAR of the Steroidgenesis Nile Tilapia[D]. Chongqing:Southwest University,2013:5-7(in Chinese with English abstract)] |




