文章信息
- 王钰, 王经满, 曹瑞兵. 2015.
- WANG Yu, WANG Jingman, CAO Ruibing. 2015.
- 鸭坦布苏病毒XZ-2012株的分离鉴定与基因变异分析
- Isolation and gene variation character of duck Tembusu virus strain XZ-2012
- 南京农业大学学报, 38(3): 446-452
- Journal of Nanjing Agricultural University, 38(3): 446-452.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.014
-
文章历史
- 收稿日期:2014-08-17
鸭坦布苏病毒病是由鸭坦布苏病毒(duck Tembusu virus,DTMUV)引起的一种急性传染病。此病的特点为产蛋鸭采食、产蛋量下降和瘫痪,产蛋率可从70%~90%下降至10%左右;雏鸭以出现站立不稳、倒立不起等神经症状为主,死淘率为10%~30%,严重的高达80%,给养鸭业造成了严重的损失[1, 2]。该病于2010年开始在我国东部沿海地区鸭群中流行,Su等[1]发现其病原与坦布苏病毒(Tembusu viurs,TMUV)同源性最高,命名为鸭坦布苏病毒病。
DTMUV属于黄病毒科黄病毒属蚊媒病毒类恩塔亚病毒群,是一种单股正链RNA病毒[3, 4],病毒粒子呈球形,大小为45~50 nm,有囊膜,表面有纤突。研究发现鸭坦布苏病毒能在鸭胚、鸡胚中增殖,也能在鸭胚成纤维细胞、Vero细胞和BHK-21细胞中增殖。该病毒对乙醚、氯仿及去氧胆酸盐敏感[5, 6]。鸭坦布苏病毒病在我国的流行范围较大,在华东各省、河南、湖南、湖北等地[7, 8]都有流行。鸭坦布苏病毒对于各种品系的鸭都能致病[9],同时在流行地区的鸡群和鹅群中也监测到该病。
2012年徐州某鸭场的樱桃谷种鸭呈现食欲不振、产蛋下降的症状,产蛋鸭的产蛋量在一周之内由90%下降至20%,同时鸭子出现了零星死亡。剖检发现脾肿大,卵巢严重出血,卵泡萎缩坏死。笔者采集发病鸭的出血卵泡进行了病原的分离,并对分离毒株进行了全基因克隆测序分析,为研究鸭坦布苏病毒的分子流行病学特征提供了参考。 1 材料与方法 1.1 试验材料
病料来自徐州某樱桃谷种鸭场产蛋下降鸭。SPF鸡胚购自南京天邦生物技术有限公司。BHK-21细胞和宿主菌DH5α由本实验室保存。 1.2 主要试剂、工具酶
pMD18-T、DNA小量凝胶回收试剂盒、质粒抽提试剂盒、DNA分子质量标准(DL2000)、反转录试剂盒、rTaq酶、DEPC处理水为TaKaRa产品;DMEM培养基为GIBCO公司产品; 胎牛血清购自杭州四季清生物工程有限公司。引物和测序由上海英骏生物技术有限公司(Invitrogen)合成。 1.3 试验方法 1.3.1 病料的采集及处理
将病变组织出血卵泡、脾脏等剪碎,按体积比1 ∶ 3加入含双抗的PBS后研磨匀浆,然后将其放入-80 ℃的冰箱中冻融2次,再将其离心过滤,滤过液保存于-80 ℃冰箱中备用。将病料上清液接种10日龄SPF鸡胚,37 ℃孵化,收集24 h后死亡鸡胚的尿囊液。 1.3.2 RT-PCR鉴定鸭坦布苏病毒
将收集到的尿囊液提取RNA,先用随机引物进行反转录,获得cDNA,然后用鸭坦布苏病毒的特异性引物进行PCR检测。鸭坦布苏病毒的特异性引物的设计参考BYD株 (GenBank登录号:JF312912)的NS 5 基因:P1:5′-CTGTCGCAGAACCACTCAT-3′,P2:5′-ACACCAGCCATCTTCCCTC-3′。 扩增片段理论大小为863 bp。 1.3.3 血凝特性分析
以常规方法进行HA试验测定鸡胚分离病毒液是否能凝集鸡红细胞。 1.3.4 分离毒株的细胞培养
用DMEM培养BHK-21细胞,将过滤后含有病毒的上清液接种到生长面积至细胞板底部70%~80%BHK-21细胞上,待细胞病变至80%时收获,冻存备用。 1.3.5 间接免疫荧光试验鉴定分离毒株
将接种DTMUV XZ-2012株36 h的细胞用甲醇固定10 min,用本实验室制备的针对鸭坦布苏病毒囊膜蛋白的单克隆抗体作为一抗孵育过夜,用FITC标记的羊抗鼠IgG作为二抗作用1 h,洗涤晾干后在荧光显微镜下观察荧光产生的情况。 1.3.6 空斑形成试验
用BHK-21细胞铺6孔板,待24 h细胞长满全孔时,用在BHK-21细胞上传了5代的病毒接入细胞,6孔板上按照10-2、10-3、10-4、10-5稀释,孵育2 h后换上低熔点琼脂糖以固定细胞。3 d后用结晶紫染色,观察每个孔内的空斑个数。 1.3.7 引物设计
根据己发表的DTMUV BYD株(国内最早发现的鸭坦布苏病毒毒株)核苷酸序列,设计12对引物扩增DTMUV XZ-2012株全基因。引物见表 1。
| 引物对名称Primers | 引物对序列(5′→3′)Primer pairs sequence | 引物位置Position of primers | 片段长度/bpSize of amplified product |
| DTMUV-1/2 | AGAAGTTCATCTGTGTGA/TTTCGGTTCATAGCAGTA | 1-18/1128-1147 | 1 147 |
| DTMUV-3/4 | TGCTATGAACCGAAAGTG/TAAATGCTGAGCCGAAAA | 1133-1150/2289-2306 | 1 174 |
| DTMUV-5/6 | GTGGCATAGAAGTGGGAGC/ACTGCGGTGTCACAATCAG | 2143-2161/2988-3006 | 864 |
| DTMUV-7/8 | GCCCGAAGATGTCAAATAA/GTCAATCCCACAGCAGTCA | 2832-2850/4218-4236 | 1 405 |
| DTMUV-9/10 | GGGATAGATGTGGTGAGAAT/GTAGGTCCAGCACTGTTAGTT | 4010-4029/5151-5171 | 1 162 |
| DTMUV-11/12 | TATGGCAAGAGGACTGTTAGG/CTGTTATTGGCGAGTTGGA | 4663-4683/5573-5591 | 929 |
| DTMUV-13/14 | CTCCAACTCGCCAATAACA/ACCCACCACTAACAAGACAAC | 5572-5590/6860-6880 | 1 309 |
| DTMUV-15/16 | CGCTCACAGAATGACAGAA/AAATGGCACATAGCAACAG | 6493-6511/7557-7575 | 1 083 |
| DTMUV-17/18 | GCTACAACATTTCTGACTCCCTT/GCACCCTAACCAAACCACC | 7031-7053/8264-8282 | 1 252 |
| DTMUV-19/20 | GAGGTGGTTTGGTTAGGGT/ATGAGTGGTTCTGCGACAG | 8262-8280/9348-9366 | 1 105 |
| DTMUV-21/22 | CTGTCGCAGAACCACTCAT/ACACCAGCCATCTTCCCTC | 9348-9366/10192-10210 | 863 |
| DTMUV-23/24 | GGTGAGTGGATGACTTCTG/CGAGACTCTGTGTTCTACCAC | 10070-10088/10972-10990 | 921 |
DTMUV XZ-2012株鸭坦布苏病毒在BHK-21细胞上传了5代后,收取细胞毒,然后按照RNA提取试剂盒的操作说明提取总RNA。参照PrimeScriptTM Reverse Transcriptase产品说明书,通过随机引物合成cDNA第一链,再利用PCR的方法扩增相应的片段,最后用10 g · L-1的琼脂糖凝胶电泳鉴定PCR产物。 1.3.9 连接反应及阳性克隆的筛选
将上述扩增的12段PCR产物与pMD18-T,于4 ℃连接过夜。制备DH5α感受态细胞,将连接产物转化感受态细胞后将其均匀涂布于带有Amp抗生素(50 μg · mL-1)的LB平板,置37 ℃培养12~18 h。挑取单个转化菌落接种于含Amp抗生素(50 μg · mL-1)的LB液体培养基(约5 mL)试管中,37 ℃振摇(150 r · min-1)培养12~20 h,然后进行菌液PCR鉴定。最后用10 g · L-1的琼脂糖凝胶电泳鉴定PCR产物。将鉴定过的菌液送Invitrogen公司测序。 1.3.10 序列分析
从GenBank上下载了14株已公布的坦布苏病毒的序列,采用DNAStar、BioEdit等数据分析软件序列对其全基因进行分析。选用的毒株为Duck egg-drop syndrome virus strain BYD[JF312912(GenBank登录号)],Duck Tembusu virus strain WFZ_2012(KC990545),Duck egg-drop syndrome virus strain JX2(JQ920426),Flavivirus White Kaiya duck_WR_China_2010(JX196334),Tembusu virus isolate Shandong1(JX965381),Tembusu virus isolate YY5(JF270480),Tembusu virus isolate ZJ-6(JF459991),Tembusu virus strain JS_2010(JF273153),Tembusu virus strain JS804(JF895923),Tembusu virus strain WJ-1(JX579382),Tembusu virus strain XHZD_2010(JQ595407),Tembusu virus strain ZJ407(JQ314464),Tembusu virus strain ZJ GH-2(JQ314465),CJD05(JF926699)。其中Tembusu virus strain JS804株为鹅源,CJD05株为鸡源,其余均为鸭源。 2 结果与分析 2.1 疑似鸭坦布苏病毒病病鸭的病变特征
将徐州某鸭场送检的发病鸭进行剖检,发现卵泡发生明显的出血、萎缩、坏死(图 1),脾脏肿大坏死,肝脏肿大出血。
 | 图 1 感染鸭坦布苏病毒的鸭卵巢病理变化 Fig. 1 Ovarian pathological changes of ducks infected with DTMUV |
将病料匀浆上清过滤液接种6个10日龄SPF鸡胚,在48~72 h内鸡胚全部死亡。死亡鸡胚颈部、腿部表现为明显的出血现象,肝脏出血,脾脏充血肿大(图 2)。无菌收集SPF鸡胚尿囊液,HA试验结果为阴性。应用病毒RNA提取试剂盒提取尿囊液中的RNA,用鸭坦布苏病毒特异引物进行RT-PCR扩增,获得863 bp的条带,与理论值大小一致(图 3)。PCR产物测序结果表明分离病毒为DTMUV,将分离病毒命名为DTMUV XZ-2012。
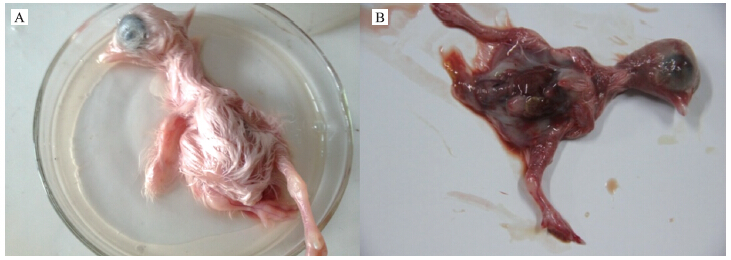 |
图 2 DTMUV XZ-2012株接种SPF鸡胚的病变
Fig. 2 SPF chicken infected with DTMUV XZ-2012 A.阴性对照Control;B.感染DTMUV XZ-2012株的SPF鸡胚SPF chicken infected with DTMUV XZ-2012 |
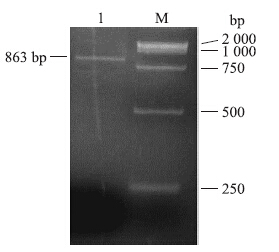 |
图 3 RT-PCR鉴定鸭坦布苏病毒
Fig. 3 Identification of DTMUV by RT-PCR M.DNA marker;1. RT-PCR products |
将DTMUV XZ-2012株接种于长满单层的BHK-21细胞上,48 h后观察发现有细胞死亡、脱落,并且都变圆缩,72 h后细胞几乎全部脱落(图 4)。
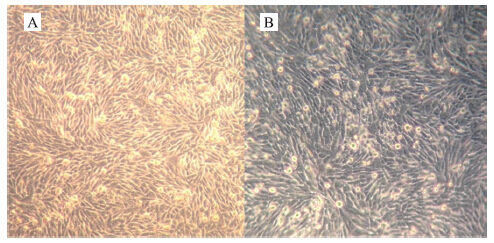 |
图 4 DTMUV XZ-2012株接种BHK-21细胞的细胞病变
Fig. 4 Cytopathic effect of BHK-21 cell infected with DTMUV XZ-2012 A.阴性对照Cell control;B.感染DTMUV XZ-2012 48 h的细胞病变BHK-21 cell at 48 h post infection with DTMUV XZ-2012 |
应用鸭坦布苏病毒囊膜蛋白特异性单克隆抗体(3D12)对分离病毒进行间接免疫荧光试验鉴定,从图 5可清楚地看到:接种了DTMUV XZ-2012株病毒的细胞含有大量绿色荧光,而对照细胞未见特异荧光,表明分离病毒具有鸭坦布苏病毒的抗原特性。
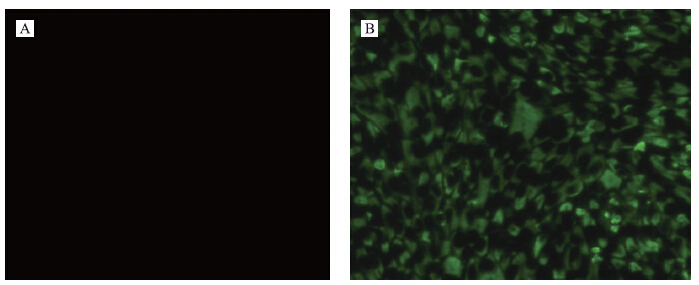 |
图 5 DTMUV XZ-2012株的间接免疫荧光试验鉴定
Fig. 5 Identification of DTMUV XZ-2012 with indirect immunofluorescence assay A.阴性对照Cell control;B.感染DTMUV XZ-2012 36 h的细胞Infected with DTMUV XZ-2012 after 36 h |
把DTMUV XZ-2012株在BHK-21细胞上传5代后接到铺满BHK-21细胞的6孔板上,将10-2、10-3、10-4、10-5稀释的病毒接种细胞,每孔1 mL。3 d后观察到6孔板上形成了明显的噬斑,噬斑大小均一,计算得出该毒株的滴度为5×104 PFU · mL-1。 2.6 DTMUV XZ-2012株全基因RT-PCR扩增结果
利用设计的12对特异性引物,覆盖了鸭坦布苏病毒的基因全序列,并有重叠区域,从而确保引物区域序列的正确性。提取RNA,然后反转录得到cDNA第一链,通过PCR扩增12个片段,得到了长度分别为1 147、1 174、864、1 405、1 162、929、1 309、1 083、1 250、1 105、863、921 bp的12个片段。取2 μL产物进行琼脂糖凝胶电泳,发现结果与预期的相符(图 6)。电泳结果初步说明已成功地扩增出DTMUV XZ-2012株基因组的各个片段。将扩增得到的片段连接到T载体上,送Invitrogen公司测序,获得DTMUV XZ-2012株的全基因序列,GenBank登录号为KM188953。
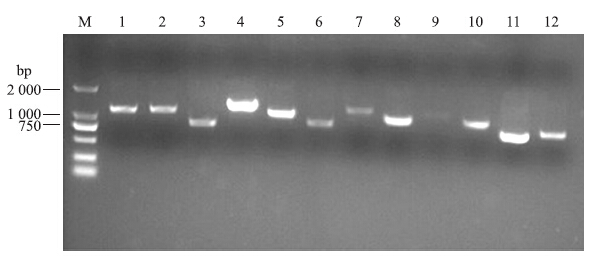 |
图 6 DTMUV XZ-2012株12个片段基因的PCR扩增结果
Fig. 6 PCR products of twelve fragments of DTMUV XZ-2012 M.DNA marker(DL 2000);1~12.扩增到的12个片段Twelve fragments as primer displayed |
全基因测序结果表明:DTMUV XZ-2012株鸭坦布苏病毒一共有10 990个核苷酸,有一个开放式阅读框,共编码3 425个氨基酸,编码3个结构蛋白(C、PrM、E)和7个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)。各个蛋白在基因中的位置组成见表 2。参照已发表文献中已知序列多聚蛋白的切割方法[9],经比较可得出各个蛋白的切割位点基本保守。
| 蛋白种类Protein type | 基因名称Gene | 核酸位置Position of nucleic acid | 核酸数目/ntNumber of nucleic acid | 氨基酸数目Number of amino acids |
| 5′-UTR | 1~94 | 94 | ||
| 结构蛋白 | C | 95~454 | 360 | 120 |
| Structural | PrM | 455~955 | 501 | 167 |
| proteins | E | 956~2 458 | 1 503 | 501 |
| NS1 | 2 459~3 514 | 1 056 | 352 | |
| NS2a | 3 515~4 195 | 681 | 227 | |
| 非结构蛋白 | NS2b | 4 196~4 588 | 393 | 131 |
| Non-structural | NS3 | 4 589~6 445 | 1 857 | 619 |
| proteins | NS4a | 6 446~6 892 | 447 | 149 |
| NS4b | 6 893~7 654 | 762 | 254 | |
| NS5 | 7 655~10 372 | 2 718 | 905 | |
| 3′-UTR | 10 373~10 990 | 618 |
将DTMUV XZ-2012株病毒与其他DTMUV分离株的基因进行进化树和同源性分析,结果见图 7。从图 7可以看出:该毒株与国内分离到的其他鸭坦布苏病毒毒株在核苷酸水平上的同源性都很高,为98.5%~99.3%,遗传上都十分接近。同时从鸡、鸭、鹅3种宿主身上分离到的坦布苏病毒多聚蛋白编码区的核苷酸与氨基酸同源性也很高,达到98.9%~99.3%。
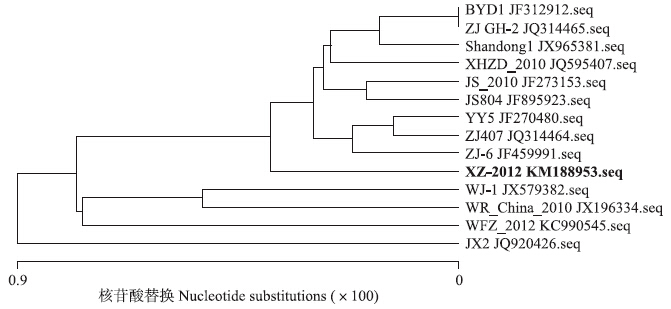 | 图 7 DTMUV XZ-2012株鸭坦布苏病毒与其他鸭坦布苏病毒分离株的全基因进化树 Fig. 7 Phylogenetic analysis of full-length genome among DTMUV XZ-2012 and other reference DTMUV |
将新分离到的DTMUV XZ-2012株和国内最先分离到的DTMUV BYD株(2010年)与Shandong1株(2010年)的蛋白及非编码区进行基因序列同源性比较(表 3)。从全基因序列来看其与这2株毒株的同源性为99.3%和99.0%,从蛋白和非编码区基因来比较:5′-UTR的同源性为100%,其他蛋白基因如C、NS 2b、NS3、NS4a、NS4b的同源性也非常高,而E、NS1、NS2a和NS5 基因存在基因位点的变异。
| 蛋白编码区及非编码区基因Protein and UTR | XZ-2012株与BYD株同源性/%Homology betweenXZ-2012 and BYD | XZ-2012株与Shandong1株同源性/%Homology betweenXZ-2012 and Shandong1 | 蛋白编码区及非编码区Protein and UTR | XZ-2012株与BYD株同源性/%Homology betweenXZ-2012 and BYD | XZ-2012株与Shandong1株同源性/%Homology betweenXZ-2012 and Shandong1 | |
| 5′-UTR | 100.0 | 98.9 | NS2b | 99.7 | 99.5 | |
| C | 99.7 | 99.7 | NS3 | 99.6 | 99.6 | |
| PrM | 99.4 | 98.8 | NS4a | 99.6 | 99.6 | |
| E | 98.9 | 98.9 | NS4b | 99.7 | 99.7 | |
| NS1 | 99.0 | 98.7 | NS5 | 99.1 | 98.9 | |
| NS2a | 99.1 | 99.1 | 3′-UTR | 99.3 | 99.7 |
本试验分离的鸭坦布苏病毒,没有血凝活性,接种鸡胚48 h后开始死亡,72 h达到死亡高峰,96 h已全部死亡。陈仕龙等[10]报道DTMUV DJD09株在96~120 h致鸡胚死亡;赵瑞宏等[11]报道的DTMUV AH01株盲传3代不能使鸡胚死亡,在鸭胚上传6代可致鸡胚死亡;DTMUV XZ-2012株对于鸡胚的致死性要强于DJD09株和AH01株。推测鸭坦布苏病毒随着时间的推移在朝着更适应鸡的方向进化,这与近年来有文献报道鸡群发生鸭坦布苏病毒病一致[12, 13]。
病毒全基因序列比较结果表明:DTMUV XZ-2012株与我国其他地区分离的鸭坦布苏病毒毒株的同源性均达到98%以上,其中与江苏、浙江、安徽、山东等邻近地区分离到的BYD株、YY5株、ZJ-6株、JS_2010株、JS804株和ZJ407株坦布苏病毒同源性均达到了99.3%。鸭坦布苏病毒病爆发期间,陈仕龙等[14]和黄欣梅等[15]也从产蛋率下降的鸡和鹅中分离到鸡黄病毒和鹅黄病毒。为了分析不同来源新型黄病毒的基因特征,我们将DTMUV XZ-2012株与其进行基因序列比对,结果表明XZ-2012株与鹅源JS804株和鸡源CJD05株的基因同源性也都达到99.0%左右。因此,感染鸡、鸭、鹅的坦布苏病毒高度同源。
在DTMUV XZ-2012株与BYD株、Shandong1株各基因区域比较中发现,C、NS 2b、NS3、NS4a和NS4 b基因的同源性非常高,约为99.6%,相较之下E、NS 1、NS2a和NS5 基因存在基因位点的变异,同源性为99.0%左右。E基因编码病毒的囊膜蛋白,集中了病毒中和抗原表位,NS 1 编码病毒补体依赖性中和表位,而NS 5 编码的酶与病毒的复制有关,这些基因的变异表明该病毒在自然界的流行存在一定的免疫压力。DTMUV XZ-2012株等鸭源毒株与鹅源的JS804株和鸡源的CJD05株的基因同源性为99.0%,提示DTMUV宿主范围较广。DTMUV XZ-2012株的E基因与SHYG株(2011)、JM株(2011)、FS株(2011)、df-2株(2012)、SDMS株(2012)等毒株的同源性很高,这提示DTMUV XZ-2012株可能代表了流行的优势毒株,能够为疫苗的研制提供一定的参考。
| [1] | Su J L,Li S,Hu X D,et al. Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus[J]. PLoS One,2011,6(3):e18106 |
| [2] | 马秀丽,于可响,高凤,等. 鸭坦布苏病毒BZ株的生物学特性研究[J]. 中国家禽,2011,33(21):12-15[Ma X L,Yu K X,Gao F,et al. Biological characteristics of BZ isolate of duck Flavivirus[J]. China Poultry,2011,33(21):12-15(in Chinese with English abstract)] |
| [3] | Tang Y,Diao Y,Yu C,et al. Characterization of a Tembusu virus isolated from naturally infected house sparrows(Passer domesticus)in northern China[J]. Transbound Emerg Dis,2012,60(2):152-158 |
| [4] | Li L L,An H J,Sun M H,et al. Identification and genomic analysis of two duck-origin Tembusu virus strains in southern China[J]. Virus Genes,2012,45(1):105-112 |
| [5] | Cao Z,Zhang C,Liu Y,et al. Tembusu virus in ducks,China[J]. Emerging Infectious Diseases,2011,17(10):1873-1875 |
| [6] | 廖敏,牟小东,耿阳,等. 鸭传染性产蛋减少症(暂定名)的病原分离初报[J]. 中国动物传染病学报,2011,19(1):22-26[Liao M,Mou X D,Geng Y,et al. The primary study on virus isolation of duck infectious egg failings[J]. Chinese Journal of Animal Infectious Diseases,2011,19(1):22-26(in Chinese with English abstract)] |
| [7] | 刘志刚,孙青松,姚蓉,等. 鸭坦布苏病毒研究进展[J]. 中国动物传染病学报,2013,21(1):81-86[Liu Z G,Sun Q S,Yao R,et al. Research progress on duck Tembusu virus[J]. Chinese Journal of Animal Infectious Diseases,2013,21(1):81-86(in Chinese with English abstract)] |
| [8] | 李玉峰,马秀丽,于可响,等. 一种从鸭新分离的黄病毒研究初报[J]. 畜牧兽医学报,2011,42(6):885-891[Li Y F,Ma X L,Yu K X,et al. A brief report of Flaviviruses newly isolated from duck[J]. Acta Veterinaria et Zootechnica Sinica,2011,42(6):885-891(in Chinese with English abstract)] |
| [9] | Yun T,Ye W C,Ni Z,et al. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J]. Veterinary Microbiology,2012,157:311-319 |
| [10] | 陈仕龙,陈少莺,王劭,等. 鸭黄病毒的分离鉴定[J]. 动物医学进展,2012,33(3):123-125[Chen S L,Chen S Y,Wang S,et al. Isolation and identification of a novel Flaviviruses strain from shelduck[J]. Progress in Veterinary Medicine,2012,33(3):123-125(in Chinese with English abstract)] |
| [11] | 赵瑞宏,侯宏艳,张丹俊,等. 鸭黄病毒AH01株的分离与鉴定[J]. 中国兽医科学,2012,42(5):473-477[Zhao R H,Hou H Y,Zhang D J,et al. Isolation and identification of duck Flaviviruses strain AH01 strain[J]. Chinese Veterinary Science,2012,42(5):473-477(in Chinese with English abstract)] |
| [12] | 傅光华,黄瑜,程龙飞,等. 坦布苏病毒鸡源分离株全基因组及遗传变异分析[J]. 中国兽医学报,2014,34(9);1418-1422[Fu G H,Huang Y,Cheng L F,et al. Genome sequence phylogenetic analysis of Tembusu virus isolation from chicken[J]. Chinese Journal of Veterinary Science,2014,34(9);1418-1422(in Chinese with English abstract)] |
| [13] | 张敬峰,李银,赵冬敏,等. 鸡源坦布苏病毒(SN01株)的分离鉴定[J]. 浙江农业学报,2013,25(5):957-960[Zhang J F,Li Y,Zhao D M,et al. Isolation and identification of chicken-derived Tembusu virus strain SN01[J]. Acta Agricultural Zhejiangensis,2013,25(5):957-960(in Chinese with English abstract)] |
| [14] | 陈仕龙,陈少莺,王劭,等. 一种引起蛋鸡产蛋下降的新型黄病毒的分离与初步鉴定[J]. 福建农业学报,2011,26(2):170-174[Chen S L,Chen S Y,Wang S,et al. Isolation and identification of new flaviviruses causing reduction on egg-laying in chicken[J]. Fujian Journal of Agricultural Sciences,2011,26(2):170-174(in Chinese with English abstract)] |
| [15] | 黄欣梅,李银,赵冬敏,等. 新型鹅黄病毒JS804毒株的分离与鉴定[J]. 江苏农业学报,2011,27(2):354-360[Huang X M,Li Y,Zhao D M,et al. Isolation and identification of a novel Flavivirus strain JS804 in geese[J]. Jiangsu Journal of Agricutural Science,2011,27(2):354-360(in Chinese with English abstract)] |




