文章信息
- 王明乐, 朱旭君, 王伟东, 王炫清, 林明露, 黎星辉. 2015.
- WANG Mingle, ZHU Xujun, WANG Weidong, WANG Xuanqing, LIN Minglu, LI Xinghui. 2015.
- 茶树小分子量热激蛋白基因CsHSP17.2的克隆与表达分析
- Molecular cloning and expression analysis of low molecular weight heat shock protein gene CsHSP17.2 from Camellia sinensis
- 南京农业大学学报, 38(3): 389-394
- Journal of Nanjing Agricultural University, 38(3): 389-394.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.006
-
文章历史
- 收稿日期:2014-07-22
高温条件下,植物体内多数正常蛋白基因的转录被抑制,翻译也降低甚至停止,植物优先翻译热激蛋白(heat shock protein,HSP)mRNA[1]。到目前为止,已发现并鉴定出5个家族的热激蛋白基因,分别是HSP 100、HSP90、HSP70、HSP60 和small HSP家族。热激蛋白在生物体内的表达不仅受到高温诱导,而且也受到其他胁迫的诱导[2]。其在细胞生物进程中主要负责自身蛋白的折叠、组装、转运和降解,起到稳定体内蛋白和协助蛋白复性的作用,这对于保护植物免受外界胁迫损伤和维持细胞动态平衡具有重要意义[3]。
小分子量热激蛋白(small heat shock proteins,sHSPs)基因作为热激蛋白基因家族的重要一员,在5大家族中种类最多,其蛋白质相对分子质量一般为(15~40)×103[4]。植物体内的sHSPs均由细胞核基因编码,依据它们在细胞内所处的位置、序列的相似性和功能而被划分为6个亚族:ClassⅠ(CⅠ)、Class Ⅱ(CⅡ)、Class Ⅲ(CⅢ)、Class Ⅳ(CⅣ)、Class Ⅴ(CⅤ)和ClassⅥ(CⅥ)。同一个亚族内,不同的热激蛋白氨基酸序列相似性较高,不同物种间也有较高的同源性;而不同亚族间热激蛋白的相似性较低。正常情况下,大多数小分子量热激蛋白在植物营养器官中不表达,而高温能促使其迅速积累。与大多数热激蛋白基因类似,sHSPs不仅能响应热刺激,而且能响应低温、干旱、重金属、紫外辐射和过氧化胁迫[5,6,7,8,9]。
张莉[10]利用cDNA-AFLP技术研究茶树种子低温贮藏过程中的基因差异表达时发现,低温诱导茶树种子中小分子量热激蛋白基因CsHSP 17.2 的表达,并通过RACE结合RT-PCR技术获得其cDNA全长。本研究利用该基因在GenBank中的序列,以茶树‘迎霜’芽头的cDNA为模板同源克隆获得其开放阅读框,初步分析了该基因的结构、进化关系及其在不同处理条件下的差异表达情况,以期为研究该基因的分子生物学功能提供必要的参考。 1 材料与方法 1.1 植物材料、菌种与试剂
试验所用材料‘迎霜’(Camellia sinensis‘Yingshuang’)为一年生水培苗,其在人工气候培养箱中的培养条件为:昼夜温度25 ℃/20 ℃,光周期16 h/8 h,光照强度200 μmol · m-2 · s-1,相对湿度70%~80%。培养1个月后同时进行高温(38 ℃)、高盐(200 mmol · L-1NaCl)、干旱(100 g · L-1 PEG 6000)和外源脱落酸(200 mg · L-1 ABA)处理,分别于0、0.5、1、2、4和8 h剪取茶树顶端往下的第4叶来提取总RNA,进行实时荧光定量PCR分析。
大肠杆菌DH5α由南京农业大学茶叶科学研究所保存;pMD18-T载体、DNA分子量标准、PCR聚合酶等购自TaKaRa公司。试验所用引物委托南京金斯瑞生物科技有限公司合成。 1.2 总RNA的提取与cDNA第一链的合成
使用快速RNA提取试剂盒(华越洋,中国)提取‘迎霜’芽头的总RNA。利用Reverse Transcriptase M-MLV(RNase H-)试剂盒(TaKaRa)将总RNA反转录成cDNA。 1.3 茶树小分子量热激蛋白基因CsHSP 17.2 的克隆
根据GenBank中来源于‘龙井43’(Camellia sinensis‘Longjing 43’)的CsHSP基因(GenBank登录号:EU727315)设计1对特异性引物(F:5′-ATGTCGATGATCCCAAGCTTC-3′和R:5′-CTAACCAGAGATATCAATAGAC-3′),以‘迎霜’的cDNA为模板进行PCR扩增。反应程序为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR产物经12 g · L-1琼脂糖凝胶电泳分离后连接pMD18-T载体,涂板转化后挑选7个阳性克隆送南京金斯瑞生物科技有限公司测序。 1.4 序列分析
利用NCBI中的BLAST对获得的核苷酸进行同源比对和保守结构域分析;用MEGA5.1构建系统发育树;用ProtParam tool[11]进行蛋白质相对分子质量、理论等电点和氨基酸组成分析;采用DNAMAN 6.0.3.99进行氨基酸亲水/疏水性预测;利用SignalP 4.1 Server进行信号肽预测;使用SOPMA[12]分析蛋白质的二级结构;用SWISS-MODEL同源建模预测蛋白质的三级结构[13];利用WoLF PSORT[14]和PredictProtein[15]进行亚细胞定位预测。 1.5 实时荧光定量PCR反应
根据扩增得到的序列设计CsHSP 17.2 表达检测引物(DL-F:5′-CCCTTCAGAAACTCTCCCTTC-3′和DL-R:5′-AACCCTGTGCCAAGTATCGT-3′)。以茶树β-actin基因(HQ420251)作为看家基因(β-actin-F:5′-GCCATCTTTGATTGGAATGG-3′和β-actin-R:5′-GGTGCCACAACCTTGATCTT-3′)。利用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa)进行反转录后,按照SYBR Premix Ex TaqTM Ⅱ(Tli RnaseH Plus)(TaKaRa)使用说明进行荧光定量PCR。利用IQ5 multicolor real time PCR detection system(Bio-Rad,USA)进行实时荧光定量PCR反应,采用2-ΔΔCT算法分析结果。 1.6 数据统计与分析
使用SPSS 17.0对数据进行统计处理,采用Duncan′s新复极差法进行分析。 2 结果与分析 2.1 茶树CsHSP 17.2 基因的克隆
以‘迎霜’的cDNA为模板,经PCR扩增得到450 bp左右的片段(图 1)。测序后与‘龙井43’对比发现:在核苷酸和氨基酸水平上均只有1个位点的差异,分别为335位的碱基C/T和112位的氨基酸P/L(图 2)。
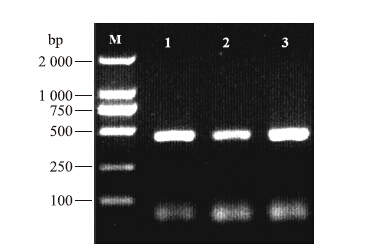 | 图 1 茶树CsHSP 17.2 基因开放阅读框的扩增 Fig. 1Amplification of CsHSP 17.2 gene open reading frame(ORF) M:DL2000 DNA分子量标准DL2000 DNA marker;1~3:CsHSP 17.2 基因片段The fragements of CsHSP 17.2 |
 | 图 2 2个茶树品种CsHSP 17.2 基因核苷酸序列(A)和氨基酸序列(B)比对 Fig. 2The alignment of nucleotide sequences(A)and amino acid sequences(B)of CsHSP 17.2 gene between‘Yingshuang’ and‘Longjing 43’ |
通过ORF Finder分析‘迎霜’CsHSP 17.2 基因的核苷酸序列,发现该基因共编码150个氨基酸,其中酸性氨基酸27个,碱性氨基酸24个,中性氨基酸99个。BLASTp同源比对发现,茶树CsHSP 17.2 氨基酸序列与可可(Theobroma cacao,XP_007016253)、蓖麻(Ricinus communis,XP_002520482)、大豆(Glycine max,NP_001235293)、蒺藜苜蓿(Medicago truncatula,XP_003619703)和拟南芥(Arabidopsis thaliana,NP_172220)的相似性较高,分别为80%、78%、77%、76%和75%。保守结构域分析发现,该蛋白属于小分子量热休克蛋白家族第Ⅰ亚族(ClassⅠ,CⅠ),羧基末端有一段由大约90个氨基酸序列组成的热休克保守结构域,即α-晶体域(α-crystallin domain,ACD)。
利用ProtParam tool分析发现,CsHSP17.2蛋白理论等电点(pI)为5.56,分子式为C759H1201N211O235S6,蛋白质相对分子质量为17.2×103,不稳定指数(instability index,II)46.55,属于不稳定蛋白。亲/疏水性预测发现,该蛋白亲水性区域多于疏水性区域,属于亲水蛋白(图 3)。信号肽预测显示该蛋白无信号肽位点,属于非分泌型蛋白。二级结构预测显示,该蛋白的随机卷曲、α螺旋、延伸链和β转角的比例分别为 53.33%、24.67%、17.33%和4.67%,以随机卷曲和α螺旋为主。通过SWISS-MODEL构建‘迎霜’CsHSP17.2 蛋白的三维结构模型(图 4),其中与‘龙井43’的差异氨基酸位点为第112位脯氨酸。亚细胞定位预测表明,该蛋白分布于细胞质中。
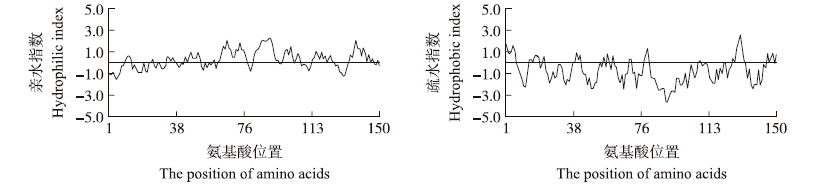 | 图 3 ‘迎霜’CsHSP17.2氨基酸序列亲/疏水性预测 Fig. 3Predicted hydrophilic and hydrophobic properties of CsHSP17.2 amino acid sequences from‘Yingshuang’ |
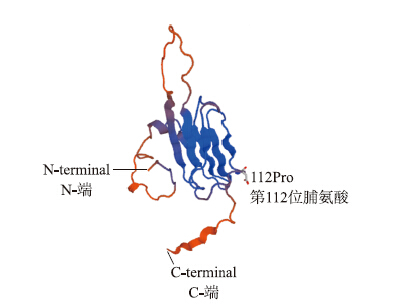 | 图 4 ‘迎霜’CsHSP17.2蛋白的三级结构 Fig. 4The three-dimension structure of CsHSP17.2 protein from‘Yingshuang’ |
为进一步研究茶树CsHSP17.2氨基酸的进化关系,利用MEGA5.1构建系统发育树。结果(图 5)显示:CsHSP17.2与禾本科的水稻(Oryza sativa,P27777)和蝶形花科的花生(Arachis hypogaea,ABC41131)的进化关系较近。
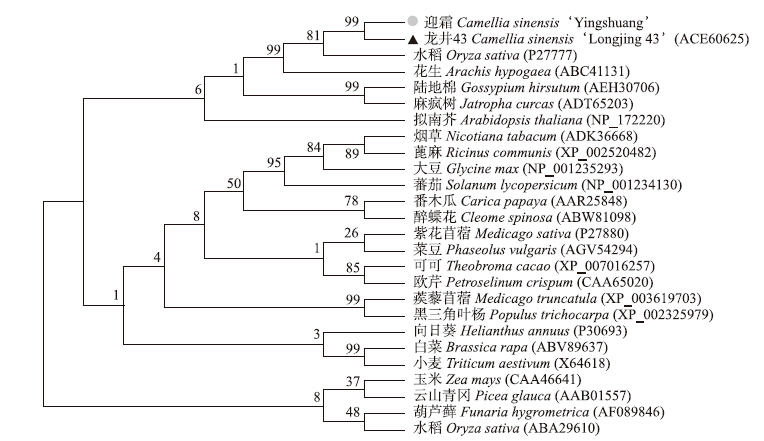 | 图 5 茶树CsHSP17.2与其他植物热激蛋白的进化树分析 Fig. 5Poylogenetic tree of CsHSP17.2 with other heat shock proteins from plants |
由图 6可知:CsHSP 17.2 基因在茶树不同的组织器官中均有表达(CsHSP 17.2 在叶中的表达量被设定为1.0),属于组成型表达基因;该基因在花中的表达量显著高于在其他组织中的表达量(P<0.05),表明茶树小分子量热激蛋白基因CsHSP 17.2 不仅在营养器官中表达,而且在生殖器官中也表达。
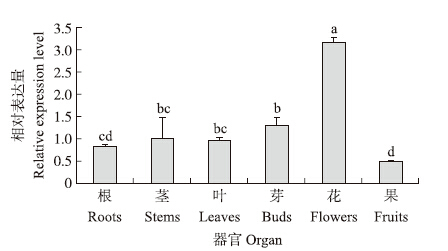 |
图 6 CsHSP 17.2 在不同器官中的表达量 Fig. 6Expression profiles of CsHSP 17.2 in various organs
不同小写字母表示差异显著(P<0.05)。 Different small letters indicate significant difference at 0.05 level.The same as follows. |
由图 7可见:38 ℃高温处理1 h内,CsHSP 17.2的转录水平显著升高,0.5和1.0 h的相对表达量分别为对照组(相对表达量被设为1.0)的637.97倍和1 359.10倍,而后在2~8 h表达量逐渐降低。这说明高温能促进CsHSP 17.2 mRNA的迅速积累,进而维持茶树体细胞的动态平衡。
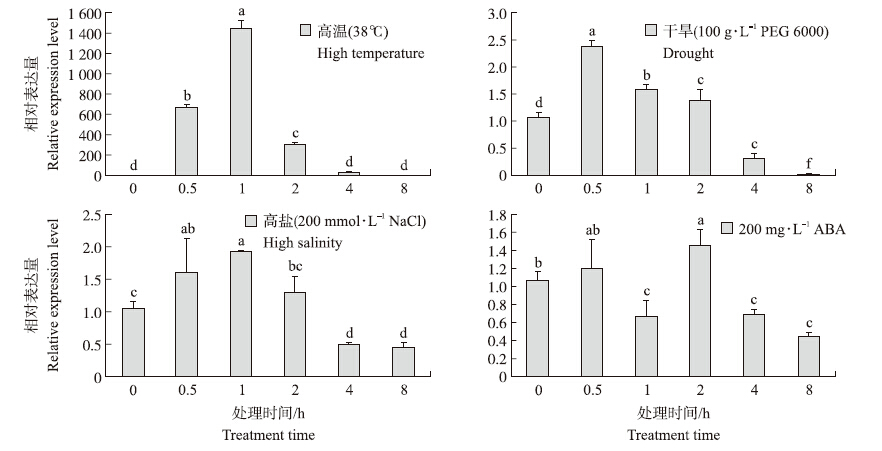 | 图 7CsHSP 17.2 在不同胁迫处理条件下的表达量 Fig. 7Expression profiles of CsHSP 17.2 under different stress treatments |
在PEG 6000和NaCl处理条件下,CsHSP 17.2 在8 h内均表现出先升后降的趋势,最大相对表达量分别出现在0.5和1.0 h,分别为初始表达量(0 h)的2.40倍和1.92倍,均显著低于高温处理1 h时CsHSP 17.2 的表达量。
ABA处理条件下,CsHSP 17.2 的表达量在0.5 h内缓慢增加后逐渐降低,至2 h又增加到最高值,但其表达量仅为对照组的1.45倍,而后逐渐降低。与高温、干旱和高盐处理相比,ABA处理过程中CsHSP 17.2 的表达量一直维持在较低水平。 3 结论与讨论
非生物胁迫条件下,植物体会出现不同程度的自身蛋白功能性障碍,热激蛋白对于维持细胞内蛋白的正确构象,避免植物非自身蛋白的聚集有重要作用。小分子量热激蛋白作为植物热激蛋白家族的重要一员,对于维持植物细胞内的动态平衡具有重要意义。针对茶树中小分子量热激蛋白相关分子生物学功能研究不多的现象,本研究在张莉[10]前期工作的基础上,对茶树CsHSP 17.2 进行了比较系统的生物信息学分析、组织特异性表达和不同处理条件下的表达分析。实时荧光定量PCR结果表明,茶树CsHSP 17.2 属于组成型表达基因,其不仅在营养器官中表达,而且也在生殖器官中表达,说明该基因在茶树体内广泛存在;在花中的表达量显著高于其他组织,推测其可能参与茶花发育。Zhou等[16]发现,莲NnHSP 17.5 主要在种子中表达,而在根、茎、花和果中基本检测不到,说明不同物种之间小分子量热激蛋白的表达存在差异。此外,越来越多的证据表明sHSP的积累与植物体对环境的耐受性有关[5,6,7]。本试验采用不同胁迫处理茶树后,发现高温(38 ℃)能在短时间内引起茶树CsHSP 17.2 的显著积累,这暗示在高温条件下CsHSP17.2可能作为分子伴侣与变性蛋白结合进而防止体内蛋白出现不可逆聚集现象。Cao等[17]发现银杏GbHSP 16.8和GbHSP17 不仅受到高温诱导,而且响应UV-B、低温和ABA处理。Zhou等[16]认为,在0.5% H2O2和20 μmol·L-1甲基紫精能上调NnHSP 17.5 基因的表达。而本试验发现,茶树在高盐(200 mmol·L-1NaCl)、干旱(100 g·L-1 PEG 6000)和脱落酸(200 mg·L-1ABA)处理条件下,CsHSP 17.2的转录水平均出现不同程度的上调,说明茶树CsHSP 17.2不仅受高温诱导,而且响应高盐、干旱和脱落酸处理。
目前,我们对茶树遭受热害时的形态和生理现象已有一定的了解,譬如,我国长江中下游茶区在每年的7—8月间,气温较高,日照强,空气湿度低,往往会发生热害,尽管其危害时间短,但能很快使植株枝叶产生不同程度的灼伤干枯,使茶树自顶部向下干枯,严重的根部死亡[18]。但是,对于sHSPs具体是如何参与到保护细胞的分子生物学机制却了解不多,这也是我们今后研究工作的重点。
| [1] | 黄祥富,黄上志,傅家瑞.植物热激蛋白的功能及其基因表达的调控[J].植物学通报,1999,16(5):530-536 [Huang X F, Huang S Z, Fu J R. Regulation of expression and functions of the heat shock proteins of plant[J]. Chinese Bulletin of Botany, 1999, 16(5):530-536(in Chinese with English abstract)] |
| [2] | Scharf K D, Siddique M, Vierling E. The expanding family of Arabidopsis thaliana small heat stress proteins and a new family of proteins containing α-crystallin domains(Acd proteins)[J].Cell Stress and Chaperones,2001,6(3):225-237 |
| [3] | Wang W,Vinocur B, Shoseyov O,et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J].Trends in Plant Science,2004,9(5):244-252 |
| [4] | Waters E R, Lee G J, Vierling E. Evolution, structure and function of the small heat shock proteins in plants[J].Journal of Experimental Botany,1996, 47(296):325-338 |
| [5] | Pla M,Huguet G,Verdaguer D,et al. Stress proteins co-expressed in suberized and lignified cells and in apical meristems[J].Plant Science, 1998,139(1):49-57 |
| [6] | Banzet N,Richaud C,Deveaux Y,et al. Accumulation of small heat shock proteins,including mitochondrial HSP22,induced by oxidative stress and adaptive response in tomato cells[J].Plant Journal,1998,13(4):519-527 |
| [7] | Sabehat A,Lurie S,Weiss D.Expression of small heat-shock proteins at low temperatures:a possible role in protecting against chilling injuries[J].Plant Physiology,1998,117(2):651-658 |
| [8] | Gyorgyey J,Gartner A,Nemeth K,et al.Alfalfa heat shock genes are differentially expressed during somatic enbryogenesis[J].Plant Molecular Biology,1991,16(6):999-1007 |
| [9] | 郑佳秋,侯喜林,朱红芳.热激诱导不结球白菜热激蛋白合成与耐冷性分析[J].南京农业大学学报,2010,33(2):30-34. doi:10.7685/j.issn.1000-2030.2010.02.006 [Zheng J Q, Hou X L, Zhu H F. Induction of heat shock protein synthesis and chilling tolerance in Biassica campestris ssp.chinensis[J].Journal of Nanjing Agricultural University,2010,33(2):30-34(in Chinese with English abstract)] |
| [10] | 张 莉.茶树种子低温贮藏过程中热激蛋白的差异表达与分析[D].合肥:安徽农业大学, 2008 [Zhang L. The expression and analysis of heat shock protein(HSP)in tea plant(Camellia sinensis)seed during the cold storage[D]. Hefei:Anhui Agricultural University,2008(in Chinese with English abstract)] |
| [11] | Gasteiger E,Gattiker A,Hoogland C,et al. ExPASy:the proteomics server for in-depth protein knowledge and analysis[J].Nucleic Acids Research, 2003,31(13):3784-3788 |
| [12] | Geourjon C,Deleage G.SOPMA:significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments[J].Computer Applications in the Bioscience,1995,11(6):681-684 |
| [13] | Kiefer F,Arnold K,Kuenzli M,et al.The SWISS-MODEL Repository and associated resources[J].Nucleic Acids Research,2009,37:D387-D392 |
| [14] | Horton P,Park K J,Obayashi T,et al.WoLF PSORT:protein localization predictor[J].Nucleic Acids Research,2007,35:W585-W587 |
| [15] | Rost B,Yachdav G,Liu J F.The PredictProtein server[J]. Nucleic Acids Research, 2004, 32:W321-W326 |
| [16] | Zhou Y,Chen H,Chu P,et al.NnHSP17.5,a cytosolic class Ⅱ small heat shock protein gene from Nelumbo nucifera, contributes to seed germination vigor and seedling thermotolerance in transgenic Arabidopsis[J].Plant Cell Reports,2012,31(2):379-389 |
| [17] | Cao F,Cheng H,Cheng S,et al. Expression of selected Ginkgo biloba heat shock protein genes after cold treatment could be induced by other abiotic stress[J].International Journal of Molecular Sciences, 2012, 13(5):5768-5788 |
| [18] | 童启庆.茶树栽培学[M].北京:中国农业出版社,2000:311-314[Tong Q Q. Tea Cultivation[M]. Beijing:China Agriculture Press, 2000:311-314(in Chinese)] |




