文章信息
- 马华, 程春燕, 徐建, 娄群峰, 李季, 陈劲枫. 2015.
- MA Hua, CHENG Chunyan, XU Jian, LOU Qunfeng, LI Ji, CHEN Jinfeng. 2015.
- 黄瓜-酸黄瓜渐渗系的验证及其抗蔓枯病筛选
- Verification of cucumber-sour cucumber introgression lines and screening resistant to gummy stem blight
- 南京农业大学学报, 38(3): 369-374
- Journal of Nanjing Agricultural University, 38(3): 369-374.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.03.003
-
文章历史
- 收稿日期:2014-08-20
黄瓜(Cucumis sativus L.)是世界十大蔬菜之一,主要分布于温带和亚热带地区。据联合国粮食与农业组织(FAO)统计,2010年中国黄瓜的栽培面积为988 680 hm2,总产量达到40.71×106 t,是世界上最大的黄瓜生产和消费国。近年来,随着设施黄瓜的不断发展,黄瓜蔓枯病(Mycosphaerella melonis)成为继根结线虫病后危害黄瓜生产的第二大病害。该病害在设施中遇高温高湿条件多发,黄瓜可减产20%左右,严重的将导致提前拉秧甚至绝收,这对黄瓜商品化生产造成严重影响[1, 2]。
黄瓜遗传背景狭窄,抗病资源比较匮乏,野生种或野生近缘种在长期进化过程中积累了抗逆遗传因子,为作物遗传改良提供了良好材料[3]。通过远缘杂交获得渐渗系是拓宽植物遗传背景提高抗逆性的有效手段。自Eshed和Zamir提出了渐渗系(introgression line,IL)群体后,在番茄、拟南芥、甜瓜、莴苣、小麦、水稻、大麦等作物上[4]已相继构建了渐渗系群体。目前已报道的番茄IL群体共6个,其中利用渐渗系群体Lycopersicon pennellii经全基因组筛选后发现6个抗枯萎病位点[5];在水稻上利用渐渗系群体克隆出多个抗白叶枯病基因,如Xa 21、Xa27 等[6],同时利用东乡野生稻-栽培稻渐渗系阐明了高世代渐渗后代的基因组遗传变异和甲基化变化的分子机制。这充分说明渐渗系群体在挖掘、利用近缘种质资源,影响作物生长发育、产量、抗逆性等复杂性状上发挥着重要作用,同时为挖掘QTL,特别是效应较小的QTL提供了一项强有力的工具[7, 8]。
黄瓜野生种Cucumis hystrix Chakr.(2n=24),是一个原产中国云南甜瓜属的珍稀野生种,经过多年多次抗性鉴定,明确该野生种对蔓枯病上具有良好的抗性[9, 10]。Chen等[11]成功实现了其与栽培黄瓜(C.sativus L.,2n=14)的种间杂交,并通过染色体加倍合成了新的异源四倍体Cucumis×hytivus。通过将该异源四倍体和栽培黄瓜‘北京截头’进行回交、自交,获得了一系列具有不同表型性状的渐渗育种材料。本试验以此渐渗系为供试材料,通过形态学统计、SSR分子标记筛选、苗期人工接种鉴定,筛选鉴定出抗蔓枯病的渐渗系材料,为黄瓜抗蔓枯病遗传研究和育种奠定基础。 1 材料与方法 1.1 供试植株
黄瓜-酸黄瓜渐渗系(野生种C.hystrix与普通栽培黄瓜‘北京截头’种间杂交后代)86份,普通栽培黄瓜‘北京截头’(感病对照),均由南京农业大学作物遗传与种质创新国家重点实验室黄瓜研究室提供。 1.2 农艺性状观察
对田间种植的黄瓜-酸黄瓜渐渗系群体农艺性状进行观察和测量,性状主要包括主节间长、分枝数、叶色、叶形、叶片长、叶片宽、叶柄长、商品瓜形、商品瓜皮色、刺色、瓜长、瓜把长以及种瓜质量。调查方法参照文献[12]。 1.3 SSR分析
采用CTAB法提取黄瓜叶片基因组DNA,SSR引物来自黄瓜基因组测序图谱[13],由英潍捷基(上海)贸易有限公司合成。SSR总反应体系为20 μL,包括ddH2O 12.7 μL,10×Buffer 2.0 μL,2.0 mmol · L-1,MgCl2 0.6 μL,2.5 mmol · L-1的dNTP 1.6 μL,引物各1 μL,5 U Taq DNA 0.1 μL,1 μL模板DNA。SSR扩增程序为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min,最后4℃保存。PCR扩增产物在70 g · L-1变性聚丙烯酰胺凝胶上电泳,银染检测。 1.4 接种处理 1.4.1 供试病原菌
选取本实验室前期分离纯化的强致病力蔓枯病菌菌种A1为接种病菌,PDA试管保存于4℃冰箱,由浙江省农业科学院植物保护与微生物研究所培养产孢。 1.4.2 病原菌培养
将保存在4℃冰箱的蔓枯病菌活化到PDA培养基上培养,25℃暗培养7 d后进行4 d紫外灯光照处理(12 h紫外灯/12 h黑暗),诱导分生孢子产生[14]。 1.4.3 分生孢子悬浮液的制备
用5~10 mL无菌水冲洗病原菌培养基表面,用L型玻璃棒轻轻刮培养基表层,获得的孢子悬浮液经4层纱布过滤,除去菌丝、琼脂等杂质的孢子粗提液作为母液。用乳酸调整孢子悬浮液的pH值至3.5~4.0,在显微镜下使用血球计数板统计悬浮液的孢子数,将接种孢子浓度配制至1×106 mL-1,接种前,加入2.5 g · L-1明胶作为表面活性剂。 1.4.4 接种鉴定
2013年9月6日将供试材料播种于72孔穴盘进行育苗,每个编号播种10株,置于温度25℃、相对湿度为80%的温室中。于9月13日黄 瓜幼苗第1片真叶展平时移苗至营养钵(口径12 cm ,底径10 cm,高8 cm)中,每钵1株。待幼苗长至3~4片真叶时进行人工喷雾接种,对照植株接种无菌水。基质由草炭和蛭石(质量比为1 ∶ 1)混合而成。接种孢子悬浮液浓度为1×106 mL-1。接种后覆盖棚膜3 d,遮光密闭,保证棚内相对湿度92%~95%,温度21~25℃。接种1周后统计叶部病级,统计部位为从茎基部起4片真叶。按如下公式计算病情指数:病情指数(DI)=∑(病级×该病级株数)/(最高病级×调查总株数)×100。DI≤15为高抗(HR);15<DI≤45为抗(R);45<DI≤75为感(S);75<DI为高感(HS)。
叶片病级分级标准[15]:0级:无症状;1~2级:零星感染;3~4级:少量小斑点;5~6级:20%~50%叶面积有小斑点;7~8级:植株萎蔫且斑点超过叶面积50%;9级:植株死亡。 2 结果与分析 2.1 黄瓜-酸黄瓜渐渗系农艺性状观察
对黄瓜-酸黄瓜86份渐渗系材料进行了田间农艺性状观察,发现渐渗系性状介于两亲本之间,具有部分野生种特有性状,如黑刺、节间短、多分枝等特点。其中筛选出的8份抗性渐渗系材料部分农艺性状见表 2。由表 2可见:CSIL59主节间最长,为12.3 cm;CSIL2主节间最短,为8.3 cm;CSIL52分枝数为10,是8份材料中最接近亲本野生种酸黄瓜,具有多分枝性状;CSIL59分枝数为2,接近轮回亲本‘北京截头’,具有少分枝特点;叶色中除CSIL59颜色为黄绿,其他均为绿色;叶形中CSIL41为掌状叶形,其他均为心状五角或掌状五角叶形;商品瓜瓜形中CSIL2为卵圆形、CSIL49为短棒状、CSIL72为短圆筒,其他均为长圆筒;商品瓜瓜皮色CSIL2、CSIL58、CSIL59、CSIL72为绿色,其他4种为浅绿色;CSIL2无瓜刺,其他均为白色;瓜把长为1.4~4.9 cm,种瓜为300~1 250 g。田间农艺性状显示,该渐渗系群体中具有部分野生酸黄瓜特有的性状,说明该渐渗系为种间杂交后代,渐渗系中含有野生酸黄瓜的外源片段。
| 编号Code | 主节间长/cmInternodelength | 分枝数Number ofbranches | 叶色Leafcolor | 叶形Leafshape | 叶片长/cmLeaflength | 叶片宽/cmLeafwidth | 叶柄长/cmPetiolelength | 商品瓜瓜形Goodsmelon-shaped | 商品瓜瓜皮色Goodsrind color | 瓜刺色Spinecolor | 瓜长/cmMelonlength | 瓜把长/cmCarpopodiumlength | 种瓜质量/gMelonsweight |
| 酸黄瓜C.hystrix | 4.1 | 14 | 墨绿Dark green | 心状五角Heart pentagon | 10.5 | 11.7 | 5.2 | 纺锤形Fusiform | 绿色Green | 黑色Black | 4.6 | 0.5 | 11 |
| 北京截头Beijingjietou | 14.5 | 2 | 绿Green | 心状五角Heart pentagon | 25.5 | 28.5 | 21.5 | 长圆筒Long cylindrical | 墨绿Dark green | 白色White | 33.5 | 5.7 | 550 |
| CSIL2 | 8.3 | 8 | 绿Green | 心状五角Heart pentagon | 22.8 | 20.1 | 14.6 | 卵圆形Ovoid | 绿Green | 无刺Stingless | 17.5 | 1.4 | 425 |
| CSIL41 | 10.8 | 3 | 绿Green | 掌状Palmate | 31.0 | 26.8 | 19.1 | 长圆筒Long cylindrical | 浅绿Light green | 白色White | 24.8 | 3.0 | 500 |
| CSIL49 | 12.0 | 5 | 绿Green | 心状五角Heart pentagon | 25.4 | 26.0 | 22.0 | 短棒Short rod | 浅绿Light green | 白色White | 16.8 | 4.9 | 350 |
| CSIL52 | 11.7 | 10 | 绿Green | 掌状五角Palmate pentagon | 28.5 | 24.3 | 23.3 | 长圆筒Long cylindrical | 浅绿Light green | 白色White | 33.0 | 2.8 | 500 |
| CSIL57 | 8.8 | 3 | 绿Green | 心状五角Heart pentagon | 24.2 | 22.8 | 18.3 | 长圆筒Long cylindrical | 浅绿Light green | 白色White | 28.8 | 1.9 | 1 250 |
| CSIL58 | 10.5 | 6 | 绿Green | 心状五角Heart pentagon | 25.8 | 26.3 | 14.5 | 长圆筒Long cylindrical | 绿Green | 白色White | 22.3 | 3.2 | 300 |
| CSIL59 | 12.3 | 2 | 黄绿Yellow green | 掌状五角Palmate pentagon | 27.8 | 26.0 | 18.2 | 长圆筒Long cylindrical | 绿Green | 白色White | 24.7 | 3.1 | 350 |
| CSIL72 | 11.6 | 0 | 绿Green | 心状五角Heart pentagon | 25.4 | 25.8 | 16.8 | 短圆筒Short cylindrical | 绿Green | 白色White | 21.5 | 2.5 | 350 |
在形态学鉴定的基础上,对渐渗系群体进行了分子鉴定。利用已经公布的黄瓜染色体上995对SSR标记对双亲之间的多态性进行筛选,检测出359对标记在亲本间具有多态性,多态性比率为35.8%,其中有112对标记可在回交世代中扩增出来自酸黄瓜的特异片段,SSR标记对回交自交后代导入片段检测如图 1所示。这个结果提供了此渐渗系群体为酸黄瓜与‘北京截头’的实证,说明野生酸黄瓜的DNA片段已经通过种间杂交及回交方式将其渐渗到后代基因组中,为渐渗系的真实性提供了可靠证明。
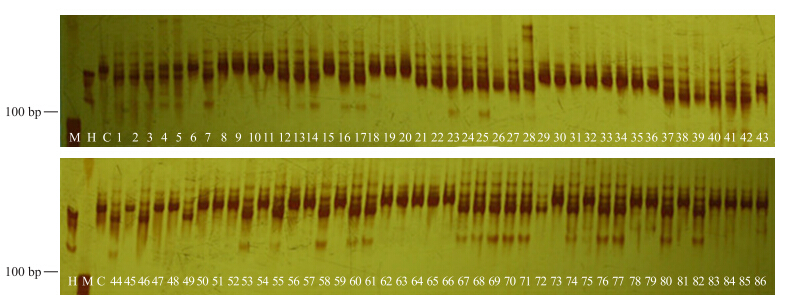 | 图 1 标记16130在双亲和86份渐渗系中的扩增结果 Fig. 1 The amplification of marker 16130 in parents and 86 introgression lines M:DNA marker;H:野生酸黄瓜Sour-cucumber;C:普通栽培黄瓜‘北京截头’Cultivated cucumber‘Beijingjietou’;1~86:渐渗系Introgression lines |
由表 2可见:供试材料中未发现对蔓枯病免疫和高抗的材料,86份群体间抗性存在明显的差异,其中表现抗性的有8份,分别为CSIL2、CSIL41、CSIL49、CSIL52、CSIL57、CSIL58、CSIL59、CSIL72,占总材料9%,其中CSIL72抗病性最强(病情指数为36);表现感病的材料有64份,占总材料74%;表现高感的材料有14份,占总材料17%。
| 编号Code | 平均病级The averagedisease level | 病情指数Diseaseindex | 抗性类型Resistancetype | 编号Code | 平均病级The averagedisease level | 病情指数Diseaseindex | 抗性类型Resistancetype | 编号Code | 平均病级The averagedisease level | 病情指数Diseaseindex | 抗性类型Resistancetype | ||
| CSIL1 | 6.00±1.044 | 67 | S | CSIL30 | 6.17±1.030 | 69 | S | CSIL59 | 3.33±0.816 | 37 | R | ||
| CSIL2 | 4.00±1.044 | 44 | R | CSIL31 | 6.00±1.054 | 67 | S | CSIL60 | 5.86±1.069 | 65 | S | ||
| CSIL3 | 5.00±0.853 | 56 | S | CSIL32 | 5.91±1.044 | 66 | S | CSIL61 | 5.20±0.632 | 58 | S | ||
| CSIL4 | 7.00±0.943 | 78 | HS | CSIL33 | 6.33±1.000 | 70 | S | CSIL62 | 6.60±0.843 | 73 | S | ||
| CSIL5 | 6.40±0.966 | 71 | S | CSIL34 | 6.00±1.044 | 67 | S | CSIL63 | 6.75±0.707 | 75 | S | ||
| CSIL6 | 5.83±1.030 | 65 | S | CSIL35 | 6.27±1.009 | 66 | S | CSIL64 | 8.00±1.155 | 89 | HS | ||
| CSIL7 | 5.00±0.853 | 56 | S | CSIL36 | 6.27±1.009 | 66 | S | CSIL65 | 7.50±0.926 | 83 | HS | ||
| CSIL8 | 6.60±0.843 | 73 | S | CSIL37 | 7.00±1.155 | 78 | HS | CSIL66 | 5.50±0.926 | 61 | S | ||
| CSIL9 | 7.55±0.934 | 84 | HS | CSIL38 | 5.50±0.926 | 61 | S | CSIL67 | 5.25±0.707 | 58 | S | ||
| CSIL10 | 6.64±0.809 | 74 | S | CSIL39 | 5.60±0.966 | 62 | S | CSIL68 | 5.67±1.033 | 63 | S | ||
| CSIL11 | 5.36±0.809 | 60 | S | CSIL40 | 6.00±1.054 | 67 | S | CSIL69 | 6.40±0.966 | 71 | S | ||
| CSIL12 | 6.50±0.926 | 67 | S | CSIL41 | 3.89±1.054 | 43 | R | CSIL70 | 5.00±0.000 | 56 | S | ||
| CSIL13 | 6.50±0.905 | 72 | S | CSIL42 | 5.29±0.756 | 59 | S | CSIL71 | 4.50±0.926 | 50 | S | ||
| CSIL14 | 4.78±0.667 | 53 | S | CSIL43 | 5.44±0.882 | 60 | S | CSIL72 | 3.22±0.667 | 36 | R | ||
| CSIL15 | 5.00±0.894 | 56 | S | CSIL44 | 7.50±1.000 | 83 | HS | CSIL73 | 5.00±1.000 | 56 | S | ||
| CSIL16 | 5.55±0.934 | 62 | S | CSIL45 | 7.00±1.265 | 78 | HS | CSIL74 | 6.50±0.926 | 72 | S | ||
| CSIL17 | 5.20±0.632 | 58 | S | CSIL46 | 5.40±0.894 | 60 | S | CSIL75 | 6.33±1.033 | 70 | S | ||
| CSIL18 | 5.75±1.035 | 64 | S | CSIL47 | 7.00±1.633 | 78 | HS | CSIL76 | 5.75±1.035 | 64 | S | ||
| CSIL19 | 6.11±1.054 | 68 | S | CSIL48 | 7.00±0.943 | 78 | HS | CSIL77 | 5.25±0.707 | 58 | S | ||
| CSIL20 | 4.82±0.603 | 54 | S | CSIL49 | 3.80±1.095 | 42 | R | CSIL78 | 6.25±1.035 | 69 | S | ||
| CSIL21 | 6.09±1.044 | 68 | S | CSIL50 | 5.22±0.667 | 58 | S | CSIL79 | 6.40±0.966 | 71 | S | ||
| CSIL22 | 5.80±1.033 | 64 | S | CSIL51 | 5.00±0.00 | 56 | S | CSIL80 | 7.40±0.894 | 82 | HS | ||
| CSIL23 | 5.89±1.054 | 65 | S | CSIL52 | 4.00±1.095 | 44 | R | CSIL81 | 7.75±1.035 | 86 | HS | ||
| CSIL24 | 6.00±1.044 | 59 | S | CSIL53 | 7.40±0.894 | 82 | HS | CSIL82 | 5.89±1.054 | 65 | S | ||
| CSIL25 | 5.33±0.778 | 59 | S | CSIL54 | 4.60±0.843 | 51 | S | CSIL83 | 5.33±0.816 | 59 | S | ||
| CSIL26 | 4.82±0.603 | 54 | S | CSIL55 | 5.40±0.843 | 60 | S | CSIL84 | 6.50±0.926 | 72 | S | ||
| CSIL27 | 6.09±1.044 | 68 | S | CSIL56 | 7.29±0.756 | 81 | HS | CSIL85 | 7.22±0.667 | 80 | HS | ||
| CSIL28 | 6.75±0.707 | 75 | S | CSIL57 | 3.50±0.926 | 39 | R | CSIL86 | 6.00±1.069 | 67 | S | ||
| CSIL29 | 6.11±1.054 | 61 | S | CSIL58 | 4.00±1.155 | 44 | R | C | 7.25±0.707 | 81 | HS | ||
| S:感;HS:高感;C:北京截头。 Note:R:Resistance;S:Susceptible;HS:High susceptible;C:Beijingjietou. | |||||||||||||
田间观察表明:抗蔓枯病的黄瓜渐渗系材料如CSIL72,染病后叶片仅形成零星状病斑,且多发于植株基部1~2片老叶,病情发展较慢且较轻,病斑不会扩大或蔓延成片,叶缘并未形成“V”型病斑,而感病材料接种后病情发展较快,易在叶缘处形成典型“V”型病斑,由外缘向中心发展并不断扩大蔓延成片,且叶片渐渐褪绿发黄,导致病情严重,抗感渐渗系材料在茎基部发病情况差异显著,一般叶部发病较轻的单株茎基部发病也相对较轻,反之,则较重。但茎基部发病较轻的单株叶部发病不一定较轻,两者并未发现明显关联性。 3 讨论
从野生资源中发掘有益基因,大量筛选具有野生外源基因的特异种质,对于种质遗传特性研究或直接用于常规育种的性状转育具有重要意义,早期已在水稻和番茄上实践并获得成功[16, 17]。通过构建种间渐渗系可有效转育野生种中的优良性状,拓宽现有资源育种的瓶颈,具有巨大利用价值。目前,在水稻和小麦等主要作物上已开展了通过渐渗系转移和利用野生种有利基因的研究,如在水稻上利用渐渗系鉴定和定位了多个抗白叶枯病、抗褐飞虱、抗稻瘟病基因[18, 19];在小麦中则利用普通小麦-提莫菲维小麦渐渗系定位了抗白粉病基因Pm 6 [20, 21]。另外,小麦中利用渐渗系群体,通过二倍体/多倍体穿梭作图策略,图位克隆法克隆到了小麦抗叶锈病基因Lr21 [22]。这些研究充分体现了渐渗系在野生种优异基因的发掘上具有巨大优势。
黄瓜蔓枯病抗病资源比较缺乏,且我国研究起步较晚、研究较少,遗传基础狭窄,变异率仅为3%~8%,这已成为黄瓜抗病性改良的瓶颈问题。前人在黄瓜抗蔓枯病研究中曾进行了抗性品种筛选,由于前人鉴定的品种均来源于不同地区,背景差异较大,环境效应影响较大,抗病稳定性相对较差,不能获得永久的种质资源库。然而渐渗系群体是永久群体,不同的研究者可在不同时间、不同地点进行试验,所获得的结果可在数据库中累加,且在多次回交中使得连锁基因间重组率提高,可缩小QTL作图区间,降低连锁累赘的影响。Ren等[13]通过野生酸黄瓜与栽培黄瓜‘北京截头’的种间杂交,染色体加倍合成新的异源四倍体,再与栽培黄瓜‘北京截头’进行回交、自交,获得了具有不同表型性状的渐渗育种材料,经证实,黄瓜-酸黄瓜渐渗系中蕴含多种有益外源基因。利用SSR分子标记对回交自交后代进行检测,能快速准确对比渐渗系与野生酸黄瓜片段异同。本研究通过对黄瓜-酸黄瓜种间渐渗系苗期人工接种鉴定和筛选,从86份渐渗系中筛选出8份抗性材料、64份感病材料和14份高感的材料,所获得的8份抗蔓枯病渐渗系材料可直接利用其渐渗系的优势,用于黄瓜抗蔓枯病育种研究,为抗蔓枯病遗传特性、机制研究及基因定位等工作提供有利材料,同时也可直接用于育种实践。利用苗期进行温室人工接种抗性鉴定的方法,可减少田间自然发病鉴定导致的不可控环境中生物及非生物对植物造成的影响从而干扰鉴定结果[23],也可减少离体接种鉴定导致黄瓜鉴定过程中叶片失水严重,叶片失绿黄化,影响幼苗正常生长发育等因素带来的结果差异,苗期鉴定既简单经济又方便可靠,不仅省时省力,更能加快品种的抗性筛选过程,这种方法在番茄、大白菜等作物上均有报道[24, 25]。
通过远缘杂交或渐渗杂交获得的种间杂交渐渗系可用于拓宽黄瓜的遗传基础,突破长期限制传统育种遗传背景狭窄的瓶颈;也可构成普通栽培黄瓜遗传改良的优异外源基因库,用于种质遗传特性分析和发掘不同抗性的优异基因源,进一步挖掘野生资源基因库中有益QTL。在此基础上也可明确抗原的遗传规律,通过杂交、回交等手段获得多抗品种,提高黄瓜综合性状,是提高黄瓜抗病性和抗逆性的重要途径。将黄瓜-酸黄瓜渐渗系中优异的种质资源加以利用,这对于打破黄瓜遗传背景狭窄的瓶颈状态并发掘野生资源优异基因及其精细定位、基因的图位克隆及品种的遗传改良等具有广泛的应用前景。
| [1] | 孙元超. 怎样防治黄瓜蔓枯病[J]. 现代农村科技, 2010(17):24-25[Sun Y C. How to control cucumber gummy stem blight[J]. Modern Rural Science and Technology, 2010(17):24-25(in Chinese)] |
| [2] | 王培双, 董勤成. 瓜类蔓枯病重发原因及综合防治措施[J]. 安徽农学通报, 2010, 16(14):140-142[Wang P S, Dong Q C. Reason and comprehensive control measures of melon gummy stem blight[J]. Anhui Agricultural Science Bulletin, 2010, 16(14):140-142(in Chinese)] |
| [3] | Hajjar R, Hodgkin T. The use of wild relatives in crop improvement:a survey of developments over the last 20 years[J]. Euphytica, 2007, 156:1-13 |
| [4] | Kole C. Genome Mapping and Molecular Breeding in Plants[M]. New York:Springer Publishing Corporation, 2007:184-190 |
| [5] | Sela-Buurlage M B, Budai H, Budai-Hadrian O, et al. Genome-wide dissection of Fusarium resistance in tomato reveals multiple complex loci[J]. Molecular Genetics and Genomics, 2001, 265:1104-1111 |
| [6] | Song W Y, Wang GL, Chen L L, et al. A receptor kinase-like protein encoded by the rice disease resistance gene, Xa21[J]. Science, 1995, 270(5243):1804-1806 |
| [7] | Eshed Y, Abied M, Saranga Y, et al. Lycopersicon esculentum lines containing small overlapping introgressions from L.pennellii[J]. Theoretical and Applied Genetics, 1992, 83:1027-1034 |
| [8] | Zamir D. Improving plant breeding with exotic genetic libraries[J]. Nature Review Genetics, 2001, 2:983-989 |
| [9] | Chen J F, Staub J E, Qian C T, et al. Reproduction and cytogenetic characterization of interspecific hybrids derived from Cucumis hystrix Chakr.×Cucumis sativus L.[J]. Theoretical and Applied Genetics, 2003, 106(4):688-695 |
| [10] | Chen J F, Staub J E, Tashiro Y, et al. Successful interspecific hybridization between Cucumis sativus L.and C.hystrix Chakr.[J]. Euphytica, 1997, 96(3):413-419 |
| [11] | Chen J F, Kirkbride J H. A new synthetic species of Cucumis(Cucurbitaceae)from interspecific hybridization and chromosome doubling[J]. Brittonia, 2000, 52(4):315-319 |
| [12] | 朱德蔚, 李锡香. 黄瓜种质资源描述规范和数据标准[M]. 北京:中国农业出版社, 2005:56-74[Zhu D W, Li X X. Descriptors and Data Standard for Cucumber(Cucumis sativus L.)[M]. Beijing:China Agriculture Press, 2005:56-74(in Chinese)] |
| [13] | Ren Y, Zhang Z H, Liu J H, et al. An integrated genetic and cytogenetic map of the cucumber genome[J]. PLoS ONE, 2009, 4(6):e5795 |
| [14] | 李英. 瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选[D]. 南京:南京农业大学, 2007[Li Y. Study on biology characteristics of Didymella bryoniae and screening of resistance germplasm of cucumber[D]. Nanjing:Nanjing Agricultural University, 2007(in Chinese with English abstract)] |
| [15] | Wehner T C, Shetty N V. Screening the cucumber germplasm collection for resistance to gummy stem blight in North Carolina field tests[J]. HortScience, 2000, 35(6):1132-1140 |
| [16] | Xiao J, Gradillo S, Ahn S N, et al. Genes from wild rice improve yield[J]. Nature, 1996, 384:223-224 |
| [17] | Tanksley S D, McCouch S R. Seed banks and molecular maps:unlocking genetic potential from the wild[J]. Science, 1997, 277:1063-1066 |
| [18] | Jena K K, Pasalu I C, Rao Y K, et al. Molecular tagging of a gene for resistance to brown planthopper in rice(Oryza sativa L.)[J]. Euphytica, 2002, 129(1):81-88 |
| [19] | Gu K, Tian D, Yang F, et al. High-resolution genetic mapping of Xa27(t), a new bacterial blight resistance gene in rice, Oryza sativa L.[J]. Theoretical and Applied Genetics, 2004, 108(5):800-807 |
| [20] | 陶文静, 刘金元, 刘大钧, 等. 普通小麦-提莫菲维小麦白粉病抗性渐渗系中渗入片段的准确鉴定[J]. 植物学报, 1999, 41(9):941-946[Tao W J, Liu J Y, Liu D J, et al. Precise identification of the introgressed segment in powdery mildew resistant introgression lines of Triticum aestivum T.timopheevi[J]. Journal of Botany, 1999, 41(9):941-946(in Chinese with English abstract)] |
| [21] | 陶文静, 刘金元, 刘大钧, 等. 与小麦抗白粉病基因Pm6紧密连锁的分子标记筛选[J]. 遗传学报, 1999, 26(6):649-656[Tao W J, Liu J Y, Liu D J, et al. Identification of molecular markers for the powdery mildew resistance gene Pm6 in wheat(Triticum aestivum L.)[J]. Journal of Genetics and Genomics, 1999, 26(6):649-656(in Chinese with English abstract)] |
| [22] | Huang L, Brooks S A, Li W, et al. Map-based cloning of leaf rust resistance gene Lr21 from the large and polyploid genome of bread wheat[J]. Genetics, 2003, 164(2):655-664 |
| [23] | 韦巧捷, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效[J]. 南京农业大学学报, 2013, 36(1):40-46. doi:10.7685/j.issn.1000-2030.2013.01.008[Wei Q J, Zheng X Y, Deng K Y, et al. Screening and identification of antagonistic Bacillus vallismortis B against cucumber Fusarium wilt and its biological effect[J]. Journal of Nanjing Agricultural University, 2013, 36(1):40-46(in Chinese with English abstract)] |
| [24] | 季佐军, 葛慧佳, 许向阳. 番茄芝麻斑病苗期抗性鉴定方法及抗病种质资源筛选[J]. 东北农业大学学报, 2009, 40(11):23-27[Ji Z J, Ge H J, Xu X Y. Identification method of tomato Helmlnthosporlum fruit rot at seedling stage and screening of resistant germplasm resources[J]. Journal of Northeast Agricultural University, 2009, 40(11):23-27(in Chinese with English abstract)] |
| [25] | 芦燕, 张鲁刚. 陕西省大白菜黑腐病苗期人工接种抗性鉴定方法研究[J]. 西北农业学报, 2008, 17(4):219-222[Lu Y, Zhang L G. Study on resistance identification method of black rot at seedling stage of Chinese cabbage in Shaanxi Province[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2008, 17(4):219-222(in Chinese with English abstract)] |




