文章信息
- 张瑜, 郭荔, 豆丹丹, 任伟龙, 王丽平. 2015.
- ZHANG Yu, GUO Li, DOU Dandan, REN Weilong, WANG Liping. 2015.
- 脂多糖对猪肝脏、肾脏和小肠组织中P-糖蛋白表达的影响
- Effect of LPS on P-glycoprotein localization and expression in live,kidney and small intestines of swine
- 南京农业大学学报, 38(2): 311-317
- Journal of Nanjing Agricultural University, 38(2): 311-317.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.020
-
文章历史
- 收稿日期:2014-07-14
P-糖蛋白(P-glycoprotein,P-gp)属于ATP结合盒式(ATP-binding cassette,ABC)转运蛋白超家族[1],是由mdr 1 基因编码的一种底物覆盖面极广的药物外排泵。P-gp首先在癌细胞中被发现,后来发现其也广泛分布于一些屏障组织(如血脑屏障、胎盘屏障)、排泄器官(包括肝脏、肾脏)及肠道等[2, 3]。作为机体重要的保护屏障,P-gp一方面能保护机体免受外来物质或内源性毒素的干扰[4];另一方面,其也能影响药物的吸收,促进药物的消除[5],从而影响药物在机体内的生物利用度并可能介导药物间的相互作用。基于P-gp对口服药物生物利用度的影响以及其介导的药物间相互作用产生的药物毒性会对兽医临床用药产生重要影响,故对家畜P-gp功能及调控的研究具有重要意义。
P-gp的表达可受年龄、疾病状况等很多因素的影响,尤其感染引起的急性期反应会造成病理生理学的改变,可影响药物的吸收、分布、代谢和排泄过程[6]。如Hanafy等[7]发现炎症能改变一些药物转运体的表达,从而影响药物在体内的药动学过程,并导致治疗的失败。研究证明细菌的脂多糖(lipopolysaccharide,LPS)处理可以作为感染和炎症的一个重要模型,并且LPS会导致机体P-gp的表达和功能发生变化[8],但LPS对P-gp表达和功能影响的研究目前多集中于大鼠和体外细胞[9, 10, 11, 12],而有关LPS处理对猪组织内P-gp表达的影响鲜有报道。本试验拟采用免疫组织化学的方法对P-gp在健康和LPS处理猪肝脏、肾脏、空肠和回肠的分布及蛋白表达差异进行比较研究,为阐明药物转运蛋白的影响因素奠定基础,并为感染状态下猪的合理用药提供参考。 1 材料与方法 1.1 试剂
SABC试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司);抗P-gp抗体,C219(Covance,USA);脂多糖(分离自Escherichia coli O55:B5,Sigma);猪IL-1β、IL-6的ELISA检测试剂盒(R&D公司)。 1.2 试验动物及其处理
15头60日龄健康三元仔猪,购自南京青龙山动物繁殖基地,体质量为19~21 kg。将猪随机均分为3组,即健康对照组、肌注LPS处理3 h组及6 h组。其中,LPS处理组肌注剂量均为15 μg · kg-1,对照组肌注等量生理盐水。另外在LPS处理前及处理后1、2、3、4、5、6、8和12 h分别采集血样,并用ELISA方法测定IL-1β和IL-6水平。剖杀猪只,其中LPS处理组猪分别于3和6 h后剖杀,并在30 min内采集肝脏、肾脏、空肠和回肠,用体积分数为10%的中性甲醛固定,用于免疫组化分析。 1.3 组织切片制备及免疫组化染色
采集的各猪组织经乙醇梯度脱水、二甲苯透明及浸蜡等步骤处理后,做连续5 μm切片。切片经脱蜡后用体积分数为3%的H2O2封闭内源性过氧化物酶,并用0.01 mol · L-1枸橼酸盐缓冲液热修复抗原,暴露抗原位点,之后按SABC试剂盒说明中免疫组化染色程序进行。用体积分数为5%的牛血清白蛋白(BSA)于37 ℃温箱内封闭30 min,一抗为C219(1 ∶ 20稀释),二抗为羊抗鼠IgG。滴加SABC试剂后用DAB显示试剂盒(武汉博士德)显色,并用苏木精轻度复染,脱水,二甲苯透明,最后用中性树胶封片。阴性对照用PBS(pH 7.4)代替一抗,其余步骤相同。 1.4 免疫组化结果判定
每只动物选取5张切片,每张切片随机选取5个视野[13],高倍镜下以细胞浆或细胞膜出现定位清晰的棕褐色颗粒状物质的定义为阳性[14]。用Image-Pro Plus 4.0软件对每个视野中阳性反应面积(Area)和累积光密度值(IOD)进行了半定量统计,并对其结果进行统计学分析。 1.5 统计学处理
阳性反应面积(Area)和IOD值用x±SE形式表示,并采用SPSS 16.0统计软件对数据进行单因素方差分析(one-way ANOVA,LSD),用t测验进行差异显著性检验。 2 结果与分析 2.1 LPS处理炎症模型的建立
经肌注LPS后表观症状显示:猪只在LPS处理2~3 h时精神沉郁、步态不稳,鼻黏膜发绀,体温升高,部分猪还出现严重的呕吐、战栗症状。ELISA检测结果显示:LPS处理猪后血浆中细胞因子IL-1β和IL-6浓度均先显著升高然后降低,其中IL-1β和IL-6质量浓度在6和3 h达到最高(图 1)。临床症状结合ELISA的结果显示LPS成功诱导了炎症模型。
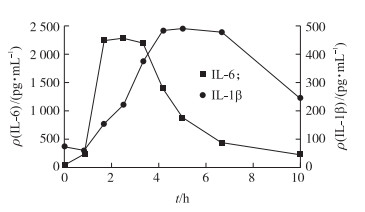 | 图 1 LPS处理不同时间猪血浆中IL-6和IL-1β 质量浓度变化 Fig. 1 Concentration changes of IL-6 and IL-1β in plasma of pigs after LPS treatment |
经免疫组化DAB法染色的切片可见,正常及LPS处理后的猪肝脏、肾脏、空肠和回肠的P-糖蛋白阳性反应部位呈棕褐色,阴性对照对应部位均未染色,说明免疫组化SABC法免疫反应特异性良好。如图 2所示,健康对照组肝脏完整性良好,光学显微镜下可见肝小叶中间的中央静脉及其周围呈放射状排列的肝细胞板,且P-gp特异性定位于肝细胞之间的胆小管膜上(图 2-A);阴性对照则无此特异反应(图 2-B)。在LPS处理猪肝小叶内,P-糖蛋白仍定位于肝细胞之间的胆小管膜上,且LPS处理3 h(图 2-C)后P-gp特异性反应加深,处理时间延长至6 h(图 2-D)时恢复至正常。
 |
图 2 P-gp在猪肝脏组织的免疫组化染色定位及半定量统计分析 Fig. 2 Immunohistochemistry staining and semi-quantitation of P-gp in the liver of pigsA.健康对照;B.阴性对照;C.LPS处理3 h;D.LPS处理6 h;E.猪肝脏中P-gp的半定量分析 A.Healthy control;B.Negative control;C.LPS for 3 h;D.LPS for 6 h;E.Semi-quantitation of P-gp in liver of pigs. *和* *分别表示差异显著(P<0.05)和差异极显著(P<0.01);箭头表示P-gp的阳性反应。 * and * * mean significant difference at 0.05 and 0.01 levels,respectively;The arrows showed the positive reaction of P-gp.The same as follows. |
为了验证免疫组化结果,用Image-Pro Plus 4.0软件对健康及LPS处理猪各组织的特异性免疫反应进行了半定量。所得结果用IOD值和阳性反应面积表示(图 2-E),结果分析可见,LPS处理肝脏3 h和健康肝脏相比,阳性反应面积极显著增大(P<0.01),IOD值显著增大(P<0.05);6 h处理组和对照相比差异不显著,但与3 h处理组相比阳性反应面积极显著降低(P<0.01)。 2.3 LPS处理后对猪肾脏中P-gp表达量的影响 如图 3-A~D所示:在健康猪及LPS处理猪肾脏内,P-gp均定位于近端小管和远端小管的细胞膜上,LPS处理3 h后P-gp特异性反应逐渐加强,至6 h后阳性反应显著增强。图 3-E显示:LPS处理6 h组和健康组相比,P-gp的阳性反应面积显著增加(P<0.05),但IOD值均无显著差异(P>0.05)。
 |
图 3 P-gp在猪肾脏组织的免疫组化染色定位及半定量统计分析 Fig. 3 Immunohistochemistry staining and semi-quantitation of P-gp in the kidney of pigs A.健康对照;B.阴性对照;C.LPS处理3 h;D.LPS处理6 h;E.猪肾脏中P-gp的半定量分析 A.Healthy control;B.Negative control;C.LPS for 3 h;D.LPS for 6 h;E.Semi-quantitation of P-gp in kidney of pigs |
如图 4-A~D所示:在健康猪及LPS处理猪空肠内,P-gp均定位于空肠绒毛的上皮细胞顶端,在肠腺主要定位于靠近腔面的细胞顶端。LPS处理3 h后P-gp特异性反应加强,处理6 h后染色强度和对照相差不大。LPS处理3 h组与对照组相比反应面积显著增加(P<0.05),6 h组与3 h组相比,阳性反应面积显著减少(P<0.05),但与对照组相比,差异不显著(图 4-E)。
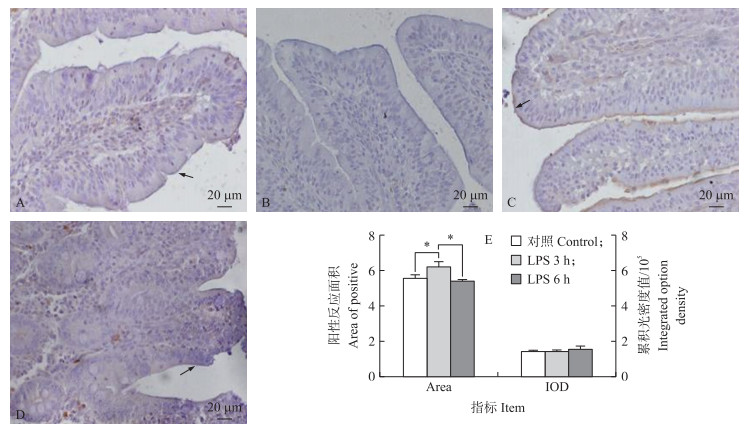 |
图 4 P-gp在猪空肠组织的免疫组化染色定位及半定量统计分析 Fig. 4 Immunohistochemistry staining and semi-quantitation of P-gp in the jejunum of pigsA.健康对照;B.阴性对照;C.LPS处理3 h;D.LPS处理6 h;E.猪空肠中P-gp的半定量分析 A.Healthy control;B.Negative control;C.LPS for 3 h;D.LPS for 6 h;E.Semi-quantitation of P-gp in jejunum of pigs |
如图 5-A~D所示:在健康猪及LPS处理猪回肠内,P-gp均定位于上皮细胞顶端及细胞核下方的胞膜上,在小肠腺主要定位于腔面细胞的顶端。LPS处理3 h后P-gp特异性反应略有加深,处理6 h后渐弱,但图 5-E显示LPS处理组与健康组的阳性反应面积和IOD值统计学上均无显著差异(P>0.05)。
 |
图 5 P-gp在猪回肠组织的免疫组化染色定位及半定量统计分析 Fig. 5 Immunohistochemistry staining and semi-quantitation of P-gp in the ileum of pigsA.健康对照;B.阴性对照;C.LPS处理3 h;D.LPS处理6 h;E.猪回肠中P-gp的半定量分析 A.Healthy control;B.Negative control;C.LPS for 3 h;D.LPS for 6 h;E.Semi-quantitation of P-gp in ileum of pigs |
P-gp最早在对秋水仙碱耐药的中国仓鼠卵巢细胞中发现,后来发现其在肿瘤细胞中大量表达[15]。近年来的研究表明P-gp也存在于人的屏障系统和代谢、排泄器官中,对其介导的正常生理功能的研究取得了一定成果[2],但是在兽医领域尚未开展广泛研究,尤其对P-gp表达和功能的影响因素及其机制研究尚待深入。本研究以此为切入点,首先探讨了LPS处理对仔猪肝脏、肾脏和小肠组织中P-gp定位及表达的影响。
大肠杆菌感染机体后,一部分自然死亡的细菌(尤其是革兰氏阴性菌)或者抗菌药物杀死的细菌会裂解释放内毒素。内毒素被感染受损的肠道上皮细胞吸收并分布至机体组织器官,进而产生损伤作用。所以目前常用LPS处理动物作为革兰氏阴性菌感染产生炎症的模型[8]。猪大肠杆菌病是由致病性大肠杆菌引起,主要毒力因子包括内毒素、黏附素、肠毒素等[16]。本研究基于此采用LPS处理仔猪诱导炎症模型来模拟临床中大肠杆菌感染病例,探讨其对仔猪组织中P-gp表达和定位的影响。本试验所用的LPS来源为Escherichia coli O55:B5菌株,但是临床中造成机体感染的大肠杆菌菌株多样,其释放的LPS含量或毒力也不同,故对机体造成的损伤程度可能与实验室条件下的处理有一定差异。但在没有更好的模型之前,LPS处理模拟细菌感染仍是一个较为实用的炎症模型。Guo等[17]研究发现大肠杆菌感染肉鸡会显著上调肾脏、空肠和回肠的mdr 1 mRNA水平,与Bughio[18]采用LPS处理肉鸡取得的研究结果相一致,进一步佐证了LPS处理模型与大肠杆菌感染模型具有一定的相关性。
本试验结果显示正常仔猪中P-gp主要定位于猪肝细胞之间的胆小管膜、肾脏近端小管和远端小管细胞膜、小肠绒毛上皮细胞顶端和肠腺靠近腔面的细胞顶端,这与Schrickx[19]的研究结果类似。健康仔猪肌注LPS后并未改变其在组织中的定位,这与已有的大鼠和人的报道结果相似[13, 20],但也有报道显示LPS处理或大肠杆菌感染会对转运蛋白的膜定位产生影响,如Apodaca[21]发现LPS可诱导极化的内皮细胞中多药耐药相关蛋白2(MRP2)的易位;Guo等[17]研究发现发现大肠杆菌感染会引起肉鸡P-gp在肝脏和肾脏细胞中的分布有向细胞浆迁移的趋势。有关LPS对P-gp定位影响的结果存在差异的原因,推测可能与动物种属或体内外试验差异有关。
虽然LPS对猪不同组织中P-gp的定位未产生影响,但采用Image-Pro Plus 4.0软件对免疫组化结果进行半定量分析的结果显示LPS处理3或6 h后,与对照组相比,仔猪肝脏、肾脏和空肠中P-gp的表达量会显著上升。此结果提示LPS处理早期P-gp表达升高可以增强其外排功能,促进有毒有害物质从机体进行排泄,故对机体起到一定的保护作用,但同时也会降低P-gp底物治疗药物的生物利用度从而导致治疗失败。人和大鼠以及细胞体外试验均已证实LPS处理会对P-gp的表达和功能产生影响,但结果存在差异。如Heemskerk等[22]发现,LPS处理后的大鼠肾近端小管P-gp的表达增多,外排功能增强;Mishra等[12]发现,LPS处理SW480细胞后Western检测P-gp的蛋白水平并没有发生改变,但免疫荧光结果显示P-gp在细胞表面的分布较对照组有所增加。而Goralski等[23]给雄性大鼠颅内注射大肠杆菌LPS 6 h造成中枢神经系统局部炎症后,发现大鼠脑和肝脏内mdr 1 a/P-gp表达降低,同时3H标记的地高辛在肝脏和脑部浓度增加,但在mdr1a-/-小鼠中并没有这种现象。Wang等[24]给小鼠腹腔注射大肠杆菌LPS 6 h后也发现小鼠的脑、心脏、肝脏中mdr 1 a mRNA和脑部P-gp水平下降,同时99mTc-sestamibi在这些组织中的蓄积增加。Tomita等[9]用在体灌流的方法表明,LPS诱导的炎症会降低由P-gp介导的罗丹明123在回肠和胆汁的排泄。Hartmann等[25]和Chen等[26]对啮齿类动物的研究也得到了相似的结果。由此显示LPS对不同种属P-gp表达影响不一致。本试验结果显示LPS处理早期可引起仔猪部分组织中P-gp的表达发生变化,提示其对药物的体内药动学过程会产生影响,值得引起重视。
综上,肌注LPS处理虽然未影响P-gp在猪肝脏、肾脏、空肠和回肠组织中的定位,但在一定程度上引起其在部分组织中的表达量上升。因此,在对大肠杆菌或其他革兰氏阴性菌感染猪用药时需考虑因为P-gp表达发生变化,从而对P-gp底物药物在猪体内的药动学过程和临床药效产生的影响。
| [1] | Aller S G, Yu J, Ward A, et al. Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding[J]. Science, 2009, 323:1718-1722 |
| [2] | Chan L M S, Lowes S, Hirst B H. The ABCs of drug transport in intestine and liver:efflux proteins limiting drug absorption and bioavailability[J]. European Journal of Pharmaceutical Sciences, 2004, 21(1):25-51 |
| [3] | Sugawara I, Kataoka I, Morishita Y, et al. Tissue distribution of P-glycoprotein encoded by a multidrug-resistant gene as revealed by a monoclonal antibody, MRK 16[J]. Cancer Research, 1988, 48(7):1926-1929 |
| [4] | Haritova A M, Rusenova N V, Rusenov A G, et al. Effects of fluoroquinolone treatment on MDR1 and MRP2 mRNA expression in Escherichia coli-infected chickens[J]. Avian Pathol, 2008, 37(5):465-470 |
| [5] | 扈正婷. 肠道转运蛋白P-糖蛋白对药物吸收的影响[J]. 食品与药品, 2008, 10(5):67-69 [Hu Z T. Contribution of intestinal transporters P-glycoprotein in drug absorption[J]. Food and Drug, 2008, 10(5):67-69(in Chinese with English abstract)] |
| [6] | 栾家杰, 宋建国. 药物转运体与药物体内过程[J]. 安徽医药, 2005, 9(10):721-723 [Luan J J, Song J G. Drug transporter and the disposition of drug in the body[J]. Anhui Medical and Pharmaceutical Journal, 2005, 9(10):721-723(in Chinese with English abstract)] |
| [7] | Hanafy S, El-Kadi A O, Jamali F. Effect of inflammation on molecular targets and drug transporters[J]. J Pharm Pharm Sci, 2012, 15(3):361-375 |
| [8] | Post L O, Farrell D E, Cope C V, et al. The effect of endotoxin and dexamethasone on enrofloxacin pharmacokinetic parameters in swine[J]. J Pharmacol Exp Ther, 2003, 304(2):889-895 |
| [9] | Tomita M, Kanbayashi A, Murata H, et al. Effect of lipopolysaccharide on P-glycoprotein-mediated intestinal and biliary excretion of rhodamine 123 in rats[J]. International Journal of Pharmaceutics, 2010, 392(1/2):35-41 |
| [10] | Shirasaka Y, Sakane T, Yamashita S. Effect of P-glycoprotein expression levels on the concentration-dependent permeability of drugs to the cell membrane[J]. Journal of Pharmaceutical Sciences, 2008, 97(1):553-565 |
| [11] | Kato R, Moriguchi J, Irie T, et al. Effects of lipopolysaccharide on P-glycoprotein expression and activity in the liver and kidneys[J]. European Journal of Pharmacology, 2010, 636(1/2/3):155-158 |
| [12] | Mishra J, Zhang Q, Rosson J L, et al. Lipopolysaccharide increases cell surface P-glycoprotein that exhibits diminished activity in intestinal epithelial cells[J]. Drug Metabolism and Disposition:the Biological Fate of Chemicals, 2008, 36(10):2145-2149 |
| [13] | 张小丽, 李非, 崔叶青. 长期高脂饮食诱导大鼠胰腺急慢性损伤的机制研究[J]. 中华肝胆外科杂志, 2010, 16(3):191-195 [Zhang X L, Li F, Cui Y Q. Mechanisms of pancreatic injury induced by long-term high-fat diet intake in rats[J]. Chinese Journal of Hepatobiliary Surgery, 2010, 16(3):191-195(in Chinese with English abstract)] |
| [14] | 李云锋, 王建美, 李鹏成, 等. 猪肺炎支原体弱毒株与佐剂配合鼻腔免疫对仔猪呼吸道抗体分泌细胞的影响[J]. 南京农业大学学报, 2013, 36(1):103-107. doi:10.7685/j.issn.1000-2030.2013.01.018 [Li Y F, Wang J M, Li P C, et al. Effects of intranasal immunization with attenuated Mycoplasma hyopneumoniae strain in combination with adjuvant on the antibody secreting cells in pig respiratory tract[J]. Journal of Nanjing Agricultural University, 2013, 36(1):103-107(in Chinese with English abstract)] |
| [15] | 何一, 王崇树, 张才全. 多药耐药蛋白——P-gp的研究进展[J]. 四川肿瘤防治, 2004, 17(4):257-263 [He Y, Wang C S, Zhang C Q. Research progress of multidrug resistance protein P-gp[J]. Sichuan Journal of Cancer Control, 2014, 17(4):257-263(in Chinese)] |
| [16] | 苟万里, 周碧君, 冯元璋, 等. 猪大肠杆菌病病原学研究进展[J]. 仲恺农业技术学院学报, 1998, 11(3):63-70 [Gou W L, Zhou B J, Feng Y Z, et al. Development of pathogenic studies of colibacillosis of piglets[J]. Journal of Zhongkai Agrotechnical College, 1998, 11(3):63-70(in Chinese with English abstract)] |
| [17] | Guo M, Sun Y, Zhang Y, et al. E.coli infection modulates the pharmacokinetics of oral enrofloxacin by targeting P-glycoprotein in small intestine and CYP450 3A in liver and kidney of broilers[J]. PLoS One, 2014, 9(1):e87781 |
| [18] | Bughio S. Modulation of P-glycoprotein by growing age and LPS exposure as well as its effect on the pharmacokinetics of enrofloxacin in broilers[D]. Nanjing:Nanjing Agricultural University, 2014 |
| [19] | Schrickx J A. ABC-transporters in the pig[D]. Utrecht:Utrecht University, 2006 |
| [20] | Heemskerk S, van Koppen A, van den Broek L, et al. Nitric oxide differentially regulates renal ATP-binding cassette transporters during endotoxemia[J]. Pflugers Archiv:European Journal of Physiology, 2007, 454(2):321-334 |
| [21] | Apodaca G. Endocytic traffic in polarized epithelial cells:role of the actin and microtubule cytoskeleton[J]. Traffic, 2001, 2(3):149-159 |
| [22] | Heemskerk S, Peters J G P, Louisse J, et al. Regulation of P-glycoprotein in renal proximal tubule epithelial cells by LPS and TNF-alpha[J]. Journal of Biomedicine and Biotechnology, 2010. doi:10.1155/2010/525180 |
| [23] | Goralski K B, Hartmann G, Piquette-Miller M, et al. Downregulation of mdr1a expression in the brain and liver during CNS inflammation alters the in vivo disposition of digoxin[J]. British Journal of Pharmacology, 2003, 139(1):35-48 |
| [24] | Wang J H, Scollard D A, Teng S, et al. Detection of P-glycoprotein activity in endotoxemic rats by 99mTc-sestamibi imaging[J]. The Journal of Nuclear Medicine, 2005, 46(9):1537-1545 |
| [25] | Hartmann G, Vassileva V, Piquette-Miller M. Impact of endotoxin-induced changes in P-glycoprotein expression on disposition of doxorubicin in mice[J]. Drug Metabolism and Disposition, 2005, 33(6):820-828 |




