文章信息
- 王辰, 张谷月, 张园园, 沈婷, 王世梅. 2015.
- WANG Chen, ZHANG Guyue, ZHANG Yuanyuan, SHEN Ting, WANG Shimei. 2015.
- 白刺链霉菌(Streptomyces albospinus)CT205菌株发酵条件优化及其次生代谢产物性质研究
- The optimization of fermentation conditions of Streptomyces albospinus CT205 and study of secondary metabolite
- 南京农业大学学报, 38(2): 304-310
- Journal of Nanjing Agricultural University, 38(2): 304-310.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.019
-
文章历史
- 收稿日期:2014-06-19
放线菌是一类重要的微生物资源,放线菌类群中的链霉菌属(Streptomyces)的许多成员都能产生在农业、医学等领域具有重要作用的次生代谢产物——抗生素,目前文献报道的抗生素有2/3产生于链霉菌属[1]。Waksman于1943年从链霉菌中首次发现了医用链霉素,1973年上海市农药研究所科研工作者从吸水链霉菌井冈变种(S.hygroscopicus var.jingganggensis)中分离出农用井冈霉素,目前井冈霉素仍是防治水稻纹枯病当家品种[2]。20世纪90年代后,中生菌素、武夷菌素等一些新的农用抗生素得到开发应用,还有一些天然农用抗菌物质正处于研发阶段[3]。产业化的农用抗生素对防治农作物病害起着举足轻重的作用,但就目前的数量、质量和品种而言还远远不能满足农业生产的需要。从现有知识及数据分析,链霉菌产生新型化合物的超强能力决定其将来仍是抗生素的主要来源[4]。
白刺链霉菌(S.albospinus)CT205是本实验室从土壤中分离的一株拮抗放线菌,对枯草芽孢杆菌、啤酒酵母菌及多种植物病原真菌具有抑制作用,盆栽试验及田间试验表明CT205对黄瓜枯萎病有较好的防控效果[5]。前人对白刺链霉菌的研究报道较少,国内仅郁蕾等[6]报道从霸王岭热带原始林区土壤中分离出一株白刺链霉菌15-4-2,从其发酵液中获得了5种抗耐甲氧西林金葡菌(MRSA)的活性成分。国外仅Makkar等[7]报道从一株白刺链霉菌A19301中分离得到一种具有抗真菌活性的二肽化合物——phenamide。由于链霉菌遗传代谢途径的多样性,不同来源的链霉菌菌种其代谢产物也不尽相同。
S.albospinus CT205发酵上清液中含有抗菌的活性成分,为进一步提高其活性成分的产量,笔者对S.albospinus CT205液体发酵培养基组分及发酵温度、初始pH值等条件进行了优化,同时对其发酵液中的活性成分的稳定性进行了研究,以期为该活性成分的纯化及结构分析提供依据。
1 材料与方法 1.1 菌种白刺链霉菌(Streptomyces albospinus)CT205为本实验室分离保存。
1.2 培养基及发酵条件PDA培养基:马铃薯200 g · L-1,蔗糖20 g · L-1,琼脂20 g · L-1,pH自然。种子摇瓶培养基:黄豆粉30.0 g · L-1,葡萄糖45.0 g · L-1,酵母膏5.0 g · L-1,碳酸钙5.0 g · L-1,pH 7.5;发酵基础无机盐培养基:NaCl 2.0 g · L-1,MgSO4 · 7H2O 0.5 g · L-1,CaCO3 3.0 g · L-1,K2HPO4 · 7H2O 0.5 g · L-1,pH 7.5,碳、氮源按试验要求加入。
将S.albospinus CT205的新鲜斜面孢子接入种子摇瓶培养基(250 mL三角瓶中装液量50 mL),置旋转式摇床于30 ℃、170 r · min-1培养48 h,然后以10%(体积分数,下同)接种量转接入发酵培养基(500 mL三角瓶中装液量100 mL),在相同条件下培养96 h。
1.3 发酵培养基的优化 1.3.1 碳源在发酵基础无机盐培养基中加入10 g · L-1蛋白胨及50 g · L-1不同的碳源(可溶性淀粉、玉米粉、葡萄糖、麦芽糖、蔗糖和乳糖等),发酵96 h,测定菌浓度及抑菌圈的大小。菌浓度的测定:取10 mL发酵液,4 ℃、6 000 r · min-1离心10 min,弃上清液称湿菌体质量,换算出1 000 mL发酵液里所含的菌体湿质量(g),用质量浓度表示菌浓度(g · L-1)。抑菌圈的测定:取200 μL上清液加入牛津杯中,以啤酒酵母菌 为指示菌(每皿涂布100 μL 108 mL-1啤酒酵母菌),用牛津杯法[8]测定抑菌圈的大小。每个试验重复3次。
1.3.2 氮源在发酵基础无机盐培养基中加入已确定的合适碳源及10 g · L-1不同的氮源(蛋白胨、酵母膏、黄豆粉、(NH4)2SO4、NH4NO3和NH4Cl等),发酵96 h,测定菌浓度及抑菌圈大小。
1.3.3 正交试验采用正交法[9]设计试验方案,把已确定的合适碳源、氮源分别以梯度浓度加入发酵基础培养基中,发酵96 h,测定菌浓度及上清液对啤酒酵母菌的抑菌圈大小。
1.4 发酵条件的优化 1.4.1 初始pH值的优化将发酵液起始pH值分别调节为5.0、6.0、7.0、8.0、9.0和10.0,接种10%种子液,于28 ℃、170 r · min-1摇床培养,发酵96 h,离心,检测菌浓度及抑菌圈大小[10, 11, 12]。
1.4.2 发酵温度的优化将发酵液分别在25、28、30、35和37 ℃条件下摇瓶发酵96 h,测定菌浓度及上清液抑菌圈大小[10, 11, 12]。
1.5 活性物质的检测及粗提物的制备取500 mL发酵液,于4 ℃、6 000 r · min-1离心10 min,取上清液,用1倍体积的乙酸乙酯萃取,将萃取液在硅胶GF254薄板上层析,选取氯仿、乙酸乙酯、甲醇、甲酸的体积比为16 ∶ 1 ∶ 2 ∶ 0.04的层析系统[13]进行层析检测,根据活性成分Rf值(比移值:点样基线至展开斑点中心的距离与从基线至展开剂前沿的距离的比值)的大小,并佐以生物自显影法[14],将层析后的薄板正面朝下,放置在涂有啤酒酵母菌液的PDA琼脂培养基上,30 ℃培养18 h,再将薄板移走,利用培养基板印上的抑菌圈确定活性成分在薄板上的位置。
上清液用乙酸乙酯萃取后,40 ℃减压浓缩至原体积的1/8,点样于制备型硅胶板上进行层析,刮取有活性的相应条带溶于乙酸乙酯中,离心,取上清液,减压浓缩后获得活性成分粗提物。取少量粗提物用乙酸乙酯稀释,然后进行紫外扫描以检测其紫外吸收波长的范围。
1.6 活性成分的稳定性检测 1.6.1 热稳定性测定取体积为10 mL的灭菌玻璃试管,每只试管中添加1 mL粗提物,加盖橡胶塞。分别在25(对照)、60、80和100 ℃恒温水浴锅分别处理5和15 min。采用滤纸片法[11]测定抗菌活性,即取处理后的20 μL样品加到直径6 mm的无菌滤纸片上,干燥后置于涂布啤酒酵母的PDA平板上,28 ℃培养48 h,测定其抑菌圈大小。
1.6.2 酸碱稳定性测定取体积为10 mL的干净玻璃试管,每只试管中添加3 mL抗菌粗提物,分别用0.5 mol · L-1 HCl或NaOH调节pH值分别为4.0、5.5、8.0和10.0,于4 ℃静置12 h后回调pH值为7.0,以未用酸碱处理的粗提物(pH 6.5)作为对照,以啤酒酵母菌为指示菌测定其抗菌活性。
1.6.3 对紫外光稳定性测定取3套干净的直径9 cm的玻璃培养皿。每只培养皿中添加2 mL粗提物和3片无菌滤纸片,置于超净工作台中,打开皿盖,经紫外灯照射,分别于5、10和30 min后取出滤纸片沥干,测定其抑菌活性。
1.7 数据分析用SPSS 19.0软件对数据进行差异性分析,计算平均值及标准差,用Origin 8.6软件绘图。
2 结果与分析 2.1 不同碳源对菌丝体生长及产活性物质的影响由表 1可见:葡萄糖和蔗糖有利于S.albospinus CT205菌丝的生长,菌浓度分别达到335和326 g · L-1,但蔗糖作碳源时抑菌活性大于葡萄糖,可溶性淀粉对S.albospinus CT205代谢产生活性物质最合适,抑菌圈直径最大,为39 mm。从材料价格及来源方便考虑,选用可溶性淀粉和蔗糖作为最佳碳源组合进行后续试验。
| 碳源 Carbon sources | 菌浓度/(g·L-1) Mycelia concentration | 抑菌圈直径/mm Diameter of inhibition zone |
| 乳糖Lactose | 275±16.3c | 30±1.30bc |
| 蔗糖Sucrose | 326±17.7ab | 36±1.90b |
| 葡萄糖Glucose | 335±24.7a | 29±1.86bc |
| 麦芽糖Maltose | 319±12.7b | 37±1.51b |
| 玉米粉Corn meal | 131±3.5e | 38±1.33ab |
| 可溶性淀粉Starch | 223±8.1d | 39±1.36a |
| 注:同列不同小写字母表示处理间差异显著(P<0.05)。 Note: Different letters in the same column indicate significant difference at 0.05 level.The same as follows. | ||
由表 2可见:菌株CT205在6种不同氮源培养基中发酵情况不同,在有机氮源中黄豆粉及蛋白胨较为合适,发酵获得的菌浓度较多,分别为288和309 g · L-1,对菌株CT205发酵产生活性物质影响较大,抑菌圈直径分别为20和23 mm。菌株CT205在无机氮源中生长及产生活性物质的能力均较差,不适合作为单独的氮源使用。综合考虑,选用蛋白胨及黄豆粉作为最佳氮源组合进行后续试验较为适宜。
| 氮源 Nitrogen sources | 菌浓度/(g·L-1) Mycelia concentration | 抑菌圈直径/mm Diameter of inhibition zone |
| NH4Cl | 93±2.3c | 10±1.15e |
| NH4NO3 | 86±1.4c | 16±0.58c |
| (NH4)2SO4 | 97±5.8c | 13±0.50d |
| 黄豆粉Soybean meal | 288±12.5a | 20±0.79b |
| 蛋白胨Peptone | 309±2.1a | 23±2.44a |
| 酵母膏Yeast extract | 209±5.7b | 23±1.30a |
根据单因素试验结果,选择可溶性淀粉和蔗糖作为碳源组合,蛋白胨和黄豆粉作为氮源组合,按总碳源与总氮源质量比为5 ∶ 1的比例设计A、B 2因素4水平(42)的正交试验,正交表如表 3所示,共16组合。试验结果较好的前5个组合如表 4所示。
| 水平Level | 因素Factor | |
| A:蔗糖/% Sucrose+淀粉/% Starch | B:蛋白胨/% Peptone+黄豆粉/% Soybean meal | |
| 1 | 4+1 | 0.2+0.8 |
| 2 | 3+2 | 0.4+0.6 |
| 3 | 2+3 | 0.6+0.4 |
| 4 | 1+4 | 0.8+0.2 |
正交试验是为了获得菌丝体生长良好且能产生较高活性成分的发酵参数,表 4的结果中组合A3B1最为合适,该组合中菌浓度195 g · L-1,生物量相对较高,说明菌丝生长良好,抑菌圈达40 mm,抑菌活性亦相对较高。故确定最优发酵培养基配方:蔗糖20.0 g · L-1,可溶性淀粉30.0 g · L-1,蛋白胨2.0 g · L-1,黄豆粉8.0 g · L-1,NaCl 2.0 g · L-1,MgSO4 · 7H2O 0.5 g · L-1,CaCO3 3.0 g · L-1,K2HPO4 · 7H2O 0.5 g · L-1。
试验号No. | 因素Factor | 菌浓度/(g·L-1)Mycelia concentration | 抑菌圈直径/mm Diameter of inhibition zone | |
| A | B | |||
| 5 | 2 | 1 | 168±7.0 | 38±2.29 |
| 6 | 2 | 2 | 166±8.1 | 38±1.58 |
| 9 | 3 | 1 | 195±10.4 | 40±1.09 |
| 10 | 3 | 2 | 161±4.7 | 39±1.83 |
| 11 | 3 | 3 | 163±20.4 | 37±2.00 |
S.albospinus CT205在发酵初始pH值为5.0~10.0均可以生长,但当初始pH值小于或大于8.0时,菌体生长受到一定的影响,因此确定该菌株液体发酵的最适初始pH值为8.0(图 1-A)。当培养温度在25~30 ℃时,均适合S.albospinus CT205的生长,菌浓度较高,但当培养温度高于35 ℃时,不利于S.albospinus CT205生长,菌浓度和抑菌圈直径均较小(图 1-B)。综合菌浓度及抑菌圈大小2个指标,确定菌株CT205液体发酵温度为28~30 ℃。
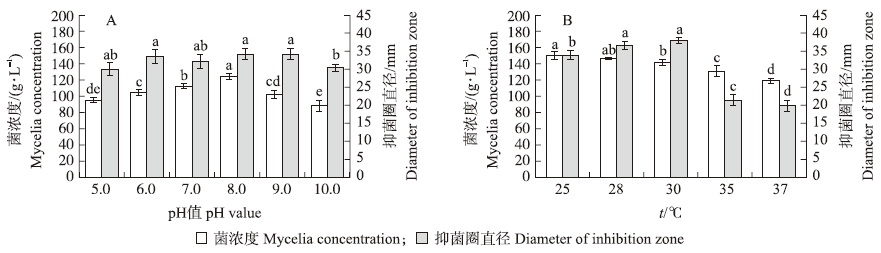 | 图 1 初始pH(A)和温度(B)对S.albospinus CT205发酵的影响 Fig. 1 Effect of different initial pH(A)and temperatures on the liquid fermentation of S.albospinus CT205 不同小写字母表示不同处理间在0.05水平差异显著。Different letters indicate significant difference at 0.05 level.The same as follows. |
把发酵上清液的乙酸乙酯相在硅胶GF254薄板上点样,在氯仿、乙酸乙酯、甲醇、甲酸的体积比为16 ∶ 1 ∶ 2 ∶ 0.04的层析系统中进行层析检测,在紫外光下观察到4个清晰的组分(Rf值分别为0.46、0.54、0.64和0.68)(图 2-A)。将每个组分分别挖取,检测其抗菌活性,结果发现组分1、2和3没有抗啤酒酵母菌的活性,组分4(Rf=0.68)具有抗菌活性(图 2-B)。将组分4溶解后在GF254薄板点样,展层,吹干后,将层析板反铺在含有指示菌的平板上培养,观察抑菌圈的位置,以验证组分4的抗菌活性(图 2-C)。
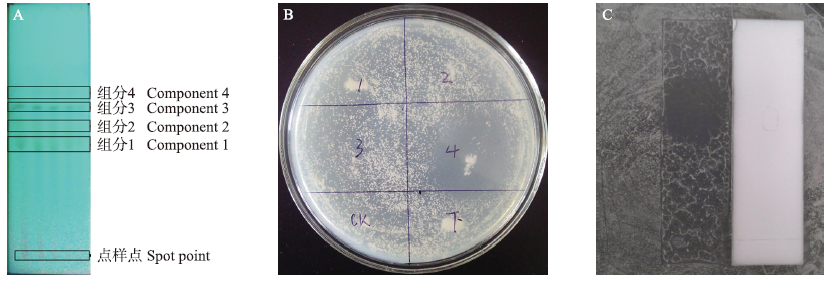 | 图 2 活性成分的薄层层析检测及生物检测 Fig. 2 Tests on the active component by thin-layer chromatography and biological activity A.薄层层析在紫外光下各组分展开效果Effect of the components expanded by thin-layer chromatography under UV light;B.各组分生物活性检测Biological detection of the components;C.组分4生物显影法检测Biological detection of component 4 by bioautography |
样品在制备型硅胶板上层析后,刮取有活性的条带溶于乙酸乙酯中,离心取上清液,浓缩获得活性成 分的粗提物。将活性成分进行全波长紫外扫描,检测其紫外吸收峰位置。紫外吸收光谱(图 3)显示在λ=258 nm 处有1个紫外吸收峰。
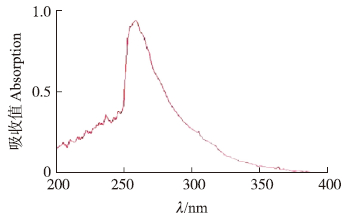 | 图 3 活性成分在200~400 nm波长范围内的紫外吸收光谱 Fig. 3 The ultraviolet absorption spectrum in 200-400 nm of active component |
从图 4可知:活性成分经60和80 ℃处理5 min,其抗菌活性与25 ℃(对照)相比,差异不显著,经100 ℃处理5 min,其抗菌活性略有下降。活性成分经60、80和100 ℃分别处理15 min,其抗菌活性与对照相比,差异不显著,表明活性成分对热较稳定。
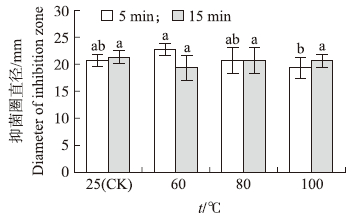 | 图 4 温度对活性成分的热稳定性影响 Fig. 4 Effect of different temperatures on the stability of active component |
经测定未经酸碱处理的原粗提物的pH值为6.5(CK),经酸碱处理后的粗提物,其抗菌活性较对照有所降低,因此在后续的提取过程中,溶液的pH值应控制在中性附近(图 5)。
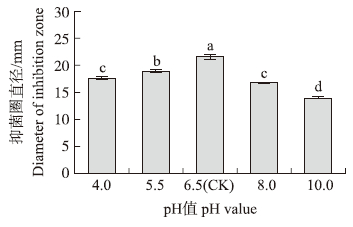 | 图 5 酸碱处理对活性成分稳定性的影响 Fig. 5 Effect of different pH on the stability of active component |
活性成分粗提物经紫外光照射5和10 min,抗菌活性没有明显变化,照射30 min后,抑菌活性略下降,说明该活性成分在短时间内对紫外光的照射较为稳定(图 6)。
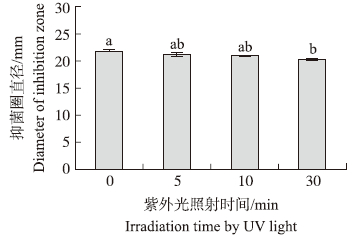 | 图 6 紫外光对活性成分稳定性的影响 Fig. 6 Effect of UV light on the stability of active component |
发酵是抗生素产业化的基础,即使抗生素产生菌的性能优良,若缺乏合理的发酵工艺也不能将其潜力发挥极致。S.albospinus CT205是本实验室获得的一株具有较好应用前景的拮抗放线菌,其拮抗的机制是产生抗菌的活性物质。本研究结果表明:菌体生物量的大小与抑菌活性的大小不一致,发酵过程中获得较高的菌体生物量,说明该发酵培养基组分及发酵条件适合于菌丝体的生长,而抑菌活性大小表明菌体代谢产生活性成分含量的多少。抗生素是拮抗菌产生的次生代谢产物,是在产生菌的生长结束之后才出现,一般是在培养液中缺乏某种营养物质,菌体的生长受到限制时才启动[15],其代谢途径复杂,菌丝体的生物量高低,并不能完全决定次生代谢产物的含量。本研究根据发酵液中菌浓度及上清液中活性物质抑菌圈的大小,对其发酵培养基的碳源和氮源进行筛选,在此基础上通过正交试验获得优化的培养基配方,并对摇瓶发酵的主要条件如温度、pH值进行优化,提高了菌株CT205发酵液中活性物质的含量。
抗生素的开发涉及发酵工艺、活性物质的分离提取、结构测定、活性物质的抗菌机制以及生物与环境安全评价等因素,是一个漫长而复杂的过程。S.albospinus CT205代谢所产生的抗菌活性物质经GF254薄板层析及生物测定,确定了其在层析系统中的位置(Rf=0.68),经紫外检测,发现该活性成分在258 nm处有1个最大吸收峰,这些研究结果为该活性物质的进一步分离纯化及液相色谱分析提供了条件。
来源于放线菌的抗菌活性物质有很多,如魏赛金等[16]报道从江西棉花土壤中筛选到一株链霉菌(Streptomyces sp.)702,其发酵液对热、紫外光及在pH 3~12条件下稳定,从发酵液分离纯化出抗细菌活性物质为红谷霉素(Honggumycin),纯化出抗尖孢镰刀菌的单体组分DZP-9为制霉色基素(Fungichromin),显示出良好的应用开发前景。张楠等[17]报道吸水链霉菌(S.hygroscopicus)BS-112产生的抗植物病原真菌活性物质Tetrins A、B及Tetramycins A、B,但Tetrins和Tetramycins对紫外光较为敏感,不宜与阳光接触,因此限制了其在大田中的应用。S.albospinus CT205代谢所产生的活性物质对热和紫外光均表现出较强的稳定性,显示出其进一步推广应用的可行性。放线菌产生的次生代谢产物种类繁多,性质各异,其活性、稳定性等特征与其结构相关[18],因此研究S.albospinus CT205代谢产生活性物质的理化性质为该物质的提纯、鉴定及保藏亦提供了理论基础。
| [1] | Baltz R H. Antimicrobials from Actinomycetes:back to the future[J]. Microbe, 2007, 2(3):125-131 |
| [2] | 沈寅初. 井冈霉素研究开发25年[J]. 植物保护, 1996(4):44-45 [Shen Y C. Research and develop Jingganggensis for 25 years[J]. Plant Protection, 1996(4):44-45(in Chinese)] |
| [3] | 陈敏纯, 廖美德, 夏汉祥. 农用抗生素作用机理简述[J]. 世界农药, 2011, 33(3):13-16 [Chen M C, Liao M D, Xia H X. An outline on the mechanism of agricultural antibiotics[J]. World Pesticides, 2011, 33(3):13-16(in Chinese with English abstract)] |
| [4] | Bérdy J. Bioactive microbial metabolites[J]. The Journal of Antibiotics, 2005, 58(1):1-26 |
| [5] | 梁银, 张谷月, 王辰, 等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报, 2013, 50(4):801-817 [Liang Y, Zhang G Y, Wang C, et al. Identification and biocontrol effect of a strain of Actinomycetes antagonistic to wilt disease of cucumber[J]. Acta Pedologica Sinica, 2013, 50(4):801-817(in Chinese with English abstract)] |
| [6] | 郁蕾, 戴好富, 曾艳波, 等. 白刺链霉菌15-4-2中的抗MRSA活性成分研究[J]. 中国抗生素杂志, 2012, 37(2):94-97 [Yu L, Dai H F, Zeng Y B, et al. Anti-MRSA constituents from the Streptomyces albospinus 15-4-2[J]. Chinese Journal of Antibiotics, 2012, 37(2):94-97(in Chinese with English abstract)] |
| [7] | Makkar N S, Nickson T E, Tran M. Phenamide, a fungicidal metabolite from Streptomyces albospinus A19301 taxonomy, fermentation, isolation, physico-chemical and biological properties[J]. The Journal of Antibiotics, 1995, 48(5):369-374 |
| [8] | 张全, 张遵霞, 王开梅, 等. WS-03574菌株活性成分的分离纯化、抗菌活性及稳定性研究[J]. 湖北农业科学, 2007, 46(4):567-570 [Zhang Q, Zhang Z X, Wang K M, et al. Studies on separation, purification, bioassay and stability of the active metabolites of WS-03574[J]. Hubei Agricultural Sciences, 2007, 46(4):567-570(in Chinese with English abstract)] |
| [9] | 阚国仕, 谢建飞, 陈红漫. 一株高产Mn-SOD菌发酵条件的优化[J]. 中国酿造, 2009, 28(4):118-120 [Kan G S, Xie J F, Chen H M. Optimization of fermentation conditions of Mn-SOD produced by Bacillus sp.[J]. China Brewing, 2009, 28(4):118-120(in Chinese with English abstract)] |
| [10] | 朱茂山, 张泽华, 吕振环. 拮抗放线菌S-091菌株的发酵条件[J]. 沈阳农业大学学报:自然科学版, 2014, 45(2):209-212 [Zhu M S, Zhang Z H, Lü Z H. Fermentation condition of antagonistic Actinomycete S-091[J]. Journal of Shenyang Agricultural University:Natural Science Edition, 2014, 45(2):209-212(in Chinese with English abstract)] |
| [11] | 刘翠娟, 段琦梅, 安德荣. 抗真菌拮抗放线菌的筛选及摇床发酵条件的优化[J]. 微生物学杂志, 2004, 24(4):12-14 [Liu C J, Duan Q M, An D R. Screening of steptomeses which inhabit pathogenic fungi and the optimization of fermentation conditions in the shaker[J]. Journal of Microbiology, 2004, 24(4):12-14(in Chinese with English abstract)] |
| [12] | 赵育卉, 李连强, 湛东锐, 等. 盐生海芦笋内生真菌S19的分离鉴定与抗氧化发酵条件优化[J]. 南京农业大学学报, 2013, 36(2):137-144. doi:10. 7685/j.issn.1000-2030.2013.02.023 [Zhao Y H, Li L Q, Zhan D R, et al. Isolation and identification of an endophytic fungus strain S19 from Salicornia bigelovii and optimization of its antioxidative fermentation conditions[J]. Journal of Nanjing Agricultural University, 2013, 36(2):137-144(in Chinese with English abstract)] |
| [13] | 张谷月. 拮抗放线菌CT205对土传西瓜枯萎病的防控效益及活性成分分析[D]. 南京:南京农业大学, 2013:32-35 [Zhang G Y. Biocontrol of watermelon wilt disease by Actinomycetes CT205 and primary study of its antagonistic compounds[D]. Nanjing:Nanjing Agricultural University, 2013:32-35(in Chinese with English abstract)] |
| [14] | 王双英, 穆青. 薄层色谱直接生物自显影方法(TLC-Bioautography)在抗菌剂分析中的应用[J]. 国外医药:抗生素分册, 2012, 33(2):67-69 [Wang S Y, Mu Q. The use of thin-layer chromatography with direct bioautography for antimicrobial analysis[J]. World Notes on Antibiotics, 2012, 33(2):67-69(in Chinese with English abstract)] |
| [15] | 陈代杰. 微生物药物学[M]. 上海:华东理工大学出版社, 1999:462-463 [Chen D J. Microbial Pharmacology[M]. Shanghai:East China University of Science and Technology Press, 1999:462-463(in Chinese)] |
| [16] | 魏赛金, 张智平, 涂晓嵘, 等. 链霉菌702抗尖孢镰刀菌次级代谢产物的分离鉴定及活性研究[J]. 江西农业大学学报, 2011, 33(5):982-986 [Wei S J, Zhang Z P, Tu X R, et al. Studies on the isolation, identification and activity of anti-Fusarium oxysporum secondary metabolites produced by Streptomyces sp.702[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(5):982-986(in Chinese with English abstract)] |
| [17] | 张楠, 孙长坡, 宋振, 等. 吸水链霉菌BS-112产生的抗真菌活性物质的分离纯化与结构鉴别[J]. 微生物学报, 2011, 51(2):224-232 [Zhang N, Sun C P, Song Z, et al. Isolation, purification and characterization of antifungal substances from Streptomyces hygroscopicus BS-112[J]. Acta Microbiologica Sinica, 2011, 51(2):224-232(in Chinese with English abstract)] |
| [18] | Joo G J. Production of antifungal substance for biological control of Phytophthora capsici causing phytophthora blight in red-peppers by Streptomyces halstedii[J]. Biotechnology Letters, 2005, 27(3):201-205 |




