文章信息
- 谯天敏, 张静, 麻文建, 朱天辉. 2015.
- QIAO Tianmin, ZHANG Jing, MA Wenjian, ZHU Tianhui. 2015.
- 双基因联合PCR检测水稻叶鞘网斑病菌
- The double gene-jointed PCR technique for detection of Cylindrocladium scoparium on rice
- 南京农业大学学报, 38(2): 273-278
- Journal of Nanjing Agricultural University, 38(2): 273-278.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.015
-
文章历史
- 收稿日期:2014-06-22
水稻(Oryza sativa)叶鞘网斑病是危害水稻幼苗下部接近水面叶鞘部位的一种真菌性病害,引起该病害的病原菌隶属于半知菌亚门、柱枝双孢霉属的帚梗柱孢霉(Cylindrocladium scoparium Morgan)[1, 2]。受到侵染的水稻叶鞘一般出现褐色纵横交错的网格状斑纹,其表面有白色霉状物产生,受侵害严重的水稻叶鞘会出现大面积脱落,以致整株水稻枯死[3, 4],而此症状恰恰与农业害虫二化螟低龄幼虫群集危害造成的水稻变色叶鞘相类似[5],很容易混淆;其病原菌极易传播的特点也是防治水稻叶鞘网斑病的困难所在。近些年来,国内学者对水稻叶鞘网斑病的研究甚少,仅薛保华[4]、金敏忠[3]就该病害的发病症状、危害程度、传播范围以及病原菌株和生物学特性进行简单概述,而在利用分子生物学手段对水稻叶鞘网斑病进行快速、有效的早期诊断,进而采取相应的措施防治水稻叶鞘网斑病方面的研究仍处于空白。
目前,对于水稻叶鞘网斑病的早期诊断仍处于传统的人为形态学判断状态,该病害的发病症状极易与虫害相混淆的特殊性,使得肉眼观察判断该病害的准确性值得考量[6]。分子生物学诊断技术是在近几年发展起来的一种在分子水平上快速、有效、准确检测多种林木和农业生产病害的新技术,主要方法有:PCR技术[7]、DNA芯片技术[8]、巢式PCR[9]、多重PCR[10]、荧光定量PCR[11]等。该技术弥补了传统鉴定病害中操作人员需要很高的专业知识、易受外界因素干扰、费时耗力、判定结果可靠性较低的缺点,已在植物病原检测中得到广泛应用。
双基因联合快速检测是一种特殊的多重PCR扩增技术[12]。该检测技术主要选定两个不同的靶基因分别进行特异性引物的设计,然后同时利用两对特异引物对反应体系进行优化、扩增,从而建立起两个互不干预基因的快速检测体系。该双基因联合快速PCR与常规PCR快速检测技术相比,具有更高的准确性、可靠性、灵敏性、时效性。本试验前期分别对C.scoparium及其NCBI中同属菌株的核糖体内转录间隔区ITS1区和ITS2区、18S和28S基因、β微管蛋白(β-tubulin)基因、翻译延长因子α-1[factor 1-α(tef1)]基因进行比对,结果表明C.scoparium与其同属菌株在28S、18S上的同源性较高,相似度达到95%以上,而 该病原菌在β-tubulin及factor 1-α(tef1)区上与其他菌株差异明显。因此,本试验分别选定Cylindrocladium 属的factor 1-α(tef1)和β-tubulin gene两个保守性极强的特定区域进行两对特异性引物的设计,并成功建立了水稻叶鞘网斑病菌快速检测体系,这为水稻叶鞘网斑病早期诊断提供了有效方法,同时为该病害的准确防治提供了技术支持。 1 材料与方法 1.1 供试菌株
供试菌株来源、名称、寄主等见表 1。
| 菌株编号Strain No. | 菌株名称Strain name | 寄主Host | 来源Locality |
| 1 | Cylindrocladium scoparium | Oryza sativa | 购自中国林科院森环森保研究所 |
| 2 | C.scoparium | O.sativa | 购自中国林科院森环森保研究所 |
| 3 | C.scoparium | O.sativa | 攀枝花 |
| 4 | C.scoparium | O.sativa | 广元 |
| 5 | C.scoparium | O.sativa | 雅安 |
| 6 | C.scoparium | O.sativa | 乐山 |
| 7 | Fusarium sp. | O.sativa | 攀枝花 |
| 8 | Helminthosporium oryzae | O.sativa | 购自中国林科院森环森保研究所 |
| 9 | Ustilaginoidea virens | O.sativa | 购自中国林科院森环森保研究所 |
| 10 | Pyricularia oryzae | O.sativa | 购自中国林科院森环森保研究所 |
| 11 | Fusicoccum sp. | O.sativa | 购自中国林科院森环森保研究所 |
| 12 | Cochliobolus fallax | O.sativa | 购自中国林科院森环森保研究所 |
| 13 | Alternaria sp. | O.sativa | 雅安 |
| 14 | Biscogniauxia sp. | O.sativa | 乐山 |
| 15 | Fusarium sp. | O.sativa | 攀枝花 |
| 16 | Diaporthe sp. | O.sativa | 广元 |
| 17 | Gibberella fujikuroi | O.sativa | 购自中国林科院森环森保研究所 |
| 18 | Hypocrea sp. | O.sativa | 广元 |
| 19 | Diaporthe sp. | O.sativa | 雅安 |
| 20 | Nigrospora sp. | O.sativa | 乐山 |
| 21 | Cochliobolus miyabeanus | O.sativa | 购自中国林科院森环森保研究所 |
| 22 | Alternaria sp. | O.sativa | 广元 |
利用平板培养法对所有参试菌株进行纯化培养。待菌落生长至平板2/3处挑取菌丝于装有200 mL马铃薯-葡萄糖液体(PDB)的锥形瓶中,28 ℃、180 r · min-1摇床振荡培养8 d。收集菌丝,灭菌蒸馏水冲洗3次,冷冻干燥,存入灭菌离心管中于-20 ℃冰箱备用。基因组DNA的提取参照天根植物组DNA提取试剂盒(购自上海生工生物技术有限公司)进行,新鲜样品组织置于研钵中用液氮研磨成粉末。后续DNA提取操作同上。吸取5 μL的DNA用10 g · L-1琼脂糖凝胶电泳检测DNA纯度,其余DNA样品置于-20 ℃冰箱备用。 1.3 factor 1-α(tef1)特异性引物的设计与合成
利用Cylindrocladium属真菌factor 1-α(tef1)区基因通用引物EF1-728F[13](5′-CATCGAGAAGTTCGAG- AAGG-3′)和EF2(5′-GGA(G/A)GTACCAGT(G/C)ATCATGTT-3′)对所有参试菌株进行常规PCR扩增。反应体系(50 μL)为:10×PCR Buffer 5 μL,Mg2+ 3 μL,10 mmol · L-1 dNTP 1.5 μL,EF1-728F(10 pmol · μL-1)1.5 μL,EF2(10 pmol · μL-1)1.5 μL,Taq聚合酶(5 U · μL-1)0.3 μL,ddH2O 33.2 μL,模板DNA 4.0 μL。反应条件:94 ℃5 min;94 ℃45 s,60 ℃30 s,72 ℃40 s,共35个循环;72 ℃10 min。
PCR产物送上海生物工程公司进行测序。根据测序结果,结合GenBank中已知Cylindrocladium属菌株的factor 1-α(tef1)gene区序列,利用软件Primer Premier 6.0进行基因保守区域内的特异性引物设计,通 过基因库BLAST比对验证引物的特异性。引物序列如下:上游EF-S-4:5′-CAAGAGTCGGATGGAATCAA-3′; 下游EF-A-4:5′-CACAGGAGGTCGTCAAAC-3′,目的片段扩增大小为272 bp。 1.4 β-tubulin特异性引物的设计与合成
利用Cylindrocladium属真菌β-tubulin gene区基因通用引物BT-T1-S[14](5′-AACATGCGTGAGATTGTAAGT-3′)和BT-CYLTUBIR-A(5′-AGTTGTCGGGACGGAAGAG-3′)分别对病原菌进行PCR扩增,除退火温度改成55 ℃外,扩增体系和程序同1.3节。特异性引物序列如下:上游BT-S-9:5′-TGCGTAAGTGCTCATTCTG-3′;下游BT-A-9:5′-AACTGGAGGTCGGAGGTA-3′,目的片段扩增大小为157 bp。 1.5 双重特异性引物的验证
用合成的特异引物EF-S-4/EF-A-4和BT-S-9/BT-A-9同时对参试菌株的基因组DNA进行扩增,检测其特异性。PCR扩增体系(50 μL):10×PCR Buffer 5.0 μL,Mg2+ 3 μL,10 mmol · L-1 dNTP 1.5 μL,EF-S-4(10 pmol · μL-1)1.0 μL,EF-A-4(10 pmol · μL-1)1.0 μL,BT-S-9(10 pmol · μL-1)1.0 μL,BT-A-9(10 pmol · μL-1) 1.0 μL,Taq聚合酶(5 U · μL-1)0.3 μL,ddH2O 32.2 μL,模板DNA 4.0 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 30 s,72 ℃ 40 s,重复循环35次;72 ℃ 10 min。用ddH2O代替模板DNA作为阴性对照。 扩增结束后取5.0 μL PCR产物上样于含0.5 μg · mL-1 EB的15 g · L-1琼脂糖凝胶上电泳,电压为9 V · cm-1、 时间为30 min,在凝胶成像系统上检测并拍照。 1.6 双重PCR退火温度优化
分别将退火温度设置成51、52、53、54、55、56、57、58和59 ℃,共9个梯度,按照1.5节的操作程序和条件进行双重PCR退火温度的优化。反应结果在15 g · L-1琼脂糖凝胶上电泳,拍照观察。 1.7 双重PCR灵敏度检测
分别将病原菌基因组DNA稀释成:550 ng · μL-1、55 ng · μL-1、5.5 ng · μL-1、550 pg · μL-1、55 pg · μL-1、5.5 pg · μL-1、550 fg · μL-1和55 fg · μL-1浓度梯度,用于双重PCR灵敏度检测。 1.8 实际病样检测
分别从雅安、攀枝花、庐山、广元、重庆、新津、天全、宝兴8个地区采集疑似水稻叶鞘网斑病的病害样本,采用新鲜样品组织DNA提取方法进行基因组DNA的提取,然后按照优化的反应体系进行野外水稻叶鞘网斑病的实际样品检测。 2 结果与分析 2.1 factor 1-α(tef1)区引物的特异性
利用引物EF-S-4/EF-A-4单独扩增全部参试菌株,只有病原菌株扩增出1条272 bp大小条带,而阴性空白对照无条带(图 1),表明该引物具有特异性。
 | 图 1 特异性引物EF-S-4/EF-A-4扩增反应结果 Fig. 1 The results of PCR amplification using primers EF-S-4/EF-A-4 M.标准分子质量DL2000 marker;1~22.引物EF-S-4/EF-A-4对表1中所对应的供试菌株DNA进行的PCR扩增Lane numbers as the strain numbers in Table 1 for PCR amplification using primers EF-S-4/EF-A-4;CK.阴性对照Negative control |
利用引物BT-S-9/BT-A-9单独扩增全部参试菌株,只有病原菌株扩增出1条157 bp大小条带,而阴性空白对照无条带(图 2),表明该引物同样具有特异性。
 | 图 2 特异性引物BT-S-9/BT-A-9扩增反应结果 Fig. 2 The results of PCR amplification using primers BT-S-9/BT-A-9 M.标准分子质量DL2000 marker;1~22.引物BT-S-9/BT-A-9对表1中所对应的供试菌株DNA进行的PCR扩增Lane numbers as the strain numbers in Table 1 for PCR amplification using primers BT-S-9/BT-A-9;CK.阴性对照Negative control |
图 3显示:仅病原菌可扩增出2条明亮条带,大小分别为272和157 bp,而其他参试菌株、对照都没有扩增出条带。通过片段回收测序及与现有的Cylindrocladium scoparium序列比对发现同源性为100%,证明该引物可以从混合DNA样品中准确地检测出Cylindrocladium scoparium,准确率为100%。说明特异性引物EF-S-4/EF-A-4和BT-S-9/BT-A-9用于水稻叶鞘网斑病害基因组DNA的PCR扩增均获得成功。
 | 图 3 已知供试菌的EF-S-4/EF-A-4和BT-S-9/BT-A-9特异性扩增结果 Fig. 3 The results of PCR amplification using primers EF-S-4/EF-A-4 and BT-S-9/BT-A-9 M.标准分子质量DL2000 marker;1~22.引物EF-S-4/EF-A-4和BT-S-9/BT-A-9对表1中所对应的供试菌株DNA进行的PCR扩增Lane numbers as the strain numbers in Table 1 for PCR amplification using primers EF-S-4/EF-A-4 and BT-S-9/BT-A-9;CK.阴性对照Negative control |
从双重PCR温度优化结果(图 4)可以看出:温度在51~56 ℃时,factor 1-α(tef1)上设计的特异性引物EF-S-4/EF-A-4的扩增条带不明显,这可能是引物之间存在着竞争作用,而使得EF-S-4/EF-A-4特异性引物扩增的量很少;而当温度提升至57~59 ℃范围内,EF-S-4/EF-A-4的扩增效果逐渐清晰,但是β-tubulin gene设计的特异性引物BT-S-9/BT-A-9条带随之减弱,根据扩增条带的明亮程度选择58 ℃为双重PCR反应体系的最优退火温度。
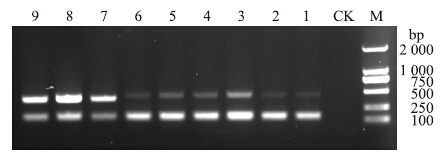 | 图 4 双重PCR温度优化 Fig. 4 Temperature optimization of dual PCR M.标准分子质量DL2000 marker;1~9.退火温度分别为51、52、53、54、55、56、57、58和59 ℃ Lane numbers as the temperature 51,52,53,54,55,56,57,58 and 59 ℃;CK.阴性对照Negative control |
利用引物EF-S-4/EF-A-4和BT-S-9/BT-A-9组合成双引物扩增水稻叶鞘网斑病病原菌,结果(图 5)显示:双重PCR具有较高检测灵敏度,检测限可达到550 fg · μL-1,完全符合田间检测的要求。
 | 图 5 双重PCR灵敏度检测 Fig. 5Sensitivity detection of dual PCR M.标准分子质量DL2000 marker;1~8.病原菌基因组DNA浓度分别为550 ng · μL-1、55 ng · μL-1、5.5 ng · μL-1、550 pg · μL-1、55 pg · μL-1、5.5 pg · μL-1、550 fg · μL-1、55 fg · μL-1 Lane numbers as different quantity of DNA:550 ng · μL-1,55 ng · μL-1,5.5 ng · μL-1, 550 pg · μL-1,55 pg · μL-1,5.5 pg · μL-1,550 fg · μL-1,55 fg · μL-1;CK.阴性对照Negative control |
利用双基因联合快速检测雅安、攀枝花、庐山、广元、重庆、新津、天全、宝兴8个地区的疑似水稻叶鞘网斑病的病害样品,结果(图 6)显示,该引物可以从混合DNA样中准确地检测出水稻叶鞘网斑病菌。
 | 图 6 双基因联合快速PCR引物检测田间发病植株 Fig. 6Detection of the filed diseased plant by using duplex double joint rapid PCR M.标准分子质量DL2000 marker;1~8.雅安、攀枝花、庐山、广元、重庆、新津、天全、宝兴病害样品Lane numbers as diseased tissues from Ya′an,Panzhihua,Lushan,Guangyuan,Chongqing,Xinjin,Tianquan,Baoxing;9.健康植株Healthy plant;CK.阴性对照Negative control |
供试菌株的选择是PCR构建的基础。参考前人PCR体系构建的供试菌株选择,主要来源有以下几类:与病原菌同属不同种的菌株,从发病寄主上分离得到的内生菌、外生菌、寄生菌,以及可能引起寄主感病的其他病原菌[12, 15, 16]。本试验所选择的参试菌株主要以上述来源为主,例如:选择了具有代表性可导致寄主植株水稻感病的重要致病菌,Helminthosporium oryzae[17]、Ustilaginoidea virens[18]、Pyricularia oryzae[19]、Cochliobolus fallax[20]、Gibberella fujikuroi[21]和Cochliobolus miyabeanus[22],可分别导致水稻感染胡麻斑病、稻曲病、稻瘟病、稻叶鞘黑斑病、水稻徒长病、水稻胡麻叶斑病等。而其中稻曲病、胡麻斑病及稻瘟病的发病症状与水稻叶鞘网斑病的症状类似,很难用肉眼区分。此外,本试验选择不同地区分离得到的病原菌,这样可以对生理小种造成的差异进行特异性鉴定,为体系的构建增加说服力。而Fusarium sp.、Alternaria sp.、Diaporthe sp.、Hypocrea sp.、Nigrospora sp.则是从感病水稻寄主植株上分离得到的,选择它们作为参试菌株排除了检测出的条带是寄主自身非特异性扩增的可能性。
保守性极强的特异序列是引物设计成功的关键因素。β-tubulin gene即β-微管蛋白基因[23],由于其具有的特异性而被广泛应用到真菌分类鉴定及系统发育分析中。factor 1-α即翻译延伸因子[24],是信使核糖核酸翻译促进多肽链延伸的蛋白质因子,其在原核、真核生物中均有存在,且具有高度的特异性,常常被用于多种病原菌的分类鉴定、系统发育、地理小种的区分上。本试验分别以C.scoparium的β-tubulin和factor 1-α 作为靶基因,进行特异性引物EF-S-4/EF-A-4和BT-S-9/BT-A-9的设计,并对引物特异性进行验证,引物表现出很强的特异性,能够分别扩增出病原菌的特异性条带。此外,优化的反应体系也是保证扩增条带观察的前提条件,适合的退火温度是扩增产物量多少的决定因子。试验对引物组成的双重PCR进行体系退火温度的优化,在58 ℃下双重PCR扩增产物量最多,条带最亮,因此确定58 ℃是该双基因联合快速检测水稻叶鞘网斑病的最佳退火温度。
水稻叶鞘网斑病作为一种世界性病害,对水稻的农业生产造成严重的经济损失。建立以水稻叶鞘网斑病菌的快速检测技术是防治该病害的有效手段。目前,常规PCR检测技术已经能够解决大多数农业真菌性病害的快速前期诊断,但是对于水稻叶鞘网斑病的快速检测技术还停留在传统肉眼鉴定上,这使得C.scoparium引起的水稻叶鞘网斑病害得不到准确判断。本研究成功建立了水稻叶鞘网斑病的快速PCR检测技术,并对其时效性进行田间试验,结果表明该体系能够应用于水稻叶鞘网斑病的田间检测,为水稻叶鞘网斑病的早期诊断提供了有力的技术支持。
| [1] | Mondal W A, Dey B B, Choudhuri M A. Proline accumulation as a reliable indicator of monocarpic senescence in rice cultivars[J]. Experientia, 1985, 41(3):346-348 |
| [2] | Ou S H. Rice Diseases[M]. Surrey, UK:Commonwealth Agricultural Bureaux, 1985 |
| [3] | 金敏忠. 浅谈水稻叶鞘网斑病[J]. 农业科技通讯, 1991(6):27-28 [Jin M Z. Study on rice leaf sheath spot disease[J]. Agricultural Science and Technology, 1991(6):27-28(in Chinese)] |
| [4] | 薛保华. 鱼台县水稻叶鞘网斑病发生严重[J]. 植保技术与推广, 2000, 20(1):45 [Xue B H. The serious happend of rice leaf sheath spot disease in Yutai district[J]. Protection Technology and Extension, 2000, 20(1):45(in Chinese)] |
| [5] | 蔡国梁. 诸暨市水稻螟虫的发生现状及治理对策探讨[J]. 中国稻米, 2006, 12(1):38-39 [Cai G L. Discussion on present situation and countermeasures happened in Zhuji rice stem borer[J]. Chinese Rice, 2006, 12(1):38-39(in Chinese)] |
| [6] | 王春林, 张宗益, 黄幼玲. 外来植物有害生物入侵及其对策[J]. 植物保护学报, 2005, 32(1):104-108 [Wang C L, Zhang Z Y, Huang Y L. Strategies to counter the invasion of exotic and harmful plant pests[J]. Acta Phytophy Lacica Sinica, 2005, 32(1):104-108(in Chinese with English abstract)] |
| [7] | 王艳, 龚义勤, 赵统敏, 等. 番茄SRAP-PCR体系优化与品种分子鉴定[J]. 南京农业大学学报, 2007, 30(1):23-29. doi:10.7685/j.issn.1000-2030.2007.01.005 [Wang Y, Gong Y Q, Zhao T M, et al. Optimization of SRAP-PCR system and cultivar molecular identification in tomato(Lycopersicon esculentum L.)[J]. Journal of Nanjing Agricultural University, 2007, 30(1):23-29(in Chinese with English abstract)] |
| [8] | 张晓梅, 林友伟, 吴新华, 等. 菜豆萎蔫病菌的PCR检测技术[J]. 南京农业大学学报, 2004, 27(3):42-45. doi:10.7685/j.issn.1000-2030.2004.03.010 [Zhang X M, Lin Y W, Wu X H, et al. Development of a PCR test for the detection of Curtobacterium flaccumfaciens pv.flaccumfaciens[J]. Journal of Nanjing Agricultural University, 2004, 27(3):42-45(in Chinese with English abstract)] |
| [9] | 王婧, 毕阳, 朱艳, 等. 巢式PCR快速检测西瓜细菌性果斑病菌[J]. 中国农业科学, 2014, 47(2):284-291 [Wang J, Bi Y, Zhu Y, et al. Nested-PCR rapidly detecte Acidovorax avenae subsp. citrullifrom watermelon seeds[J]. Scientia Agricultura Sinica, 2014, 47(2):284-291(in Chinese with English abstract)] |
| [10] | 张贺, 彭军, 喻群芳, 等. 芒果炭疽病菌多重巢式PCR检测体系建立及田间快速检测[J]. 热带作物学报, 2013, 34(5):952-957 [Zhang H, Peng J, Yu Q F, et al. Development and application of multiplex nested-PCR system for the detection and differentiation of Colletotrichum gloesporioides and C.acutatum of mango[J]. Chinese Journal of Tropical Crops, 2013, 34(5):952-957(in Chinese with English abstract)] |
| [11] | 刘巍, 隆文杰, 石玲玲, 等. 应用实时荧光定量RT-PCR技术快速检测基因Ⅱ型诺如病毒[J]. 应用预防医学, 2007, 13(3):129-132 [Liu W, Long W J, Shi L L, et al. Rapid detection of genogroup Ⅱ Norovirus by real-time RT-PCR[J]. Applied Preventive Medicine, 2007, 13(3):129-132(in Chinese with English abstract)] |
| [12] | Schaad N W, Frederick R D. Real-time PCR and its application for rapid plant disease diagnostics[J]. Canadian Journal of Plant Pathology, 2002, 24(3):250-258 |
| [13] | 陈全助. 福建桉树焦枯病菌鉴定及其诱导下桉树转录组和蛋白组学研究[D]. 福州:福建农林大学, 2013 [Chen Q Z. Pathogenic identification of Cylindrocladium leaf blight collected from Fujian Province and studies on Transcriptomics and proteomics of eucalyptus induced by Calonectria pseudoreteaudii[D]. Fuzhou:Fujian Agriculture and Forestry University, 2013(in Chinese with English abstract)] |
| [14] | 陈全助, 郭文硕, 冯丽贞, 等. 桉树扦插苗焦枯病病原鉴定[J]. 福建农林大学学报:自然科学版, 2013, 42(3):257-262 [Chen Q Z, Guo W S, Feng L Z, et al. Identification of Calonectria associated with Eucalyptus spp.cutting seedling leaf blight[J]. Journal of Fujian Agriculture and Forestry University:Natural Science Edition, 2013, 42(3):257-262(in Chinese with English abstract)] |
| [15] | Leister D, Ballvora A, Salamini F, et al. A PCR-based approach for isolating pathogen resistance genes from potato with potential for wide application in plants[J]. Nature Genetics, 1996, 14(4):421-429 |
| [16] | Singh Z, Jones R A C, Jones M G K. Identification of cucumber mosaic virus subgroup Ⅰ isolates from banana plants affected by infectious chlorosis disease using RT-PCR[J]. Plant Disease, 1995, 79(7):713-716 |
| [17] | 陈洪亮, 彭陈, 王俊伟, 等. 水稻胡麻叶斑病病原菌的分离及鉴定[J]. 西北农林科技大学学报:自然科学版, 2012, 40(8):83-88 [Chen H L, Peng C, Wang J W, et al. Isolation and identification of pathogenic fungi of rice brown spot[J]. Journal of Northwest A & F University:Natural Science Edition, 2012, 40(8):83-88(in Chinese with English abstract)] |
| [18] | 杨秀娟, 林廷邦, 阮宏椿, 等. 稻曲病对水稻产量的影响及水稻新品种抗病性测定[J]. 热带作物学报, 2013, 34(7):1309-1313 [Yang X J, Lin T B, Ruan H C, et al, Effect of false smut on yield of rice and disease resistance detection of new rice varieties[J]. Chinese Journal of Tropical Crops, 2013, 34(7):1309-1313(in Chinese with English abstract)] |
| [19] | 吴淑潮, 杨毅, 文民操, 等. 两系杂交稻培杂629在海南省规模化高产制种技术[J]. 现代农业科技, 2013(19):45-46 [Wu S C, Yang Y, Wen M C, et al. Two-line hybrid rice 629 in Hainan scale yielding seed technology[J]. Modern Agricultural Science and Technology, 2013(19):45-46(in Chinese with English abstract)] |
| [20] | 黄微, 夏花, 高必达. 水稻新病害叶鞘黑斑病的病原鉴定[J]. 植物病理学报, 2014, 44(3):225-231 [Hung W, Xia H, Gao B D. Identification of the causal agent of a new rice disease sheath black spot[J]. Acta Phytopathologiea Sinica, 2014, 44(3):225-231(in Chinese with English abstract)] |
| [21] | Mihlan M, Homann V, Liu T W D, et al. AREA directly mediates nitrogen regulation of gibberellin biosynthesis in Gibberella fujikuroi, but its activity is not affected by NMR[J]. Molecular Microbiology, 2003, 47(4):975-991 |
| [22] | de Vleesschauwer D, Yang Y, Cruz C V, et al. Abscisic acid-induced resistance against the brown spot pathogen Cochliobolus miyabeanus in rice involves MAP kinase-mediated repression of ethylene signaling[J]. Plant Physiology, 2010, 152(4):2036-2052 |
| [23] | Wang R Y, Gao B, Li X H, et al. First report of Fusarium solani causing fusarium root rot and stem canker on storage roots of sweet potato in China[J]. Plant Disease, 2014, 98(1):160 |
| [24] | Blackwell J L, Brinton M A. Translation elongation factor-1 alpha interacts with the 3' stem-loop region of West Nile virus genomic RNA[J]. Journal of Virology, 1997, 71(9):6433-6444 |




