文章信息
- 马理邦, 许爱理, 佘思玥, 张杨青慧, 陈发棣. 2015.
- MA Libang, XU Aili, SHE Siyue, ZHANG Yangqinghui, CHEN Fadi. 2015.
- 4种蒿属植物再生技术研究
- The regeneration technology research of four Artemisia plants
- 南京农业大学学报, 38(2): 233-239
- Journal of Nanjing Agricultural University, 38(2): 233-239.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.009
-
文章历史
- 收稿日期:2014-06-18
蒿属(Artemisia)为菊科春黄菊族Anthemideae(Compositae)的一个大属,是菊花的近缘属,全世界约300余种,我国有186种,44变种,分布遍及全国各地。蒿属植物多生长在自然条件恶劣的沙漠、高原、沿海滩涂地带,具有抗虫、抗病、抗逆等优良性状[1, 2]。蒿属植物由于携带许多栽培菊花缺乏的优质基因,其野生种的收集、评价对栽培菊花的品种改良、抗性育种等研究非常重要。同时,蒿属植物也是进行菊科亲缘关系讨论和栽培菊花起源研究的重要材料。
目前栽培菊花组织培养技术已较为成熟,利用芽尖[3]、叶柄[4]、叶片[5, 6]、茎段[7, 8]、管状花[9]、花梗[10]等外植体和体细胞胚培养[10]实现植株再生的研究均已见报道,但其近缘野生种质的研究却相对薄弱,尚待解决的问题很多。本研究通过对黄金艾蒿、香蒿、青蒿、艾蒿4种代表性的蒿属植物进行再生技术研究,探究不同植物生长调节剂和添加物对蒿属植物再生体系建立的影响,从而寻找出最优体系的培养条件组合,为种质资源保存、突变体的离体筛选、遗传转化和克服远缘杂交障碍等研究奠定基础。 1 材料与方法 1.1 材料及培养条件
供试蒿属植物材料为黄金艾蒿(Artemisia vulgaris‘Variegate’)、香蒿(A.annua)、青蒿(A.annua‘Belgium’)和艾蒿(A.argyi),分别简写为HH、XH、QH、AH,均由南京农业大学中国菊花种质资源保存中心提供。
培养基均添加30 g · L-1蔗糖,7.0 g · L-1琼脂,pH为5.8,置于121 ℃灭菌20 min。在室温(25±2)℃,光周期16 h/8 h,光照度2 000~3 000 lx条件下培养。 1.2 试验方法 1.2.1 不同质量浓度NAA和6-BA组合对蒿属植物茎段外植体愈伤诱导和不定芽分化的影响
以黄金艾蒿、香蒿为试材,选取生长整齐健壮的无菌苗,切割成长1 cm左右不带茎节的茎段,接种到添加有不同质量浓度NAA(0.1、0.3、0.5 mg · L-1)和6-BA(1.0、2.0、3.0 mg · L-1)组合的MS培养基中诱导愈伤组织的形成,统计愈伤组织诱导率后将生长状态良好的愈伤组织转接到同样的新鲜培养基中诱导不定芽发生,统计不定芽再生率。每处理接2个培养皿,每个培养皿接15个外植体,重复3次。愈伤组织诱导率=形成愈伤组织外植体数/总存活外植体数×100%;不定芽再生率=出芽外植体数/形成愈伤组织外植体数×100%。
1.2.2 不同质量浓度NAA和6-BA组合对蒿属植物花蕾外植体愈伤诱导和不定芽分化的影响以青蒿和艾蒿为试材,采集自然条件下开放的饱满花蕾,消毒后对半切成1/2小块,接种到MS培养基中,7 d后将生长正常、无污染的花蕾外植体转接到添加有不同质量浓度NAA(0.1、0.3、0.5 mg · L-1)和6-BA(1.0、2.0、3.0 mg · L-1)组合的MS培养基中诱导愈伤组织的形成,统计愈伤组织诱导率。将生长状态良好的愈伤组织转接到同样的新鲜培养基中诱导不定芽发生,统计不定芽再生率。每处理接3个培养皿,每个培养皿接15个外植体,重复3次。
1.2.3 不同质量浓度IBA和6-BA组合对蒿属植物带节茎段增殖的影响以黄金艾蒿、香蒿、青蒿和艾蒿为试材,选取生长整齐健壮的无菌苗,切割成带1个节的茎段,接种到不同质量浓度IBA(0.1、0.3 mg · L-1)和6-BA(0.5、1.0、2.0 mg · L-1)组合的增殖培养基中诱导不定芽。每处理4瓶,每瓶接4个外植体,重复3次。培养40 d后统计增殖系数。增殖系数=增殖的新芽总数/存活的带节茎段总数。
1.2.4 不同质量浓度的IBA和活性炭组合对蒿属植物带叶茎段生根的影响以黄金艾蒿、香蒿、青蒿和艾蒿为试材,选取生长整齐健壮的无菌苗,切割成带1片叶子的茎段,接种到不同质量浓度IBA(0、0.1、0.2、0.4 mg · L-1)和活性炭(0、0.5、1.0 g · L-1)组合的生根培养基上进行生根诱导。每处理4瓶,每瓶接种4个外植体,重复3次。30 d后统计生根苗数及平均根数,测量根长,计算生根率。 1.3 数据处理
数据统计分析采用Microsoft Excel 2013和IBM SPSS Statistics Version 20软件处理,多重比较采用Duncan′s检验法。
2 结果与分析 2.1 不同质量浓度NAA和6-BA组合对4种蒿属植物愈伤组织诱导和不定芽分化的影响 2.1.1 对茎段外植体愈伤诱导和不定芽分化的影响
由表 1可知:黄金艾蒿茎段愈伤组织诱导率在6-BA质量浓度为1.0 mg · L-1时最高;当6-BA为2.0 mg · L-1时愈伤组织诱导率随NAA质量浓度增加而增加;当6-BA为3.0 mg · L-1时,黄金艾蒿茎段愈伤组织诱导率随NAA质量浓度增加而呈先增加后减少的趋势。表明低浓度的6-BA对黄金艾蒿茎段愈伤组织的形成有利,且在一定范围内,NAA质量浓度越高,愈伤组织诱导率越高。最适合黄金艾蒿茎段诱导愈伤组织的6-BA质量浓度为1.0 mg · L-1,NAA质量浓度为0.1、0.3和0.5 mg · L-1皆适宜。香蒿茎段在NAA为0.5 mg · L-1和6-BA为2.0 mg · L-1处理下愈伤组织诱导率最高,在NAA为0.3 mg · L-1、6-BA为1.0 mg · L-1和NAA为0.5 mg · L-1、6-BA为3.0 mg · L-1处理下诱导率也较高。
| ρ(NAA)/ (mg·L-1) | ρ(6-BA)/ (mg·L-1) |
|
|
| 0.1 | 1.0 | 100.00a | 41.33e | 88.24b | 73.68c | 0.00b | 12.57e | 8.82d | 3.95d | |||
| 0.3 | 1.0 | 100.00a | 71.80b | 74.07g | 83.33b | 0.00b | 0.00f | 33.33a | 9.56a | |||
| 0.5 | 1.0 | 100.00a | 35.57f | 95.00a | 95.45a | 0.00b | 36.53b | 0.00g | 4.55c | |||
| 0.1 | 2.0 | 32.47g | 21.20h | 62.26h | 33.85h | 0.00b | 0.00f | 3.77e | 0.00e | |||
| 0.3 | 2.0 | 77.53e | 42.37d | 81.63d | 39.47g | 0.00b | 21.40d | 30.61b | 0.00d | |||
| 0.5 | 2.0 | 82.33c | 78.60a | 28.95i | 52.27f | 0.00b | 27.23c | 2.63f | 9.09b | |||
| 0.1 | 3.0 | 47.40f | 11.10i | 80.00e | 57.41e | 22.20a | 40.36a | 0.00g | 0.00e | |||
| 0.3 | 3.0 | 82.90b | 33.47g | 75.00f | 29.63i | 0.00b | 0.00f | 16.07c | 0.00e | |||
| 0.5 | 3.0 | 78.10d | 68.33c | 87.50c | 61.29d | 0.00b | 0.00f | 0.00g | 0.00e | |||
| 注: 1)HH:黄金艾蒿A.vulgaris‘Variegate’;XH:香蒿A.annua;QH:青蒿A.annua‘Belgium’;AH:艾蒿A.argyi 2) 同列内不同字母表示差异显著(P < 0.05)。Means within columns followed by the different letter are significantly different at 0.05 level.The same as follows. | ||||||||||||
黄金艾蒿和香蒿均在NAA为0.1 mg · L-1、6-BA为3.0 mg · L-1时不定芽再生率最高,显著优于其他组合。另外,香蒿在NAA为0.5 mg · L-1和6-BA为1.0 mg · L-1时不定芽分化效果也较好。 2.1.2 对花蕾外植体愈伤诱导和不定芽分化的影响
由表 1可知:青蒿花蕾愈伤诱导的最适组合是NAA为0.5 mg · L-1和6-BA为1.0 mg · L-1,诱导率显著高于其他组合。另外,在NAA为0.1 mg · L-1和6-BA为1.0 mg · L-1与NAA为0.5 mg · L-1和6-BA为3.0 mg · L-1时,青蒿愈伤组织诱导效果也较好。艾蒿花蕾在NAA为0.3 mg · L-1和0.5 mg · L-1,6-BA为1.0 mg · L-1时愈伤组织诱导率均显著高于其他组合,而在NAA为0.5 mg · L-1和6-BA为1.0 mg · L-1时愈伤组织诱导率达到最高。
青蒿在NAA为0.3 mg · L-1时,不定芽发生都较好,最适宜青蒿愈伤组织发生不定芽的NAA为0.3 mg · L-1,6-BA为1.0 mg · L-1。艾蒿在NAA为0.3 mg · L-1和6-BA为1.0 mg · L-1时不定芽再生率最高,显著优于其他组合。另外,在NAA为0.5 mg · L-1和6-BA为2.0 mg · L-1时不定芽再生率也较高。 2.2 不同质量浓度IBA和6-BA组合对带节茎段增殖系数的影响
由表 2和图 1可以看出:当IBA为0.3 mg · L-1和6-BA为0.5 mg · L-1时,黄金艾蒿、香蒿、青蒿均具有较高增殖系数,其中黄金艾蒿、香蒿在此组合下增殖系数最高。但不同物种之间也存在基因型差异,黄金艾蒿在IBA为0.1 mg · L-1和6-BA为0.5 mg · L-1与IBA为0.3 mg · L-1和6-BA为1.0 mg · L-1时增殖系数也较高,均显著高于其他组合;香蒿在IBA为0.1 mg · L-1和6-BA为0.5 mg · L-1时增殖系数显著高于其他组 合;青蒿在IBA为0.3 mg · L-1和6-BA为2.0 mg · L-1时增殖系数最高;而艾蒿则在IBA为0.3 mg · L-1和6-BA为 1.0 mg · L-1时增殖系数最高。另外,艾蒿在IBA为0.3 mg · L-1和6-BA为2.0 mg · L-1时增殖也较好。
| 处理 Treatment | ρ(IBA)/ (mg·L-1) | ρ(6-BA)/ (mg·L-1) |
|
|
|
|
| 1 | 0.1 | 0.5 | 135 | 7.44a | 53 | 2.33b | 68 | 3.22d | 38 | 1.38b | |||
| 2 | 0.1 | 1.0 | 82 | 4.14b | 33 | 1.08cd | 100 | 5.25cd | 40 | 1.50b | |||
| 3 | 0.1 | 2.0 | 77 | 3.82b | 30 | 0.83d | 79 | 3.92d | 30 | 0.87c | |||
| 4 | 0.3 | 0.5 | 163 | 9.22a | 68 | 3.25a | 142 | 7.90b | 23 | 0.44d | |||
| 5 | 0.3 | 1.0 | 135 | 7.44a | 35 | 1.17cd | 127 | 6.92bc | 48 | 1.92a | |||
| 6 | 0.3 | 2.0 | 83 | 4.15b | 43 | 1.67c | 201 | 11.53a | 39 | 1.42b | |||
| Note:RB:Regeneration number;PC:Proliferation coefficient | |||||||||||||
 | 图 1 不同质量浓度IBA和6-BA组合对4种蒿属植物带节茎段增殖效果的影响 Fig. 1 Effects of different IBA and 6-BA concentrations on the shoot proliferation of four Artemisia plants 编号1~6同表2。Number 1-6 are the same with Table 2. |
由表 3和图 2~图 5可见:4种蒿属植物生根都较易,但种间基因型差异也较明显。除艾蒿所有处理均100%生根外,黄金艾蒿、香蒿、青蒿各处理间的生根率差异显著。黄金艾蒿在IBA为0、0.1、0.2 mg · L-1和活性炭为0、0.5、1.0 g · L-1处理下生根率皆为100%;当IBA为0.4 mg · L-1时,生根率有所下降,但仍维持较高水平,并随活性炭质量浓度的增加而增加。香蒿则在0 mg · L-1 IBA+1.0 g · L-1活性炭,0.1 g · L-1 IBA+0 g · L-1活性炭,0.2 mg · L-1 IBA+0 g · L-1活性炭,0.4 mg · L-1 IBA+0.5 g · L-1活性炭中都获得了100%的生根率。而青蒿则在IBA和活性炭质量浓度皆为0时获得100%生根率。另外,在IBA为0.1 mg · L-1、活性炭为1.0 g · L-1,IBA为0.2 mg · L-1、活性炭为0.5 g · L-1时,青蒿也维持了比较好的生根率。
处理 Treatment | ρ(IBA)/ (mg·L-1) | 活性炭/(g·L-1) Activated carbon |
|
|
|
| 1 | 0 | 0 | 100.00a | 94.12b | 100.00a | 100.00a | 3.83c | 3.17d | 1.88d | 1.88f | 3.46cd | 2.04h | 5.64cd | 9.01ef | ||
| 2 | 0 | 0.5 | 100.00a | 70.00i | 87.50d | 100.00a | 2.50gh | 2.09e | 2.25bc | 4.88bc | 2.00g | 2.82c | 4.74ef | 8.43fg | ||
| 3 | 0 | 1.0 | 100.00a | 100.00a | 75.00g | 100.00a | 3.17e | 2.83de | 1.35e | 2.88e | 4.88a | 2.89bc | 4.61f | 9.51de | ||
| 4 | 0.1 | 0 | 100.00a | 100.00a | 78.57f | 100.00a | 2.98f | 4.28c | 2.42ab | 5.50ab | 2.80ef | 2.12gh | 5.23de | 9.19ef | ||
| 5 | 0.1 | 0.5 | 100.00a | 80.00f | 87.50d | 100.00a | 2.14i | 3.04de | 2.05cd | 4.50c | 3.31de | 2.58d | 8.33a | 8.23fgh | ||
| 6 | 0.1 | 1.0 | 100.00a | 92.31e | 91.67b | 100.00a | 1.67j | 3.20d | 2.67a | 4.13cd | 1.88g | 2.25fg | 4.84ef | 7.26h | ||
| 7 | 0.2 | 0 | 100.00a | 100.00a | 70.00h | 100.00a | 2.64g | 5.75ab | 2.38b | 4.25cd | 3.20de | 2.49de | 5.79c | 7.83gh | ||
| 8 | 0.2 | 0.5 | 100.00a | 93.33d | 90.90c | 100.00a | 2.40h | 4.83bc | 1.93d | 4.38c | 3.95bc | 2.30efg | 5.95c | 10.31cd | ||
| 9 | 0.2 | 1.0 | 100.00a | 75.00h | 66.67i | 100.00a | 3.45d | 4.25c | 1.00f | 4.25cd | 4.12b | 3.01b | 8.62a | 9.53de | ||
| 10 | 0.4 | 0 | 81.82d | 76.92g | 58.33j | 100.00a | 4.78b | 4.25c | 1.38e | 3.25de | 2.67f | 3.30a | 3.40g | 14.56a | ||
| 11 | 0.4 | 0.5 | 83.26c | 100.00a | 85.71e | 100.00a | 4.72b | 6.67a | 1.17ef | 5.88a | 3.45cd | 2.33ef | 5.43cd | 11.89b | ||
| 12 | 0.4 | 1.0 | 93.34b | 93.75c | 28.57k | 100.00a | 6.06a | 4.36c | 2.50ab | 4.25cd | 3.42cd | 2.60d | 7.45b | 10.63c |
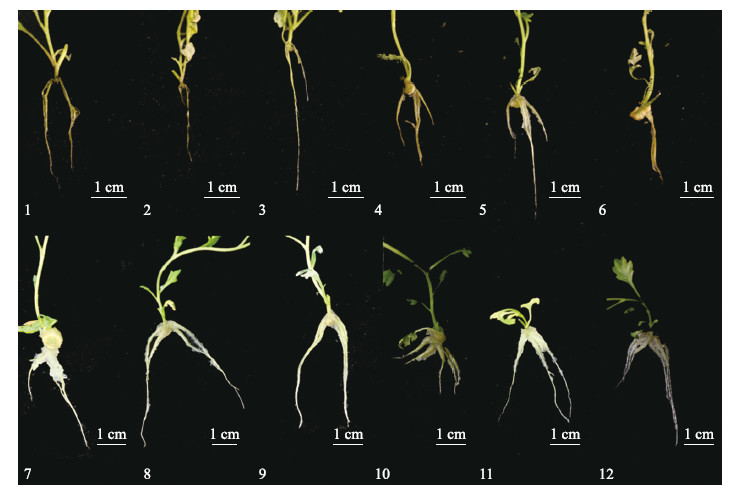 | 图 2 不同质量浓度的IBA和活性炭组合对黄金艾蒿生根培养的影响 Fig. 2 Effects of different IBA and activated carbon concentrations on A.vulgaris‘Variegate’rooting 编号1~12同表3。Number 1-12 are the same with Table 3.The same as follows |
 | 图 3 不同质量浓度的IBA和活性炭组合对香蒿生根培养的影响 Fig. 3 Effects of different IBA and activated carbon concentrations on A.annua rooting |
 | 图 4 不同质量浓度的IBA和活性炭组合对青蒿生根培养的影响 Fig. 4 Effects of different IBA and activated carbon concentrations on A.annua‘Belgium’rooting |
 | 图 5 不同质量浓度的IBA和活性炭组合对艾蒿生根培养的影响 Fig. 5 Effects of different IBA and activated carbon concentrations on A.argyi rooting |
在平均根长、平均根数指标上,不同蒿属植物间也存在较大的基因型差异。种间比较,艾蒿表现优异,香蒿、青蒿次之,黄金艾蒿最差。种内比较,平均根数方面,随着IBA质量浓度逐渐增大,除黄金艾蒿平均根数先降后升,香蒿、青蒿和艾蒿都呈现先升后降的趋势;平均根长方面,随着IBA质量浓度增大,根长呈现波动变化。而活性炭对4种蒿属平均根长和平均根数的影响则较复杂,也呈波动变化。
综合以上3种指标,按照生根率 ∶ 平均根数 ∶ 平均根长=5 ∶ 3 ∶ 2的权重进行评估,黄金艾蒿在IBA质量 浓度为0 mg · L-1和活性炭质量浓度为1.0 g · L-1时表现最佳,香蒿在IBA为0.4 mg · L-1和活性炭为0.5 g · L-1 时表现最佳,青蒿在IBA为0 mg · L-1和活性炭为0 g · L-1时表现最佳,艾蒿在IBA为0.4 mg · L-1和活性炭为0.5 g · L-1时表现最佳。 3 讨论
本试验结果表明:茎段和花蕾外植体的愈伤组织诱导率与生长调节剂组合的浓度相关性较大,最高愈伤组织诱导率都是在中低质量浓度的6-BA条件下获得,其中黄金艾蒿、青蒿、艾蒿愈伤诱导的最适6-BA质量浓度为1 mg · L-1,香蒿的最适6-BA质量浓度为2.0 mg · L-1,而NAA对愈伤组织形成则表现出或促进或抑制的作用,适宜的NAA质量浓度有待进一步探讨。
本研究中,不定芽再生方面,各蒿属植物间存在较明显的基因型差异。黄金艾蒿和香蒿都在NAA为0.1 mg · L-1,6-BA为3.0 mg · L-1时不定芽再生率最高,当6-BA质量浓度过高时,会抑制不定芽的分化和生长,甚至产生毒害性[11],本试验中尚未产生,因此适宜的6-BA质量浓度还有待进一步试验验证;而青蒿和艾蒿则在NAA为0.3 mg · L-1,6-BA为1.0 mg · L-1时取得最高不定芽再生率。
NAA与6-BA是经济有效、适合增殖培养的植物生长调节剂组合[12],而李会珍等[13]则发现IBA与6-BA组合时红颊草莓组培苗不仅增殖系数高,且生长健壮。本文以效果相近的IBA代替NAA,黄金艾蒿、香蒿、青蒿在IBA为0.3 mg · L-1,6-BA为0.5 mg · L-1时均获得较高增殖系数,但各蒿属植物间也表现出了基因型差异,青蒿在IBA为0.3 mg · L-1和6-BA为2.0 mg · L-1时增殖系数最高,艾蒿则在IBA为0.3 mg · L-1和6-BA为1.0 mg · L-1时获得最高增殖系数。
根据王平红[14]的报道,活性炭具有明显提高蓝莓组培苗生根率,使根数增加、根粗壮的效果。本研究结果显示:在很多处理组合上活性炭的确体现了明显的促进根系形成的作用,但在不少组合中也出现了抑制作用,这与孙占育等[15]的研究结果一致。因此,在不同基因型植物的组培苗生根培养中,寻找活性炭的有效添加浓度仍是一个难点。IBA和活性炭对生根影响的研究表明:两者组合对根系形成的作用并不是简单的效应叠加,两者之间很可能存在互作效应。孙占育等[15]的研究认为,有可能是活性炭一定程度上吸附了IBA,在一定条件下存在抵消作用。
本研究初步建立了黄金艾蒿、香蒿茎段离体快繁体系和青蒿、艾蒿花蕾植株再生体系,为蒿属植物进一步研究如基因转化等提供了技术基础。
| [1] | 白茹珍, 王呼和. 蒿属植物在中国北方沙漠治理中的作用[J]. 内蒙古林业科技, 2009, 34(4):49-51 [Bai R Z, Wang H H. Role of Artemisia species in desert control in the north of China[J]. Journal of Inner Mongolia Forestry Science and Technology, 2009, 34(4):49-51(in Chinese with English abstract)] |
| [2] | 孙娅, 管志勇, 陈素梅, 等. 菊属与蒿属植物苗期抗蚜虫性鉴定[J]. 生态学报, 2012, 32(1):319-325 [Sun Y, Guan Z Y, Chen S M, et al. Identification of aphid resistance in eleven species from Dendranthema and Artemisia at seedling stage[J]. Acta Ecologica Sinica, 2012, 32(1):319-325(in Chinese with English abstract)] |
| [3] | Hill G P. Shoot formation in tissue cultures of chrysanthemum ‘Bronze Pride'[J]. Physiologia Plantarum, 1968, 21(2):386-389 |
| [4] | Yepes L M, Mittak V, Pang S Z, et al. Biolistic transformation of chrysanthemum with the nucleocapsid gene of tomato spotted wilt virus[J]. Plant Cell Reports, 1995, 14(11):694-698 |
| [5] | Kaul V, Miller R M, Hutchinson J F, et al. Shoot regeneration from stem and leaf explants of Dendranthema grandiflora Tzvelev[J]. Plant Cell Tiss Org Cult, 1990, 21:21-30 |
| [6] | 董凤丽, 刘杰, 马欣, 等. 露地菊‘纽9717'的茎叶离体快繁体系[J]. 草业科学, 2014, 31(3):423-430 [Dong F L, Liu J, Ma X, et al. Establishment of the rapid propagation system from stem and leaf explant of Chrysanthemum×grandiflora ‘Niu9717'[J]. Pratacultural Science, 2014, 31(3):423-430(in Chinese with English abstract)] |
| [7] | Annadana S, Rademaker W, Ramanna M, et al. Response of stem explants to screening and explant source as a basis for methodical advancing of regeneration protocols for chrysanthemum[J]. Plant Cell Tiss Org Cult, 2000, 62:47-55 |
| [8] | Mitiouchkina T Y, Dolgov S V. Regeneration from leaf disks of Chrysanthemum morifolium Ramat[J]. Acta Hort, 1995, 420:112-114 |
| [9] | 陈发棣, 滕年军, 房伟民, 等. 三个菊花品种花器官愈伤组织辐射效应的研究[J]. 中南林学院学报, 2003, 23(5):49-52 [Chen F D, Teng N J, Fang W M, et al. Effects of irradiation on the browning and differentiation of calli derived from the flower organs of three small-flowered Dendranthema morifolium[J]. Journal of Central South Forestry University, 2003, 23(5):49-52(in Chinese with English abstract)] |
| [10] | Rout G R, Das P. Recent trends in the biotechnology of chrysanthemum:a critical review[J]. Scientia Horticulture, 1997, 69(3/4):239-257 |
| [11] | 刘国红, 梁明祥, 周诗雨, 等. 甘蓝型油菜'南盐油1号'不同外植体再生体系的比较研究[J]. 南京农业大学学报, 2012, 35(3):42-46. doi:10.7685/j.issn.1000-2030.2012.03.008 [Liu G H, Liang M X, Zhou S Y, et al. The comparative study on different explant regeneration systems in canola ‘Nanyanyou 1'(Brassica napus L.)[J]. Journal of Nanjing Agricultural University, 2012, 35(3):42-46(in Chinese with English abstract)] |
| [12] | 潘宇, 庞少萍, 邹卓, 等. 菊芋快速繁殖与植株再生研究[J]. 西南大学学报:自然科学版, 2013, 35(12):16-20 [Pan Y, Pang S P, Zhou Z, et al. Jerusalem artichoke fast breeding and plant regeneration[J]. Journal of Southwest University:Natural Science Edition, 2013, 35(12):16-20(in Chinese with English abstract)] |
| [13] | 李会珍, 徐东进, 陈登金, 等. 不同植物生长调节剂对脱毒红颊草莓组培快繁的影响[J]. 江苏农业科学, 2013, 41(2):43-45 [Li H Z, Xu D J, Chen D J, et al. Effect of different plant growth regulators on detoxification cheeked strawberry tissue culture[J]. Jiangsu Agricultural Sciences, 2013, 41(2):43-45(in Chinese)] |
| [14] | 王平红. 活性炭对蓝莓组培苗生根的影响[J]. 安徽农业科学, 2010, 38(22):11762-11763 [Wang P H. Effect of activated carbon on rooting of tissue-cultured seedlings of blue berry[J]. Journal of Anhui Agvicultuval Sciences, 2010, 38(22):11762-11763(in Chinese with English abstract)] |
| [15] | 孙占育, 孙志强, 曹斌. 活性炭在促进组培苗植物生根中的作用[J]. 湖南农业科学, 2010(7):3-5 [Sun Z Y, Sun Z Q, Cao B. Effect of activated charcoal in rooting process of plant tissue culture[J]. Hunan Agricultural Sciences, 2010(7):3-5(in Chinese with English abstract)] |




