文章信息
- 陈小云, 余心怡, 张仕杰, 屠煦童, 章镇, 渠慎春. 2015.
- CHEN Xiaoyun, YU Xinyi, ZHANG Shijie, TU Xutong, ZHANG Zhen, QU Shenchun. 2015.
- ‘南通小方柿’DkADH1基因遗传转化及功能分析
- Genetic transformation of‘Nantongxiaofangshi’ DkADH1 gene and function analysis
- 南京农业大学学报, 38(2): 219-225
- Journal of Nanjing Agricultural University, 38(2): 219-225.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.007
-
文章历史
- 收稿日期:2014-05-15
柿(Diospyros kaki)是柿科(Ebenaceae)柿属植物(Diospyros spp.)的代表种。根据柿果实能否自然脱涩及其与种子数目、种子挥发性物质和果肉褐斑形成的关系,分为完全甜柿(PCNA)、不完全甜柿(PVNA)、不完全涩柿(PVA)和完全涩柿(PCA)4类[1]。我国栽培的柿品种大多为涩柿,甜柿分布较少。
可溶性单宁,亦被称作原花青素(proanthocyanidins,PA),其积累是柿果实呈现涩味的主要原因[2]。单宁生物合成是由公共苯丙烷途径、核心类黄酮-花青素途径、PA特异途径和莽草酸途径构成的一个复合途径[3, 4, 5],受多种结构基因和调节基因共同调控。柿果的脱涩过程主要是可溶性单宁转变成不溶性单宁的过程。乙醛是果实中的一种自然芳香成分,能与可溶性单宁发生缩合反应,对柿果脱涩具有直接作用[6],脱涩的难易程度与乙醛形成的能力密切相关[7, 8, 9]。乙醛乙醇脱氢酶(alcohol dehydrogenas,ADH)是无氧呼吸过程中的一种关键酶[10],催化无氧呼吸产生的乙醇氧化成为乙醛,同时也可催化乙醛与可溶性单宁聚合形成不可溶单宁。据报道,香蕉果实的脱涩与ADH活性的增加以及乙醛、乙醇含量提高密切相关[11]。有研究发现,将ADH基因转入葡萄中使其过量表达,增加了果肉中乙醛含量,降低了多酚的含量和聚合度,起到提高果实风味和品质的作用[12]。
‘南通小方柿’(Diospyros kaki Linn.‘Nantongxiaofangshi’)是江苏省南通市的地方品种,属于不完全涩柿[13]。其成熟果实采后自然放置7 d左右就可脱涩,部分果实在树上即可自然脱涩,是珍贵的易脱涩柿子种质资源。本课题组已利用同源克隆的方法从‘南通小方柿’中分离出ADH基因,命名为DkADH 1 [14]。qRT-PCR分析结果表明,随着果实的成熟,该基因的表达呈现上升趋势,而单宁合成途径中的相关基因DkF 3′5′H、DkMYB4 的表达量均下调。推测‘南通小方柿’中DkADH 1 基因的高表达使果实中的乙醛含量升高并抑制单宁的生物合成,导致可溶性单宁含量的降低,从而实现果实脱涩。本文进一步将从‘南通小方柿’中克隆的DkADH 1 基因转入番茄中进行异位表达,分析其在柿原花色素代谢途径中的作用,旨在揭示该基因在柿果脱涩过程中的相关功能,为深入研究柿果脱涩机制及相关遗传机制提供参考。 1 材料与方法 1.1 材料 1.1.1 植物材料
南通小方柿(Diospyros kaki Linn.‘Nantongxiaofangshi’)采自江苏省南通市海安县,番茄(Lycopersicon esculentum Miller)品种‘红玉’种子购自于江苏省农业科学院。
1.1.2 菌种与试剂大肠杆菌(Escherichia coli)菌株DH5α和pYH4215载体均由南京农业大学果树生物技术实验室保存。各种限制性内切酶、pMD19-T Vector、rTaq DNA聚合酶、T4 DNA连接酶和反转录试剂盒购自大连宝生物工程公司。DNA片段回收试剂盒、质粒提取试剂盒购自北京爱思进生物技术有限公司。
1.2 方法 1.2.1 DkADH 1 基因载体的构建与鉴定
根据pYH4215载体和DkADH 1 基因的酶切位点,设计含有BamHⅠ和SacⅠ酶切位点的基因特异引物,扩增带有酶切位点的DkADH 1 基因。上游引物XDkADH1-F: GGATCC -ACGCAAACCAACTGCG,下游引物XDkADH1-R: GAGCTC TGCAGACGATGCAACTCCA(下划线表示酶切位点)。
将扩增的目的片段回收,连接于pMD19-T克隆载体,并进行克隆测序。利用BamHⅠ和SacⅠ对pYH4215载体和经测序验证正确后的pMD19-T载体中DkADH 1 基因进行完全双酶切,酶切体系为20 μL。电泳后分别回收XDkADH1和pYH4215载体片段,用T4 DNA连接酶在4 ℃下连接过夜,将DkADH 1 基因插入pYH4215载体的CMV35s启动子下游。将重组DNA连接于pMD19-T克隆载体,进行T/A克隆后在含有卡那霉素(Km)的LB固体培养基上转化大肠杆菌DH5α,待转化出阳性菌落后进行PCR检测,提取质粒后,进行PCR检测和酶切鉴定。将大肠杆菌质粒用冻融法转入农杆菌EHA105感受态细胞,菌液PCR鉴定阳性克隆。
1.2.2 DkADH 1 基因转化番茄取适量番茄种子用70%乙醇消毒30 s,用清水冲洗掉乙醇,在超净台上用10%次氯酸钠消毒15 min后,用灭菌水冲洗5~6次,倒入灭过菌的装有吸水纸的培养皿中,接种于1/2 MS培养基上,暗培养2~3 d,番茄种子发芽后,置于25 ℃;取生长10~12 d的无菌番茄苗,将番茄苗剪成大约为0.5 cm×0.5 cm的小方块,置于预培养基上暗培养2~3 d,用于转化;将带有目的基因的农杆菌28 ℃过夜培养,室温下5 000 r · min-1离心5 min收集菌体,菌体用40 mL的MS0(含100 μmol · L-1乙酰丁香酮)重新悬浮30 min;取预培养的番茄子叶,放入上述用MS0液体培养基重新悬浮的农杆菌菌液中,侵染13~15 min,期间不断轻摇,取出侵染过的子叶,用灭过菌的滤纸吸去子叶多余的菌液,近轴面朝下将其置于共培养基上,25 ℃暗培养2 d。
共培养结束后,将番茄子叶放入诱导分化培养基上培养10 d后,置换于筛选培养基上,2~3周就可以看见愈伤组织的形成,每2周继代1次,1个月后可见不定芽的产生,待抗性不定芽长至2~3 cm时,将其剪下,转入生根培养基,在25 ℃诱导生根。2周后生根,4~5周后根系逐渐发达时拧松瓶盖。继续培养2 d,打开瓶盖移至人工气候箱中,16 h光照,8 h黑暗,25 ℃炼苗1周。后将转化的植株栽入装有培养基质(草炭土、蛭石、珍珠岩体积比为9 ∶ 5 ∶ 3)的营养钵中,置于植物生长室中自然光照培养。
1.2.3 转基因植株PCR检测分别取生根的转基因和非转基因番茄幼苗的上部叶片,采用CTAB裂解法[15]提取番茄总DNA,利用PCR法检测,反应体系为25 μL。
1.2.4 RT-PCR检测参照蔡斌华等[16]的方法提取番茄叶片的总RNA,经过DNA消化后,利用反转录试剂盒按照说明书合成cDNA,得到反转录产物,稀释10倍,取1 μL用于RT-PCR试验,其反应体系为25 μL。
1.2.5 番茄单宁含量的测定采用钨酸钠-钼酸钠比色法测定番茄组织中可溶性单宁含量[17]。分别取4.0 g转基因番茄和非转基因番茄的叶片、花和果实,充分研磨后加入蒸馏水定容至80 mL,沸水浴锅中水浴30 min,冷却定容至100 mL,12 000 r · min-1离心10 min,取1.0 mL上清液,加5.0 mL水、1.0 mL钨酸钠-钼酸钠混合溶液和3.0 mL Na2CO3溶液后静置1 h,765 nm波长下测定单宁含量(单位mg · g-1),其中标准曲线用单宁酸进行绘制。
1.2.6 转基因番茄株系PA途径相关基因的表达分析分别采集转基因和非转基因番茄的叶片、花和果实,提取各组织RNA,利用反转录试剂盒按照说明合成cDNA,用实时荧光定量PCR(qRT-PCR)方法对转基因番茄PA合成途径相关基因的表达进行定量分析。以番茄actin基因为内参基因,利用Primer Premier 5.0设计特异性引物(表 1)。试验设置3次重复。数据分析采用7300 system软件和2-ΔΔCT的方法[18]。
引物名称Primer name | 引物序列(5′→3′)Primer sequence |
| actin F/R | AGAAGAAGACCTACACCAAGCC/TCCCAAGGGTTGTCACATACATC |
| PAL F/R | AAGGAACCCCTATTGGTGTCTC/CTGTCAGATTAGATGGCAACCC |
| MYB4 F/R | CAGGTAGAACAGACAATGAG/CTTCATCATCAATCACCACG |
| F3′5′H F/R | AAACGCAAAGATTGAACCTCG/CACTATTCCCATCCTTGTCCC |
pMD19-T-DkADH 1 和pYH4215载体经BamHⅠ+SacⅠ完全双酶切后,产生了与预期一致的目的条带(图 1),回收目的片段。将回收后的目的片段和载体片段用T4连接酶连接后转化,进行PCR检测,扩增出了目的条带,说明目的片段已经构建在载体上,同时酶切鉴定后确定已经将该基因正确构建到载体上。
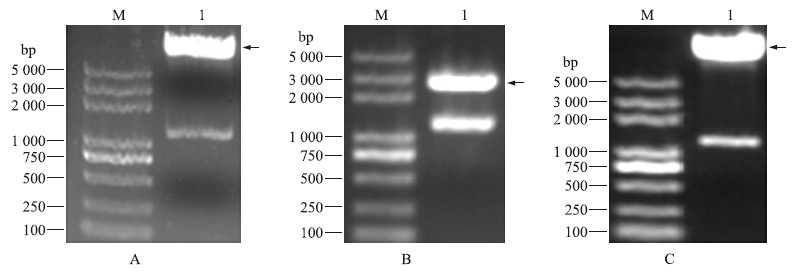 | 图 1 DkADH 1 载体的酶切鉴定 Fig. 1 Enzyme digestion of DkADH 1 vector A.pYH4215载体双酶切后检测pYH4215 carrier detected after double digestion;B.pMD19-T-DkADH 1 双酶切后检测pMD19-T-DkADH 1 digested after detection;C.pYH4215-DkADH 1 双酶切检测pYH4215-DkADH 1 double enzyme digestion M.DL5000 marker;1.DkADH 1 |
番茄叶片通过农杆菌的侵染、预培养、共培养、诱导分化培养、筛选培养以及生根培养后,最终获得了3个阳性植株(图 2)。
 | 图 2 转基因番茄苗 Fig. 2 Transgenic tomato plants with DkADH 1 gene A.初代培养Primary culture;B.番茄叶片转化Transformation of tomato leaf;C.转化番茄筛选培养Tomato screening culture;D.产生抗性芽Resistant shoots;E.转基因番茄生根培养Transgenic tomato rooting culture;F.转基因番茄株系Transgenic tomato strains |
剪取转基因番茄植株叶片和非转基因番茄叶片,分别提取DNA,用10 g · L-1琼脂糖电泳检测,3个转基因植株中都扩增出DkADH 1 基因片段,而非转基因对照中没有扩增出DkADH 1 基因片段,这说明DkADH 1 基因已整合到3个检测植株的基因组中(图 3)。
 | 图 3 PCR鉴定转基因番茄植株 Fig. 3 Confirmation of transgenic tomato plants by PCR M.DL5000 marker;P.阳性对照质粒Positive control plasmid;CK.非转基因植株Non-transgenic plants;1~3.转基因植株Transgenic plants |
为了检测DkADH 1 基因在转基因番茄植株体内的转录情况,分别提取了经PCR检测显示阳性的3个转基因植株和2个非转基因番茄植株RNA,用RT-PCR方法对外源融合基因在3个PCR阳性植株基因组中的转录进行检测。结果(图 4)表明:这3个转基因植株均能扩增出目的条带,而2个非转基因植株没有扩增出目的条带,表明DkADH 1 基因在转基因植株中得到有效的转录。
 | 图 4 番茄转DkADH 1 基因植株的RT-PCR检测 Fig. 4 Detection of the DkADH 1 gene transcripts by RT-PCR M.DL2000 marker;CK.非转基因植株Non-transgentic plants;1~3.转基因植株Transgentic plants |
由图 5可见:在转基因番茄的叶片、花和果实中的,单宁含量明显低于非转基因番茄,在叶片中,单宁 含量由0.252 mg · g-1降低到0.159 mg · g-1,花中由0.704 mg · g-1降低到0.372 mg · g-1,果实中由0.236 mg · g-1 降低到0.123 mg · g-1。表明将DkADH 1 基因转入番茄中能够降低番茄中单宁的含量。
 | 图 5 番茄中单宁含量的测定 Fig. 5 Determination of tannin content in tomato |
在番茄的叶片、花和果实中对PA途径中的相关基因进行了相关的表达分析,其中包含LAR、F 3′5′H、PAL和MYB4 基因。这4个基因表达量虽然存在着差异,但是总体上都是呈现下降趋势(图 6)。相对于非转基因番茄植株,LAR、F 3′5′H、PAL和MYB4 基因在叶片、花、果实中明显下调。表明转入的DkADH 1 基因对PA途径中相关基因在番茄不同组织上都具有调节作用。
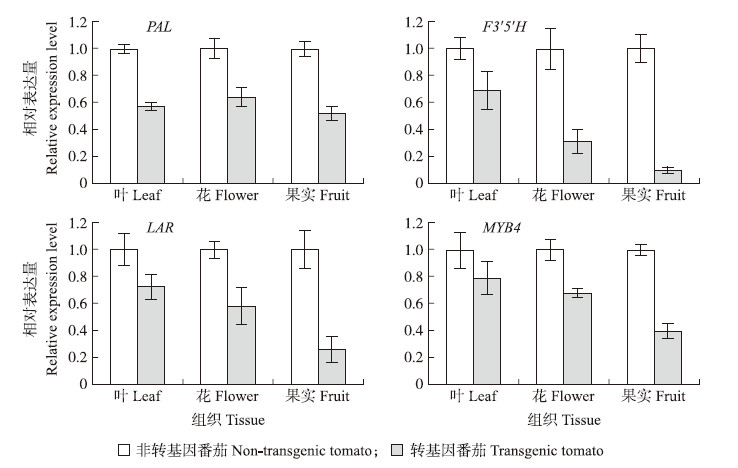 | 图 6 转基因番茄中PA合成相关基因的表达分析 Fig. 6 Expression of PA biosynthetic related genes in transgenic tomato plants |
本研究通过构建‘南通小方柿’DkADH 1 基因植物双元表达载体,通过农杆菌介导法将其转入番茄中,对转基因植株不同组织的单宁含量进行了测定,分析了PA生物合成途径相关基因的表达情况,初步探索了DkADH 1 在植物果实脱涩过程中的作用。
乙醛乙醇脱氢酶(ADH)广泛存在于植物的不同器官组织中,对果实风味和芳香物质的合成、种子发育以及果实后熟过程起重要作用[19]。果实成熟过程中,ADH活性逐渐增加[20]。对柿子果实的返涩研究表明,果实中ADH活性与可溶性单宁和不溶单宁含量之间的变化相关[21]。本试验中,转入‘南通小方柿’DkADH 1 基因的番茄株系叶、花及果实中单宁含量均显著低于非转基因植株,表明该基因对植物果实脱涩起重要作用。
有研究认为,不完全甜柿、不完全涩柿和完全涩柿类型果实脱涩与乙醇有关。不完全甜柿果实成熟过程中,种子无氧呼吸产生大量乙醇,因而能在树上完成脱涩[22]。不完全涩柿和完全涩柿果实成熟时产生的乙醇量极少,因此需要在采后经过人工处理[23]。用乙醇处理不完全涩柿类型品种‘平核无’幼果和成熟果实后均能完成脱涩,同时产生大量乙醛[24]。用乙醇对不同品种的柿果实进行脱涩处理,脱涩效率与脱涩前果实可溶性单宁含量无关,与ADH活性有关[10]。‘南通小方柿’为不完全涩柿品种,种子产生乙醇量较少,然而极易脱涩,推测可能与DkADH 1 基因转录水平较高或其编码的ADH活性较高有关,需要进一步试验验证。
日本原产的完全甜柿单宁细胞在幼果期就停止发育[25],随着果实的质量和体积不断增大,单位果质量内的单宁含量迅速下降,因“稀释效应”而实现自然脱涩。而不完全甜柿、不完全涩柿和完全涩柿类型果实单宁细胞随着果实生长体积不断增大,数量不断增多,涩味逐渐加强[26]。单宁的生物合成由结构基因和调节基因共同作用,目前研究较多的有PAL、F 3′5′H、DFR、LAR、ANR、DHD/SDH、WD40 和MYB等,这些基因的表达水平随着柿果实的成熟而逐渐降低[15, 16, 17],与单宁细胞的发育模式一致。本研究发现,经过乙醇脱涩处理的柿子果实中单宁合成相关基因PAL、F 3′5′H、LAR和MYB4 的表达量均显著低于未处理果实,推测乙醇处理不仅能转化可溶性单宁为不可溶单宁,还能抑制单宁合成途径有关结构基因的表达。qRT-PCR结果显示:将‘南通小方柿’DkADH 1 基因转入番茄后,单宁合成途径有关结构基因PAL、F 3′5′H、LAR和MYB4 的表达均下调,表明乙醇处理可能通过诱导DkADH 1 基因表达上调而影响单宁生物合成途径。‘南通小方柿’易脱涩的特性也可能与其DkADH 1 基因转录活性较高而抑制单宁的生物合成有关。
番茄生长周期较短、遗传转化效率相对较高,是基因功能分析的模式作物之一,但因其不含PA特异途径,较少被用来验证原花色素相关基因的功能[27]。单宁的生物合成是由多条代谢途径通过关联的节点连接在一起的复杂网络[3, 4, 5],受到多种结构基因和调控基因的控制。其中类黄酮合成途径广泛存在于植物界中,参与植物体内各类生理生化反应,对植物生长发育及环境响应起着重要作用。Bovy等[28]曾以转入玉米花青素调节基因Lc和C 1 的番茄为材料,检测类黄酮合成途径相关基因的表达情况,以研究植物PA生物合成相关酶的底物特异性。本研究表明将‘南通小方柿’DkADH 1 基因转入番茄后,转基因番茄叶、花和果实中的单宁含量均显著低于非转基因植株;相对非转基因植株,PA合成途径相关基因LAR、F 3′5′H、PAL及MYB4 在转基因植株不同组织中的表达量均有不同程度的降低。因此,转入的DkADH 1 基因是果实脱涩过程中的一个关键基因。
| [1] | 章镇, 戴文浩, 蔡斌华, 等. 不同脱涩类型柿果实发育过程中单宁物质的变化[J]. 南京农业大学学报, 1997, 20(1):105-107. doi:10.7685/j.issn.1000-2030.1997.01.021 [Zhang Z, Dai W H, Cai B H, et al. Changes of tannin during fruit development in different depuckey-type persimmons[J]. Journal of Nanjing Agricultural University, 1997, 20(1):105-107(in Chinese with English abstract)] |
| [2] | 董新海, 张宝善, 苏百兖. 柿果单宁组成及其生物学特性的研究状况[J]. 中国林副特产, 2008(1):91-93 [Dong X H, Zhang B S, Su B Y. Research briefing of composition of persimmon tannin and the biological properties[J]. Forest By-Product and Speciality in China, 2008(1):91-93(in Chinese with English abstract)] |
| [3] | Akagi T, Ikegami A, Suzuki Y, et al. Expression balances of structural genes in shikimate and flavonoid biosynthesis cause a difference in proanthocyanidin accumulation in persimmon(Diospyros kaki Thunb.)fruit[J]. Planta, 2009, 230(5):899-915 |
| [4] | Dixon R A. Engineering of plant natural product pathways[J]. Current Opinion in Plant Biology, 2005, 8(3):329-336 |
| [5] | Lepiniec L, Debeaujon I, Routaboul J M, et al. Genetics and biochemistry of seed flavonoids[J]. Annu Rev Plant Biol, 2006, 57:405-430 |
| [6] | Matsuo T, Itoo S. A model experiment for de-astringency of persimmon fruit with high carbon dioxide treatment:in vitro gelation of kaki-tannin by reacting with acetaldehyde[J]. Agricultural and Biological Chemistry, 1982, 46(3):683-689 |
| [7] | Pesis E, Levi A, Benarie R. Role of acetaldehyde production in the removal of astringency from persimmon fruits under various modified atmospheres[J]. Journal of Food Science, 1988, 53(1):153-156 |
| [8] | Matsuo T, Itoo S, Benarie R. A model experiment for elucidating the mechanism of astringency removal in persimmon fruit using respiration inhibitors[J]. Journal of the Japanese Society for Horticultural Science, 1991, 60(2):437-442 |
| [9] | Taira S, Onodera K, Itamura H, et al. Differences between the Japanese persimmon(Diospyros kaki Thunb.)'Denkuro'and'Hiratanenashi'on acetaldehyde production by their flesh discs[J]. Journal of the Japanese Society for Horticultural Science, 1994, 62(4):897-902 |
| [10] | Yamada M, Taira S, Ohtsuki M, et al. Varietal differences in the ease of astringency removal by carbon dioxide gas and ethanol vapor treatments among oriental astringent persimmons of Japanese and Chinese origin[J]. Scientia Horticulturae, 2002, 94(1):63-72 |
| [11] | Pesis E, Copel A, Benarie R, et al. Low-oxygen treatment for inhibition of decay and ripening in organic bananas[J]. Journal of Horticultural Science and Biotechnology, 2001, 76(5):648-652 |
| [12] | Torregrosa L, Pradal M, Souquet J M, et al. Manipulation of VvAdh to investigate its function in grape berry development[J]. Plant Science, 2008, 174(2):149-155 |
| [13] | 蒋德新, 薛晓晖, 盛炳成, 等. 珍稀矮生型柿品种——南通小方柿[J]. 江苏农业科学, 1992, 8(1):49-50 [Jiang D X, Xue X H, Sheng B C, et al. Rare and dwarf type persimmon—Nantongxiaofangshi[J]. Jiangsu Agricultural Sciences, 1992, 8(1):49-50(in Chinese with English abstract)] |
| [14] | 陈小云, 张仕杰, 屠煦童, 等. ‘南通小方柿’乙醇脱氢酶基因DkADH1的克隆及表达分析[J]. 园艺学报, 2014, 41(10):2001-2011 [Chen X Y, Zhang S J, Tu X T, et al. Isolation and expression analysis of DkADH1 gene from ‘Nantong Xiaofangshi' persimmon[J]. Acta Horticulturae Sinica, 2014, 41(10):2001-2011(in Chinese with English abstract)] |
| [15] | 佟兆国, 王富荣, 章镇, 等. 一种从果树成熟叶片提取DNA的方法[J]. 果树学报, 2008, 25(1):122-125 [Tong Z G, Wang F R, Zhang Z, et al. A method for DNA extraction from mature leaves of fruit trees[J]. Journal of Fruit Science, 2008, 25(1):122-125(in Chinese with English abstract)] |
| [16] | 蔡斌华, 张计育, 高志红, 等. 一种改良的提取草莓属叶片总RNA的方法[J]. 江苏农业学报, 2008, 24(6):875-877 [Cai B H, Zhang J Y, Gao Z H, et al. An improved method for isolation of total RNA from the leaves of Fragaria spp.[J]. Jiangsu Journal of Agricultural Sciences, 2008, 24(6):875-877(in Chinese with English abstract)] |
| [17] | 陈佩, 李平, 郝艳宾, 等. 柿果成熟过程中可溶性果胶和单宁含量的变化[J]. 中国农业大学学报, 2012, 17(1):88-92 [Chen P, Li P, Hao Y B, et al. The change of soluble pectin and tannic during maturation of persimmon fruit[J]. Journal of China Agricultural University, 2012, 17(1):88-92(in Chinese with English abstract)] |
| [18] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408 |
| [19] | Bellincontro A, Morganti F, Desantis D, et al. Inhibition of ethylene via different ways affects LOX and ADH activities, and related volatiles compounds in peach(cv.'Royal gem')[M]//Mencarelli F, Tonutti P. Proceedings of the 5th International Postharvest Symposium. Leuven, Belgium:International Society Horticultural Science, 2005:445-452 |
| [20] | Shiesh C C, Liu H L, Lin H L. Studies on the possible mechanism of ripening process induced deastringency in'Syh Jou'persimmon(Diospyros kaki L.)fruit[J]. Journal of the Chinese Society for Horticultural Science, 2000, 46(4):399-416 |
| [21] | 张宝善, 张有林. 涩柿生长, 脱涩及返涩单宁细胞形态的变化[J]. 西北植物学报, 2000, 20(2):303-308 [Zhang B S, Zhang Y L. The change of tannic cells in astringent persimmon fruits during the process of growing, deastringenting and reastringenting[J]. Acta Botanica Boreali-Occidentalia Sinica, 2000, 20(2):303-308(in Chinese with English abstract)] |
| [22] | 张永卓. 部分中国原产甜柿种质甜涩性状的鉴定及其超低温保存的研究[D]. 武汉:华中农业大学, 2004:20-28 [Zhang Y Z. Studies on the identification of the property of natural loss of astringency and cryopreservation of non-astringent persimmons germplasm originated in China[D]. Wuhan:Huazhong Agricultural University, 2004:20-28(in Chinese with English abstract)] |
| [23] | Yonemori K. Persimmon industry and research activities in Japan[J]. Acta Horticulturae, 1997, 436:21-32 |
| [24] | Taira S, Satoh I, Watanabe S. Relationship between differences in the ease of removal of astringency among fruits of Japanese persimmon(Diospyros kaki Thunb.)and their ability to accumulate ethanol and acetaldehyde[J]. Journal of the Japanese Society for Horticultural Science, 1992, 60(4):1003-1009 |
| [25] | Yonemori K, Matsushima J, Sugiura A. Differences in tannins of non-astringent and astringent type fruits of Japanese persimmon(Diospyros kaki Thunb.)[J]. Journal of the Japanese Society for Horticultural Science, 1983, 52(2):135-144 |
| [26] | Sugiura A. Retrospects and prospects on persimmon research[J]. Acta Horticulturae, 2005, 685:177-186 |
| [27] | Marles M, Ray H, Gruber M Y. New perspectives on proanthocyanidin biochemistry and molecular regulation[J]. Phytochemistry, 2003, 64(2):367-383 |
| [28] | Bovy A, de Vos R, Kemper M, et al. High-flavonol tomatoes resulting from the heterologous expression of the maize transcription factor genes LC and C1[J]. The Plant Cell, 2002, 14(10):2509-2526 |




