文章信息
- 李玉, 张成, 吴伟民, 王剑, 房经贵. 2015.
- LI Yu, ZHANG Cheng, WU Weimin, WANG Jian, FANG Jinggui. 2015.
- 拉枝处理对‘夏黑’葡萄冬芽成花过程中花发育相关基因表达的影响
- The influence of branch drawing treatment on flower development- related gene expression during the flowering process of ‘Summer Black'grape winter buds
- 南京农业大学学报, 38(2): 212-218
- Journal of Nanjing Agricultural University, 38(2): 212-218.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.006
-
文章历史
- 收稿日期:2014-05-25
2. 江苏省农业科学院园艺研究所, 江苏 南京 210014
2. Institute of Horticulture, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
植物的花发育是由植物内在的遗传机制与周边的环境信号共同作用的结果[1]。在环境信号方面,环剥、刻芽等栽培措施有促花早果的作用,用拉枝的方法也可促进成花和结实。近年来,拉枝作为一项整形修剪技术已在苹果、梨、桃等果树中得到较广泛的应用。有研究表明,经拉枝处理的红富士苹果会抑制枝条的生长势,促花作用增加,亦可增加树体的受光面积,有利于营养物质的积累,从而促进果实的增大[2]。许利军[3]也有类似的报道,他指出苹果树拉枝可改善树体的通风透光状况,特别是树体下部及内膛叶片的光合效能有所提高。由于拉枝改变了枝条的角度,从而削弱了顶端优势,木质部受到损伤,水路畅通受到限制,从而使树势得以缓和,这些都对促花成果起着重要的作用[4]。对幼树拉枝可促进树冠扩大,促进幼树的成形和结果;而大树拉枝则改善了树体的通风透光条件,提高光能利用率,并促进果实着色,从而提高果树的产量与品质[5]。尽管拉枝技术已在果树生产中得到较广泛的应用,但将拉枝法应用于葡萄生产的研究还相对滞后,尤其是从分子水平反映栽培措施对葡萄的生理状态及发育进程影响的研究报道较少。葡萄虽易成花,但研究拉枝对葡萄枝条及枝上芽的影响,对于认识拉枝在果树上的应用效果与作用机制同样具有重要意义。
随着葡萄基因组全序列的测序与释放,葡萄分子生物学与功能基因组学也已逐渐成为重要的研究课题。然而,葡萄的花发育是一个复杂的生物学过程,人们对其的研究也仅处于初步阶段,尤其在中国,不仅远远落后于拟南芥等模式植物的研究,而且也明显落后于苹果、梨等其他重要果树,并且还多局限于栽培管理技术和激素调控等方面的研究。本研究则在已克隆出的花发育相关基因的基础上,探究拉枝处理对‘夏黑’葡萄冬芽成花过程中VvFT、VvSOC 1、VvLFY、VvAP2 、VvFLC这5个花发育相关基因表达特征的影响,为更进一步在分子水平上认识栽培措施对葡萄花发育的影响提供理论依据。 1 材料与方法 1.1 材料 1.1.1 植物材料
研究所用的葡萄植株是江苏省农业科学院溧水植物科学基地种植的树龄为3年生的‘夏黑’葡萄。对葡萄新梢的长、中、短枝(枝条的长度以芽的节位多少来区分:短枝约1~12节位;中枝约13~25节位;长枝约25~36节位)分别进行平拉及下拉处理(图 1)。具体操作方法如下:用左手握住被拉枝条的基部,以防其折断,右手握着枝条的中上部,揉动使其渐渐软化后,再用绳索使枝条呈近似水平或下垂的姿势。处理时间为2012年6月22日。分别选取正常生长状态,未处理过的长、中、短枝条作为对照。试验从处理之日起分4次采取芽位基本一致的‘夏黑’葡萄冬芽,采样时间分别为7月9日、7月23日、8月12日及9月10日。
 | 图 1 ‘夏黑’葡萄不同长度枝条的拉枝处理与对照的比较 Fig. 1 The comparing between the different drawing treatment on different length of branches and the control group of the‘Summer Black’grapes |
根据拟南芥成花途径网络[6]中的位置推测,这5个葡萄花发育相关基因的位置在葡萄成花途径中也可能处于中游或下游。根据在GenBank上发表的不同葡萄品种的基因序列,选择其中的保守区域设计引物[7]。所用引物由上海英骏生物技术有限公司合成,其编号及序列见表 1。
引物 Primer | 序列(5′→3′) Sequence | 片段大小/bp Size of amplified product | 用途 Usage |
| Actin-1/Actin-2 | ACTGCTGAACGGGAAATTGT/ACGGAATCTCTCAGCTCCAA | 162 | 扩增Actin Actin amplification |
| AP2-1/AP2-2 | AGCCCCACCATACCATGTAA/CCTCTTCATATCCCCCAACA | 120 | 半定量RT-PCR Semi-quantitative RT-PCR |
| FLC-1/FLC-2 | AGTGGAAGGCCAAGTGTTTG/TACAGCTCCTGCTTGATTCG | 168 | 半定量RT-PCR Semi-quantitative RT-PCR |
| FT-1/FT-2 | GTGTTAGCCTAAACCAAGCT/ACGATTCATTAAGACCGAAAG | 124 | 半定量RT-PCR Semi-quantitative RT-PCR |
| LFY-1/LFY-2 | TCACGGTGAGTACGCTTCTG/GGCGTGACTCTTCTTCATCC | 161 | 半定量RT-PCR Semi-quantitative RT-PCR |
| SOC1-1/SOC1-2 | GTCCATGCTCAGCAACACTG/GCAGGGCAATTTACATCAT | 171 | 半定量RT-PCR Semi-quantitative RT-PCR |
| P01/P02 | GCAGGACTGCAGCTGACTGACTACT30VN/GACCAGTGGTATCAACGCAGAGTACGCGGG | cDNA合成cDNA synthesis |
‘夏黑’葡萄冬芽总RNA的提取采用常用的CTAB法[8, 9],用DNaseⅠ酶(RNase free)进行消化并用氯仿进行抽提,mRNA的纯化采用Promega公司生产的PloyA Ttract® mRNA Isolation System Ⅳ试剂盒。
以mRNA为模板,引物P01反转录合成cDNA的第1条链,引物P02延伸加帽子,加热条件下42 ℃保温1 h,75 ℃保温10 min,冰上冷却2 min,置于-70 ℃的冰箱里保存备用。
1.2.2 基因特异引物的PCR以cDNA为模板,分别用表 1中的各对引物进行PCR扩增。PCR反应体 系为20 μL:10×Buffer 2.0 μL,25 mmol · L-1的MgCl2 1.2 μL,2.5 mmol · L-1 dNTPs 1.6 μL,上游引物(10 mmol · L-1) 1.0 μL和下游引物(10 mmol · L-1)1.0 μL,Taq DNA聚合酶(5 U · μL-1)0.1 μL,模板DNA(30 ng · μL-1)2 μL,最后用ddH2O补足至20 μL。PCR程序为:94 ℃预变性5 min,变性30 s;60 ℃退火30 s,复性30 s;72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min,4 ℃保存备用。用20 g · L-1的琼脂糖凝胶电泳进行扩增产物的检测,溴化乙锭(EB)染色,观察拍照,用于后续分析。试验设3次重复。 1.3 叶绿素、叶面积、座果率的测定
叶片叶绿素含量采用丙酮提取法[10]测定;叶片叶面积采用直尺测量;座果率采用计数法计算。每个处理取5个处理枝进行测定。数据用SPSS Statistics V17.0软件进行分析。
2 结果与分析 2.1 RNA的提取质量检测
由图 2可见:28S和18S RNA条带亮度的比例约为2 ∶ 1,而5S条带亮度较弱,泳道中无明显背景。这表明RNA样品的完整性较好、纯度较高,无明显降解,可用于接下来的反转录。
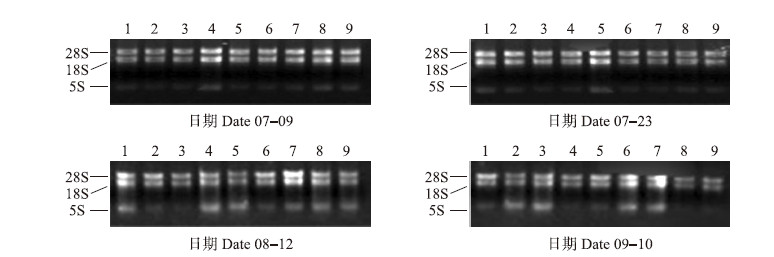 | 图 2 经不同拉枝处理的‘夏黑’葡萄冬芽RNA的提取质量 Fig. 2 The quality of RNA extraction of‘Summer Black’grape winter buds by different branch drawing treatment 1~9分别为长枝平拉处理、长枝下拉处理、长枝对照、中枝平拉处理、中枝下拉处理、中枝对照、短枝平拉处理、短枝下拉处理、短枝对照。1-9 represent level treatment of long branches,dropping treatment of long branches,control of long branches,level treatment of medium branches,dropping treatment of medium branches,control of medium branches,level treatment of short branches,dropping treatment of short branches,control of short branches,respectively.The same as follows. |
为确定5个葡萄花发育相关基因在不同处理及对照葡萄冬芽中的时空性表达特性,以不同处理及对照和不同时期的芽cDNA作为PCR模板,以actin基因为内参基因来标定,再进行半定量RT-PCR,各基因的表达情况见图 3。从图 3可见:经拉枝处理后冬芽的VvFT基因的表达量明显高于对照,后期表达量有所降低,且对照也有较高的表达量;随着时间的推移,上调基因VvSOC 1 的表达量整体处于升高的状态;VvLFY在第2次采样时表达量就很高,第3次采样时的表达量达到高峰;VvAP 2 在前3次采样的样品中都处于高表达,从第4次采样时开始下降;VvFLC在前2次采样的样品中有较高的表达,但随后表达量降低。
 | 图 3 不同拉枝处理‘夏黑’葡萄冬芽5个花发育相关基因的表达 Fig. 3 The expression of the five important floral genes of‘Summer Black’grape winter buds by different branch drawing treatment |
不同拉枝角度对‘夏黑’葡萄冬芽的影响是不同的,与对照相比,平拉枝条的效果最佳,基因的表达量明显高于下拉枝和对照,而下拉枝的表达量也高于对照(图 3)。
另外,从图 3还可以看出,不同长度的枝条经拉枝处理后的效果是不同的,整体而言,短枝的基因表达量最高,明显高于长枝,其次是中枝。 2.3 拉枝处理对叶片叶绿素含量、叶面积和座果率的影响
从表 2可以看出:叶绿素a含量在短枝下拉处理达最大值,叶绿素b含量在中枝平拉和短枝平拉处理均达到最大值,且平拉时叶绿素的含量与对照差异显著,下拉处理虽叶绿素含量有所减小,但也高于对照,且不同拉枝处理间均存在显著差异。叶面积也有相似的规律。但拉枝对座果率的影响并不大,中枝和短枝之间的差异并不明显,但高于长枝的各种拉枝处理。
| 处理 Treatment | 叶绿素a含量/(mg·L-1) Chlorophyll a content | 叶绿素b含量/(mg·L-1) Chlorophyll b content | 叶面积/cm2 Leaf area | 座果率/% Fruit-setting rate |
| 1 | 1.70bc | 0.85abc | 301.6abc | 26.5bcd |
| 2 | 1.47de | 0.60c | 293.3bc | 24.8cd |
| 3 | 1.33e | 0.28d | 287.5c | 23.2d |
| 4 | 1.88ab | 1.17a | 322.7ab | 31.1ab |
| 5 | 1.76bc | 0.90abc | 316.5abc | 28.1abcd |
| 6 | 1.62cd | 0.81bc | 302.1abc | 26.9bcd |
| 7 | 2.06a | 1.17a | 330.7a | 32.2a |
| 8 | 1.93ab | 0.91abc | 319.8ab | 29.7abc |
| 9 | 1.78bc | 0.95ab | 306.3abc | 27.1abcd |
| 注:同列中不同字母表示差异显著(P < 0.05)。 Note:Different letters in the same column represent significant difference at 0.05 level. | ||||
葡萄的成花过程是复杂而又缓慢的,常受基因型、栽培管理技术和环境条件等的相互影响,并伴随各种细胞学、形态学和生理生化的变化[11]。拉枝可使树体的生长势得以明显缓和,有利于营养生长向生殖生长转化,促花的作用增加(促进花芽形成),从而有利于早成花。已有研究表明,90°拉枝处理既有利于花芽分化,又不会造成树体早衰,是生产上较为理想的拉枝角度[12]。本研究中平拉枝条的效果最佳,基因的表达量显著高于对照和下拉枝,而下拉枝的表达量也明显高于对照,与上述理论基本一致。不同长度的枝条经拉枝处理后的效果也不同,整体而言,中、短枝的表达量明显高于长枝。这可能是由于中、短枝前期生长较快,停止生长早,有利于营养物质的积累,促进枝条的成熟,从而促进花芽的形成。 3.2 拉枝处理对花发育相关基因表达的影响
植物的任何性状本质上都是由基因控制的,植物花发育的遗传机制也是由许多花发育相关基因相互作用并共同调控的[13]。本研究中5个葡萄重要花发育相关基因VvSOC 1、VvFUL、VvFT、VvFLC、VvAP2 在不同处理的‘夏黑’葡萄冬芽上均有表达,说明这几个花发育相关基因对于葡萄花发育都具有一定作用,但作用的大小存在着差异。根据植物成花途径中有关基因的上下游关系、相互作用方式以及功能特点[6],研究的5个基因中上调基因有VvFT、VvLFY、VvSOC 1,下调基因有VvAP2 、VvFLC。VvFT是多个成花途径的交汇作用基因[14],也是典型的早花基因,可诱导植物早开花,即使在对照也有较高的表达,但在经拉枝处理后的冬芽中的表达量明显高于对照。VvSOC 1 基因联系植物开花途径中的光周期途径、赤霉素途径、春化途径等,在调控花器官发育的过程中起着非常重要的作用[15, 16, 17]。由于FT位于SOC 1 基因的上游,因此正调控基因SOC 1 [18],所以SOC 1 的表达量整体处于上升的趋势。LFY是重要的花分生组织特异基因,有研究表明过量表达LFY基因可提前拟南芥等植物的开花时间[19]。LFY不仅控制花分生组织的表达,还与植物的营养生长有一定的关系,所以LFY在营养分生组织中也有一定水平的表达[20, 21],同时也是控制营养生长向生殖生长转变的重要基因[22]。本研究结果显示,LFY在第2次采样时表达量就很高,第3次采样时表达量达到高峰,与理论基本一致。VvAP 2是植物花器官特异表达基因,可提早花分生组织的建立。AP2的表达始终存在于植物花发育和器官分化的早期阶段,而在花器官形成的后期,AP2 的表达空间仅局限于花的特异细胞、组织和器官中[23]。所以VvAP 2 基因在前3次采样中都处于高水平表达,从第4次采样时开始下降;VvFLC是调控春化作用的关键基因,其通过抑制上调基因SOC 1 和FT抑制成花[24],抑制程度与其剂量成正比[25],所以VvFLC基因早期有较高的表达,但在后2次的采样中表达量降低。综上所述,从花发育调控网络中[26]也可以看出,本试验中这5个重要的花发育相关基因的相对表达量的变化趋势与已有的研究报道[7]相符。 3.3 拉枝处理对葡萄生长发育的影响
从生理角度来看,拉枝影响植物开花的机制,在于拉枝能加大枝条角度,分散旺枝的生长并削弱了顶端优势,使树体生长势得以缓和[27]。并且,拉枝增加了中短枝的量,提高了光合利用率,前期有利于技条的生长和营养物质的积累,中、后期则有利于花芽的形成和果实的成熟[28]。所以经拉枝处理后叶绿素a和叶绿素b的含量明显升高,叶面积也有所增加。
‘夏黑’葡萄自然座果率低,可能与其三倍体果实不能形成种子而缺乏幼果发育所需要的多种植物激素有关[29]。而拉枝在一定程度上提高了‘夏黑’葡萄的座果率,但如果辅以激素或肥料处理,可能效果更好。
从分子角度来看,除了本文的研究内容,也有可能是拉枝改变了枝条内源激素或其他物质的分布状态从而影响了葡萄芽的生长状况,其主要机制也有待于进一步全面而系统的研究。
| [1] | 陈英, 关亚丽, 程强, 等. 簸箕柳AP3同源基因SsMADS的克隆与特性分析[J]. 植物生理学通讯, 2007, 43(3):469-475 [Chen Y, Guan Y L, Cheng Q, et al. Cloning and character analysis of Salix suchowensis AP3 homologue gene SsMADS[J]. Plant Physiology Communications, 2007, 43(3):469-475(in Chinese with English abstract)] |
| [2] | 高建国. 红富士苹果树生长季修剪关键技术[J]. 西北园艺, 2005(4):44 [Gao J G. Pruning key techniques in growth season of Fuji apple trees[J]. Northwest Horticulture, 2005(4):44(in Chinese)] |
| [3] | 许利军. 苹果"强拉枝"及拉后的管理[J]. 西北园艺, 2004(4):13-14 [Xu L J. "Strong bending branch" of apple and the later management[J]. Northwest Horticulture, 2004(4):13-14(in Chinese)] |
| [4] | 刘志坚. 论拉、刻、剥技术在苹果树上的应用[J]. 北方园艺, 1994(1):18-19 [Liu Z J. On branching, carved, stripping technique in the application of apple trees[J]. Northern Horticulture, 1994(1):18-19(in Chinese)] |
| [5] | 李保国, 杨兆静, 董立欣, 等. 拉枝刻芽对苹果幼树1年生枝条萌芽和内源激素含量的影响[J]. 河北林果研究, 2010, 25(4):373-376 [Li B G, Yang Z J, Dong L X, et al. Effects of bending and carving on the germination of one year branches and the content of endogenous hormones of young apple tree[J]. Hebei Journal of Forestry and Orchard Research, 2010, 25(4):373-376(in Chinese with English abstract)] |
| [6] | Blazquez M A. Flower development pathways[J]. Cell Science at a Glance, 2010, 113(20):3547-3548 |
| [7] | 杨光, 岳林旭, 王晨, 等. 葡萄9个重要花发育相关基因在‘藤稔'夏芽成花过程中的表达分析[J]. 果树学报, 2010, 27(6):898-903 [Yang G, Yue L X, Wang C, et al. Expression of nine important floral genes during flower differentiation and development of the summer buds of grapevine cv.‘Fujiminori'[J]. Journal of Fruit Science, 2010, 27(6):898-903(in Chinese with English abstract)] |
| [8] | 张彦苹, 王晨, 于华平, 等. 适于葡萄不同组织RNA提取方法的筛选[J]. 西北农业学报, 2010, 19(11):135-140 [Zhang Y P, Wang C, Yu H P, et al. Screening of RNA extraction methods for various grapevine organs and tissues[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2010, 19(11):135-140(in Chinese with English abstract)] |
| [9] | Chang S, Puryear J, Cairney J. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter, 1993, 11:113-116 |
| [10] | 朱广廉, 钟诲文, 张爱琴. 植物生理学实验[M]. 北京:北京大学出版社, 1990:51-54 [Zhu G L, Zhong H W, Zhang A Q. Plant Physiology Experiment[M]. Beijing:Peking University Press, 1990:51-54(in Chinese)] |
| [11] | 王晨, 孙欣, 房经贵, 等. 5个葡萄microRNA及其靶基因在冬芽二次成花过程中的表达[J]. 西北植物学报, 2011, 31(12):2429-2436 [Wand C, Sun X, Fang J G, et al. Spatiotemporal expression of five microRNAs and their targetgenes during flower development of treated winter buds of grapevine in growing season[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(12):2429-2436(in Chinese with English abstract)] |
| [12] | 余拱鑫, 韩明玉, 张满让, 等. 不同拉枝角度对‘嘎啦'苹果顶芽及叶片碳氮含量的影响[J]. 北方园艺, 2012(15):9-12 [Yu G X, Han M Y, Zhang M R, et al. The effect of different drawing treatment on the carbon and nitrogen content of ‘Gala'apple apical buds and leaves[J]. Northern Horticulture, 2012(15):9-12(in Chinese)] |
| [13] | Levy Y Y, Dean C. The transition to flowering[J]. Plant Cell, 1998, 10:1973-1989 |
| [14] | Hepworth S R, Valverde F, Ravenscroft D, et al. Antagonistic regulation of flowering-time gene SOCI by CONSTANS and FLC via separate promoter motifs[J]. The EMBO Journal, 2002, 21(16):4327-4337 |
| [15] | 姜仕豪, 庞基良, 王利琳, 等. 赤霉素促进花发育的分子机制[J]. 植物生理学通讯, 2008, 44(5):8-12 [Jiang S H, Pang J L, Wang L L, et al. Molecular mechanism of gibberellin promotion on floral development[J]. Plant Physiology Communications, 2008, 44(5):8-12(in Chinese)] |
| [16] | Moon J, Suh S S, Lee H, et al. The SOC1 MADS-box gene integrates vernalization and gibberellin signals for flowering in Arabidopsis[J]. The Plant Journal, 2003, 35:613-623 |
| [17] | 李昱, 罗志鹏, 赵淑清. 拟南芥开花时间调控的整合途径[J]. 植物生理学通讯, 2007(5):16-19 [Li Y, Luo Z P, Zhao S Q. Integration pathway of flowering time control in Arabidopsis[J]. Plant Physiology Communications, 2007(5):16-19(in Chinese)] |
| [18] | Abe M, Kobayashi Y, Yamamoto S, et al. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science, 2005, 309:1052-1056 |
| [19] | Weigel D, Alvarez J, Smyth D R, et al. LEAFY controls floral meristem identity in Arabidopsis[J]. Cell, 1992, 69(5):843-859 |
| [20] | Bossp K, Sreekantan L, Thomas M R. A grapevine TFLl homologue can delay flowering and alter floral development when overexpressed in heterologous species[J]. Functional Plant Biology, 2006, 33(1):31-41 |
| [21] | Carmona M J, Cubas P, Martinez-Zapater J M. VFL, the grapevine FLORICAULA/LEAFY ortholog, is expressed in meristematic regions independently of their fate[J]. Plant Physiology, 2002, 130:68-77 |
| [22] | 杨光, 曹雪, 房经贵, 等. 葡萄花发育基因的亚细胞定位和表达分析[J]. 中国农业科学, 2011, 44(3):641-650 [Yang G, Cao X, Fang J G, et al. Sub-cellular localization and expression analysis of genes involved in grapevine floral development[J]. Scientia Agricultura Sinica, 2011, 44(3):641-650(in Chinese with English abstract)] |
| [23] | 赵奇, 王台, 魏小弟. AP2基因在高等植物花器官发育中的作用概述[J]. 热带农业科学, 2005, 25(3):50-56 [Zhao Q, Wang T, Wei X D. Function of AP2 gene during floral organs development in higher plant[J]. Chinese Journal of Tropical Agriculture, 2005, 25(3):50-56(in Chinese with English abstract)] |
| [24] | Simpson G G, Dean C. Arabidopsis, the Rosetta stone of flowering time?[J]. Science, 2002, 296:285-289 |
| [25] | Metzger J D. Localization of the site of perception of thermo-inductive temperatures in Thlaspi arvense L.[J]. Plant Physiol, 1988, 88:424-428 |
| [26] | Kaufmann K, Melzer R, Theigen G. MIKC-type MADS-domain proteins:structural modularity, protein interactions and network evolution in land plants[J]. Gene, 2005, 347(2):183-198 |
| [27] | 吴鲜亮, 何志爱, 杨勇. 拉枝对苹果梨幼树生长发育的影响[J]. 内蒙古农业科技, 2008(1):54-55 [Wu X L, He Z A, Yang Y. Effects of branch bending on the growth and development of young apple-pear tree[J]. Inner Mongolia Agricultural Science and Technology, 2008(1):54-55(in Chinese)] |
| [28] | 李雄, 吴鲜亮. 苹果梨幼树拉枝效应的研究[J]. 内蒙古农牧学院学报, 1989, 10(2):152-157 [Li X, Wu X L. A study on effect of branch bending for young apple-pear trees[J]. Journal of Inner Mongolia College of Agriculture and Animal Husbandry, 1989, 10(2):152-157(in Chinese)] |
| [29] | 谢荔, 成学慧, 冯新新, 等. 氨基酸肥料对‘夏黑’葡萄叶片光合特性与果实品质的影响[J]. 南京农业大学学报, 2013, 36(2):31-37. doi:10.7685/j.issn.1000-2030.2013.02.006 [Xie L, Cheng X H, Feng X X, et al. Effects of an amino acid fertilizer on the leaf photosynthesis and fruit quality of‘Summer Black'grape[J]. Journal of Nanjing Agricultural University, 2013, 36(2):31-37(in Chinese with English abstract)] |




