文章信息
- 武悦, 徐良, 王娟娟, 龚义勤, 谢洋, 柳李旺. 2015.
- WU Yue, XU Liang, WANG Juanjuan, GONG Yiqin, XIE Yang, LIU Liwang. 2015.
- 萝卜硝酸还原酶基因的克隆与表达分析
- Cloning and molecular characterization of nitrate reductase gene in radish(Raphanus sativus L.)
- 南京农业大学学报, 38(2): 205-211
- Journal of Nanjing Agricultural University, 38(2): 205-211.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.02.005
-
文章历史
- 收稿日期:2014-05-20
2. 全国农业技术推广服务中心, 北京 100125
2. The National Agro-Tech Extension and Service Center, Beijing 100125, China
近年来,为了提高蔬菜产量,生产中常常过量施用氮肥,使得蔬菜中硝酸盐积累量逐渐上升,造成品质下降。蔬菜中的硝酸盐可在人体中还原成亚硝酸盐,而亚硝酸盐对人体健康构成威胁[1],研究表明,人类亚硝酸盐中毒主要导致高铁血红蛋白症、肾上腺肾小球肥大等症状,甚至致癌[2]。萝卜(Raphanus sativus L.)为起源于我国的一种重要十字花科根菜类蔬菜作物,其肉质根中硝酸盐含量较高[3]。因此,在分析不同萝卜品种硝酸盐含量差异基础上,如何培育出低硝酸盐累积品种已成为当前蔬菜遗传育种中的重要研究课题,但是对于萝卜硝酸还原酶(NR)基因特征的研究鲜有报道。
氮(N)是植物生长发育必需元素之一,是氨基酸、蛋白质的构成成分,也是核酸、叶绿素、多种维生素及辅酶等的主要成分。植物能够利用不同形式的氮,包括气态氮(NH3)、氮氧化合物(NOx)、无机氮(NO3-和NH4+)和其他有机氮形式[4],而NO3-是植物可利用氮素的主要形式。NO3-被根吸收后,会先在根和叶肉细胞中被硝酸还原酶(nitrate reductase,NR)还原为NO2-,NO2-在亚硝酸还原酶的催化下还原成NH4+,NH4+与谷氨酸结合在谷氨酰胺合成酶(glutamine synthetase,GS)的催化下合成氨基酸,从而被植物体利用。NR是硝酸盐同化过程中的关键酶和限速酶。近年来,对白菜、黄瓜、马铃薯等重要蔬菜作物中硝酸盐积累的研究已有报道[5],已经证实提高NR基因的表达能够提高NR活性,进而降低马铃薯块茎中硝酸盐积累[6]。毛伟华等[7]克隆出黄瓜CsNR基因cDNA片段,但萝卜硝酸还原酶基因(RsNR)的克隆及表达分析尚未见报道。本研究以本实验室转录组测序所得unigene为参考序列,分离出RsNR基因cDNA序列,并对其序列进行生物学信息分析;在研究硝酸盐含量和硝酸还原酶活性(NRA)关系基础上,利用RT-qPCR技术分析不同浓度硝态氮处理下RsNR基因在转录水平上的表达特征,探究硝酸盐同化过程的分子调节机制,为低硝酸盐含量萝卜新品种选育与种质创新提供理论依据。
1 材料与方法 1.1 试验材料供试材料为本实验室保存的萝卜(Raphanus sativus L.)高代自交系NAU-QTSH。种子浸泡4 h后在25 ℃恒温催芽培养,露白后播种于穴盘中,于温室中进行常规管理。当幼苗长至4~5片真叶时转移至含有1/2Hoagland营养液(不含NO3-)的水培箱中培养7 d[8]。分别以0、5、20、30和50 mmol · L-1 KNO3溶液处理幼苗24 h,取叶片和根;以30 mmol · L-1 KNO3溶液处理0、4、8、12和24 h后,取叶片和根。3次重复。样品经液氮速冻后保存于-80 ℃冰箱中备用。
1.2 RNA提取及cDNA第一链合成取适量(100~300 mg)萝卜幼嫩叶片于研钵中,用液氮充分研磨成粉末。RNA提取采用Biolfux总RNA提取试剂盒(Bioertechnology Co.Ltd.)。cDNA第一链合成利用cDNA合成试剂盒(TaKaRa)。
1.3 RsNR基因片段的克隆以NCBI数据库中油菜(Brassica napus L.)NR基因序列(GenBank登录号:D38219)为参照,与本实验室萝卜转录组测序所得unigene中的同源序列进行比对、拼接,应用DNAstar设计引物。RsNRF1:TCAAAAACCAAAAGAGATAAAAA;RsNRR1:CTGGGATAAAAACTCTAACAAAAG。PCR产物回收后与pMD18-T vector(TaKaRa)连接,转化大肠杆菌DH5α感受态细胞,挑取单克隆鉴定后送南京思普金生物科技有限公司测序。
1.4 序列分析将测序得到的核苷酸序列和推导的氨基酸序列分别在NCBI网站用BLASTn和BLASTp进行序列相似性比对;应用ProtParam程序(http://au.expasy.org/tools/protparam.html)预测蛋白质相对分子质量和等电点;利用ORF finder软件在NCBI站点进行开放阅读框(ORF)分析;利用DNAMAN 6.0软件进行氨基酸多重序列比对分析及系统进化树构建。
1.5 硝酸盐含量及硝酸还原酶活性的测定硝酸盐含量采用硫酸-水杨酸比色法[9, 10]测定,硝酸还原酶活性采用离体法[9]测定。每组数据设置3次重复,利用SPSS 16.0软件进行方差分析(ANOVA)与差异显著性分析(Duncan′s test)。
1.6 实时定量表达分析利用Beacon Designer 7.0(Premier Biosoft International,USA)软件设计荧光定量PCR引物。QRsNRF1:CAAGAAGATGACCAGACC;QRsNRR1:GGAGTTGGATTTGAGGAC。参照SYBR Green Master ROX(Roche,Japan)试剂说明书,应用Bio-Rad iCycler iQ荧光定量PCR仪进行PCR分析。扩增程序为:95 ℃ 3 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;70 ℃ 10 min。每个样品设置3次重复。以actin 2/7 基因为 内标,引物为actin2/7F:GCATCACACTTTCTACAAC,actin2/7R:CCTGGATAGCAACATACAT。参照2-ΔΔCT法[11] 计算待测基因相对表达量。
2 结果与分析 2.1 萝卜RsNR基因分离与生物信息学分析利用基因特异引物RsNRF1/R1进行PCR扩增(图 1),获得RsNR基因cDNA目标片段。测序结果表明目标片段长2 894 bp,RsNR基因cDNA开放阅读框(ORF)为2 742 bp,编码913个氨基酸,GenBank登录号为KM272859。ExPASy数据库预测表明,RsNR蛋白理论等电点(pI)为5.93,相对分子质量为102.3×103。
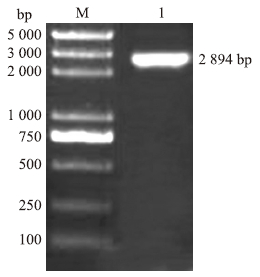 | 图 1 RsNR基因PCR扩增结果 Fig. 1 Amplification result of RsNR gene M:DNA标准分子质量DNA marker;1:RsNR |
利用DNAMAN 6.0软件对RsNR基因编码氨基酸序列进行多重序列比对分析(图 2),结果表明该序列与油菜、不结球白菜、拟南芥、黄瓜NR基因编码的氨基酸序列高度同源,其中与油菜NR蛋白之间同源性最高,为95%。系统进化分析表明,萝卜与油菜(Brassica napus,D38219)同在一个分支(图 3),二者亲缘关系最近,其次与不结球白菜(B.campestris subsp.chinensis,EU662272)和拟南芥(Arabidopsis thaliana,NM_103364)聚为一大支,表明萝卜NR基因与不结球白菜NR基因和拟南芥NR基因亲缘关系较近。
 | 图 2 RsNR基因推导的氨基酸序列与其他作物NR蛋白同源性比对 Fig. 2 Alignment of RsNR deduced amino acid sequence with several other NR proteins RsNR:萝卜Raphanus sativus(KM272859);AtNR:拟南芥Arabidopsis thaliana(NM_103364);BcNR:不结球白菜Brassica campestris subsp.chinensis(EU662272);BnNR:油菜Brassica napus(D38219);CsNR:黄瓜Cucumis sativus(GU345781) |
 | 图 3 RsNR氨基酸序列的系统进化树分析 Fig. 3 Phylogenetic tree analysis of the deduced amino acid sequence of RsNR At:拟南芥A.thaliana;Bc:不结球白菜B.campestris subsp.chinensis;Bn:油菜B.napus;Rs:萝卜R.sativus;Bv:甜菜Beta vulgaris;Nb:野生烟草Nicotiana benthamiana;Sl:番茄Solanum lycopersicum;St:马铃薯Solanum tuberosum;Bp:垂枝桦Betula pendula;Rc:蓖麻Ricinus communis;Tp:阔叶椴Tilia platyphyllos;Cs:黄瓜C.sativus;Gm:大豆Glycine max;Mt:蒺藜苜蓿Medicago truncatula;Mh:湖北海棠Malus hupehensis;Pp:桃Prunus persica |
由图 4-A可见:随着NO3--N浓度的增加,叶片和根中的硝酸盐含量均呈先上升后下降的趋势,且在30 mmol · L-1时达到最大值。由图 4-B可见:萝卜叶片和根中NRA与硝酸盐含量变化趋势相似。随着NO3--N浓度的增加,叶片和根中的NRA均呈现先上升后下降的趋势,且在30 mmol · L-1时达到最大值。
 | 图 4 NO3--N处理对萝卜叶片和根中硝酸盐含量和NRA的影响 Fig. 4 Effect of NO3--N treatments on nitrate content and NRA in leaf and root of radish 不同小写字母表示差异显著(P<0.05)。Different small letters indicate significant difference at 0.05 level.The same as follows. |
在30 mmol · L-1 NO3--N处理下,叶片和根中硝酸盐含量随着处理时间的延长而增加(图 4-C),但萝卜根中硝酸盐积累量较高,叶片中相对较低。由图 4-D可见:叶片和根中NRA随着处理时间的延长呈先上升后下降的趋势,在处理4 h达到最大值。
2.3 RsNR基因表达特性分析 2.3.1 不同NO3--N处理浓度下RsNR基因的表达由图 5-A可见:RsNR基因在叶片和根中的表达量均随NO3--N处理浓度呈先增加后下降的趋势,并且在30 mmol · L-1处理浓度下达到最大值。50 mmol · L-1 NO3--N处理的RsNR基因表达量明显低于30 mmol · L-1 NO3--N处理,且存在显著差异,表明高浓度的NO3--N 不利于RsNR基因表达。
 | 图 5 不同NO3--N处理浓度(A)与时间(B)对萝卜叶片和根RsNR基因表达的影响 Fig. 5 Effect of NO3--N concentration(A)and treatment time(B)on the RsNR expression level in leaf and root of radish |
如图 5-B所示:30 mmol · L-1NO3--N处理下,叶片和根中RsNR基因的表达量均在4 h时达到最大,分别为0 h的3.3和2.2倍;之后,随着处理时间的延长,叶片和根中RsNR基因的表达量呈现出不同程度的下降,且各处理间差异显著。
3 讨论目前对于蔬菜中硝酸盐积累研究主要集中在生理机制方面[12],而在分子水平上研究的相对较少[8]。本研究利用测序所得unigene及RT-qPCR技术成功克隆得到萝卜NR基因cDNA全长序列,其编码的氨基酸序列与油菜、不结球白菜、拟南芥序列高度同源,为进一步从分子水平开展硝酸盐代谢机制研究提供了基础。
硝酸还原酶(NR)是植物NO3-同化第一阶段所需要的关键酶与限速酶,植物体内硝酸还原酶活性(NRA)的高低可直接影响NO3-的利用率[13]。硝酸还原酶基因的表达受到NO3-、NO2-、谷氨酰胺和一些碳代谢产物等诸多因子调控[14, 15]。对大麦叶片进行15 mmol · L-1 NO3--N诱导处理,对照组(0 h)NR基因不表达,而2和5 h处理下呈现出诱导表达[16]。本研究中,RsNR基因在不同的NO3--N处理下均呈现差异表 达,并在30 mmol · L-1处理下达到最大值,随后显著降低,表明较低浓度可促进基因的表达。而30 mmol · L-1 NO3--N处理4 h时叶片和根中的RsNR基因表达量达到最大值,之后随着处理时间的延长,其表达量显著下降,表明硝酸盐对RsNR基因表达的诱导具有瞬时效应。
研究表明,高NRA可催化更多的硝酸盐还原为亚硝酸盐[17]。另外,NR是一种底物诱导酶,硝酸盐浓度高,NRA也相对较高,因此硝酸盐含量和NRA呈正相关性,并且NRA存在一定的阈值,当硝酸盐浓度升高到某一水平后,NRA就不会再被诱导[18, 19]。本研究结果表明,较低浓度NO3--N能够显著提高叶片和根中硝酸盐含量与NRA,促进RsNR基因表达;而当NO3--N浓度较高时,三者达到一个相对稳定的水平。在NO3--N处理初期(0~4 h),RsNR基因的表达呈现显著增加趋势,且与NRA和硝酸盐含量呈相同变化趋势,表明短时间的NO3--N诱导对三者有促进作用;而随着处理时间的增加,NRA和RsNR基因的表达量显著下降,但硝酸盐含量显著上升[17, 20]。推测是因为硝酸盐被植物根吸收后,会通过木质部运输到地上部,并且积累在液泡中,导致细胞质中的硝酸盐含量与NRA降低[21]。因此,叶片和根中NRA和RsNR基因表达量在一定程度上依赖于细胞质中NO3--N浓度。本研究表明,NO3--N在转录水平上可以调控萝卜RsNR基因的表达,进而调控硝酸盐含量和NRA,研究结果为萝卜优质高效生产以及硝酸盐含量遗传改良提供了理论依据。
| [1] | 郭静利, 张洁瑕. 蔬菜硝酸盐研究概况和展望[J]. 北方园艺, 2011(11):183-188 [Guo J L, Zhang J X. Review and outlook of the research on nitrate content of vegetables[J]. Northern Horticulture, 2011(11):183-188(in Chinese with English abstract)] |
| [2] | Marco T A, Neil P B, Giovanna S C, et al. Combining social learning with agro-ecological research practice for more effective management of nitrate pollution[J]. Environmental Science and Policy, 2007, 10(6):551-563 |
| [3] | Chan T Y K. Vegetable-borne nitrate and nitrite and the risk of methaemoglobinaemia[J]. Toxicology Letters, 2011, 200(1):107-108 |
| [4] | Luo J, Li H, Liu T, et al. Nitrogen metabolism of two contrasting poplar species during acclimation to limiting nitrogen availability[J]. Journal of Experimental Botany, 2013, 64(14):4207-4224 |
| [5] | 都韶婷, 章永松, 林咸永, 等. 蔬菜积累的硝酸盐及其对人体健康的影响[J]. 中国农业科学, 2007, 40(9):2007-2014 [Du S T, Zhang Y S, Lin X Y, et al. Accumulation of nitrate in vegetables and its possible implications to human health[J]. Scientia Agricultura Sinica, 2007, 40(9):2007-2014(in Chinese with English abstract)] |
| [6] | Djennane S, Quilleré I, Leydecker M T, et al. Expression of a deregulated tobacco nitrate reductase gene in potato increases biomass production and decreases nitrate content in all organs[J]. Planta, 2004, 219(5):884-893 |
| [7] | 毛伟华, 龚亚明, 夏晓剑, 等. 黄瓜硝酸还原酶cDNA片段的克隆及其在缺氮胁迫下的表达[J]. 浙江农业学报, 2007, 19(3):160-163 [Mao W H, Gong Y M, Xia X J, et al. Cloning of a cDNA fragment of nitrate reductase(NR)gene in cucumber and its expression analysis under nitrogen deficiency stress[J]. Acta Agriculturae Zhejiangensis, 2007, 19(3):160-163(in Chinese with English abstract)] |
| [8] | 孙淑斌, 罗金葵, 徐国华, 等. 小白菜硝酸还原酶基因的克隆与初步鉴定[J]. 植物营养与肥料学报, 2006, 12(4):592-596 [Sun S B, Luo J K, Xu G H, et al. Cloning and characterization of nitrate reductase gene in pakchoi(Brassica campestris L.ssp chinensis)[J]. Plant Nutrition and Fertilizer Science, 2006, 12(4):592-596(in Chinese with English abstract)] |
| [9] | 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000:123-127 [Li H S. The Experiment Principle and Technology of Plant Physiology and Biochemistry[M]. Beijing:High Education Press, 2000:123-127(in Chinese)] |
| [10] | 龚义勤, 任同辉, 柳李旺, 等. 低硝酸盐含量萝卜的筛选[J]. 南京农业大学学报, 2006, 29(1):135-137. doi:10.7685/j.issn.1000-2030.2006.01.030 [Gong Y Q, Ren T H, Liu L W, et al. Selection for low nitrate content radish(Raphanus sativus L.)[J]. Journal of Nanjing Agricultural University, 2006, 29(1):135-137(in Chinese with English abstract)] |
| [11] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408 |
| [12] | 孙菲菲, 李英, 侯喜林, 等. 硝态氮对不结球白菜产量与主要营养品质及硝酸盐含量的影响[J]. 南京农业大学学报, 2008, 31(2):37-40. doi:10.7685/j.issn.1000-2030.2008.02.008 [Sun F F, Li Y, Hou X L, et al. Effect of different NO3--N concentration on yield, nutrient quality and nitrate content of Brassica campestris ssp.chinensis Makino[J]. Journal of Nanjing Agricultural University, 2008, 31(2):37-40(in Chinese with English abstract)] |
| [13] | 黄建凤, 徐小梦, 沈其荣, 等. 2个不结球白菜品种硝酸盐累积差异的生理机制[J]. 南京农业大学学报, 2011, 34(1):74-78. doi:10.7685/j.issn.1000-2030.2011.01.014 [Huang J F, Xu X M, Shen Q R, et al. Physiological mechanisms for the difference of nitrate accumulation in two cultivars of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2011, 34(1):74-78(in Chinese with English abstract)] |
| [14] | Munzarova E, Lorenzen B, Brix H, et al. Effect of NH+4/NO3- availability on nitrate reductase activity and nitrogen accumulation in wetland helophytes Phragmites australis and Glyceria maxima[J]. Environmental and Experimental Botany, 2006, 55:49-60 |
| [15] | Zou D H. Effects of elevated atmospheric CO2 on growth, photosynthesis and nitrogen metabolism in the economic brown seaweed, Hizikia fusiforme[J]. Aquaculture, 2005, 250(3):726-735 |
| [16] | Miyazaki J, Juricek M, Angelis K, et al. Characterization and sequence of a novel nitrate reductase from barley[J]. Molecular Genetics and Genomics, 1991, 228(3):329-334 |
| [17] | Wang Z H, Li S X. Effect of nitrogen and phosphorus fertilization on plant growth and nitrate accumulation in vegetables[J]. Journal of Plant Nutrition, 2004, 27(3):539-556 |
| [18] | Márquez A J. Lotus japonicus Handbook[M]. Dordrecht, The Netherlands:Springer, 2005:295-313 |
| [19] | Matt P, Geiger M, Walch L P, et al. The immediate cause of the diurnal changes of nitrogen metabolism in leaves of nitrate-replete tobacco:a major imbalance between the rate of nitrate reduction and the rates of nitrate uptake and ammonium metabolism during the first part of the light period[J]. Plant, Cell and Environment, 2001, 24(2):177-190 |
| [20] | Li Q, Wang X, Ma L, et al. Molecular characterization of a cucumber nitrate reductase(CsNR)gene under NO3- stress[J]. Molecular Biology Reports, 2012, 39(4):4283-4290 |
| [21] | Huang C B, Wang Z H, Li S X, et al. Effect of external nitrate concentrations on nitrate efflux from roots and accumulation in two Brassica napus L.cultivars[J]. Journal of Plant Nutrition, 2011, 34(11):1602-1615 |




