文章信息
- 秦晓杰, 高梦, 蒋晓玲, 司林媛, 杨远鹏, 杨蓉, 蔡子康, 肖红梅. 2015.
- QIN Xiaojie, GAO Meng, JIANG Xiaoling, SI Linyuan, YANG Yuanpeng, YANG Rong, CAI Zikang, XIAO Hongmei. 2015.
- 采前喷施拮抗酵母菌对草莓采后贮藏性能的影响
- Effect of preharvest spraying antagonistic yeast on the postharvest storability of strawberry
- 南京农业大学学报, 38(1): 152-160
- Journal of Nanjing Agricultural University, 38(1): 152-160.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.023
-
文章历史
- 收稿日期:2014-05-06
草莓(Fragaria×ananassa Duch)果实水分含量高,营养丰富,而且生长周期较短,能够多季节多批次种植收获,产量高,经济效益好。近些年,人们对草莓的消费量不断增加,这促使了草莓产业的迅速发展。但草莓果实外皮极薄易遭受机械伤而被病原微生物侵染导致腐烂变质。草莓果实腐烂变质的病害主要有灰霉病(gray mould)、软腐病(rhizopus rot)、炭疽病(chili anthracnose)和白粉病(powdery mildew)[1, 2]。其中,由灰葡萄孢霉(Botrytis cinerea)引起的灰霉病害是草莓种植生产和采后贮藏的主要病害,也是导致草莓产量和质量下降的重要因素之一。随着人们对自身健康和环境的重视,传统的化学杀菌剂已不再是理想方法,因此对生物防治的研究探索将成为必要途径。
目前,研究获得具有拮抗作用的微生物分别有酵母菌、真菌和细菌等[3, 4, 5],其中酵母菌由于具有遗传稳定,广谱抑菌性,使用安全,对营养要求较低,对逆境有较强的耐受性等特点被广泛用于防治果蔬采后病害[6]。已报道具有拮抗作用的酵母菌属有假丝酵母属[7]、毕赤酵母属[8]、红酵母属[9]、梅奇氏酵母属[10]、有孢汉逊酵母属[11]、克鲁维酵母属[12]、掷抱酵母属[13]等。拮抗酵母菌在草莓果实上的应用也有相关的研究,如黏红酵母[14]、柠檬形克勒克酵母[15]、罗伦隐球酵母[16]、季也蒙毕赤酵母[6]、葡萄有孢汉逊酵母[17]等对草莓采后病害均有抑制效果。单一酵母菌可能只抑制一种病原菌,而导致果蔬腐烂变质的病原菌一般有多种,因此把拮抗酵母结合使用能够扩展抑菌谱,增强对病害的防治效果。
本试验将葡萄有孢汉逊酵母与季也蒙毕赤酵母复合对草莓进行喷施处理,研究复合拮抗酵母菌对草莓采后贮藏性能的影响,旨在提高拮抗酵母菌的防治效果,简化使用方法,从而降低生产成本,为商业化开发提供技术指导。
1 材料与方法 1.1 供试果实
草莓(Fragaria×ananassa Duch)品种为‘红颜’,采摘于南京市雨花台区板桥政府生态园,大棚内温度为17~20 ℃。试验中选择无病虫害、无机械损伤、成熟度及大小一致的果实。
1.2 供试菌株
葡萄有孢汉逊酵母(Hanseniaspora uvarum)和季也蒙毕赤酵母(Pichia guilliermondii)均由本实验室筛选鉴定,保藏于4 ℃、PDA马铃薯葡萄糖琼脂培养基(含葡萄糖20 g,去皮马铃薯200 g,琼脂15 g,蒸馏水1 000 mL;120 ℃高压灭菌20 min)试管斜面上。将PDA培养基培养2 d进行活化。
葡萄有孢汉逊酵母菌悬液制备:取活化后的菌种于PDB马铃薯葡萄糖液体培养基(含葡萄糖20 g,去皮马铃薯200 g,蒸馏水1 000 mL),28 ℃、180 r · min-1振荡培养24 h。4 ℃、5 000 r · min-1离心10 min后收集菌体,并用无菌水清洗2次。血球计数板计数,并用无菌水(含0.05% Tween-20)配制成1×105、1×106、1×107 和1×108 CFU · mL-1,待用。
季也蒙毕赤酵母菌悬液制备:步骤同上,于28 ℃、180 r · min-1振荡培养36 h,离心,血球计数板计数,并用无菌水(含0.05% Tween-20)配制成1×105、1×106、1×107和1×108 CFU · mL-1,待用。
复合拮抗菌菌悬液制备:将1×105、1×106 CFU · mL-1葡萄有孢汉逊酵母菌悬液和季也蒙毕赤酵母菌悬液分别等体积混合,复配成1×105、1×106 CFU · mL-1复合拮抗酵母菌悬液。
1.3 试验仪器
UV-2802PCS紫外可见光分光光度计购于北京莱伯泰科有限公司;WYT-4型手持糖量仪购于泉州光学仪器厂;TA.XT2i质构分析仪购于英国Stable Micro Systems公司;TGL20M台式高速冷冻离心机购于湘仪离心机仪器有限公司;Nikon102光学显微镜购于Japan Nikon Co.Ltd.;全温振荡培养箱购于太仓市实验设备厂;DELTA 320 pH计购于梅特勒-托利多仪器上海有限公司;SW-CJ-JD型单人净化工作台购于苏州净化设备有限公司;HVE-50自动灭菌锅购于HIRAYAMA有限公司;XB-K-25血球计数板购于国营上海医用光学仪器厂;TM-100扫描电镜购于日本电子公司。 1.4 试验处理 1.4.1 采前喷施拮抗酵母菌浓度的筛选
草莓果实商业成熟前3 d田间处理:分别用1×105、1×106、1×107和1×108 CFU · mL-1葡萄有孢汉逊酵母菌悬液(即H5、H6、H7、H8)和季也蒙毕赤酵母菌悬液(即P5、P6、P7、P8)以及1×105和1×106 CFU · mL-1复合酵母菌悬液(HP5、HP6)对草莓进行喷施处理,以未做任何处理的草莓作为对照(CK)。商业成熟后采摘运回实验室,于25 ℃、相对湿度(RH)为90%~95%的恒温培养箱中贮藏。贮藏4 d后测定腐烂指数、商品率、感官评分。每处理约200个果实,设3个平行,试验重复3次。 1.4.2 采前喷施拮抗酵母菌对草莓采后冷藏影响
于草莓果实商业成熟前3 d进行田间处理:分别用1×108 CFU · mL-1葡萄有孢汉逊酵母菌悬液、1×108 CFU · mL-1季也蒙毕赤酵母菌悬液以及1×106 CFU · mL-1复合酵母菌悬液对草莓进行喷施处理,以未做任何处理草莓作为对照(CK)。商业成熟后采摘运回实验室。于(2±1)℃、RH 90%~95%条件下贮藏15 d,每隔3 d测定品质指标及理化指标。采摘当天,取样在扫描电镜下观察果实表皮的微生物动态。每处理约400个果实,设3个平行,试验重复3次。 1.5 指标测定 1.5.1 腐烂指数及商品率
参照巩惠芳等[18]方法并略作改进。根据果实腐烂面积大小将腐烂指数分为5级别:0级,无腐烂,无病斑;1级,腐烂面积占果实面积的比例小于10%;2级,腐烂面积占果实面积的10%~25%;3级,腐烂面积占果实面积的25%~40%;4级,腐烂面积大于总果实面积的40%。每组3个平行,每个平行20个草莓。按如下公式计算:
腐烂指数=∑(腐烂级别×果实数量)/(最高腐烂级别×总果实数量);
商品率=(0级×草莓数量+1级×草莓数量)/总草莓数量×100%。
1.5.2 硬度采用TA.XT2i质构仪[19]测定,利用P/50探头进行TPA测定,设置参数为:测前预压速度为5.00 mm · s-1,测中下压速度为10.00 mm · s-1,测后上行速度为5.00 mm · s-1,草莓受压变形距离为4.00 mm,两次中间压缩的停顿时间为5 s,触发力为1.0 N。由质地特征曲线得到果实的硬度,每组取15个草莓,结果取平均值。 1.5.3 感官评分
感官评价是从南京农业大学食品科技学院选出10名研究生,对不同处理组的草莓外观和香气进行评价和评分,综合评分为10人评分结果的平均值。评价方法采用4分法,具体如表 1。
分数 Score | 色泽 Color | 香气 Aroma | 水渍斑 Water-soaked spots | 霉斑 Mildew |
| 4分4 score | 鲜艳,有光泽Bright,shiny | 正常Normal | 无No | 无No |
| 3分3 score | 略微发暗,仍有光泽Slightly dark,still shiny | 略有酒味Slight alcohol | 少且小Few and small | 1 |
| 2分2 score | 发暗,无光泽Dark,dull | 有酒味Alcohol | 少但大Small but big | 2~3 |
| 1分1 score | 发白,无光泽Pale,dull | 酒味浓郁,伴有异味Alcohol-bodied,with odor | 多且大Many and large | 多个Multiple |
可溶性固形物采用WYT-4型手持糖量仪测定,每组取20个草莓,结果取平均值。抗坏血酸含量采用分光光度法[20]测定。pH值用DELTA 320 pH计测定。每组取15个果实,设3个平行。过氧化物酶(POD)活性测定采用愈创木酚法[21],以反应液每分钟在460 nm处吸光值上升0.001为1个酶活性单位(U)。超氧化物歧化酶(SOD)活性测定采用NBT光还原法[21],以抑制反应50%为1个酶活性单位。过氧化氢(CAT)活性测定采用分光光度法[21],以每分钟240 nm处吸光值下降0.001作为1个酶活性单位。丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[21]。多酚氧化酶(PPO)活性测定采用邻苯二酚比色法[21],以每分钟在398 nm处吸光值变化0.001为1个酶活性单位。β-1,3-葡聚糖酶(GLU)活性 测定参照余挺[22]的方法,以每毫升上清液在530 nm处每小时分解产生1 mg葡萄糖为1个酶活性单位(U)。 1.6 扫描电镜观察
用2.5%(体积分数)戊二醛将样品在4 ℃条件下预固定8 h;磷酸缓冲液(0.1 mol · L-1,pH 7.2)清洗3次,每次10 min;分别以30%、50%、70%、80%和90%乙醇(体积分数)梯度脱水,每次15 min,100%乙醇脱水3次,每次30 min;叔丁醇置换3次,每次30 min;冷冻干燥约3~4 h;双面胶带将样品粘到样品台上,于扫描电镜下观察。
1.7 数据分析
试验数据处理采用SAS 8.2统计软件进行方差分析(ANOVA),采用邓肯氏多重(Duncan′s Multiple Range Test)比较分析处理间的差异显著性。
2 结果与分析 2.1 采前喷施拮抗酵母菌对草莓常温贮藏腐烂指数及商品率的影响
如图 1所示:处理组果实的腐烂指数显著低于对照组,处理组间腐烂指数存在显著性差异(P<0.05),且酵母菌浓度越高,腐烂指数越低。单一酵母菌处理组中,1×108 CFU · mL-1葡萄有孢汉逊酵母组(H8)和季也蒙毕赤酵母组(P8)果实腐烂指数最低,分别为0.38和0.43,抑制效果较好。1×105和1×106 CFU · mL-1复合酵母菌组(HP5、HP6)腐烂指数显著低于相同浓度的单一酵母菌处理组(H5、H6、P5和P6),说明复合酵母菌处理有利于果实贮藏。HP6组腐烂指数显著低于P8组,与H8组没有显著性差异(P>0.05)。表明2种低浓度的拮抗酵母菌结合能有效降低果实的腐烂指数。
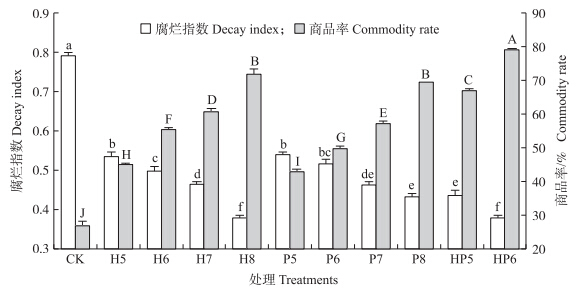 |
图 1 采前喷施拮抗酵母菌对草莓常温贮藏4 d后腐烂指数和商品率的影响 Fig. 1 Effects of preharvest spraying antagonist yeasts on the decay index and commodity rate of strawberries at ambient temperature for 4 days
1)CK:对照;H5~H8:1×105、1×106、1×107和1×108 CFU · mL-1 葡萄有孢汉逊酵母;P5~P8:1×105、1×106、1×107和1×108 CFU · mL-1季也蒙毕赤酵母;HP5和HP6:1×105和1×106 CFU · mL-1葡萄有孢汉逊酵母和季也蒙毕赤酵母复合菌。
2)不同大小写字母表示处理间差异显著(P<0.05)。 |
采前喷施拮抗酵母菌能够显著提高草莓的商品率(图 1)。常温贮藏4 d后,对照组商品率仅为27%,单一葡萄有孢汉逊酵母组(H5、H6、H7和H8)之间商品率存在显著性差异,分别为45%、56%、61%和73%。同样,单一季也蒙毕赤酵母组(P5、P6、P7和P8)之间商品率也存在显著性差异,分别为43%、50%、57%和70%。复合酵母菌组HP6商品率为77%,高于单一酵母菌组(H8和P8),说明2种酵母菌结合使用不仅能提高草莓果实的商品率,而且能够降低酵母菌的使用浓度。
2.2 采前喷施拮抗酵母菌对草莓常温贮藏感官评分的影响
由图 2可见:酵母菌处理组感官评分均高于对照组,单一酵母菌处理组(H8、P8)和复合酵母处理组(HP6)评分值较高。表明:采前喷施拮抗酵母菌能够提高果实的外观品质,保持果实的色泽、香气,抑制霉菌,减少腐烂。因此,冷藏试验中选用1×106 CFU · mL-1复合菌及1×108 CFU · mL-1单一酵母菌菌悬液处理草莓果实。
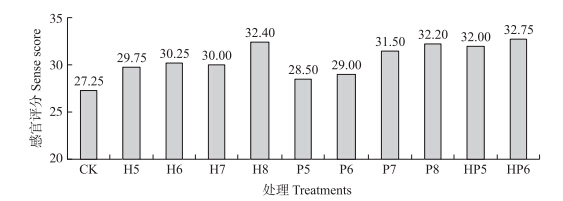 | 图 2 采前喷施拮抗酵母菌对草莓常温贮藏4 d后感官评分的影响 Fig. 2 Effects of preharvest spraying antagonist yeasts on sense score of strawberries at ambient temperature for 4 days |
从草莓外观来看,随着冷藏时间的延长,对照组果实腐烂面积大,霉变的果实多,而处理组只有个别果实出现腐烂霉变现象,感官良好。从草莓整体外观品质来看,复合处理组果实贮藏效果最好。
由图 3可见:贮藏15 d后,对照组草莓果实的腐烂指数为0.73,商品率为25%;而单一处理组H8和P8组果实腐烂指数分别为0.58和0.52,均显著低于对照组,且商品率分别达到55.5%和59%,均显著高于对照组。复合菌处理(HP6)组腐烂指数为0.35,商品率高达85%,与单一处理组及对照组均差异显著。因此,采前拮抗酵母菌处理可以有效地降低草莓采后病害的发生,且低浓度复合处理效果最好,能够更有效延长草莓贮藏寿命。
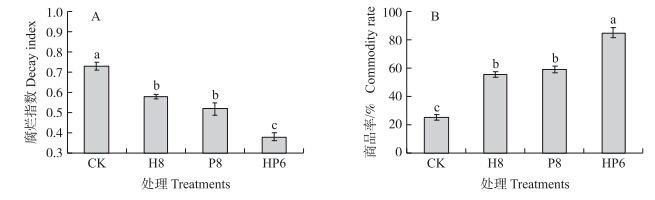 | 图 3 采前喷施拮抗酵母菌对冷藏后草莓腐烂指数(A)和商品率(B)的影响 Fig. 3 Effects of preharvest spraying antagonist yeasts on the decay index(A) and commodity rate(B)of strawberries after cold storage |
由表 2可知:随着贮藏时间的增加,草莓果实硬度逐渐降低,拮抗酵母菌处理组能维持较高的硬度,其硬度显著高于对照组。贮藏后各组可溶性固形物(TSS)含量均下降,且拮抗酵母菌处理对其没有显著影响。采前喷施拮抗酵母菌对草莓的pH值没有显著影响。贮藏结束后,各组果实维生素C含量均下降,但处理组维生素C含量显著高于对照组,说明拮抗酵母菌采前喷施能使草莓保持较高的维生素C含量。冷藏过程中,各组草莓果实的L*值均下降,但对照组与处理组间无显著区别,从表观看,采前喷施复合拮抗酵母菌能很好地保持草莓果实色泽。贮藏结束时,各组a值均上升,但组间没有显著差异,说明采前拮抗酵母菌处理对草莓果皮的颜色变化基本没有影响。
| 贮藏时间/d Storage time | 处理 Treatment | 硬度/N Firmness | 可溶性固形物/% TSS | pH值 pH value | 维生素C/(mg·100 g-1) Vitamin C | L*值 L* value | a值 a value |
| 0 | CK | 3.02±0.01a | 7.50±1.75a | 3.86±0.06a | 86.58±1.14a | 41.41±0.56a | 27.65±0.50a |
| H8 | 3.27±0.02a | 7.54±0.86a | 3.88±0.10a | 86.24±1.21a | 42.35±1.30a | 28.80±1.91a | |
| P8 | 3.20±0.01a | 7.57±0.76a | 3.85±0.17a | 86.23±1.14a | 43.01±1.20a | 29.18±1.61a | |
| HP6 | 3.35±0.03a | 7.60±1.43a | 3.92±0.06a | 88.35±1.01a | 42.98±1.44a | 28.72±1.77a | |
| 15 | CK | 2.17±0.02b | 5.97±0.70a | 4.94±0.04a | 43.08±1.06c | 28.31±1.14a | 37.04±1.54a |
| H8 | 2.53±0.01a | 6.10±0.95a | 4.90±0.10a | 47.85±1.07a | 30.14±1.90a | 39.30±1.14a | |
| P8 | 2.47±0.04a | 6.05±1.22a | 4.93±0.17a | 44.79±1.12b | 30.51±1.30a | 41.21±1.40a | |
| HP6 | 2.73±0.03a | 6.20±1.23a | 4.98±0.09a | 49.91±1.28a | 30.78±1.06a | 41.12±1.12a |
由图 4-A可知:冷藏期间,处理组与对照组果实POD活性均呈先上升后下降的趋势,且处理组的POD活性显著高于对照组。处理组POD活性在贮藏6 d时出现高峰,达到最大值,HP6组POD活性高于H8和P8;而对照组在9 d时出现峰值。表明拮抗酵母菌处理能诱导草莓果实的POD活性增加,且峰值提前出现。在整个贮藏期间,HP6组果实SOD活性显著高于对照组及P8组(图 4-B)。除12 d外,HP6组果实SOD活性高于H8组。贮藏期间所有组CAT活性均呈先上升后下降的趋势,且HP6组CAT活性高于H8和P8(图 4-C),说明拮抗酵母菌能够诱导果实CAT活性的升高。由图 4-D可知:整个贮藏过程中,H8、P8和HP6处理组MDA含量明显低于对照组,且HP6组与对照组之间差异显著。说明采前喷施拮抗酵母菌能减缓MDA含量的积累,从而延长果实的衰老进程。
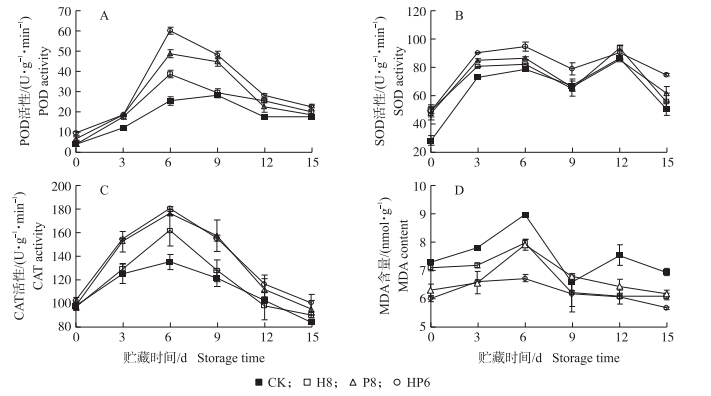 | 图 4 采前喷施拮抗酵母菌对冷藏草莓果实POD(A)、SOD(B)、CAT(C)活性和MDA含量(D)的影响 Fig. 4 Effects of preharvest spraying antagonist yeasts on POD(A),SOD(B),CAT(C)activities and MDA contents(D)of strawberries during cold storage |
如图 5-A所示:在贮藏前期3~9 d,HP6组果实PPO活性高于单一酵母菌处理组,且显著高于对照组。贮藏9 d之后,处理组果实PPO活性均显著高于对照组。HP6组果实PPO活性一直处于较高水平,表明葡萄有孢汉逊酵母和季也蒙毕赤酵母能共同诱导果实PPO活性的增加。所有组GLU活性均呈先上升后下降的趋势,在6 d时达到峰值(图 5-B)。整个贮藏过程中,HP6组果实GLU活性显著高于对照组,且高于单一酵母菌处理组,结果说明复合菌处理能更好地诱导果实的GLU活性,从而抑制果实病害的发生。
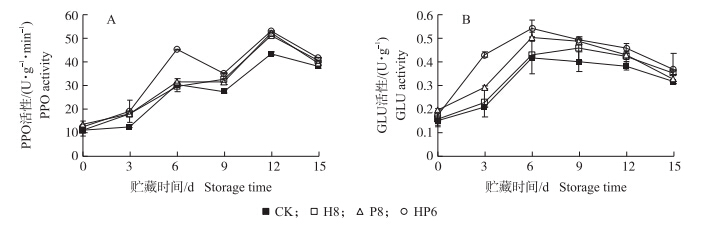 | 图 5 采前喷施拮抗酵母菌对冷藏草莓果实PPO(A)和GLU(B)活性的影响 Fig. 5 Effects of preharvest spraying antagonist yeasts on PPO(A)and GLU(B) activities of strawberries during cold storage |
由图 6可以看出:对照组果实上有颗粒状附着物和病原菌丝。处理组的草莓果实表皮均存在酵母菌,但在电镜下能够观察到酵母菌的数量是不同的,H8组和HP6组的酵母菌数量相对较多,P8组酵母菌数量相对较少,但也有一些颗粒物吸附,这些物质可能是采前喷施时,吸附的灰尘或者其他微生物。对照组中有病原菌丝的存在,但在其他处理组中没有看到明显的菌丝存在,说明了拮抗酵母菌能够抑制病原菌菌丝的生长。
 | 图 6 草莓果实表皮微生物的扫描电镜观察 Fig. 6 SEM images of microorganism on the surface of strawberry fruit Y:酵母菌Yeast;B:菌丝Mycelial |
有研究表明,采前喷施拮抗酵母菌能够有效防治果蔬采后病害。Meng等[23]研究表明:葡萄采摘前喷施罗伦隐球酵母能够较好地维持果实贮藏品质,减少果实腐烂,同时提高相关抗病性酶活性。Lu等[24]研究显示采前喷施海洋红酵母能够减少柑橘果实发病率,提高果实采后抗病性。本试验也得出类似结果,无论是单一酵母菌还是复合酵母菌处理,随着酵母菌使用浓度的升高,果实贮藏商品率增高,腐烂指数降低,感官评分越高。1×106 CFU · mL-1复合菌处理效果较好,原因可能是单一酵母菌只能对一种或一类病原菌起作用,多种生防菌的复合提高抑菌广谱性,进而抑制病原菌。Janisiewicz[25]研究得出拮抗菌Acremonium breve和Pseudomonas sp.混合使用能够显著提高对苹果病害的生防效果。Calvo等[26]研究结果显示黏红酵母Rhodotorula glutinis SL1与Cryptococcus albidus SL43结合及黏红酵母R.glutinis SL30与C.albidus SL43结合都能够抑制苹果果实上的扩展青霉菌(Penicillium expansum)。本试验结果证实了葡萄有孢汉逊酵母与季也蒙毕赤酵母均有协同作用,能够共同抑制草莓采后病害。考虑拮抗酵母菌生产成本、田间环境条件的复杂性及微生物群落间的彼此平衡性,1×106 CFU · mL-1复合酵母菌悬液可以作为采前喷施的较优浓度选择。
本试验结果表明:拮抗酵母菌采前应用对草莓采后冷藏品质有积极作用,较好地维持果实的TSS、pH值及色泽,显著减缓果实的硬度和维生素C含量下降,保持果实良好的外观,其中复合酵母菌处理效果最佳。分析原因可能是酵母菌在果实表皮定殖并大量繁殖,有利于在果实细胞表皮形成保护层,进而减少水分的蒸腾流失和果实的皱缩变软,保持果实较好的光泽。扫描电镜观察结果显示相同条件下,复合酵母菌在果实上与其他微生物竞争能力强,更容易占据空间从而定殖繁殖。根据这一结果也进一步证实了营养与空间竞争是拮抗菌的主要抑菌机制。
根据一系列的研究成果证实:诱导果蔬自身产生抗性,是防治其采后病害的有效方法之一[27]。SOD和CAT是生物体内防御氧化损伤的重要酶类,不仅在活性氧清除中起着重要作用,而且能促进H2O2转变成O2和H2O,进而避免H2O2对果实细胞的破坏。POD和PPO在催化木质素合成过程中起着关键作用,木质素可以形成交织网来硬化细胞壁,从而提高果实的抗病性[28]。酵母菌能够诱导果实的抗性酶活性,延缓MDA含量的积累。冷藏前期,低温引起果实的应激反应,相关酶类表现出较高活性,活性氧含量较低,果实未受到损害。随着贮藏时间的延长,果实逐渐成熟,组织细胞代谢增强,活性氧的产生也随之增加,此时酵母菌诱导果实抗性酶活性增强,使活性氧的产生和清除达到一种平衡状态,从而延缓果实的衰老。贮藏后期,果实抗性酶活性降低,活性氧清除系统的清除能力下降,导致活性氧积累,对果实造成伤害而导致其衰老。这与前人的研究结果相一致[24, 29]。
综上所述,两种或更多的防治方法相结合处理果蔬,相比单独使用一种拮抗菌能达到更好的贮藏效果。此外,研究更多具有较高拮抗作用的酵母菌结合使用,生防菌的田间应用,拮抗酵母菌的大规模生产及商业化应用是今后努力的方向。
| [1] | Sallato B V,Torres R,Zoffoli J P,et al. Effect of boscalid on postharvest decay of strawberry caused by Botrytis cinerea and Rhizopus stolonifer[J]. Spanish Journal of Agricultural Research,2007,5(1):67-78 |
| [2] | 赵妍,邵兴锋,屠康,等. 枯草芽孢杆菌(Bacillus subtilis)B10对采后草莓果实病害的抑制效果[J]. 果树学报,2007,24(3):339-343 [Zhao Y,Shao X F,Tu K,et al. Inhibitory effect of Bacillus subtilis B10 on the diseases of postharvest strawberry[J]. Journal of Fruit Science,2007,24(3):339-343(in Chinese with English abstract)] |
| [3] | 韦莹莹,毛淑波,屠康. 果蔬采后病害生物防治的研究进展[J]. 南京农业大学学报,2012,35(5):183-189. doi:10.7685/j.issn.1000-2030.2012.05.020 [Wei Y Y,Mao S B,Tu K. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists[J]. Journal of Nanjing Agricultural University,2012,35(5):183-189(in Chinese with English abstract)] |
| [4] | 杨晓蕾,钱国良,范加勤,等. 梨黑斑病菌拮抗细菌的筛选鉴定及其拮抗活性的研究[J]. 南京农业大学学报,2014,37(1):68-74. doi:10.7685/j.issn.1000-2030.2014.01.012 [Yang X L,Qian G L,Fan J Q,et al. Selection and identification of antagonist Alternaria alternate and initial analysis of its antipathogenic activity[J]. Journal of Nanjing Agricultural University,2014,37(1):68-74(in Chinese with English abstract)] |
| [5] | 韦巧婕,郑新艳,邓开英,等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效[J]. 南京农业大学学报,2013,36(1):40-46. doi:10.7685/j.issn.1000-2030.2013.01.008 [Wei Q J,Zheng X Y,Deng K Y,et al. Screening and identification of antagonistic Bacillus vallismortis B against cucumber Fusarium wilt and its biological effect[J]. Journal of Nanjing Agricultural University,2013,36(1):40-46(in Chinese with English abstract)] |
| [6] | 丁玥,孟帆,王奎,等. 季也蒙毕赤酵母对采后草莓病害控制及冷藏品质的影响[J]. 南京农业大学学报,2010,33(4):64-68. doi:10.7685/j.issn.1000-2030.2010.04.012 [Ding Y,Meng F,Wang K,et al. Effects of Pichia guilliermondii on disease control and quality of postharvest strawberry during cold storage[J]. Journal of Nanjing Agricultural University,2010,33(4):64-68(in Chinese with English abstract)] |
| [7] | Sui Y,Liu J,Wisniewski M,et al. Pretreatment of the yeast antagonist,Candida olephila,with glycine betaine increases oxidative stress tolerance in the microenvironment of apple wounds[J]. International Journal of Food Microbiology,2012,157:45-51 |
| [8] | Luo Y,Zeng K F,Ming J. Control of blue and green mold decay of citrus fruit by Pichia membranefaciens and induction of defense responses[J]. Science Horticulturae,2012,135:120-127 |
| [9] | Zong Y Y,Liu J,Li B Q,et al. Effects of yeast antagonists in combination with hot water treatment on postharvest diseases of tomato fruit[J]. Biological Control,2010,54:316-321 |
| [10] | Spadaro D,Sabetta W,Acquadro A,et al. Use of AFLP for differentiation of Metschnikowia pulcherrima strains for postharvest disease biological control[J]. Microbiological Research,2008,163(5):523-530 |
| [11] | Liu H M,Guo J H,Cheng Y J,et al. Control of gray mold of grape by Hanseniaspora uvarum and its effects on postharvest quality parameters[J]. Annals of Microbiology,2010,60(1):31-35 |
| [12] | Geng P,Chen S H,Hu M Y. Combination of Kluyveromyces marxianus and sodium bicarbonate for controlling green mold of citrus fruit[J]. International Journal of Food Microbiology,2011,151(2):190-194 |
| [13] | Filonow A B. Role of competition for sugars by yeasts in the biocontrol of gray mold of apple[J]. Biocontrol Science and Technology,1998,8:243-256 |
| [14] | Zhang H Y,Wang L,Dong Y,et al. Postharvest biological control of gray mold decay of strawberry with Rhodotorula glutinis[J]. Biological Control,2007,40(2):287-292 |
| [15] | Long C A,Yuan C. Kloeckera apiculata strain(34-9)to control Botrytis cinerea during the pre- and postharvest handing of strawberries[J]. Annals of Microbiology,2009,59(1):77-81 |
| [16] | Zhang H Y,Zheng X D,Fu C X,et al. Postharvest biological control of gray mold rot of pear with Cryptococcus laurentii[J]. Postharvest Biology and Technology,2005,35:79-86 |
| [17] | 罗凯. 拮抗酵母结合化学物质提高草莓果实采后贮藏性能的研究[D]. 南京:南京农业大学,2012 [Luo K. Effect of antagonistic yeast alone or in combination with chemical materials on postharvest storability of strawberry fruit[D]. Nanjing:Nanjing Agricultural University,2012(in Chinese with English abstract)] |
| [18] | 巩惠芳,杜正顺,汪良驹,等. 气调处理延长草莓果实保鲜效应的研究[J]. 南京农业大学学报,2009,32(2):35-39. doi:10.7685/j.issn.1000-2030.2009.02.008 [Gong H F,Du Z S,Wang L J,et al. Study on the effect of controlled atmosphere on extending storage of strawberry fruits[J]. Journal of Nanjing Agricultural University,2009,32(2):35-39(in Chinese with English abstract)] |
| [19] | Muskovics G,Felföldi J,Kovács E. Changes in physical properties during fruit ripening of Hungarian sweet cherry(Prunus avium L.)cultivars[J]. Postharvest Biology and Technology,2006,40:56-63 |
| [20] | 宁正祥. 食品成分分析手册[M]. 北京:中国轻工业出版社,1998 [Ning Z X. Handbook of Food Composition Analysis[M]. Beijing:China Light Industry Press,1998(in Chinese)] |
| [21] | 王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京:高等教育出版社,2006:197 [Wang X K. The Principle and Technology of Plant Physiological and Biochemical Experiment[M]. 2nd ed. Beijing:Higher Education Press,2006:197(in Chinese)] |
| [22] | 余挺. 提高罗伦隐球酵母拮抗效力的途径及其机理的研究[D]. 杭州:浙江大学,2007 [Yu T. Improvement of the biocontrol efficacy of Crytococcus laurentii against postharvest fungal diseases and the possible mechanisms involved[D]. Hangzhou:Zhejiang University,2007(in Chinese with English abstract)] |
| [23] | Meng X H,Qin G Z,Tian S P. Influence of preharvest spraying Cryptococcus laurentii combinated with postharvest chitosan coating on postharvest diseases and quality of table grapes in storage[J]. LWT-Food Science and Technology,2010,43(4):596-601 |
| [24] | Lu L F,Ye C Z,Guo S H,et al. Preharvest application of antagonistic yeast Rhodosporidium paludigenum induced resistance against postharvest diseases in mandarin orange[J]. Biological Control,2013,67:130-136 |
| [25] | Janisiewicz W. Biocontrol of postharvest diseases of apples with antagonist mixtures[J]. Postharvest Pathology and Mycotoxins,1988,78:194-198 |
| [26] | Calvo J,Calvente V,de Orellano M E,et al. Improvement in the biocontrol of postharvest diseases of apples with the use of yeast mixtures[J]. BioControl,2003,48:579-593 |
| [27] | Droby S,Vinokur V,Weiss B,et al. Induction of resistance to Penicillium digitatum in grape fruit by the yeast biocontrol agent Candida oleophila[J]. Phytopathology,2002,92:393-399 |
| [28] | Zhao Y,Tu K,Shao X F,et al. Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit[J]. Postharvest Biology and Technology,2008,49(1):113-120 |
| [29] | Zhang D P,Spadaro D,Garibaldi A,et al. Potential biocontrol activity of a strain of Pichia guillermondii against grey mold of apples and its possible modes of action[J]. Biological Control,2011,57:193-201" |




