文章信息
- 杨英士, 陈伟, 杨海燕, 辛志宏. 2015.
- YANG Yingshi, CHEN Wei, YANG Haiyan, XIN Zhihong. 2015.
- 昆仑雪菊中血管紧张素转化酶活性抑制成分的分离鉴定
- Isolation and identification of active ingredients on angiotensin-converting enzyme inhibition from Coreopsis tinctoria Nutt.
- 南京农业大学学报, 38(1): 146-151
- Journal of Nanjing Agricultural University, 38(1): 146-151.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.022
-
文章历史
- 收稿日期:2014-05-08
2. 新疆农业大学食品科学与药学学院, 新疆 乌鲁木齐 830052
2. College of Food Science and Pharmacy, Xinjiang Agricultural University, Urumqi 830052, China
血管紧张素转化酶(angiotensin-converting enzyme,ACE),是一种含锌离子的膜结合外肽酶,在调节血压过程中起双重作用。一方面,ACE可以将不具有活性的血管紧张素Ⅰ转化为具有强烈收缩血管作用的血管紧张素Ⅱ,另一方面,ACE可降解具有舒张血管作用的舒缓激肽使其失活[1],从而导致血压升高。因此,以ACE活性为靶点,从各种天然资源中筛选具有ACE抑制活性的生物活性成分,已经成为寻找和发掘天然降血压物质的常用方法。
雪菊(Coreopsis tinctoria Nutt.)是一年生菊科植物,又名蛇目菊、双色金鸡菊,原产于北美[2]。在我国新疆,野生雪菊主要分布在和田喀喇昆仑山脉海拔3 000 m以上高寒地区,因此又被称为昆仑雪菊、天山雪菊、高寒香菊[3]。长期以来,昆仑雪菊都被当地居民当花茶饮用,经世代传承,发现其具有清热解毒、和胃健脾、活血化瘀等功效[4],尤其是降血压活性尤为显著,因而昆仑雪菊也被称为“降压雪菊”[5],然而对其化学成分的研究鲜有文献报道。因此,深入研究昆仑雪菊的化学成分,对于开发这一稀有资源的食用和药用价值具有重要意义。
本研究采用不同溶剂提取昆仑雪菊,测试提取物对ACE的抑制作用,筛选出最佳萃取溶剂,对粗提物进行分离纯化得到单体化合物,采用核磁共振(nuclear magnetic resonance,NMR)和电喷雾质谱(electrospray ionization mass spectrometry,ESIMS)鉴定其化学结构,并评价单体化合物对ACE的抑制活性。 1 材料与方法 1.1 材料与试剂
昆仑雪菊(Coreopsis tinctoria Nutt.)购于乌鲁木齐市北园春市场。
Sephadex LH-20购于瑞典Pharmacia公司;硅胶H(38~75 μm)购于青岛海洋化工厂产品。α-生育酚、ACE、马尿酰-组氨酰-亮氨酸(HHL)、马尿酸均购于Sigma公司;硼砂、硼酸、盐酸、氯化钠等均为分析纯;常规提取分离用的甲醇、丙酮、环己烷、正丁醇、乙酸乙酯、石油醚、氯仿等均为分析纯,重蒸后使用。
1.2 仪器与设备
AVANCE3型(400 MHz)核磁共振仪购于德国Bruker公司;Mariner API-TOF型质谱仪购于美国应用生物系统公司;N-1100V-WD立式旋转蒸发仪购于日本东京理化有限公司;电子天平购于北京赛多利斯仪器系统有限公司;Microfuge 22R型台式冷冻离心机购于美国Beckman公司;数显恒温水浴锅购于上海江星仪器有限公司;CJJ78-1型磁力加热搅拌器购于金坛市大地自动化仪器厂;FW200高速万能粉碎机购于天津市华鑫仪器厂;UV-2102PC型紫外可见分光光度计、酸度计购于上海精密科学仪器有限公司。
1.3 最佳萃取溶剂的选择 1.3.1 血管紧张素转化酶活性测定
马尿酸标准曲线的制作:称取适量马尿酸标准品,配成浓度分别为25、50、75、100、125和150 μmol · L-1的溶液,于228 nm波长处分别测其吸光值,以马尿酸浓度为横坐标,吸光值为纵坐标,绘制马尿酸标准曲线,得到马尿酸标准曲线方程:y=0.011x+0.047(R2=0.997)。其中:x为马尿酸浓度(μmol · L-1);y为样品的吸光值。 按照Cushman等[6]的方法并稍作改动,以HHL为底物,在该条件下1 min反应生成1 μmol马尿酸为一个酶活性单位,比活力以U · mL-1表示。根据标准曲线测得ACE的比活力为0.16 U · mL-1。 1.3.2 昆仑雪菊粗提物的制备
将干燥的昆仑雪菊花序用高速万能粉碎机粉碎,准确称取7份0.5 g样品,分别加入50 mL环己烷、乙酸乙酯、氯仿、丙酮、甲醇、蒸馏水及正丁醇作为萃取溶剂,用磁力搅拌器搅拌萃取;然后用布氏漏斗抽滤,取上清液,重复萃取3次,将上清液合并减压真空浓缩得到萃取物,用适量的蒸馏水溶解,4 ℃保存备用。 1.3.3 不同溶剂萃取物ACE抑制活性测定
按照Cushman等[6]的方法并稍作改动。将HHL用0.1 mol · L-1 pH 8.3且含有0.3 mol · L-1 NaCl的硼酸盐缓冲液配成5 mmol · L-1的溶液。取50 μL样品,加100 μL HHL溶液,37 ℃条件下保温10 min;然后加入50 μL ACE溶液(溶解于蒸馏水中)混匀,37 ℃水浴30 min;之后加入150 μL 1 mol · L-1的盐酸溶液终止反应;再加入1 mL乙酸乙酯,15 s震荡混匀后,于4 ℃、4 000 r · min-1离心10 min;用移液管吸取0.8 mL乙酸乙酯层溶液,置于玻璃瓶中,120 ℃烘干后加入3 mL蒸馏水,在228 nm波长处测定吸光值A。以蒸馏水为对照组测得吸光值B,以HHL为空白测得吸光值C。 ACE抑制率=(B-A)/(B-C)×100%。
1.4 昆仑雪菊活性成分的萃取
取500 g干燥的昆仑雪菊花序,用高速万能粉碎机粉碎,置于20 L的容量瓶中,加入10 L最佳溶剂浸泡萃取充分后,用布氏漏斗抽滤,残渣重复萃取2次,合并滤液,减压浓缩得到萃取浸膏。
1.5 化合物的分离与纯化
将萃取得到的浸膏用干法拌样后上装有200 g硅胶(48 μm)的常压柱进行分离纯化,经过正相硅胶柱分离,以石油醚-丙酮-甲醇(体积比分别为100 ∶0∶0,0∶100∶0,0∶0∶ 100)为洗脱剂进行梯度洗脱,每次洗脱200 mL,经TLC检测,得到4个组分(Fraction,简写Fr.):Fr.1~Fr.4。Fr.1(3.8 g)经过正相硅胶柱分离,以氯仿-甲醇(体积比为200 ∶ 1)为洗脱剂进行梯度洗脱,经TLC检测,得到Fr.1.1和Fr.1.2两个组分。Fr.1.1经过正相硅胶柱分离,以纯氯仿洗脱,得到Fr.1.1.1和Fr.1.1.2两个组分,Fr.1.1.1经Sephadex LH-20进一步分离纯化,以氯仿-甲醇(体积比为1 ∶ 1,下同)洗脱,得到化合物1(8.2 mg)。Fr.2(5.8 g)经过正相硅胶柱分离,以氯仿-甲醇(100 ∶ 1)为洗脱剂进行梯度洗脱,经TLC检测,得到Fr.2.1和Fr.2.2两个组分。Fr.2.2经正相硅胶柱继续分离,以氯仿-甲醇(200 ∶ 1)为洗脱剂进行梯度洗脱,经TLC检测,得到Fr.2.2.1和Fr.2.2.2两个组分,Fr.2.2.1经Sephadex LH-20进一步分离纯化,以氯仿-甲醇(1 ∶ 1)洗脱,得到化合物2(20.2 mg)。Fr.3(3.6 g)经正相硅胶柱分离,以石油醚-丙酮(200 ∶ 1)梯度洗脱,经TLC检测得到Fr.3.1和Fr.3.2两个组分,Fr.3.2经Sephadex LH-20进一步分离纯化,以氯仿-甲醇(1 ∶ 1)洗脱,得到化合物3(12.2 mg)。Fr.4(4.3 g)经过正相硅胶柱分离,以氯仿-甲醇(100 ∶ 1)为洗脱剂进行梯度洗脱,经TLC检测,得到Fr.4.1和Fr.4.2两个组分,其中Fr.4.1经反相硅胶柱分离,以甲醇-水梯度洗脱,当甲醇浓度为75%时,得到化合物4(8.7 mg);Fr.4.2经Sephadex LH-20进一步分离纯化,以氯仿-甲醇(1 ∶ 1)洗脱,得到化合物5(6.8 mg)。
1.6 数据处理与统计分析
采用Excel 2007和SPSS 16.0统计软件进行数据分析。
2 结果与分析 2.1 不同溶剂的昆仑雪菊萃取物对血管紧张素转化酶(ACE)的抑制效果
由图 1可见:在1 mg · mL-1质量浓度下,测得环己烷和乙酸乙酯的昆仑雪菊萃取物对ACE抑制率较弱,分别为3.6%和7.94%;丙酮和正丁醇萃取物对ACE抑制率为29.95%和20.95%;氯仿和水萃取物对ACE抑制率为49.68%和40.63%;甲醇萃取物对ACE抑制作用最强,达到74.25%,因此选择甲醇为最佳的萃取溶剂。
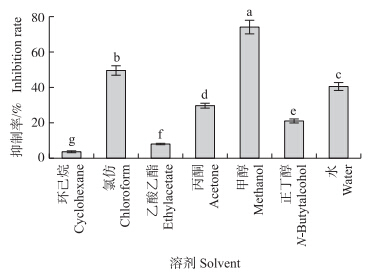 | 图 1 不同溶剂的昆仑雪菊萃取物对ACE的抑制效果 Fig. 1 The effect of angiotensin-converting enzyme (ACE)inhibition of Coreopsis tinctoria Nutt. extracts in different solvents 不同字母表示在0.05水平上差异显著(P<0.05)。 Different letters indicate significant difference at 0.05 levels. |
化合物1:白色无定形粉末,熔点160 ℃(158~160 ℃),ESIMS分别在m/z 193.1[M-H]-和m/z 217.1[M+Na]+处给出准分子离子峰,结合 1H NMR 和 13C NMR数据确定其分子式为C10H10O4。 1H NMR (400 MHz,DMSO)在δ 7.53(1H,s,H-2)和δ 7.57(1H,s,H-3)处提示分子中含有不饱和的烯烃质子,δ 7.17(d,J=1.2 Hz,H-5)、6.87(d,J=8.1 Hz,H-6)、7.04(d,J=8.40 Hz,H-9)分别为苯环上的氢,δ 3.72(3H,s)为甲氧基上的3个氢信号; 13C NMR(100 MHz,DMSO)在δ 167.90处提示分子中存在1个羰基,δ 51.51处提示分子中含有甲基碳信号,δ 127.56(C-4)、146.32(C-7)、148.79(C-8)显示 分子中有3个季碳,并且都是环内双键上的季碳。具体核磁数据归属为: 1H NMR(400 MHz,DMSO)δ 7.53 (1H,s,H-2)、7.57(1H,s,H-3)、7.17(d,J=1.2 Hz,H-5)、6.87(d,J=8.1 Hz,H-6)、7.04(d,J=8.40 Hz,H-9)、3.72(3H,s,—OCH3)。 13C NMR(100 MHz,DMSO)δ 51.51(CH3)、127.56(C-4)、146.32(C-7)、148.79(C-8)。以上数据与Zhu等[7]报道的咖啡酸甲酯的数据完全一致,因此确定化合物1为咖啡酸甲酯(图 2)。
 | 图 2 化合物1~5的结构 Fig. 2 Structure of compounds 1-5 1.咖啡酸甲酯Methyl ester caffeate;2.脱镁叶绿素a Pheophorbide a;3.β-香树脂β-amyrin;4.异奥卡宁-7-O-β-D-吡喃葡萄糖苷Isookanin-7-O-β-D-glucopyranoside;5.对香豆酸甲酯Methyl-p-coumarate |
化合物2:墨绿色无定形固体,熔点228 ℃(228 ℃),ESIMS在m/z 593.4[M+H]+处给出准离子峰,结合 1H NMR和 13C NMR数据确定其分子式为C35H36N4O5。红外光谱在3 393和1 736 cm-1处提示分子结构中含有羟基和羰基,在1 692和1 612 cm-1处提示分子结构中含有C C,紫外光谱在310、410、506、536、610和660 nm处有强吸收峰,以上数据与卟啉酯的特征数据吻合,初步判断该化合物为卟啉酯类化合物。 1H NMR在δ 3.89(s,H-134)、3.58(s,H-121)、3.36(s,H-21)、2.98(s,H-71)、1.85(d,J=7.35 Hz,H-181)、1.55(t,J=7.70 Hz,H-82)显示分子结构中存在6个甲基;δ 9.50(s,H-10)、9.17(s,H-5)和8.83(s,H-20)处显示分子结构中存在3个烯烃质子;δ 7.96(dd,J=17.90,11.55 Hz,H-31)、6.26(d,J=17.95 Hz,H-32-1)和6.11(d,J=11.60 Hz,H-32-2)显示分子结构中存在1个单取代乙烯基。 1H-1H COSY中δ 6.11、δ 6.26与δ 7.96相关,δ 1.55与δ 3.47相关,δ 2.38与δ 2.60相关,δ 1.85与δ 4.65相关,说明H-31与H-32,H-81与H-82,H-171与H-172,H-18与H-181相连。由HMBC谱可看到分子中存在的几组关键耦合关系:C-31与C-2、C-3、C-32耦合,且根据C-31的化学位移(δ 129.8)可推测C-31处存在乙烯基,且C-31与C-3相连;C-134与C-133耦合,C-132与C-131、C-133、C-14、C-15耦合,且根据C-133的化学位移(δ 170.3)可推测分子中存在1个甲酸基,且C-133与C-132相连;C-171与C-172、C-173、C-18耦合,C-172与C-171、C-173耦合,且根据C-173的化学位移(δ 174.2)与 1H-1H COSY的相关性可推测分子中存在1个丁酸基,且质子连接顺序为H-17到H-173,以上可确定该化合物的平面结构。NOESY谱显示H-18与H-171相关,H-181与H-17相关,H-132与H-17相关,说明17与18位上的H在异侧,132与17位上的H在同侧,同时通过比较CD谱发现,该化合物在320、420和550 nm处出现正的cotton效应,而670 nm处为负的cotton效应,且与Jin等[8]数据比较,可判断其绝对立体构型,最终确定该化合物为脱镁叶绿素a(图 2)。
化合物3:白色不定形粉末,熔点197 ℃(197.0~197.5 ℃),ESIMS在m/z 449.2[M+Na]+处给出准分子离子峰,结合 1H NMR和 13C NMR数据确定其分子式为C30H50O。 1H NMR(400 MHz,DMSO)在δ 0.76(3H,s)、0.90(3H,s)、0.72(3H,s)、0.94(3H,s)、1.19(3H,s)、1.06(3H,s)、0.88(3H,s)、1.80(3H,s)显示含有24个甲基质子,推测分子中含有8个甲基,δ 3.42显示为活泼氢信号,推测分子中可能含有1个羟基,δ 5.23(t,J=3.2,1H)显示为双键质子信号。 13C NMR(100 MHz,DMSO)在δ 27.71、15.43、15.43、16.44、25.99、27.91、32.56、23.36显示分子中含有8个甲基信号,δ 77.69、55.26、47.63、121.93、47.23显示分子中含有5个次甲基,δ 38.58、36.98、39.75、144.97、41.56、32.56、30.77显示分子中含有7个季碳。具体核磁数据归属为: 1H NMR(400 MHz,DMSO)δ 0.76(3H,s)、0.90(3H,s)、0.72(3H,s)、0.94(3H,s)、1.19(3H,s)、1.06(3H,s)、0.88(3H,s)、1.80(3H,s)、3.42(OH)、5.23(t,J=3.2,H-12)。 13C NMR(100 MHz,DMSO)δ 27.71(C-23)、15.43(C-24)、15.43(C-25)、16.44(C-26)、25.99(C-27)、27.91(C-28)、32.56(C-29)、23.36(C-30)、77.69(C-3)、55.26(C-5)、47.63(C-9)、121.93(C-12)、47.23(C-18)、38.58(C-4)、36.98(C-8)、39.75(C-10)、144.97(C-13)、41.56(C-14)、32.56(C-17)、30.77(C-20)。以上数据与Liliana等[9]中β-香树脂的数据完全一致,因此确定化合物3为β-香树脂(图 2)。
化合物4:黄色粉末,熔点237.5 ℃(236~239 ℃),ESIMS在m/z 449.1[M-H]-处给出准分子离子峰,结合 1H NMR和 13C NMR数据确定其分子式为C21H12O11。 1H NMR(400 MHz,DMSO)在δ 8.31(1H,br s)、9.00(1H,br s)提示分子中至少存在2个酚羟基质子,δ 6.87(1H,d,J=2.0 Hz)、6.79(1H,dd,J=2.0,8.0 Hz)、6.75(1H,d,J=8.0 Hz)显示分子中含有3个苯环质子且存在1个ABX自旋系统,δ 7.23(1H,d,J=9.0 Hz)、δ 6.87(1H,d,J=9.0 Hz)显示分子中存在1个AB自旋系统。δ 4.84(1H,d,J=7.3 Hz)是端基质子信号,提示分子中含有1个糖单元且为β型。 13C NMR(100 MHz,DMSO)在δ 190.99的碳信号,提示分子中含有1个羰基,δ 43.35的碳信号,显示分子中含有1个亚甲基。具体核磁归属为: 1H NMR(400 MHz,DMSO)δ 8.31(OH,br s)、9.00(OH,br s)、(1H,d,J=2.0 Hz)、6.79(1H,dd,J=2.0,8.0 Hz)、6.75(1H,d,J=8.0 Hz)、7.23(1H,d,J=9.0 Hz)、6.87(1H,d,J=9.0 Hz)、4.84(1H,d,J=7.3 Hz)。 13C NMR(100 MHz,DMSO)δ 190.99(C O)、79.17(C-2)、45.35(C-3)、117.9(C-5,C-6′)、109(C-6)、150.67(C-7,C-9)、135.13(C-8)、116.34(C-10)、130.1(C-1′)、114.42(C-2′),145.1(C-3′)、145.56(C-4′)、115.24(C-5′)、117.9(C-6′)、101.47(C-1″)、3.14(C-2″)、75.71(C-3″)、69.67(C-4″)、77.22(C-5″)、60.62(C-6″)。以上数据与Yang等[10]报道中异奥卡宁-7-O-β-D-吡喃葡萄糖苷的数据完全一致,因此化合物4为异奥卡宁-7-O-β-D-吡喃葡萄糖苷(图 2)。
化合物5:黄色无定形粉末,熔点135~137 ℃(137 ℃),ESIMS在m/z 177.06[M-H]-处给出准分子离子峰,结合 1H NMR和 13C NMR数据确定其分子式为C10H10O3。 1H NMR(400 MHz,CDCl3)显示在δ 3.86(3H,s,—OCH3)处有1个甲氧基信号,在δ 7.68(1H,d,J=16.0 Hz,β-H)和6.35(1H,d,J=16.0 Hz,α-H)提示分子中存在1个反式双键,δ 7.46(2H,d,J=8.5 Hz,2-H,6-H)和δ 6.91(2H,d,J=8.5 Hz,5-H,3-H)分别为苯环上的氢信号; 13C NMR(100 MHz,CDCl3)在δ 168.45处提示分子中存在1个羰基,δ 127.17( C-1)、115.96(C-2,C-6)、130.09(C-3,C-5)、158.07(C-4)为苯环上的6个碳,δ 114.90(C-α)和145.07 (C-β)为双键上的2个碳,δ 51.87(—OCH3)为甲氧基上的碳。具体核磁数据归属为: 1H NMR(400 MHz,CDCl3)δ 7.68(1H,d,J=16.0 Hz,β-H)、6.35(1H,d,J=16.0 Hz,α-H)、7.46(2H,d,J=8.5 Hz,2-H,6-H)、6.91(2H,d,J=8.5 Hz,5-H,3-H)、3.86(3H,s,—OCH3)。 13C NMR(100 MHz,CDCl3)δ 127.17(C-1)、 115.96(C-2,C-6)、130.09(C-3,C-5)、158.07(C-4)、114.90(C-α)、145.07(C-β)、168.45(C O)、51.87(—OCH3)。以上波谱数据与屠鹏飞等[11]报道一致,因此化合物5鉴定为对香豆酸甲酯(图 2)。
2.3 化合物抑制ACE活性测定结果
由图 3可知:在测定的浓度范围内,5个化合物对ACE均表现出了一定的抑制活性且具有剂量依赖关系,但存在差异性。在100~200 μmol · L-1浓度范围内,随着浓度的增加,抑制率增大较快;在200~400 μmol · L-1浓度范围内,随着浓度的增加,抑制率变化缓慢,在400 μmol · L-1时抑制率基本达到最大值,之后随浓度的增加,抑制率变化不大。其中,化合物4对ACE的半数抑制率最小,IC50为(167.02±4.32)μmol · L-1,其次为化合物1和5,IC50分别为(237.74±5.82)μmol · L-1和(331.57±4.69)μmol · L-1,化合物2和3在所测范围内抑制率均未达到50%。综上所述,表明化合物1、4和5都表现出了较强的抑制ACE活性,其中化合物4对ACE的抑制活性最强。
 | 图 3 化合物抑制ACE活性效果 Fig. 3 effect of ACE inhibition of compounds |
高血压的危害性在心脑血管疾病中高居首位[12],可引发心、肾、脑等重要脏器功能受损,甚至出现功能性衰竭,但早期无明显症状和不适感,易被人们忽视而耽误诊断和治疗,导致出现严重并发症或发生临床危急状况。因此,高血压又被称为“无声杀手”[13, 14]。人工合成的降压药物虽然具有一时的降压、稳压效果,但同时也具有明显的毒副作用和依赖性[15];与药品相比较,天然产物中的化合物细胞毒副作用要小得多,因此从天然产物中寻找高效低毒的降压活性物质具有重要意义。
本研究从昆仑雪菊的甲醇萃取物中分离到了5个单体化合物,鉴定其结构分别为咖啡酸甲酯、脱镁叶绿素a、β-香树脂、异奥卡宁-7-O-β-D-吡喃葡萄糖苷和对香豆酸甲酯。活性测试结果表明:咖啡酸甲酯、异奥卡宁-7-O-β-D-吡喃葡萄糖苷和对香豆酸甲酯都具有较强的抑制ACE活性,提示这些化合物可能为昆仑雪菊中潜在的降血压物质。由于具有ACE酶活性的物质进入体内后需要经过吸收、代谢与生物转换等过程而可能活性降低或失活,因此在以后的研究中需要通过动物试验进一步证实这些物质在体内是否具有降血压作用,以便确认其是否为真正的降血压物质。
| [1] | 韩飞,于婷婷,周孟良. 酶法生产大豆蛋白ACE抑制肽的研究[J]. 食品科学,2008,29(11):369-374 [Han F,Yu T T,Zhou M L. Enzymatic preparation of angiotensinⅠ-converting enzyme(ACE)inhibitory peptides derived from soybean protein[J]. Food Science,2008,29(11):369-374(in Chinese with English abstract)] |
| [2] | Dias T,Bronze M R,Houghton P J,et al. The flavonoid-rich fraction of Coreopsis tinctoria promotes glucose tolerance regain through pancreatic function recovery in streptozotocin-induced glucose-intolerant rats[J]. Journal of Ethnopharmacology,2010,132:483-490 |
| [3] | 杨英士,陈伟,杨海燕,等. 昆仑雪菊中2个黄酮类化合物的分离鉴定及其抗氧化活性评价[J]. 南京农业大学学报,2014,37(4):149-154. doi:10.7685/j.issn.1000-2030.2014.04.022 [Yang Y S,Chen W,Yang H Y,et al. Isolation and identification of two flavonoids compounds from Coreopsis tinctoria Nutt.and evaluation of their antioxidant activities[J]. Journal of Nanjing Agricultural University,2014,37(4):149-154(in Chinese with English abstract)] |
| [4] | 木合布力·阿布力孜,张燕,景兆均,等. 新疆昆仑雪菊化学成分的初步定性研究[J]. 新疆医科大学学报,2010,33(6):628-630 [Ablise M,Zhang Y,Jing Z J,et al. Chemical constituents of Coreopsis tinctoria flowers from the Kunlun Mountain in Xinjiang[J]. Journal of Xinjiang Medical University,2010,33(6):628-630(in Chinese with English abstract)] |
| [5] | 梁淑红,哈木提拉,庞市宾,等. 金鸡菊提取物降血压化学成分实验研究[J]. 时珍国医国药,2010,21(7):1619-1621 [Liang S H,Hamu L,Pang S B,et al. Experimental study on hypertensive effects of extracts of Coreopsis basalis[J]. Lishizhen Medicine and Materia Medica Research,2010,21(7):1619-1621(in Chinese with English abstract)] |
| [6] | Cushman D W,Cheung H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology,1971,20:1637-1648 |
| [7] | Zhu Y,Zhang L X,Zhao Y,et al. Unusual sesquiterpene lactones with a new carbon skeleton and new acetylenes from Ajania przewalskii[J]. Food Chemistry,2010,118:228-238 |
| [8] | Jin P F,Deng Z W,Pei Y H,et al. Two phaeophytin type analogues from marine sponge Dysidea sp.[J]. Chinese Chemical Letters,2005,16(2):209-211 |
| [9] | Liliana H V,Javier P,Arturo N O. The pentacyclic triterpenes α,β-amyrins:a review of sources and biological activities[C]//Rao V. Phytochemicals—A Global Perspective of Their Role in Nutrition and Health. Croatia:InTech,2012:487-502 |
| [10] | Yang X W,Huang M Z,Jin Y S. Phenolics from Bidens bipinnata and their amylase inhibitory properties[J]. Fitoterapia,2012,83:1169-1175 |
| [11] | 屠鹏飞,吴卫中,郑俊华. 太白米的酚酸类成分研究[J]. 药学学报,1999,4(1):39-42 [Tu P F,Wu W Z,Zheng J H. Phenolic acids from the bulbs of Notholirion bulbuliferum[J]. Acta Pharmaceutica Sinica,1999,34(1):39-42(in Chinese with English abstract)] |
| [12] | Levine D A,Lewis C E,Williams O D,et al. Geographic and demographic variability in 20-year hypertension incidence:the CARDIA study[J]. Hypertension,2011,57(1):39-47 |
| [13] | Daugherty S L,Powers J D,Magid D J,et al. The association between medication adherence and treatment intensification with blood pressure control in resistant hypertension[J]. Hypertension,2012,60(2):303-309 |
| [14] | Sharifi N,Souri E,Ziai S A,et al. Discovery of new angiotensin converting enzyme(ACE)inhibitors from medicinal plants to treat hypertension using an in vitro assay[J]. DARU Journal of Pharmaceutical Sciences,2013,21(1):74-81 |
| [15] | Guerrero L,Castillo J,Quinones M,et al. Inhibition of angiotensin-converting enzyme activity by flavonoids:structure-activity relationship studies[J]. PLoS ONE,2012,7(11):e49493 |




