文章信息
- 杨维维, 许媛媛, 荣超, 权素玉, 张源淑. 2015.
- YANG Weiwei, XU Yuanyuan, RONG Chao, QUAN Suyu, ZHANG Yuanshu. 2015.
- 山羊血管紧张素转换酶2基因的克隆表达与生物信息学分析
- Clone expression and bioinformatic analysis of angiotensin converting enzyme 2(ACE2)gene from Capra hircus
- 南京农业大学学报, 38(1): 120-126
- Journal of Nanjing Agricultural University, 38(1): 120-126.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.018
-
文章历史
- 收稿日期:2014-02-28
血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)是2000年首次从心衰病人的心脏中发现的肾素-血管紧张素系统(renin angiotensin system,RAS)中的一个新的成员,与Ang(1-7)和Mas受体共同构成ACE2-Ang(1-7)-MasR轴,成为RAS的另一重要分支,该轴能够和经典的ACE-AngⅡ-AT1R作用轴相互对抗,共同维持RAS的平衡[1]。已有的研究证实ACE2主要的功能表现在3个方面:1)通过肽酶活性进行全身或局部RAS系统调节的负调节,通过靶向降解血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ),在心血管系统和很多其他器官中表现出了抗损伤、抗纤维化等保护性作用[2, 3, 4]。2)是SARS冠状病毒的必要受体[5, 6]。在SARS介导的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)中起保护作用,下调ACE2能够强烈导致严重肺衰竭的发病。3)与氨基酸吸收不良、肠道微生态平衡和肠道炎症有关[7]。
目前研究表明,ACE2同RAS的其他成员一样不仅存在于循环系统中,也存在于局部组织器官中,并且ACE2的表达存在物种差异[8]。而目前关于ACE2的研究主要集中在人类和啮齿类动物,有关动物组织中ACE2的定位以及相关功能的数据却非常有限。目前,GenBank上关于ACE2的mRNA序列只有人、牛、大鼠等生物的,未有山羊的序列,并且目前关于ACE2的研究也多是在人医方面的,有关动物方面的研究较少,山羊方面的研究尚属空白。故本试验拟应用RT-PCR技术扩增山羊ACE 2 基因编码区,对其基因进行克隆和序列分析,通过生物信息学分析对其蛋白结构和相应理化性质进行初步预测,同时构建pET-28a-ACE 2 原核表达载体,以表达ACE2蛋白,旨在为ACE2在山羊体内的分布表达、生物学功能等方面的研究奠定基础。
1 材料与方法 1.1 试验材料 1.1.1 试验动物
选取健康萨能奶山羊,颈部放血处死后取肾脏等组织,-70 ℃保存。
1.1.2 主要试剂和仪器DH5α感受态细胞(鼎国昌盛生物技术有限公司,北京),反转录试剂盒(Promega公司),Taq DNA聚合酶(Fermentas,加拿大),BL21(DE3)感受态、高保真聚合酶(诺唯赞生物技术有限公司,南京),胶回收试剂盒(Omega,美国),各种限制性内切酶、T4 DNA连接酶、pMD19-T、Triozal、PCR反转录试剂盒均购自大连TaKaRa公司。
匀浆机(Polytron PT1200CL,瑞士),核酸蛋白浓度测定仪(Eppendorf,德国),Mikro-22R型高速冷冻离心机(Andreas Hettich GmbH8 Co.KG,德国),PCR扩增仪(Biometra,美国),JS-380自动凝胶图像分析仪(上海培清科技有限公司),电泳仪(Bio-Rad,美国)等。
1.2 山羊ACE 2 基因的克隆与序列分析 1.2.1 引物的设计与合成
应用Primer Premier 5.0基因分析软件,根据GenBank上公布的牛ACE 2 基因序列(NM_001024502)自行设计引物,引物序列(F1/R1,5′→3′)为:GATGGGATCTTGGCGTAC/GACTGGGGAGAATCACTGG,产物预期大小为2 954 bp。由南京鼎国生物科技有限公司合成。
1.2.2 RNA的提取及cDNA的合成随机取约100 mg奶山羊肾脏组织,用电动匀浆机彻底匀浆后采用Trizol抽提法提取总RNA,以紫外比色法测定RNA的浓度和纯度。选取质量较高的RNA进行反转录,总体积25 μL,包括2 μg RNA、20 U RNA酶抑制剂、100 U M-MLV反转录酶、5 μL 5×RT Buffer、0.14 mmol · L-1 dNTP、4 μmol · L-1随机引物。反转录采用两步法。以此cDNA为模板进行PCR扩增,扩增体系包括:4 μL反转录产物、4 μL(10 pmol · μL-1)引物、25 μL 2×Phanta Mix、17 μL三蒸水。扩增条件:95 ℃ 3 min;95 ℃ 10 s,57 ℃30 s,72 ℃ 1 min 30 s,35个循环;加入Taq DNA聚合酶1 μL后72 ℃再延伸10 min。
1.2.3 基因克隆及序列分析循环结束后取PCR产物,用10 g ·L-1琼脂糖凝胶电泳,拍照分析。对大小吻合的目的条带的PCR产物按凝胶回收试剂盒的步骤进行合并回收,产物纯化后连接到pMD19-T载体,转化到DH5α感受态细胞,再涂布到含氨苄青霉素的LB平板上,37 ℃倒置培养过夜。培养至阳性克隆菌落出现,挑选出白色单克隆菌落进行PCR鉴定。加样和反应条件与ACE 2 基因的扩增一致。对成功连接载体的菌落送至上海英骏生物技术有限公司测序。
1.2.4 山羊ACE 2 基因的遗传进化分析根据测序结果,用BioEdit软件将得到的山羊ACE 2 基因序列与GenBank中已知的牛、绵羊基因及部分哺乳动物基因序列做同源性比对,并采用Mega 5.0软件绘制分子遗传进化树,分析其遗传进化关系。利用ClustalX 1.83软件进行氨基酸序列比较。
1.2.5 山羊ACE2蛋白结构及理化性质预测分析利用ProtParam tool(http://cn.expasy.org/tools/prot param.html)对编码蛋白的理化性质进行预测。利用SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP-3.0/)和TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行信号肽及跨膜螺旋预测。采用在线软件SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质的二级结构,用SWISS-MODEL(http://swissmodel.expasy.org/interactive)进行蛋白质立体结构的预测分析。
1.2.6 原核表达载体pET-28a-ACE 2 的构建和鉴定根据山羊ACE 2 序列设计如下引物对,F2/R2(5′→3′):CGC GGATCC ATGGCCTCCACCACTGAAGAACAG/GGG AAGCTT CTAGGTGACAGGTGGCTCGTAAG,下线划序列分别为BamHⅠ和Hind Ⅲ酶切位点。扩增的目的片段为山羊ACE 2 mRNA除去跨膜区和信号肽之后的片段,即19~738氨基酸处。以pMD19-T-ACE 2 为模板,用引物F2/R2扩增ACE 2 基因,PCR扩增反应体系和条件参照1.2.2节。PCR产物经过琼脂糖凝胶电泳后利用琼脂糖胶回收试剂盒回收ACE 2 基因。回收产物和原核表达质粒pET-28a均使用BamHⅠ和Hind Ⅲ双酶切,酶切产物纯化回收后利用T4 DNA连接酶连接12 h。连接产物转化大肠杆菌BL21(DE3),涂布含卡那霉素的平板培养基,37 ℃过夜培养。挑取生长出的单个菌落,于LB液体培养基中振荡培养12 h,菌液经PCR鉴定(反应体系和条件参照原PCR反应体系和条件)。鉴定正确的菌落经BamHⅠ和Hind Ⅲ双酶切鉴定后再进行测序鉴定。
1.2.7 重组质粒在大肠杆菌中的表达与检测将测序正确的重组质粒和pET-28a质粒转化进入BL21(DE3)感受态,在1 mL LB液体培养基中培养,37 ℃震荡培养过夜。以1 ∶ 100的体积比将活化的过夜培养物加入4 mL LB液体培养基中,加入4 mL卡那霉素(100 mg · mL-1),37 ℃、200 r · min-1摇床扩大培养约3 h。期间取样监控菌液的A600值,控制菌液A600在0.6~0.8。利用IPTG(终浓度为0.25 mmol · L-1)诱导ACE2蛋白表达,28 ℃震荡培养16 h。
将培养物转移到2 mL的离心管中,5 000 r · min-1离心10 min。取沉淀,加入500 μL的RIPA裂解液悬浮菌体后再加入10 μL溶菌酶(20 mg · mL-1),混匀后置冰上裂解30 min,超声破碎,12 000 r · min-1离心10 min,吸取上清液,沉淀加入100 μL三蒸水稀释。在收集的上清液和沉淀中加入适当体积的5×SDS PAGE电泳缓冲液,用漩涡器剧烈震荡,确保将管底沉淀震散。将样品于100 ℃恒温加热器上加热10 min后,取样品经过80 g · L-1 SDS-PAGE凝胶电泳,考马斯亮蓝染色,脱色后凝胶成像仪拍照。
2 结果与分析 2.1 山羊ACE 2 基因cDNA的扩增与克隆
本试验从山羊肾脏组织中经RT-PCR扩增到大小约3 kb的片段,与预测的ACE 2 基因大小相符(图 1)。
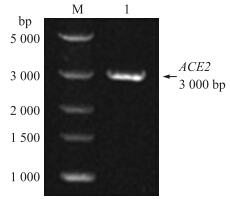 | 图 1 山羊肾脏ACE 2 基因PCR产物电泳图Fig. 1 The electrophoresis of PCR product of ACE 2 gene fragmentsM.DNA标准品DL5000 DNA maker DL5000;1.ACE 2扩增产物ACE2 PCR product |
对目的片段进行回收后连接到pMD19-T载体,转化DH5α感受态细胞,再涂布到含氨苄青霉素的LB平板上,培养后挑选7个阳性菌落进行PCR验证。由图 2可以看出,PCR鉴定插入载体的片段大小(1~7泳道)与RT-PCR扩增片段一致,提示阳性菌落中目的片段插入成功。挑选验证后的阳性菌落送至上海英骏生物技术有限公司测序。
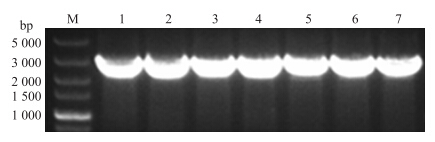 | 图 2 ACE 2 基因阳性菌落验证电泳图Fig. 2 The electrophoresis validation of ACE 2 gene positive coloniesM.DNA标准品DL5000 DNA maker DL5000;1-7.阳性菌落ACE 2 gene positive colonies |
对阳性菌落测序(图 3)结果表明:扩增的山羊ACE 2 基因编码区核苷酸序列长度为2 415 bp,与预期序列长度一致。
 | 图 3 山羊ACE 2 基因测序结果Fig. 3 Result of ACE 2 gene sequences determination in Capra hircus |
运用Bioedit将测定的编码区序列与GenBank上的野猪(Sus scrofa,NM_001123070.1)、牛(Bos taurus,NM_001024502.4)、人(Homo sapiens,NM_021804.2)、家猫(Felis catus,AY957464.1)、绵羊(Ovis aries,XM_004021932.1)、褐家鼠(Rattus norvegicus,NM_001012006.1)、猕猴(Macaca mulatta,NM_001135696.1)、斑马鱼(Danio rerio,NM_001007297.1)、家犬(Canis lupus familiaris,NM_001165260.1)、兔(Oryctolagus cuniculus,XM_002719845.1)的ACE 2 基因序列进行同源性比对。结果表明:以上物种的ACE 2 基因与山羊ACE 2 基因核苷酸序列同源性分别为89%、97%、85%、87%、99%、83%、85%、60%、87%和86%,其中与绵羊的最高,与斑马鱼的最低。
使用Mega 5.0软件构建萨能奶山羊ACE 2 基因序列与上述其他种属动物的基因进化树(图 4)。从基因系统发育树可以看出,ACE 2 基因与绵羊距离最近,与斑马鱼处在两个不同分支上。所得结果与羊在其他基因遗传进化上的规律相符。
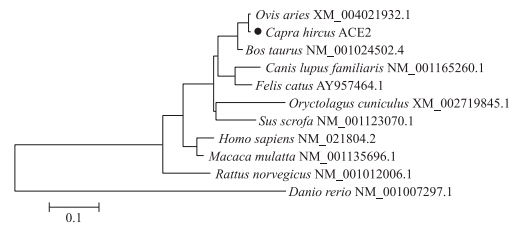 | 图 4 不同种属生物间ACE 2 基因的系统发育树Fig. 4 Biological phylogenetic tree of ACE 2 gene among different species |
将山羊ACE 2 基因所编码蛋白质氨基酸与人、牛、褐家鼠的进行同源性比较,人、褐家鼠有805个氨基酸,山羊与人、褐家鼠相差1个氨基酸,与牛一致有804个氨基酸,且山羊氨基酸组成上与人和褐家鼠有较大差异,与牛较为接近。表明氨基酸进化与基因进化分析结果基本一致,山羊与牛同源性较高,与褐家鼠同源性较低。
2.4 山羊ACE2蛋白的氨基酸同源性分析和结构及理化性质预测分析
利用ProtParam tool程序对山羊ACE 2 基因编码蛋白质理化性质进行分析,显示其分子结构式为C4203H6391N1097O1242S35,理论pI值为5.20,相对分子质量为93 282.6。其负电性氨基酸残基(Asp+Glu)111个,正电性氨基酸残基(Arg+Lys)85个。脂肪系数为76.78,不稳定系数为38.56,属于稳定型蛋白。ACE2在大肠杆菌细胞内的蛋白质半衰期约为10 h,脂溶性指数(aliphatic index)为72.78,总体平均亲水性(grand average of hydropathicity)为-0.462,表明ACE2属于亲水性蛋白质。
利用SignalP 3.0软件对山羊ACE 2 基因编码蛋白进行了信号肽分析,发现在第17~18氨基酸处存在潜在的裂解位点,结合其他预测工具的预测结果,确定山羊ACE2蛋白信号肽序列应该位于第1~18氨基酸之间(图 5)。
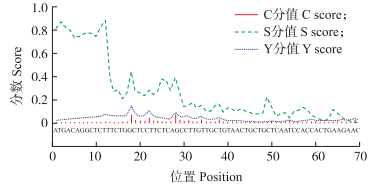 | 图 5 山羊ACE 2 基因信号肽位点分析图Fig. 5 ACE 2 gene locus analysis of signal peptides in Capra hircus |
以TMHMM Server 2.0软件对山羊ACE2蛋白进行跨膜螺旋预测,发现第1~738氨基酸处为胞外区部分,第739~761氨基酸处有1个跨膜螺旋,第762~804氨基酸为胞内部分,说明山羊ACE2蛋白同已鉴定的人等的ACE2蛋白一样属于Ⅰ型跨膜蛋白(图 6)。
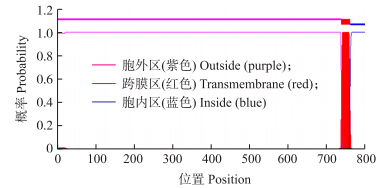 | 图 6 山羊ACE2蛋白跨膜区预测图Fig. 6 The map of ACE2 protein transmembrane helics prediction in Capra hircus |
运用SOPMA软件预测ACE2二级结构,结果表明:ACE2含有52.36%的α螺旋,10.32%的β折叠,4.23%的β转角和33.08%的无规则卷曲。利用SWISS-MODEL对ACE2的三维结构进行在线预测,结果如图 7所示。
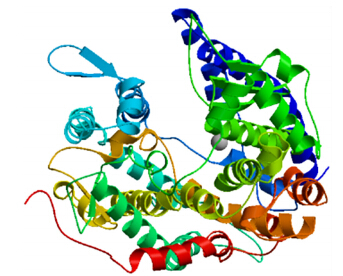 | 图 7 SWISS-MODEL预测的ACE2三维结构图Fig. 7 The tertiary structure of ACE2 was predicted with SWISS-MODEL |
以质粒pMD19-T为模板,用引物F2/R2扩增的PCR产物经过琼脂糖凝胶电泳检测,在2 000~3 000 bp处有一清晰的扩增条带,与预期大小相符(图 8)。经过连接转化并对生长出的单菌落进行酶切验证(图 9),验证正确的进行测序。将测序结果与山羊ACE 2 基因进行比对分析,100%相同的菌落留样保存,说明山羊ACE2原核表达质粒pET-28a-ACE 2 构建成功。
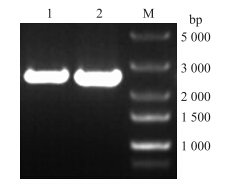 | 图 8 ACE 2 基因扩增电泳图Fig. 8 The electrophoresis result of ACE 2 geneM.DNA标准品DL5000 DNA maker DL5000;1-2.ACE 2扩增产物ACE2 PCR product |
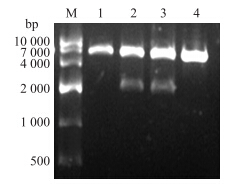 | 图 9 ACE2原核表达载体鉴定电泳图Fig. 9 The electrophoresis result of ACE2 prokaryotic expression carrierM.DNA标准品DL10000 DNA maker DL10000;1-4.pET-28a-ACE 2 酶切产物pET-28a-ACE 2 enzyme digestion product |
质粒pET-28a-ACE 2 按常规方法转化大肠杆菌BL21(DE3),经IPTG诱导的菌体作SDS-PAGE电泳分析。由图 10可以看出:样品pET-28a-ACE 2 菌体沉淀在相对分子质量约90×103处有1条特异性表达带,而空白载体pET-28a则没有此条带,同时在pET-28a-ACE 2 菌体上清液中没有出现明显的条带,说明ACE 2 基因片段在大肠杆菌中获得表达,主要以包涵体的形式存在。
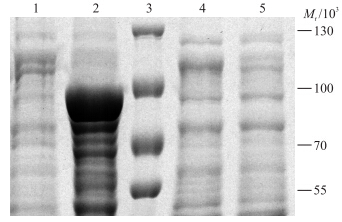 | 图 10 ACE2蛋白的SDS-PAGE电泳图Fig. 10 SDS-PAGE electrophoresis result of ACE2 protein1.pET-28a菌体沉淀Vector pET-28a precipitation;2.pET-28a-ACE 2 菌体沉淀pET-28a-ACE 2 precipitation;3.蛋白标准品Protein maker;4.pET-28a菌体上清液Vector pET-28a supernatant;5.pET-28a-ACE 2 菌体上清液pET-28a-ACE 2 supernatant. |
RAS是心血管和肾脏功能调节的中心环节,通过其经典的ACE-AngⅡ(血管紧张素Ⅱ)-AT1R(血管紧张素Ⅰ型受体)/AT2R(血管紧张素Ⅱ型受体)通路在调节水盐代谢、维持血容量与血管张力以及调控心和肾脏功能等方面功效显著。目前公认RAS的过度激活是导致心血管疾病,应激,心肺、肝脏和乳腺损伤及晚期肾脏疾病的主要原因[3, 4, 9, 10]。血压升高时,肾脏局部组织中ACE和ACE2表达失衡,表现为ACE-AngⅡ-AT1通路的过度活跃,ACE2-Ang(1-7)-Mas通路相对不足。目前对RAS中关键因子的调节成为心、肾等疾病治疗中备受关注的研究方向[11]。
血管紧张素转化酶(angiotensin converting enzyme,ACE)和AngⅡ一直占据了RAS的核心地位,直到2000年两个研究小组相继证实,在体内不仅存在ACE,还存在ACE2[12, 13]。目前的研究[2, 5, 6, 7]已证实ACE2在正常的心脏、肺、肝、肾、胃肠道等组织中表达量均较低,其主要参与了许多特殊生理或病理情况下的抗损伤作用。Hashimoto等[7]研究发现:肠道色氨酸转运吸收是通过B0AT1/ACE2转运通路在小肠上皮细胞刷状缘吸收,ACE2在肠道炎症,尤其是氨基酸缺乏导致的营养不良症中可能具有一定的作用。已被证实ACE2可以分别水解AngⅠ和Ang Ⅱ生成Ang(1-9)和Ang(1-7)[12, 13]。后者通过其受体Mas拮抗Ang Ⅱ的负面效应,诱导内皮细胞释放NO,减少活性氮,减轻氧化应激,从而实现对组织的保护作用[14]。ACE2在心肌损伤、肺损伤、糖尿病肾损伤、肝脏损伤及SARA引起的肺损伤以及肠道腹泻炎症[2, 3, 4, 7, 10]等病理过程中的抗损伤作用已被证实。ACE2成为一个新的疾病标志物和药物治疗新靶点在人类医学上已受到关注,成为研究热点。
哺乳动物的ACE2具有相似的结构,它包含1个由大约17个氨基酸组成的N端信号肽区域,1个含有单一活性位点(HEMGH)的催化区域,以及位于C端的膜锚定区域和42个氨基酸组成的细胞质短区域组成。ACE2的N端金属蛋白酶催化区与ACE的胞外催化结构域有41.8%的同源性,而C端序列与Collectrin的C端有47.8%的同源性。不包含羧肽酶催化区的Collectrin不具备催化功能,而缺失跨膜和胞内结构的ACE2也失去了参与中性氨基酸转运的功能。ACE2蛋白结构与它的功能息息相关。
Donoghue等[13]首次克隆了人类ACE 2 全长cDNA并报道了其序列;2005年,王冲等[15]成功克隆家猫ACE 2 基因序列。同年,Harhay等[16]和Li等[17]分别将牛和果子狸的ACE 2 基因全长测出;Chen等[18]完成了猕猴ACE 2 基因克隆的工作。至今,已有包括家犬、家蚕、野猪、鲫鱼、褐家鼠等十多种动物的ACE 2 基因被相继克隆成功,但尚缺乏山羊ACE 2 的序列资料。本试验首次成功克隆出了萨能奶山羊ACE 2 基因编码区,与GenBank公布的其预测序列进行比对,其同源性均高于99%。本研究也对扩增出的山羊ACE 2 基因编码区核苷酸序列进行了鉴定,其编码区核苷酸长度及其所编码的蛋白质序列的长度与GenBank上预测的绵羊ACE 2 长度完全一致。综上,本研究扩增得到了山羊的ACE 2 基因。根据测得的山羊ACE 2 序列,构建pET-28a-ACE 2 重组质粒,表达ACE2胞外区蛋白,pET-28a-ACE 2 在大肠杆菌中得到了高效的表达,并且大部分以包涵体的形式表达。
| [1] | Santos R A S,Simoese S A C,Maric C,et al. Angiotensin-(1-7)is an endogenous ligand for the G protein-coupled receptor Mas[J]. Proc Natl Acad Sci USA,2003,100:8258-8263 |
| [2] | Crackower M A,Sarao R,Oudit G Y,et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function[J]. Nature,2002,417:822-828 |
| [3] | Zhang W,Miao J F,Li P F,et al. Up-regulation of components of the renin-angiotensin system in liver fibrosis in the rat induced by CCL4[J]. Research in Veterinary Science,2013,95(1):54-58 |
| [4] | Liu C X,Hu Q,Wang Y,et al. Angiotensin-converting enzyme(ACE)2 overexpression ameliorates glomerular injury in a rat model of diabetic nephropathy:a comparison with ACE inhibition[J]. Molecular Medicine,2011,17(1/2):59-69 |
| [5] | Li W H,Moore M J,Vasilieva N,et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature,2003,426:450-454 |
| [6] | Li F,Li W,Farzan M,et al. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor[J]. Science,2005,309:1864-1868 |
| [7] | Hashimoto T,Perlot T,Rehman A,et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J]. Nature,2012,487:477-481 |
| [8] | Singer D,Camargo S M. Collectrin and ACE2 in renal and intestinal amino acid transport[J]. Channels,2011,5(5):410-423 |
| [9] | Vinson G P,Barker S,Puddefoot J R. The renin-angiotensin system in the breast and breast cancer[J]. Endocrine-related Cancer,2012,19(1):R1-R19 |
| [10] | Lambert D W,Hooper N M,Turner A J. Angiotensin-converting enzyme 2 and new insights into the renin-angiotensin system[J]. Biochemical Pharmacology,2008,75(4):781-786 |
| [11] | 李鹏飞,苗晋锋,马畅,等. ACE和ACE2在自发性高血压大鼠肾脏中的表达与作用分析[J]. 南京农业大学学报,2011,34(4):85-88. doi:10.7685/j.issn.1000-2030.2011.04.015 [Li P F,Miao J F,Ma C,et al. Expression and analysis of ACE and ACE2 in the kidney of spontaneously hypertensive rats[J]. Journal of Nanjing Agricultural University,2011,34(4):85-88(in Chinese with English abstract)] |
| [12] | Tipnis S R,Hooper N M,Hyde R,et al. A Human Homolog of Angiotensin-converting Enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. J Biol Chem,2000,275(43):33238-33243 |
| [13] | Donoghue M,Hsieh F,Baronas E,et al. A novel angiotensin-converting enzyme-related carboxypeptidase(ACE2)converts angiotensinⅠto angiotensin1-9[J]. Cire Res,2000,87(5):E1-E9 |
| [14] | Briones A M,Touyz R M. Oxidative stress and hypertension:current concepts[J]. Current Hypertension Reports,2010,12(2):135-142 |
| [15] | 王冲,谭亚娣,郭爱珍,等. 家猫ACE2基因克隆、测序及生物信息学分析[J]. 武汉大学学报:理学版,2005,51(6):739-743 [Wang C,Tan Y D,Guo A Z. Clone sequence and bioinformatic analysis of angiotensin converting enzyme 2(ACE2)gene from Felis catus[J]. J Wuhan Univ:Nat Sci Ed,2005,51(6):739-743(in Chinese with English abstract)] |
| [16] | Harhay G P,Sonstegard T S,Keele J W,et al. Characterization of 954 bovine full-CDS cDNA sequences[J]. BMC Genomics,2005,6:166 |
| [17] | Li W H,Zhang C,Sui J,et al. Receptor and viral determinants of SARS-coronavirus adaptation to human ACE2[J]. The EMBO Journal,2005,24(8):1634-1643 |
| [18] | Chen Y,Liu L,Wei Q,et al. Rhesus angiotensin converting enzyme 2 supports entry of severe acute respiratory syndrome coronavirus in Chinese macaques[J]. Virology,2008,381(1):89-97 |




