文章信息
- 李荣佳, 李治忠, 周闯, 司慧民, 吴文达, 张海彬. 2015.
- LI Rongjia, LI Zhizhong, ZHOU Chuang, SI Huimin, WU Wenda, ZHANG Haibin. 2015.
- 新型复合吸附剂HG对黄曲霉毒素B1和呕吐毒素的吸附脱毒研究
- Detoxification of aflatoxin B1and deoxynivalenol by new compound adsorbent HG
- 南京农业大学学报, 38(1): 113-119
- Journal of Nanjing Agricultural University, 38(1): 113-119.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.017
-
文章历史
- 收稿日期:2014-05-17
黄曲霉毒素B1(aflatoxin B1,AFB1)和呕吐毒素(deoxynivalenol,DON)分别是由黄曲霉菌和禾谷镰刀菌产生的次级代谢产物,他们广泛存在于饲料中,危害人类和动物的健康。动物的黄曲霉毒素中毒症状主要是采食率下降、胃肠紊乱、贫血、黄疸,严重的会出现肝脏癌变甚至死亡[1]。王金勇[2]调查显示,东南亚地区的黄曲霉毒素阳性检出率从2010年的65%增长到2011年的71%,平均污染水平从2010年的22 μg · kg-1增长至42 μg · kg-1。Eskandari等[3]于2013年研究发现,伊朗国内饲料中广泛存在黄曲霉毒素;Asai等[4]在胆囊癌发病率较高的玻利维亚和秘鲁地区的调查研究中发现,红辣椒中出现了黄曲霉毒素污染,并认为这是重要的致病因素。DON的中毒症状主要是引起动物的呕吐反应、拒食、腹泻,可引起细胞凋亡和神经毒性。靳露等[5]研究表明DON还可引发免疫和繁殖机能的衰退,严重的可导致死亡。DON在饲料中的污染更为严重,在北亚地区,其检出率为83%,平均污染水平782 μg · kg-1;2011年澳大利亚田间DON检出率为49%[2]。
水合硅铝酸钠钙(HSCAS),是指任何相对纯净的含有一定水分和少量钠、钙(可交换阳离子的形式或可溶性盐出现)的硅铝酸盐类物质。杨晓建[6]报道,HSCAS中铝离子的边缘位点可与黄曲霉毒素的β-羰基形成复合物,故HSCAS易与含β-酮内酯或α-二内酯的化合物(如B族和G族黄曲霉毒素)结合形成稳定的复合物。由此推测,化学吸附和降解可能是HSCAS具有脱毒性能的作用机制。Spotti等[7]报道在水或瘤胃液中,HSCAS对AFB1吸附率达100%。葡甘露聚糖(GM)是一种多糖,具有多孔、比表面积大等特点[8]。Raju等[9]认为GM可捕获AFB1,从而阻止胃肠道对毒素的吸收,以达到解毒的效果。由于GM能吸附多种霉菌毒素,吸附速度也较快,而且在不同的pH值范围内稳定性高,因而是一种广泛应用的霉菌毒素脱毒剂。Swamy等[10]将1 g · kg-1的GM聚合物添加到被AFB1污染的日粮中,结果AFB1的毒性受到了抑制,猪的饲料采食量和日增体质量都显著提高。
本试验主要是以HSCAS为基础,配合GM制备成一种新型复合吸附剂HG,通过体外吸附试验和体内脱毒试验,研究HG对AFB1和DON的吸附能力,为解决饲料中霉菌毒素的污染问题,实现畜产品的安全生产和为霉菌毒素脱毒剂的开发提供理论依据。
1 材料与方法 1.1 试验材料与仪器设备
水合硅酸铝钠钙(潍坊雍联膨润土有限公司);魔芋葡甘露聚糖精粉(北京华迈科生物技术有限责任公司)。HG:将上述两种物质按一定比例合理配伍。1日龄来航蛋雏鸡,购自南京市江宁区青龙山动物繁殖场。
Aflatoxin B1、Deoxynivalenol标准品(Sigma公司);AFB1、DON的免疫亲和柱(R · BIOPHARM,德国拜发公司);日本岛津LC-20AT型高效液相色谱仪、SPD-20A紫外检测器、RF-10AXL荧光检测器、色谱柱(Inertsil ODS-3V,150 mm×4.6 mm,5 μm和Inertsil ODS-SP,250 mm×4.6 mm,5 μm);YS-200Ⅱ型半自动生化分析仪(深圳越华科技有限公司);721可见分光光度计(上海菁华科技有限公司)。各种检测试剂盒购自上海东湖生物医学有限公司。饲料由南京某饲料有限公司提供,其营养原料配比符合国家标准。
1.2 AFB1和DON的含量测定 1.2.1 AFB1测定方法
取AFB1标准品1 mg,用甲醇1 mL溶于棕色瓶中,配成1 mg · mL-1的母液。取适量母液,用甲醇稀释配制成不同质量浓度的工作液。取1 mL工作液,0.45 μm滤膜过滤,高效液相色谱检测。色谱条件:inertsil ODS-3V C18色谱柱,流动相为甲醇-水(体积比50 ∶ 50);流速0.5 mL · min-1;进样量20 μL;荧光激发波长365 nm,发射波长435 nm;柱温40 ℃。
1.2.2 DON测定方法取DON标准品1 mg,用1 mL乙腈溶于棕色瓶中,配成浓度为1 mg · mL-1的母液。取适量母液,用乙腈稀释配制成不同浓度的工作液。取1 mL工作液,过0.45 μm滤膜,高效液相色谱检测。色谱条件:inertsil ODS-SP C18色谱柱,流动相为乙腈-水(体积比16 ∶ 84);流速0.8 mL · min-1;进样量20 μL;紫外光检测波长218 nm;柱温30 ℃[11]。
1.3 HG对AFB1的吸附试验 1.3.1 等温吸附试验
取2.0 mg HG于5 mL带塞离心管中,用AFB1质量浓度分别为0.4、0.8、1.2、1.6和2.0 μg · mL-1的磷酸盐缓冲液(PBS,pH 7.0)定容至2 mL,于37 ℃恒温振荡水浴锅中,按120 r · min-1振荡吸附60 min。吸附反应结束后于10 000 r · min-1离心10 min。取1 mL上清液过0.45 μm滤膜后经HPLC测定AFB1浓度。每次2个重复。同时设置没有添加HG的PBS作为空白对照。按下式计算吸附量(q,μg · mg-1)和吸附率(Y,%)[12]:
q=V(C1-C2)/m,Y=100(C1-C2)/C1。
式中:V是溶液的体积(mL);m为吸附剂的质量(mg);C1、C2是吸附反应前后黄曲霉毒素的质量浓度(μg · mL-1)。以吸附反应体系中AFB1平衡浓度为横坐标,AFB1平衡浓度与吸附量的比值为纵坐标,绘制pH 7.0的等温吸附曲线,使用Origi软件中的Langmuir方程和Freundlich方程对曲线进行拟合。
Langmuir方程的表达式为:Cr/Ca=Cr/K1+1/(K1×K2)。
式中:Ca是吸附剂对黄曲霉毒素的单位吸附量(μg · g-1);Cr是平衡溶液中黄曲霉毒素的含量;K1是吸附容量常数(ng · mg-1或μg · mg-1),即最大吸附量;K2是亲和常数(mL · ng-1或mL · μg-1),表示吸附剂对毒素的吸附程度。Freundlich方程的表达式为:Ca=KCrn。
式中:K、n是Freundlich常数,K是与吸附能力有关的常数(ng · mg-1或μg · mg-1),n是与吸附强度有关的常数(mL · ng-1或mL · μg-1)。 1.3.2 不同pH值下HG对AFB1的吸附试验取2.0 mg HG于5 mL带塞离心管中,用AFB1质量浓度为1.0 μg · mL-1的PBS(pH值分别为3.0、5.0、7.0、9.0和11.0)定容至2 mL,置于37 ℃恒温振荡水浴锅中,按120 r · min-1振荡吸附60 min,每隔5 min振摇混匀1次。吸附反应结束后于10 000 r · min-1离心10 min,取1 mL上清液过0.45 μm滤膜后用HPLC测定AFB1质量浓度。
1.4 HG对DON的吸附试验 1.4.1 等温吸附试验用PBS(pH 7.0)稀释的DON质量浓度分别为2.0、4.0、6.0、8.0和10.0 μg · mL-1,其他条件同1.3.1节。
1.4.2 不同pH值下HG对DON的吸附试验吸附试验中的DON质量浓度为5.0 μg · mL-1,其他测定步骤同1.3.2节。
1.5 动物试验
选取150只质量相近、健康的蛋雏鸡(1日龄),饲喂常规饲料1周,在8日龄时,随机选取其中120只分为4个处理组,每个处理组3个重复,每个重复10只鸡。分别饲喂正常饲料(对照组)、霉变饲料(污染组)、正常饲料+0.5%HG(处理组1)、霉变饲料+0.5%HG(处理组2)。饲养方式采用层叠式笼养,自由采食和饮水。饲养至28日龄结束。饲养期间,每天观察鸡群生长状态,记录异常情况。
霉变饲料的制备:取一定量的正常饲料,不含主要霉菌毒素,调节含水量到30%左右,搅拌混匀,分次经121 ℃、10 min高压蒸汽灭菌后冷却至室温。均匀平铺在密封培养室内地面上,将含有黄曲霉菌孢子和镰刀菌孢子的菌悬液均匀地洒在饲料表面,保持室内温度在37 ℃左右,每天搅拌1次,保证氧气供应,以利于霉菌生长。霉变时间15 d。霉变结束后经高压灭菌、晒干、混合,最后密封备用。取霉变饲料少量,提取,纯化,过柱,HPLC测得AFB1和DON含量分别为169 μg · kg-1和2 800 μg · kg-1。
1.6 测定指标和方法 1.6.1 试验样品的采集与处理
饲养试验结束后,从每个重复中随机挑选试验鸡3只,共36只,自由饮水,禁食12 h。称活体体质量后,采取血样,然后屠宰,取肝、肾和免疫器官后称质量,计算肝脏和肾脏的器官指数和免疫器官指数。
1.6.2 血清中酶活性的测定天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)活性按试剂盒说明,于半自动生化分析仪上测定。
1.6.3 抗氧化指标超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的测定血清和肝脏中SOD活性、MDA含量测定均按试剂盒说明书用分光光度计进行测定。
1.6.4 血清中总蛋白(TP)和白蛋白(ALB)的测定血清总蛋白和白蛋白含量测定按试剂盒说明书的操作步骤进行。 1.7 数据统计与分析
数据经Excel 2010处理后,利用SPSS 20.0统计软件进行单因素方差分析和Duncan′s多重比较。试验数值均以平均数±标准差(x±SD)表示。
2 结果与分析
2.1 HG对AFB1和DON的等温吸附结果 2.1.1 反应体系AFB1和DON平衡浓度与吸附量关系
以吸附反应体系中的AFB1和DON平衡浓度分别对AFB1和DON的吸附量作图,分别得pH 7.0下HG对AFB1(图 1-A)和DON(图 1-B)的等温吸附曲线图。其等温吸附曲线呈非线性相关。用Langmuir方程拟合,HG对AFB1的等温吸附方程为Cr/Ca=0.000 308Cr+0.000 066,K1=3 243.2 μg · g-1,最大吸附量为3 243.2 μg · g-1(R2=0.96)。用Freundlich方程拟合,HG对AFB1的等温吸附方程为y=4 267.51x0.63(R2=0.92)。
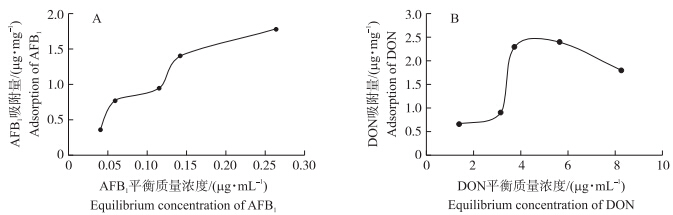 | 图 1 HG对AFB1(A)和DON(B)的等温吸附曲线(pH 7.0)Fig. 1 Adsorption isotherms of AFB1(A)and DON(B)on adsorbent HG |
由计算可得,HG对AFB1的平均吸附率为90.24%。在AFB1的平衡质量浓度为2.0 μg · mL-1时,HG对AFB1的饱和吸附量可达1.74 μg · mg-1。
HG对DON的等温吸附曲线呈非线性,不符合Langmuir方程和Freundlich方程。经计算,HG对DON的平均吸附率为28.08%。
2.1.2 反应体系AFB1和DON初始浓度与吸附量关系由吸附反应体系中初始浓度对AFB1和DON吸附量作图。由图 2-A可知:HG对AFB1的吸附量(y)随AFB1初始浓度(x)增加而增加,并呈直线相关。pH 7.0时,y=0.866 8x+0.036(R2=0.997 3)。由图 2-B可知,DON初始浓度与吸附量不符合线性关系,无任何规律。
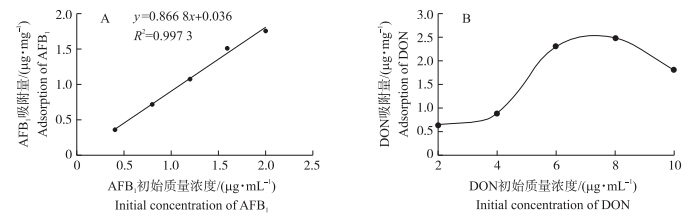 | 图 2 初始浓度对HG吸附AFB1(A)和DON(B)的影响Fig. 2 The effects of initial concentration on the adsorption of AFB1(A)and DON(B)on adsorbent HG |
由图 3可知:HG对AFB1的吸附量随pH值的增大而增加,但增加趋势不是太高,在碱性条件下比酸性条件吸附量较多。经计算,碱性条件下HG对AFB1的吸附率比在酸性条件下提高了20.02%。DON的吸附量随pH值的增大而增加,在碱性条件下比酸性条件下增加了17.80%。
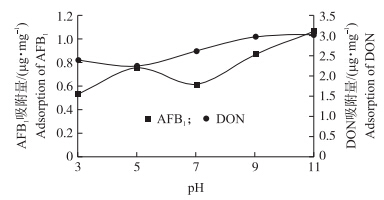 | 图 3 不同pH值对HG吸附AFB1和DON的影响Fig. 3 The effect of different pH value on the adsorption of AFB1 and DON on adsorbent HG |
由表 1可知:7至28日龄饲养期间,各组的平均日增体质量之间无显著差异(P>0.05),日采食量与饲料转化率同样差异不显著。结果表明在本试验中低剂量AFB1和DON污染的霉变饲料对雏鸡的生长性能影响较小。同时,HG对雏鸡的生长性能也没有影响。
| 组别 Groups | 平均日增体质量/(g·d-1) Average daily gain | 平均日采食量/(g·d-1) Average daily feed intake | 饲料转化率/% Feed conversion rate |
| 对照组(正常饲料)Control(Normal feed) | 6.46±0.52a | 16.86±0.08a | 2.61±0.08a |
| 污染组(霉变饲料)Contaminated(Moldy feed) | 6.25±0.75a | 17.44±0.11a | 2.79±0.06ab |
| 处理组1(正常饲料+0.5%HG)Treatment 1(Normal feed and 0.5% HG) | 6.58±0.62a | 17.11±0.11a | 2.60±0.04a |
| 处理组2(霉变饲料+0.5%HG)Treatment 2(Moldy feed and 0.5% HG) | 6.60±0.51ab | 17.95±0.07a | 2.72±0.11ab |
| 注: 同列右肩标字母不同者表示差异显著(P<0.05)。Means within a column with different superscript letters are significant difference at 0.05 level. The same as follows. | |||
由表 2可见:处理组1、处理组2与对照组之间,肝脏与肾脏指数均无显著性差异(P>0.05);而污染组较对照组、处理组1、处理组2均显著增大(P<0.05)。较对照组和处理组2,污染组肝脏分别增大了9.63%和8.95%,肾脏则分别增加了14.08%和8.00%。
| 组别 Groups | 脏器指数 Organ index | 免疫器官指数Immunity organ index | |||
| 肝脏 Liver | 肾脏 Kidney | 脾脏Spleen | 胸腺Thymus | 法氏囊Fabricius | |
| 对照组Control | 3.22±0.24b | 1.42±0.17b | 0.16±0.03b | 0.57±0.08a | 0.51±0.08a |
| 污染组Contaminated | 3.53±0.35a | 1.62±0.14a | 0.21±0.08a | 0.45±0.11b | 0.42±0.06b |
| 处理组1 Treatment 1 | 3.25±0.15b | 1.47±0.09b | 0.16±0.04b | 0.58±0.11a | 0.50±0.04a |
| 处理组2 Treatment 2 | 3.24±0.27b | 1.50±0.04b | 0.16±0.02b | 0.47±0.07b | 0.49±0.11a |
| 注:脏器指数、免疫器官指数=器官质量/100 g体质量。Organ index or immunity organ index=organ mass/100 g body mass. | |||||
处理组1、处理组2与对照组之间,脾脏、法氏囊的器官指数均无显著性差异(P>0.05);而污染组与对照组、处理组1、处理组2之间,脾脏、法氏囊指数均有显著性差异(P<0.05)。较对照组和处理组2,污染组脾脏指数均增加了31.25%,而法氏囊指数则分别减小了17.65%和14.29%。处理组1与对照组之间、处理组2与污染组之间胸腺指数差异均不显著,且处理组2、污染组较对照组分别减少了17.54%和21.05%。
以上结果说明,霉变饲料可引起肝脏、肾脏、脾脏发生一定程度的肿胀,而加入0.5%的HG,肝脏、肾脏和脾脏的肿胀程度得到显著改善,起到了一定的保护作用。同时,在正常饲料中加入HG不会对肝脏和肾脏造成影响。霉变饲料使得胸腺和法氏囊发生萎缩,添加0.5%的HG对法氏囊萎缩起到了一定保护作用,有显著改善,但对胸腺的萎缩仅有轻微缓解,没有达到正常组水平。
2.4 HG吸附对血清中总蛋白和白蛋白含量的影响
由表 3可见:污染组与对照组、处理组2之间,总蛋白含量均有显著差异(P<0.05),但与处理组1差异不显著;污染组与对照组、处理组1、处理组2之间,白蛋白含量均有显著性差异(P<0.05),而处理组1、处理组2与对照组之间,白蛋白含量则差异不显著(P<0.05)。污染组的总蛋白含量较对照组、处理组2分别降低了13.93%和15.03%(P<0.05),白蛋白含量较对照组、 处理组2分别降低了20.12% 和16.65%(P<0.05)。| g · L-1 | ||
| 组别 Groups | 总蛋白含量 Total protein content | 白蛋白含量 Albumin content |
| 对照组Control | 25.56±1.81a | 13.22±1.64a |
| 污染组Contaminated | 22.00±2.96b | 10.56±1.81b |
| 处理组1 Treatment 1 | 24.00±2.55ab | 13.00±1.66a |
| 处理组2 Treatment 2 | 25.89±2.47a | 12.67±1.32a |
由此可见,霉变饲料可使血清中总蛋白、白蛋白含量减少,而在霉变饲料中加入0.5%的HG使得总蛋白、白蛋白含量增加,基本恢复到了正常的水平。在正常饲料中加入0.5%的HG,血清中总蛋白含量相比正常水平有一定的减少,但差异不显著。
2.5 HG吸附对血清中酶活性的影响
由表 4可见:各组对AST活性均无显著影响。污染组的另3种血清酶则显著高于对照组(P<0.05)。处理组1、处理组2中酶活性较污染组有不同程度的改善,其中ALT活性分别下降了10.63%和8.66%,AKP活性分别下降了14.4%和31.14%,而LDH活性则分别下降了17.17%和10.73%。
| 组别 Groups | 酶活性/(IU·L-1)Enyme activities | |||
| ALT | AST | AKP | LDH | |
| 对照组Control | 374.18±30.79b | 7.33±3.81a | 1334.67±357.47b | 3432.89±659.84c |
| 污染组Contaminated | 448.01±42.23a | 10.22±5.56a | 2037.33±654.25a | 4695.67±387.22a |
| 处理组1 Treatment 1 | 400.38±46.91b | 7.00±5.92a | 1743.89±743.44ab | 3889.62±802.61bc |
| 处理组2 Treatment 2 | 409.20±15.71b | 7.44±2.92a | 1402.89±239.65b | 4192.02±1010.37ab |
| 注: ALT:丙氨酸氨基转移酶Alanine aminotransferase;AST:天门冬氨酸氨基转移酶Aspartate aminotransferase;AKP:碱性磷酸酶Alkaline phosphatase;LDH:乳酸脱氢酶Lactate dehydrogenase | ||||
从血清中酶活性的变化可看出,在霉变饲料中添加0.5%的HG显著改善了霉变饲料引起的血清酶活性变化。在正常饲料中添加0.5%的HG对血清中酶活性没有显著影响,表明HG对肝脏没有损伤作用。
2.6 HG吸附对抗氧化指标的影响由表 5可看出:污染组中SOD活性显著低于对照组、处理组1和处理组2(P<0.05),MDA含量显著高于对照组、处理组1、处理组2(P<0.05)。污染组MDA含量较对照组、处理组2分别提高了24.41%和14.25%。霉变饲料显著降低了鸡血清中SOD的活性,使得MDA含量明显提高。在霉变饲料中添加0.5% HG显著改善毒素对其的影响,基本恢复到了正常水平。
| 组别 Groups | SOD活性/(U·mL-1) SOD activity | MDA含量/(nmol·L-1) MDA content |
| 对照组Control | 120.50±6.92a | 17.66±1.44b |
| 污染组Contaminated | 110.60±4.84b | 21.97±2.53a |
| 处理组1 Treatment 1 | 121.08±6.34a | 18.29±3.82b |
| 处理组2 Treatment 2 | 118.42±11.15a | 19.23±1.98b |
试验结果表明:HSCAS和GM以一定比例配比时,二者能很好的结合,提高了吸附能力,而且HG对AFB1具有良好的吸附能力。Langmuir方程和Freundlich方程是研究等温吸附的两种不同方程。其中,Langmuir方程能较好地反映单分子层吸附,Freundhch方程能更好地反映多分子层吸附。从本试验中看出:HG对AFB1的吸附既符合Langmuir方程,也符合Freundlich方程,但Langmuir方程的相关系数高于Freundlich方程的相关系数,因此在对AFB1的吸附中,单分子层的吸附可能占主导地位。本试验中,碱性条件下HG对AFB1的吸附率比在酸性条件下提高了20.02%。HSCAS本身表面带负电荷,当溶液中的pH值较低时,H+浓度较高,H+与HSCAS结合,占据了一定的吸附位点,H+和AFB1之间存在吸附竞争效应。随着pH值的增加,H+的竞争减弱,使得AFB1的吸附量增加。碱性条件下HG对AFB1的吸附量比在酸性条件下高一些,推测HG如果在胃酸性环境中吸附AFB1后不会因进入肠道的碱性环境而解吸。
本试验中,HG对DON的吸附不符合Langmuir方程和Freundlich方程,可能存在其他的吸附机制。选用HSCAS和GM配制,目的是使HG在吸附AFB1的同时,也能有效地吸附DON,增加吸附毒素的能力。本试验中,HG对DON的吸附率是28.08%,吸附效果较好,但实际生产中还需进一步改进。Giuseppina等[13]模拟胃肠道模型研究吸附材料对DON和雪腐镰刀菌烯醇(nivalenol,NIV)的吸附时指出,大多数吸附材料对毒素的吸附发生在空肠部分。这与本试验中测得的HG对DON的吸附在碱性条件下比在酸性条件下高一些相符合,说明HG在碱性环境中即肠道中对毒素的吸附占有很大比例。
肝脏是机体主要的解毒器官,而AFB1的主要作用器官就是肝脏。AFB1在肝脏中被细胞色素P450代谢为AFB1环氧化物,该物质可与DNA碱基,如鸟嘌呤相结合,成为DNA加合物,使DNA发生改变[14]。当肝脏机能受损后,胞内酶大量释放到血液中,导致血清中酶活性明显升高;同时肝脏受损会影响蛋白的合成,由此AST、ALT、总蛋白以及白蛋白含量是反映肝功能是否正常的重要指标。另外,AKP、LDH活性变化也可衡量肝功能的正常与否。本试验霉变饲料污染组中的AST、AKP、LDH活性都有不同程度地升高,总蛋白及白蛋白数量下降明显,说明霉菌毒素对肝脏损伤较重,影响了肝脏正常合成蛋白。
SOD与MDA是体内反映氧化应激的特异性指标[15]。SOD是生物体内清除活性氧(ROS)的首要物质,其活性升高,可在一定程度内抵抗ROS对细胞造成的氧化应激,但当ROS产生过多时,SOD便不再有保护作用[16]。ROS作用于脂质即可发生脂质过氧化反应,氧化终产物为MDA,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。目前已知AFB1和DON都可引起氧化应激反应[17, 18],虽然他们诱导氧化应激的通路仍不清晰。试验中污染组中霉菌毒素使得动物机体内SOD活性降低,MDA含量升高。在霉变饲料中加入HG的处理组改善了这一情况,保护了机体避免受到霉菌毒素对其的过氧化作用伤害。
| [1] | 庄振宏,张峰,李燕云,等. 黄曲霉毒素致癌机理的研究进展[J]. 湖北农业科学,2011,50(8):1522-1525 [Zhuang Z H,Zhang F,Li Y Y,et al. The progress on the carcinogenesis mechanism of aflatoxins[J]. Hubei Agricultural Sciences,2011,50(8):1522-1525(in Chinese with English abstract)] |
| [2] | 王金勇. 2011年全球霉菌毒素调查报告[J]. 中国畜牧杂志,2012,48(14):49-52 [Wang J Y. 2011 survey of global mycotoxins[J]. Chinese Journal of Animal Science,2012,48(14):49-52(in Chinese)] |
| [3] | Eskandari M H,Pakfetrat S. Aflatoxins and heavy metals in animal feed in Iran[J]. Food Additives and Contaminants:Part B,2014,7(3):202-207 |
| [4] | Asai T,Tsuchiya Y,Okano K,et al. Aflatoxin contamination of red chili pepper from Bolivia and Peru,countries with high gallbladder cancer incidence rates[J]. Asian Pac J Cancer Prev,2012,13(10):5167-5170 |
| [5] | 靳露,董国忠. 呕吐毒素对动物免疫及繁殖性能的影响[J]. 饲料研究,2012(3):18-21 [Jin L,Dong G Z. The effect of vomiting toxin on animals immunity and reproductive performance[J]. Feed Research,2012(3):18-21(in Chinese)] |
| [6] | 杨晓建. 水合硅铝酸钙钠与黄曲霉毒素[J]. 广东畜牧兽医科技,1995,20(1):4-5 [Yang X J. Hydrated sodium calcium aluminosilicate and aflatoxins[J]. Guangdong Journal of Animal and Veterinary Science,1995,20(1):4-5(in Chinese)] |
| [7] | Spotti M,Fracchiolla M L,Arioli F,et al. Aflatoxin B1 binding to sorbents in bovine ruminal fluid[J]. Veterinary Research Communications,2005,29(6):507-515 |
| [8] | 于宗民. 酯化葡甘露聚糖对黄曲霉毒素B1吸附能力的研究[D]. 青岛:青岛农业大学,2007 [Yu Z M. The study of the ability of esterified glucomannan adsorpts aflatoxin B1[D]. Qingdao:Qingdao Agricultural University,2007(in Chinese with English abstract)] |
| [9] | Raju M V L N,Devegowda G. Influence of esterified-glucomannan on performance and organ morphology,serum biochemistry and hematology in broilers exposed to individual and combined mycotoxicosis(aflatoxin,ochratoxin and T-2 toxin)[J]. British Poultry Science,2000,41:640-650 |
| [10] | Swamy H,Smith T K,McDonald E J,et al. Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on swine performance,brain regional neurochemistry,and serum chemistry and the efficacy of a polymeric glucomannan mycotoxin adsorbent[J]. Journal of Animal Science,2002,80(12):3257-3267 |
| [11] | 班晓敏. AFB1、OTA、DON高效液相色谱检测方法的优化和应用[D]. 南京:南京农业大学,2012 [Ban X M. Optimization and application of high performance liquid chromatography detection methods for AFB1,OTA,DON[D]. Nanjing:Nanjing Agricultural University,2012(in Chinese with English abstract)] |
| [12] | Ramos A J,Hernandez E. In vitro aflatoxin adsorption by means of a montmorillonite silicate. A study of adsorption isotherms[J]. Animal Feed Science and Technology,1996,62(2):263-269 |
| [13] | Giuseppina A,Robert H,Angelo V. Evaluation of the intestinal absorption of deoxynivalenol and nivalenol by an in vitro gastrointestinal model,and the binding efficacy of activated carbon and other adsorbent materials[J]. Food and Chemical Toxicology,2004,42:817-824 |
| [14] | Guengerich F P. Cytochrome P450s and other enzymes in drug metabolism and toxicity[J]. The AAPS Journal,2006,8(1):101-111 |
| [15] | Valavanidis A,Vlahogianni T,Dassenakis M,et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants[J]. Ecotoxicology and Environmental Safety,2006,64(2):178-189 |
| [16] | Omar H E D M. Mycotoxins-induced oxidative stress and disease[J]. Mycotoxin and Food Safety in Developing Countries,2013,3:63-92 |
| [17] | Bernabucci U,Colavecchia L,Danieli P P,et al. Aflatoxin B1 and fumonisin B1 affect the oxidative status of bovine peripheral blood mononuclear cells[J]. Toxicology in vitro,2011,25(3):684-691 |
| [18] | Sanden M,Jørgensen S,Hemre G I,et al. Zebrafish(Danio rerio)as a model for investigating dietary toxic effects of deoxynivalenol contamination in aquaculture feeds[J]. Food and Chemical Toxicology,2012,50(12):4441-4448 |




