文章信息
- 陈鹏, 张茂星, 张明超, 刘赣, 朱毅勇. 2015.
- CHEN Peng, ZHANG Maoxing, ZHANG Mingchao, LIU Gan, ZHU Yiyong. 2015.
- 不同氮素营养形态对香蕉生长及其根系质子泵活性的影响
- Influence of nitrate/ammonium ratio on the growth and root plasma membrane H+-ATPase activity of banana
- 南京农业大学学报, 38(1): 101-106
- Journal of Nanjing Agricultural University, 38(1): 101-106.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.015
-
文章历史
- 收稿日期:2014-04-12
NO3--N与NH4+-N是植物根系吸收的2种主要的氮素形态,但是由于土壤类型不同,在一定程度上限制了植物对NO3--N和NH4+-N的吸收[1]。通常中性与石灰性土壤硝化作用强烈,因此硝态氮的比例高;酸性红壤中由于硝化作用受到抑制[2],容易在土壤中大量积累铵态氮,例如我国海南岛的红壤与砖红壤[3]。
大多数植物在铵态氮营养下生长受到抑制,浓度过高时还会导致铵中毒[4, 5, 6]。而硝态氮对植物没有毒害,过量时可以积累在液泡中[7]。但是,NO3-的吸收是以细胞膜质子泵消耗能量所产生的质子驱动力来维持[8],而NH4+吸收不需要耗能,因此通常都认为这是植物优先吸收NH4+的主要原因。事实上,NH4+吸收过程主要是通过细胞膜上的水通道蛋白进行的,因此速度要远远高于硝态氮转运蛋白。而且,铵离子吸收后会导致细胞膜去极化,引起质子泵活性的升高[9]。研究发现,植物根系为了应对根际酸化的胁迫,只有进一步提高质子泵活性,才能维持细胞膜电位,保证其他养分离子的吸收[10]。因此,无论铵态氮还是硝态氮营养,事实上都与质子泵密切相关。细胞膜质子泵不仅反映物质跨膜运输的能力,而且也在一定程度上反映植物生长环境对它的影响。有关质子泵与养分元素吸收之间的研究很多,但是大多数研究都是在单一养分影响下测定的。由于氮素吸收形态至少有2种,如果仅仅是在单一的铵态氮或硝态氮处理时测定,则无法全面判断植物生长状况与质子泵活性之间的关系。
香蕉是海南主要的热带农业作物,香蕉生长周期长,需肥量大,而长期以来一直以铵态氮肥为主,并且土壤酸性很强,硝化作用弱,铵态氮积累多,如何通过增施硝态氮来改善香蕉的生长一直是生产中的主要问题。因此,本研究通过水培试验,分别施用不同比例的氮素营养形态,测定植物的生长状况并分离根系细胞膜,测定质子泵活性,建立植物生长状况与质子泵活性之间的联系,为进一步研究细胞膜质子泵在氮素营养吸收与代谢过程中的作用提供理论依据,同时也为农业生产中合理施用不同形态氮肥提供参考。
1 材料与方法 1.1 香蕉植株培养
试验地点设在海南省乐东县海南万钟实业有限公司香蕉枯萎病研究所,供试香蕉品种为海南主栽的巴西种香蕉(Musa AAA Cavendish cv.Baxi)。选择长势一致的香蕉幼苗,轻轻洗去根部基质,再用5 g · L-1高锰酸钾溶液消毒幼苗的根系15 min,最后定植于容积为2.5 L的塑料桶中,并在塑料桶外部套上黑色遮光袋。香蕉苗先用清水培养7 d后,筛选长势一致、根系发育良好的幼苗进行不同浓度的硝/铵配比的营养液培养。营养液参照张茂星等[11]所用的配方。其中氮的总浓度为5 mmol · L-1,共设5个处理:100%硝态氮(100%N),75%硝态氮和25%铵态氮(75%N+25%A),50%硝态氮和50%铵态氮(50%N+50%A),25%硝态氮和75%铵态氮(25%N+75%A),100%铵态氮(100%A)。每隔3 d更换1次营养液,并用H2SO4将起始pH值调至6.5,处理3个月后,取香蕉根系分离细胞膜。试验重复3次。
1.2 测定项目与方法 1.2.1 香蕉根系细胞膜分离及细胞质膜H+-ATPase水解活性的测定
香蕉根系细胞膜分离参照Yan等[12]的方法。剪取距根尖5 cm的水稻根系10~20 g,用去离子水清洗3遍,吸水纸将水吸净。加入预冷的4倍体积研磨缓冲液在0 ℃条件下充分研磨。研磨液用双层微滤膜过滤后置于高速离心管中,0 ℃、1 500 g离心10 min。弃沉淀,取上清液并转移到超速离心管中,0 ℃、87 000 g下离心35 min。弃上清液,沉淀(膜微囊体)在BTP缓冲液中用涡旋仪和玻璃棒涡旋搅拌重新悬浮。悬浮液加入到两相分离系统中。在4 ℃、720 g离心23 min,即可使细胞膜从微囊体重悬液中分离。A管离心的同时可先将B、C管中的上相吸出,保存(用于后续分离管离心前,配平各管);离心后将A管中的上相吸入B管,B管离心15 min,将B管上相吸入C管,C管离心10 min,将C管上相吸出保存在冰盒中。将C管上相平均分成6管,用BTP缓冲液补足32 g,在0 ℃、151 200 g离心40 min后,沉淀即为细胞膜的微囊体,将6管沉淀用BTP缓冲液重新悬浮合为1管再次离心(条件同上)得到沉淀,沉淀用1 mL BTP缓冲液溶解后分装,液氮速冻,置于-80 ℃冰箱中保存。
香蕉细胞质膜H+-ATPase水解活性的测定参照Zhu等[10]和狄廷均等[13]的方法。质膜H+-ATPase水解活性的测定原理是膜蛋白与底物(ATP)反应后会释放出无机磷,因此可以通过测定释放的无机磷的量 与空白对照的差值计算得出其水解活性。反应时间为30 min,反应体系体积为0.50 mL,含有30 mmol · L-1 BTP/MES缓冲液。加入30 μL 1~2 μg膜蛋白(以测定煮沸30 min后失去活性的膜蛋白作为空白对照)开始反应,30 ℃水浴下反应30 min;加入2.5 mL终止液充分反应,然后加入0.25 mL显色液30 ℃下显色30 min后在波长720 nm下比色。
1.2.2 细胞膜蛋白凝胶电泳和免疫印迹试验Western blot分析方法参照Zhu等[10]的方法,7.5 μg膜蛋白用SDS-PAGE凝胶(4%浓缩胶和10%分离胶组成)电泳将目的蛋白与其他蛋白分离。然后用电泳转移槽(Bio-Rad伯乐公司)将分离出的目的蛋白用湿转法转移到PVDF膜上,用TBST(150 mmol · L-1 NaCl,10 mmol · L-1 Tris-HCl,0.05% Tween-20,pH 7.8)清洗3次,然后用含50 g ·L-1脱脂奶粉(或BSA)的TBST室温封闭1 h(或4 ℃封闭过夜),加入一抗(日本名古屋大学木下俊则教授赠送的植物细胞膜H+-ATPase多克隆抗体),室温下轻摇孵育1 h或4 ℃静置过夜,一抗孵育结束后,TBST漂洗膜后再浸洗3次,每次5~10 min,然后再用辣根过氧化物酶标记的IgG二抗(Sigma公司)室温孵育2 h,最后再用TBST浸洗3次,每次5~10 min,免疫印迹结果通过ECL试剂盒(KPL公司)检测。
1.2.3 营养液pH值的测定每次换下来的营养液过滤后用pH计测定。
1.2.4 生物量的测定收获时将地上部和根分开采样,叶片用湿纱布轻轻擦拭,根用去离子水洗净之后用吸水纸吸干,先测定鲜质量,105 ℃、30 min杀青后70 ℃烘干至恒质量。
1.2.5 植株全氮、磷、钾、钙、镁含量的测定香蕉根、茎、叶烘干样品用浓硫酸消煮。全氮含量采用水杨酸-锌粉还原法测定;全磷含量采用钼锑抗比色法测定;全钾含量采用火焰光度计法测定;植物全钙、镁含量采用原子吸收分光光度法测定[14]。
1.3 数据统计与分析
试验数据用Excel 2007软件进行处理,SPSS 18.0进行统计分析,单因素方差分析检验处理间的差异显著性。
2 结果与分析 2.1 不同比例NH4+/NO3-对香蕉生物量的影响
从图 1可知:香蕉在不同比例NH4+/NO3-营养液中处理45 d后,香蕉地上部与地下部在50%N+50%A处理中鲜质量最大,且叶片数量多(图 1),叶片面积大(图 2),根系发达,数量明显比其他处理多(图 3)。在其他铵硝配比处理(25%A+75%N和25%N+75%A)中,香蕉的生长优势、叶片数和根系发达程度均不如50%N+50%A;但是相比单一的铵态氮或硝态氮营养,所有的铵/硝混合处理都对香蕉的生长具有促进作用。在铵态氮营养下,香蕉根系的长度明显减小(图 1),一般认为这是铵态氮影响了根系的向地性[15],并且植株的地上部叶片面积明显比硝态氮处理小,植株相对矮小,虽然还没有明显的铵中毒症状,但是相对于含有不同比例硝态氮的处理,单一的铵态氮营养已经对植物形成一定的胁迫。而单一硝态氮处理的植物,仅比单一铵态氮处理的长势略好。因此,在铵态氮营养的基础上增加硝态氮供应可促进植物的生长。
 | 图 1 不同比例NH4+/NO3-对香蕉生长的影响Fig. 1 Effects of different nitrate/ammonium ratio on banana growth A代表NH4+-N,N代表NO3--N,百分比代表不同铵硝在营养液中的比例。 A represents the NH4+-N and N represents NO3--N. Percent represents the ratio of NH4+-N and NO3--N in solution. The same as follows. |
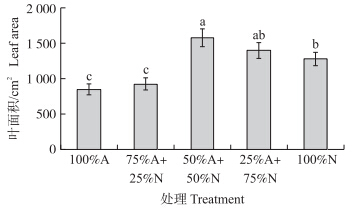 | 图 2 不同比例NH4+/NO3-对香蕉叶面积的影响Fig. 2 Effects of different nitrate/ammonium ratio on banana leaf area 柱上不同字母表示处理间差异达5%的显著水平。Different letters above the bars mean significant difference at the 5% level. The same as follows. |
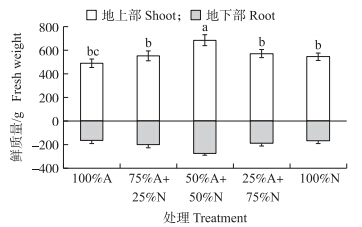 | 图 3 不同比例NH4+/NO3-对香蕉生物量的影响Fig. 3 Effects of different nitrate/ammonium ratio on banana biomass |
从表 1可以看出:不同比例NH4+/NO3-影响了香蕉对各种养分的吸收,香蕉叶片中的N和K含量在50%N+50%A处理中最高,与100%A和100%N处理相比,差异显著。香蕉叶片中的阳离子如K、Ca、Mg含量在100%A处理中最低。随着硝态氮比例的增加,3种阳离子的含量均增加,在全硝处理时含量最高。地下根系部分的养分含量与地上部分在总体上都处于相同的范围之内,并且总体上变化趋势与地上部类似(表 2)。
| g · kg-1 | |||||
| 处理 Treatment | 氮含量 Total N content | 磷含量 Total P content | 钾含量 Total K content | 钙含量 Total Ca content | 镁含量 Total Mg content |
| 100%N | 37.45±0.26bc | 3.17±1.26b | 50.90±1.84bc | 13.26±0.63a | 4.72±0.06a |
| 75%N+25%A | 37.05±1.62c | 3.95±0.04ab | 53.18±2.21ab | 10.93±0.42b | 4.13±0.04b |
| 50%N+50%A | 47.96±1.51a | 3.98±0.02ab | 55.43±2.80a | 10.17±0.68b | 4.02±0.34b |
| 25%N+75%A | 38.02±0.43bc | 4.08±0.12ab | 48.20±1.30c | 10.00±0.27b | 4.01±0.16b |
| 100%A | 38.84±0.54b | 4.22±0.06a | 42.46±1.48d | 9.62±0.22b | 3.92±0.15b |
| 注:不同字母表示处理间差异达5%的显著水平。Different letters mean different significance at the 5% level. The same as follows. | |||||
| g · kg-1 | |||||
| 处理 Treatment | 氮含量 Total N content | 磷含量 Total P content | 钾含量 Total K content | 钙含量 Ca content | 镁含量 Mg content |
| 100%N | 32.07±0.28c | 4.24±0.04d | 55.86±1.06b | 10.26±0.63a | 3.72±0.06a |
| 75%N+25%A | 31.87±0.73c | 5.55±0.09bc | 54.83±0.05a | 7.93±0.42c | 2.92±0.15b |
| 50%N+50%A | 41.14±0.25b | 8.28±0.80a | 49.72±1.07c | 9.00±0.27bc | 3.13±0.04b |
| 25%N+75%A | 40.24±0.53b | 5.27±0.14c | 47.62±2.06d | 8.62±1.22bc | 3.02±0.34b |
| 100%A | 43.61±0.57a | 6.03±0.23b | 41.90±0.99e | 9.37±0.68bc | 3.01±0.16b |
虽然每次换营养液时将pH值均调整为6.5,但是3 d后植物由于吸收了不同形态的氮源,导致根际pH值发生不同的变化。从图 4可以看出:75%N+25%A处理中,根际pH值基本没有变化,而100%N处理后pH值上升,在所有处理中最高;25%N+75%A、50%N+50%A处理中pH值都降低,100%A处理后pH值下降最低。从图 4还可以发现:只要有铵离子存在,根际pH值均有所下降,这说明根系优先吸收铵态氮,而且吸收的铵态氮的量要大于硝态氮的量。
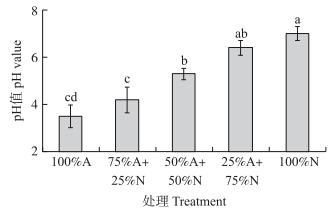 | 图 4 不同比例NH4+/NO3-对香蕉根际pH值的影响Fig. 4 Effects of different ammonium/nitrate ratio on banana rhizosphere pH value |
分离香蕉根系细胞膜,测定细胞质膜H+-ATPase水解活性,并进行Western blot免疫分析。结果表明:在全铵营养下香蕉根系的质子泵水解活性最高,蛋白含量也最高,并且当试验处理中铵态氮比例减少时,根系细胞膜质子泵活性降低(图 5),其蛋白含量也降低(图 6)。这从酶学水平和蛋白质水平上都验证了在NH4+-NO3-混合营养中,随着铵态氮比例的增加香蕉根系细胞膜质子泵活性也增加。
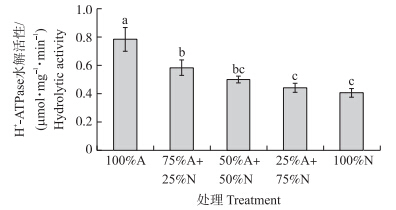 | 图 5 不同比例NH4+/NO3-对香蕉根系质子泵活性的影响Fig. 5 Effects of different nitrate/ammonium ratio on plasma membrane H+-ATPase activity |
 | 图 6 香蕉根系细胞膜H+-ATPase的Western blot免疫分析Fig. 6 Immunodetection of banana plasma membrane H+-ATPase by Western blot |
本研究中,在50%硝态氮和50%铵态氮处理下香蕉长势最好,生物量也最大。在100%铵态氮处理下香蕉长势最差,根系很少且地上部叶片也相对较少。100%硝态氮处理时香蕉长势也不尽良好。因此,铵硝混合营养是促进作物生长的最佳氮素营养处理。
单一铵态氮处理下香蕉根际酸化严重,很可能是造成植物受到铵胁迫乃至铵中毒的一个主要原因[16]。基于阴阳离子吸收平衡的学说,根系在吸收NH4+时要释放出等量的H+[17, 18],事实上是因为NH4+在细胞质膜外脱H+后进入细胞[19]。由于NH4+的吸收量很大(约占所有阳离子总量的70%),因此根际酸化非常强烈[20]。本研究中,在100%铵态氮营养下香蕉根系对无机阳离子的吸收量最少,但是根际酸化最强。当铵态氮运输到细胞内参与氨基酸的同化后,也会释放H+造成细胞质酸化,原生质体的酸化容易造成细胞内的果胶和多糖间的稳定性降低[21],从而破坏细胞内环境的稳定性并影响植物养分运输及生理代谢。当植物细胞内H+浓度增加时,细胞可以暂时通过液泡膜质子泵把H+泵入液泡中,但是液泡的体积有限,如果植物不断吸收铵态氮,则不能无限地储运H+[22]。因此,通过细胞膜质子泵将体内的质子运输到细胞外是一种更加重要的途径,本研究中在全铵处理下细胞膜质子泵水解活性最高。Britto等[23]提出,在铵态氮营养下,植物可能要将细胞中多余的NH4+排出根系,且需要将NH4+主动运输出细胞,因此也需要提高细胞膜质子泵的活性才能实现。本研究中,随着铵态氮浓度的增加香蕉根系细胞膜质子泵的活性也增加,Western blot免疫分析从蛋白水平进一步验证了该结果。
本研究在100%铵态氮营养下植物体内的氮含量相对较少。张茂星等[11]的研究表明:香蕉在全铵处理下植株体内的氮含量比较低,说明当铵态氮达到一定浓度时植物不能进一步吸收利用铵。植物吸收1分子NH4+释放1分子H+,而吸收1分子NO3-至少需消耗2分子H+,随着硝态氮比例的增加,根际pH值也升高,从而可以缓解根际酸化和细胞内的酸化;并且为了平衡细胞膜电位[17, 18],还要增加对阳离子的吸收。而这些阳离子,如钾、钙、镁等营养元素都是植物细胞内各种酶学激活剂和细胞信号分子,对植物生理代谢反应起着不可替代的作用[19, 20]。这也是植株在硝态氮营养比例增加的情况下比在100%铵态氮条件下生长要好的原因之一。
综上所述,质子泵的活性与根际的硝/铵比例有关,其主要原因是铵态氮吸收后根际pH值的降低导致的,无论质子泵活性高还是低并不能完全代表植物的生长优劣,相反在一个合适的硝/铵配比营养条件下,质子泵的活性处于一个相对稳定和适中的状态,此时植物生长最优,而过高与过低的活性均对植物的生长不利。在香蕉种植区增加硝态氮能有效缓解南方土壤的铵中毒及土壤酸化现象,同时这方面也需在今后的生产实践中进一步研究验证。
| [1] | Gigon A,Rorison I H. The response of some ecologically distinct plant species to nitrate- and ammonium-nitrogen[J]. Journal of Ecology,1972,60:93-102 |
| [2] | 李辉信,胡锋,刘满强,等. 红壤氮素的矿化和硝化作用的特征[J]. 土壤,2000,32(4):194-197 [Li H X,Hu F,Liu M Q,et al. The characteristics of the red soil nitrogen mineralization and nitrification[J]. Soils,2000,32(4):194-197(in Chinese with English abstract)] |
| [3] | 钱琛,蔡祖聪. 利用方式对红壤硝化作用的水分效应的影响[J]. 环境科学,2010,31(10):2417-2421 [Qian C,Cai Z C. Influence of land-use type on moisture-effect of nitrification in subtropical red soils[J]. Environment Science,2010,31(10):2417-2421(in Chinese with English abstract)] |
| [4] | Britto D T,Glass A D M,Kronzucker H J,et al. Cytosolic concentrations and transmembrane fluxes of NH4+/NH3. An evaluation of recent proposals[J]. Plant Physiology,2001,125:523-526 |
| [5] | Brix H,Dyhr-Jensen K,Lorenzen B. Root-zone acidity and nitrogen source affects Typha latifolia L.growth and uptake kinetics of ammonium and nitrate[J]. Journal of Experiment Botany,2002,53:2441-2450 |
| [6] | Loqué D,Wirén N V. Regulatory levels for the transport of ammonium in plant roots[J]. Journal of Experiment Botany,2004,55:1293-1305 |
| [7] | 曾后清,刘赣,朱毅勇,等. 拟南芥体内硝酸盐积累差异与细胞膜H+-ATPase的关系[J]. 南京农业大学学报,2011,34(6):89-94. doi:10.7685/j.issn.1000-2030.2011.06.016 [Zeng H Q,Liu G,ZHU Y Y,et al. The relationship between the accumulation of nitrate and plasma membrane H+-ATPase in Arabidopsis[J]. Journal of Nanjing Agricultural University,2011,34(6):89-94(in Chinese with English abstract)] |
| [8] | Garnica M,Houdusse F,Yvin J C,et al. Nitrate modifies urea root uptake and assimilation in wheat seedlings[J]. Journal of Science in Food and Agriculture,2009,89:55-62 |
| [9] | Schubert S,Schubert E,Mengel K. Effect of low pH of the root medium on proton release,growth,and nutrient uptake of field beans(Vicia faba)[J]. Plant and Soil,1990,124:239-244 |
| [10] | Zhu Y Y,Di T J,Xu G H,et al. Adaptation of plasma membrane H+-ATPase of rice roots to low pH as related to ammonium nutrition[J]. Plant and Cell Environment,2009,32:1428-1440 |
| [11] | 张茂星,张明超,陈鹏,等. 硝/铵营养对香蕉生长及其枯萎病发生的影响[J]. 植物营养与肥料学报,2013,19(5):1241-1247 [Zhang M X,Zhang M C,Chen P,et al. Influence of nitrate/ammonium ratio on the banana plant growth and related wilt disease development[J]. Plant Nutr Fert Sci,2013,19(5):1241-1247(in Chinese with English abstract)] |
| [12] | Yan F,Zhu Y,Muller C,et al. Adaptation of H+-pumping and plasma membrane H+-ATPase activity in proteoid roots of white lupin under phosphate deficiency[J]. Plant Physiol,2002,129:50-63 |
| [13] | 狄廷均,朱毅勇,仇美华,等. 水稻根系细胞膜H+-ATPase对铵硝营养的响应差异[J]. 中国水稻科学,2007,21(4):360-366 [Di T J,Zhu Y Y,Qiu M H,et al. Response of plasma membrane H+-ATPase of rice root to ammonium and nitrate nutrition[J]. Chin J Rice Sci,2007,21(4):360-366(in Chinese with English abstract)] |
| [14] | 鲍士旦. 土壤农化分析[M]. 3版. 北京:中国农业出版社,2000 [Bao S D. Analytic of Soil and the Agriculture Chemistry[M]. 3rd ed. Beijing:China Agricultural Press,2000(in Chinese)] |
| [15] | Li B,Li G,Shi W. Ammonium stress in Arabidopsis:signaling,genetic loci,and physiological targets[J]. Trends in Plant Science,2013,12:1-8 |
| [16] | Bligny R,Gout E,Kaiser W,et al. pH regulation in acid-stressed leaves of pea plants grown in the presence of nitrate or ammonium salts:studies involving 31P-NMR spectroscopy and chlorophyll fluorescence[J]. Biochimica et Biophysica Acta,1997,1320:142-152 |
| [17] | Raven J A. Biochemical disposal of excess H+ in growing plants[J]. New Phytologist,1986,104:175-206 |
| [18] | Kirkby E A,Mengel K. Ionic balance in different tissues of the tomato plants in relation to nitrate,urea and ammonium nutrition[J]. Plant Physiology,1967,42:6-14 |
| [19] | Mengel K,Kirkby E A. Principles of Plant Nutrition[M]. 3rd ed. London:Kluwer Academic Publishers,1982 |
| [20] | Zhu Y Y,Zeng H Q,Di T J,et al. Involvement of plasma membrane H+-ATPase in adaption of rice to ammonium nutrient[J]. Rice Science,2011,18(4):335-342 |
| [21] | Koyama H,Toda T,Hara T. Brief exposure to low-pH stress causes irreversible damage to the growing root in Arabidopsis thaliana:pectin-Ca interaction may play an important role in proton rhizotoxicity[J]. Journal of Experimental Botany,2001,52:361-368 |
| [22] | Raven J A. Nitrogen assimilation and transport in vascular land plants in relation to intracellular pH regulation[J]. New Phytologist,1976,76:415-431 |
| [23] | Britto D T,Siddiqi M Y,Glass A D M,et al. Futile transmembrane NH4+ cycling:a cellular hypothesis to explain ammonium toxicity in plants[J]. Proc Natl Acad Sci USA,2001,98:4255-4258 |




