文章信息
- 程越, 韩笑, 杨煊, 陈发棣, 房伟民, 蒋甲福. 2015.
- CHENG Yue, HAN Xiao, YANG Xuan, CHEN Fadi, FANG Weimin, JIANG Jiafu. 2015.
- 菊花脑花器官的离体培养
- Floral organ in vitro culture of Chrysanthemum nankingense
- 南京农业大学学报, 38(1): 57-62
- Journal of Nanjing Agricultural University, 38(1): 57-62.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.009
-
文章历史
- 收稿日期:2014-05-06
菊花脑(Chrysanthemum nankingense)又名路边黄、菊花叶等,为菊科菊属多年生宿根草本植物,适应性强,在江苏、湖南、贵州等地均有野生种。菊花脑的嫩茎和叶富含维生素、挥发油和矿物质,具有消暑清热、调中健脾、降压开胃等保健功效,在江苏地区属于经济价值较高的传统野生蔬菜。
菊花脑属于二倍体植物,遗传背景较为简单且参与栽培菊的起源[1],将其作为模式植物开展研究可为栽培菊的遗传育种提供理论依据。目前国内外对菊花脑的报道多集中在生产技术[2]、成分分析[3]、遗传加倍[4, 5]、种属间杂交[6, 7]及以菊花脑叶片、茎段和叶柄为外植体构建再生体系[8, 9]等方面。本试验以菊花脑花器官为外植体,研究不同质量浓度生长调节剂对不定芽再生、生根的影响,观察花蕾不定芽的分化过程,旨在探索花蕾再生不定芽的机制,建立高效稳定的再生体系,为菊花脑的遗传转化提供新的受体系统。
1 材料与方法 1.1 材料与培养条件
供试材料为二倍体菊花脑的花蕾,取自南京农业大学中国菊花种质资源保存中心。
组培室温度为(22±1)℃,相对湿度为40%~50%,光照时间为16 h · d-1,光照强度为32~36 μmol · m-2 · s-1。
1.2 试验方法 1.2.1 花蕾大小对不定芽再生的影响
先对花蕾进行消毒:于秋季选取尚未露白、萼片包裹紧密的菊花脑花蕾,流水冲洗20~30 min,在超净工作台上先用70%乙醇(体积分数)浸泡30 s,再用0.1%(体积分数)升汞溶液浸泡7~8 min,无菌水冲洗5次。选择直径为0.2、0.4和0.6 cm共3种大小的花蕾为外植体,分别接种于添加1.0 mg · L-1 6-BA、0.5 mg · L-1 NAA的MS培养基(含30 g · L-1蔗糖,7 g · L-1琼脂,pH调至5.8,以下同)。每处理接种24个,重复3次,30 d后统计污染率和再生情况。不定芽长势按生长从弱到强依次划分为3个等级,分别用+、++和+++表示,分级标准对应为不定芽叶片卷曲畸形和玻璃化、不定芽黄绿色和绿色。 1.2.2 不同浓度生长调节剂对不定芽再生的影响
花蕾消毒方法同1.2.1节。将直径为0.4 cm的花蕾接种至9种再生培养基:以MS为基本培养基,6-BA质量浓度设置为1.0、2.0和3.0 mg · L-1,NAA设置为0.1、0.25和0.5 mg · L-1。每处理接种30个外植体,重复3次,30 d后统计愈伤率、不定芽再生率和平均不定芽数。愈伤率=形成愈伤的外植体总数/接种外植体总数×100%;不定芽再生率=再生不定芽的外植体总数/接种外植体总数×100%;平均不定芽数=再生不定芽总数/再生不定芽的外植体总数。 1.2.3 不同花器官对不定芽再生的影响
花蕾消毒方法同1.2.1节。在超净工作台上将直径为0.4 cm的花蕾拆分为花托、舌状花、管状花和子房,并用手术刀切去舌状花和管状花的部分上端。将这4种花器官分别接种于花蕾的最适再生培养基中,每种花器官接种30个外植体,重复3次,30 d后统计愈伤率、不定芽再生率和平均不定芽数。 1.2.4 花蕾不定芽再生的组织细胞学观察
花蕾消毒方法同1.2.1节。将直径为0.4 cm的花蕾接种至最适再生培养基培养30 d。每隔3~4 d取5个花蕾,FAA固定24 h,4 ℃保存。按常规石蜡法包埋,组织切片经铁矾-苏木精染色后,在OLYMPUS BX41TF显微镜下观察拍照。 1.2.5 生根培养与炼苗移栽
切取长约2 cm的菊花脑不定芽,接种至生根培养基(以1/2MS为基本培养基,IBA质量浓度分别为0、0.05、0.1、0.2和0.3 mg · L-1)。20 d后统计生根率、平均根数和平均根长。每处理接种10个外植体,重复3次。不定根在最适生根培养基中长至3~4 cm时,将瓶盖半开炼苗。3 d后取出组培苗,洗净根部培养基,移栽至混合基质(泥炭、蛭石、珍珠岩质量比为1 ∶ 2 ∶ 1)中,每日喷水保湿,15 d后统计成活率。 1.3 数据处理
采用Microsoft Excel 2007及SPSS 20.0软件Duncan′s多重比较法(P<0.05)进行统计分析。
2 结果与分析 2.1 花蕾大小对不定芽再生的影响
由表 1可知:花蕾直径越小,包裹的越紧密,消毒效果越好。直径0.2 cm的花蕾污染率最低,为10.4%,但再生率和平均不定芽数也最低,再生出的不定芽个体小,长势弱。直径0.6 cm的花蕾再生率和平均不定芽数均为最大值,但消毒效果最差,污染率达37.5%。0.4 cm的花蕾污染率较低,再生率和平均不定芽数较高,分别为31.9%和2.9个,不定芽长势健壮。因此,直径0.4 cm的花蕾适于用作诱导不定芽的外植体。
| 花蕾直径/cm Diameter of flower bud | 污染率/% Browning rate | 再生率/% Regeneration rate | 平均不定芽数 Average number of adventitious buds | 不定芽长势 Growth potential of adventitious buds |
| 0.2 | 10.4c | 23.6b | 2.5b | ++ |
| 0.4 | 18.8b | 31.9a | 2.9a | +++ |
| 0.6 | 37.5a | 34.7a | 3.1a | +++ |
| 注: 1) +:不定芽卷曲畸形和玻璃化;++:不定芽黄绿色;+++:不定芽绿色。+:The adventitious buds are curly,abnormal and hyperdric;++:The adventitious buds are yellow-green;+++:The adventitious buds are green. 2) 同一列中不同小写字母表示在0.05水平差异显著。The different small letters in the same column mean significant difference at 0.05 level. The same as follows. | ||||
花蕾接种1周后开始膨大,花萼增厚突起。12 d后花蕾继续膨大开放,并在其底部形成黄色愈伤组织。2周后陆续观察到绿色芽点突起,大多数芽点发生于花蕾侧面和底部的愈伤组织,也有少数发生于花蕾中部。25 d后不定芽分化完全,呈绿色或黄绿色丛生状(图 1)。
 | 图 1 不同浓度6-BA和NAA对花蕾不定芽再生的影响 Fig. 1 Effects of different concentrations of 6-BA and NAA on shoot regeneration of flower bud 编号1~9同表 2。The code 1-9 are corresponding to Table 2. |
由表 2可知:随着NAA质量浓度的升高,愈伤率不变(均为100%),愈伤量增多。6-BA和NAA的浓度对不定芽分化的影响很大,当NAA(或6-BA)浓度一定时,随着6-BA(或NAA)浓度的升高,不定芽再生率和平均不定芽数呈现出先升高后降低的趋势。2.0 mg · L-16-BA与0.25 mg · L-1NAA组合,再生率最高为66.5%,平均不定芽数最多,为4.9个,不定芽为黄绿色或绿色,生长健壮。在3.0 mg · L-16-BA或0.5 mg · L-1NAA时,不定芽易出现叶片卷曲畸形和玻璃化现象。因此,MS+2.0 mg · L-16-BA+0.25 mg · L-1NAA最适于诱导花蕾再生不定芽。
| 编号 Code | 生长调节剂质量浓度/(mg·L-1) Plant growth regulator concentrations | 愈伤率/% Callus induction rate | 再生率/% Regeneration rate | 平均不定芽数 Average number of adventitious buds | 不定芽长势 Growth potential of adventitious buds | |
| 6-BA | NAA | |||||
| 1 | 1.0 | 0.10 | 100 | 22.2e | 2.5d | + |
| 2 | 1.0 | 0.25 | 100 | 35.6cd | 3.1c | +++ |
| 3 | 1.0 | 0.50 | 100 | 31.1d | 2.9cd | ++ |
| 4 | 2.0 | 0.10 | 100 | 57.8b | 4.1b | +++ |
| 5 | 2.0 | 0.25 | 100 | 66.5a | 4.9a | +++ |
| 6 | 2.0 | 0.50 | 100 | 38.9cd | 3.4bc | ++ |
| 7 | 3.0 | 0.10 | 100 | 43.3c | 3.8b | ++ |
| 8 | 3.0 | 0.25 | 100 | 54.5b | 4.1ab | + |
| 9 | 3.0 | 0.50 | 100 | 36.7cd | 3.3bc | + |
由表 3可知:不同花器官的愈伤率和再生率差异很大。舌状花和管状花接种2周后形成绿色致密状愈伤,4周后再生出芽体,再生率较低,分别为16.7%和13.1%,不定芽茎叶细小,存在玻璃化现象。子房接种2周后形成黄色疏松状愈伤,愈伤率较高为65.8%,但再生率最低且再生时间长,培养30 d时只分化出少量芽体。花托接种10 d后形成黄色致密状愈伤,3周后再生出不定芽,愈伤率和再生率远高于其他花器官,分别为77.4%和42.6%,不定芽为绿色,叶形正常,长势良好。
花器官 Flower organs | 愈伤率/% Callus induction rate | 再生率/% Regeneration rate | 平均不定芽数 Average number of adventitious buds | 不定芽长势 Growth potential of adventitious buds |
| 舌状花Ray flower | 41.2c | 16.7b | 4.5a | ++ |
| 管状花Tubular flower | 38.5c | 13.1b | 3.7b | ++ |
| 子房Ovary | 65.8b | 6.3c | 1.4c | + |
| 花托Torus | 77.4a | 42.6a | 3.2b | +++ |
接种0 d的花蕾,其花托表面紧密排布着一层狭长形细胞,体积较小,细胞核颜色深,内部的薄壁细胞体积大,细胞核颜色浅(图 2-A)。接种10 d后,花托内部少数薄壁细胞胞质浓缩,细胞核变大,聚集成分生细胞团(图 2-B)。这些细胞作为生长中心继续分裂,构成了与周围愈伤细胞存在明显界限的分生组织结节(图 2-C)。接种16 d,花托愈伤组织的表层细胞大量增殖,向相同方向极性分裂,形成瘤状突起(图 2-D)。接种22 d,表层瘤状突起分化为生长锥,这表明花托愈伤组织芽分化属于外起源。随着叶原基的出现,生长锥成长为完整不定芽(图 2-E)。
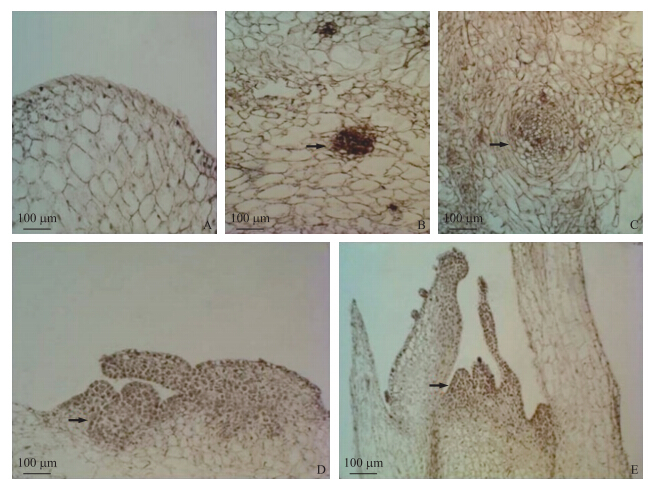 |
图 2 花蕾不定芽再生的组织细胞学观察 Fig. 2 Observation of the organizations anatomy on shoot regeneration of flower buds
A.花托表皮细胞结构;B.分生细胞团;C.分生组织结节;D.花托表层瘤状突起;E.不定芽。箭头指示分化的细胞和分生组织。 A.Structure of receptacle epidermis;B.Meristematic cell mass;C.Merisematic nodules;D.Strumae in receptacle epidermis;E.Adventitious bud. The arrows indicate the differentiation and meristem cells. |
生根培养6~7 d后,不定芽切口处长出白色不定根。由表 4可知:菊花脑在5种生根培养基中的生根率均为100%。在不添加IBA的1/2MS培养基中,不定芽根系细长,根毛稀疏。当IBA质量浓度在0.05~0.20 mg · L-1范围内,随着IBA浓度的升高,根系变得更加粗壮。当IBA质量浓度为0.20 mg · L-1时,平均根数为7.1条,平均根长为7.35 cm,根系粗长,根毛浓密,生根效果最好。再生植株经炼苗后移栽15 d的成活率为100%。
ρ(IBA)/ (mg·L-1) | 生根率/% Rooting rate | 平均根数 Meaning number of roots | 平均根长/cm Meaning length of roots | 根系生长状态 Growth state of roots |
| 0 | 100 | 6.9a | 6.68b | 细长,根毛稀疏Thin,long and the fibril is sparse |
| 0.05 | 100 | 4.7c | 4.96c | 细短,根毛稀疏Thin,short and the fibril is sparse |
| 0.10 | 100 | 5.5b | 5.22c | 粗短,根毛浓密Wide,short and the fibril is thick |
| 0.20 | 100 | 7.1a | 7.35a | 粗长,根毛浓密Wide,long and the fibril is thick |
| 0.30 | 100 | 6.7a | 7.19a | 粗长,根毛浓密Wide,long and the fibril is thick |
本研究中,最适于诱导菊花脑花蕾再生的植物生长调节剂组合为2.0 mg · L-1 6-BA+0.25 mg · L-1 NAA,低浓度的6-BA诱导不定芽再生的概率低、平均不定芽数少,高浓度的6-BA或NAA则易引发苗体玻璃化,这说明较高浓度的细胞分裂素与较低浓度的生长素搭配有利于不定芽再生,这与李辛雷等[10]对不同品种小菊再生体系构建的研究结果相一致。
菊花花器官是离体再生的良好材料,Song等[11]研究了6种菊花叶片、叶柄、茎段和花瓣的再生能力,结果表明花瓣诱导不定芽的再生率最高,平均不定芽数最多;李玉芬[12]比较了栽培菊不同花器官的再生频率,结果表明花蕾、雌雄蕊分化的不定芽数最多,其次为花托、花萼,花瓣分化的不定芽数最少。本研究发现,菊花脑不同花器官中花托的再生率最高,舌状花、管状花次之,子房的再生率最低且再生周期长。由此可见,菊属植物花器官的再生能力不仅因品种而异,同一品种不同花器官的再生能力也存在差别。本研究还发现舌状花和管状花形成愈伤和不定芽的部位在花瓣基部,上部切口几乎无愈伤产生,可能是因为基部是花瓣的发生处,该处组织分化程度低于花瓣上部,真实原因有待进一步考证。
器官间接发生途径是指先通过外植体诱导愈伤组织,愈伤组织再分化出芽和根,继而获得完整植株的过程,这是组培成苗的一种较为普遍的方式[13]。赵云鹏等[14]对花烛愈伤组织解剖结构的研究表明,花烛离体再生以器官间接发生途径为主,芽原基主要形成于愈伤组织近表层处,属于外起源。本研究结果与之相似,培养初期菊花脑花托内部形成了具有再生潜能的分生组织结节,但在后续观察中并未发现其进一步分化,培养中后期花托愈伤表层细胞大量增殖,分化为芽原基。
以菊花脑叶片、茎段和叶柄为外植体已成功构建再生体系,但每个外植体的出芽数并不清楚,其优点在于取材方便[8, 9]。本研究以花蕾为外植体,虽然外植体只能在秋季开花时取材,但是若通过光周期调节也可实现周年开花以方便取材。在我们研究过程中发现菊花脑的花蕾出芽数在4个左右,可以满足下一步转化要求。构建高效稳定的再生体系是植物基因工程育种的基础[15]。本研究通过器官间接发生途径,成功以花蕾为外植体建立了再生体系,为菊花脑的离体培养提供了新的外植体类型,也为其遗传转化奠定了基础。
| [1] | 张莉俊,戴思兰. 菊花种质资源研究进展[J]. 植物学报,2009,44(5):526-535 [Zhang L J,Dai S L. Research advance on germplasm resources of Chrysanthemum × morifolium[J]. Chinese Bulletin of Botany,2009,44(5):526-535(in Chinese with English abstract)] |
| [2] | 何铁光,文国荣,韦星光,等. '桂特一号’大叶菊花菜特征特性及栽培技术[J]. 北方园艺,2013(4):54-55 [He T G,Wen G R,Wei X G,et al. Study on characteristics and cultivation techniques of Chrysanthemum nankingense'Guiteyihao’[J]. Northern Horticulture,2013(4):54-55(in Chinese)] |
| [3] | 杨立刚,李莉华,林丽凤,等. 南京菊花脑部分成分分析及挥发油的提取研究[J]. 现代食品科技,2010,26(2):212-214 [Yang L G,Li L H,Lin L F,et al. Analysis of functional ingredients and extraction of volatile oil from Chrysanthemum nankingense[J]. Modern Food Science and Technology,2010,26(2):212-214(in Chinese with English abstract)] |
| [4] | 陈发棣,蒋甲福,房伟民. 秋水仙素诱导菊花脑多倍体的研究[J]. 上海农业学报,2002,18(1):46-50 [Chen F D,Jiang J F,Fang W M. Study on induction of polyploidy Dendranthema nankingense with colchicine[J]. Acta Agriculture Shanghai,2002,18(1):46-50(in Chinese)] |
| [5] | 刘思余,张飞,陈素梅,等. 四倍体菊花脑与栽培菊种间杂交及F1杂种的遗传表现[J]. 中国农业科学,2010,43(12):2500-2507 [Liu S Y,Zhang F,Chen S M,et al. Interspecific hybridization between the tetraploid Chrysanthemum nankingense and C.grandiflorum'Zhongshanzixing’and the genetic performance of their F1 hybrids[J]. Scientia Agricultura Sinica,2010,43(12):2500-2507(in Chinese with English abstract)] |
| [6] | Cheng X,Chen S M,Chen F D,et al. Interspecific hybrids between Dendranthema morifolium(Ramat.)Kitamura and D.nankingense(Nakai)Tzvel.achieved using ovary rescue and their cold tolerance characteristics[J]. Euphytica,2010,172(1):101-108 |
| [7] | Tang F P,Wang H B,Chen S M,et al. Intergeneric hybridization between Dendranthema nankingense and Tanacetum vulgare[J]. Scientia Horticulturae,2011,132:1-6 |
| [8] | 费建业,黄文苑,白卉,等. 菊花脑叶片组织培养再生植株的研究[J]. 安徽农业科学,2009,37(17):7872-7874 [Fei J Y,Huang W Y,Bai H,et al. Plant regeneration in the tissue culture of Chrysanthemum nankingense leaves[J]. Journal of Anhui Agriculture Sciences,2009,37(17):7872-7874(in Chinese with English abstract)] |
| [9] | 白卉,黄文苑,贲爱玲,等. 菊花脑离体培养再生植株的研究[J]. 安徽农业科学,2010,38(15):7782-7783 [Bai H,Huang W Y,Bi A L,et al. Study on plant regeneration of Chrysanthemum nankingense via in vitro culture[J]. Journal of Anhui Agriculture Sciences,2010,38(15):7782-7783(in Chinese with English abstract)] |
| [10] | 李辛雷,陈发棣,王红,等. 菊花外植体再生体系的研究[J]. 上海农业学报,2004,20(2):13-16 [Li X L,Chen F D,Wang H,et al. Study on regeneration system of chrysanthemum explants[J]. Acta Agriculture Shanghai,2004,20(2):13-16(in Chinese)] |
| [11] | Song J Y,Mattson N S,Jeong B R. Efficiency of shoot regeneration from leaf,stem,petiole and petal explants of six cultivars of Chrysanthemum morifolium[J]. Plant Cell,Tissue and Organ Culture,2011,107(2):295-304 |
| [12] | 李玉芬. 几种菊花花器培养及愈伤组织分化频率研究[J]. 生物技术,1997,7(2):24-26 [Li Y F. Study on culture of several floral organs and callus differential rate of chrysanthemum[J]. Biotechnology,1997,7(2):24-26(in Chinese)] |
| [13] | Sangeetha P,Venkatachalam P. Induction of direct shoot organogenesis and in vitro flowering from shoot tip explants of cucumber(Cucumis sativus L.cv.'Green long’)[J]. In vitro Cellular & Developmental Biology-Plant,2014,50(2):242-248 |
| [14] | 赵云鹏,郭维明,王广东. 花烛不同愈伤组织解剖结构的观察[J]. 园艺学报,2005,32(1):60-64 [Zhao Y P,Guo W M,Wang G D. Observation on anatomic structure of eight kinds of calli in Anthurium andraeanum[J]. Acta Horticulturae Sinica,2005,32(1):60-64(in Chinese with English abstract)] |
| [15] | 刘宣雨,刘树君,宋松泉. 建立甜高粱(Sorghum bicolor)高频、高效再生体系的研究[J]. 中国农业科学,2010,43(23):4963-4969 [Liu X Y,Liu S J,Song S Q. Research on establishment of a highly frequent and efficient regeneration system of Sorghum bicolor[J]. Scientia Agricultura Sinica,2010,43(23):4963-4969(in Chinese with English abstract)] |




