文章信息
- 张璐, 刘帅, 竹龙鸣, 蔡斌华, 章镇, 王三红. 2015.
- ZHANG Lu, LIU Shuai, ZHU Longming, CAI Binhua, ZHANG Zhen, WANG Sanhong. 2015.
- 苹果CAX基因家族生物信息学和表达分析
- Bioinformatics and expression analysis of CAX gene family in apple
- 南京农业大学学报, 38(1): 41-49
- Journal of Nanjing Agricultural University, 38(1): 41-49.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.007
-
文章历史
- 收稿日期:2014-05-25
Ca2+在植物生长发育中起着非常重要的作用,它既是细胞膜和细胞壁的主要组成成分,可以维持细胞壁、细胞膜和膜结合蛋白的稳定性[1];又是一种信号分子,在细胞内与钙调蛋白(CaM)结合作为第二信使,行使信号转导的功能,当植物受到外界环境改变和內源激素信号等刺激时,胞内的Ca2+浓度([Ca2+]cyt)发生变化,植物感受钙信号,经过信号传递,完成一系列的生理生化反应[2]。植物缺钙会引起多种并发症,如叶片坏疽、果实腐烂等,严重影响产量;若植物含Ca2+过高,则会破坏胞内Ca2+的平衡,引起Ca2+中毒,磷代谢受到干扰[3]。植物体内Ca2+浓度的调节主要是通过精细的Ca2+转运系统来实现的,主要包括:Ca2+通道、Ca2+-ATPase(Ca泵)和Ca2+/H+反向转运蛋白(Ca2+/H+exchanger antiporter,CAX)等[4]。
CAX是一类重要的跨膜转运蛋白,主要存在于质膜或液泡膜上[5]。自从大肠杆菌(Escherichia coli)的细胞质膜上发现Ca2+/H+反向转运体以后[6],已在越来越多的植物基因组中克隆或预测到CAX全长和cDNAs开放阅读框(ORF),目前基因组数据中已经有200多个[7]。据报道CAXs广泛分布于植物、大部分动物、真菌和细菌中,但在哺乳动物、昆虫、线虫的基因组中却不存在[8]。CAX是Ca2+/Cation antiporter(CaCA)大家族的一个进化分化支,也可称为阳离子/H+离子交换器(Cation/H+exchanger)。它不直接依靠ATP水解供能,而是依赖H+-ATPase或H+-PPase产生的跨膜质子梯度来驱动Ca2+的运输[9]。研究表明:植物CAXs除具有Ca2+反向转运活性外,还可以转运其他金属离子,例如拟南芥AtCAX2可转运Mn2+和Cd2+,莱茵衣藻CrCAX1和AtCAX4能转运Cd2+等[10, 11, 12]。过量表达CAXs可提高植物对Ca2+、Cd2+或Mn2+等金属离子耐受性和累积能力[13, 14, 15, 16],从而降低土壤重金属对植物的毒害。近年来对水稻CAXs的研究发现,OsCAX4不仅可以参与Ca2+、Mn2+的转运,而且还可以转运Cu2+[17]。除此之外,CAX也可转运Na+、K+和Li+等一价阳离子[18]。
Shigaki等[9]根据CAXs序列和结构的相似性对其进行归类分析,可将其分成3大类:Ⅰ型(植物以及部分真菌和细菌的CAXs)、Ⅱ型(酵母类似CAXs)和Ⅲ型(大肠杆菌类似CAXs)。Ⅰ型CAXs又可分为A~G 8个不同的亚型,其中植物的CAXs被分为Ⅰ-A型和Ⅰ-B型2个截然不同的亚型[9]。大部分植物CAXs有11个跨膜结构(TM)和4个典型的功能域:即N-端自抑制区域(NRR)、Ca2+功能域(CaD)、C功能域和D功能域;且在TM3~TM4、TM8~TM9之间均含有与离子转运专一性有关的保守氨基酸重复序列c-1和c-2[19, 20]。许宽勇等[21]对苹果MdCAX1的研究发现,MdCAX1属于Ⅰ-A型,编码350个氨基酸,且其N-末端调节区(NRR)对MdCAX1没有抑制作用,荧光定量PCR分析表明,Ca2+、Mn2+诱导处理后表达量较对照有大幅度提高。
本文利用生物信息学方法搜索苹果全基因组数据库,鉴定苹果CAXs基因家族成员,分析基因的结构域、序列保守性和其进化关系,并利用实时荧光定量PCR方法分析了MdCAXs家族成员在不同种类盐处理后的表达变化,以期为研究MdCAXs的生物学功能奠定理论基础。
1 材料与方法
1.1 苹果MdCAXs家族基因的确定
用InterProScan 5[22]分析已克隆的MdCAX 1 基因(登录号为:FJ008871),获得3个主要结构域IPR004713(calcium/proton exchanger)(TIGR00846)、IPR004798(calcium/proton exchanger CAX)(TIGR00378)和IPR004837(sodium/calcium exchanger membrane region)(PF01699)(Na_Ca_ex),下载最新预测的‘金冠’苹果蛋白质组(下载于第8版的Phytozome)建立本地搜索,借助于隐马模型程序HMMER(3.0)[23],获得潜在的CAX蛋白。从拟南芥基因组数据库(http://www.arabidopsis.org)中下载已注册的6个AtCAXs,其他物种序列下载于NCBI。
1.2 MdCAXs家族基因的生物信息学鉴定
利用MEGA 6.0软件对预测的苹果MdCAXs蛋白序列与拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、玉米(Zea mays)、大麦(Hordeum vulgare)、盐地碱蓬(Suaeda salsa)、蓖麻(Ricinus communis)、毛果杨(Populus trichocarpa)、绿豆(Vigna radiata)、裂叶牵牛(Ipomoea nil)、胡菜(Arabidopsis lyrata subsp.lyrata)、桃(Prunus persica)、荠菜(Capsella bursa-pastoris)、莱茵衣藻(Chlamydomonas reinhardtii)、酿酒酵母(Saccharomyces cerevisiae)等NCBI数据库中已收录的CAX序列进行序列同源性分析,并利用邻接算法(Neighbor-Joining)构建系统进化树,Bootstrap重复设1 000。利用perl程序选取MdCAXs基因的染色体位置信息,并利用MapDraw工具进行染色体定位作图。利用DNAMAN生物学软件进行保守域序列比对分析。
用相关网站分析:氨基酸的理化性质(http://web.expasy.org/protparam/)、跨膜区域预测(http://www.cbs.dtu.dk/services/TMHMM)、结构功能域预测(http://smart.embl-heidelberg.de/和http://www.ebi.ac.uk/interpro)、亚细胞定位预测(http://psort.hgc.jp/form2.html)。内含子外显子预测参照http://genes.mit.edu/GENSCAN.html。
1.3 MdCAXs基因表达分析
选取同一批生根培养、生长状态一致的‘长富6号’苹果组培苗进行液体培养,培养液为Hoagland营养液,取生长一致的苗进行处理。将材料分成5组,1组为对照(CK),用正常的Hoagland营养液培养,其他4组分别用不同种类的盐处理:Na+盐处理,在Hoagland培养液中添加80 mmol · L-1 NaCl;Ca2+盐处理,添加100 mmol · L-1 CaCl2;Mg2+盐处理,添加50 mmol · L-1 MgCl2;Mn2+盐处理,添加2 mmol · L-1 MnCl2。处理16 h后取根、茎、叶液氮冷冻。采用改良CTAB法[24]提取RNA,用TaKaRa公司的PrimeScript RT reagent Kit进行反转录,cDNA用于实时荧光定量PCR进行表达分析。所用的特异引物和预计产物长度见表 1,所用内参基因为Mdtubulin(GU317944)。
通过搜索苹果全基因组数据库,共获得8个MdCAXs基因家族成员,将这些MdCAXs基因与拟南芥(6个)、水稻(6个)、玉米(2个)、大麦(1个)、盐地碱蓬(1个)、蓖麻(1个)、毛果杨(1个)、绿豆(1个)、裂叶牵牛(1个)、胡菜(1个)、桃(1个)、荠菜(1个)、莱茵衣藻(2个)和酿酒酵母(1个)的CAX基因序列进行系统进化分析(图 1)。结果表明:进化树被分为4个不同的进化分支,其中8个MdCAXs基因与高等植物拟南芥、水稻、玉米、大麦、盐地碱蓬、蓖麻、毛果杨、绿豆、裂叶牵牛、胡菜、桃和荠菜的CAXs形成独立的A亚型和B亚型两大分支,而酿酒酵母VCX 1和莱茵衣藻CrCAX1、CrCAX2 分别位于独立的F亚型和C亚型,这与Shigaki等[19]的分析结果相似。A亚型包含4个基因,即MdCAX 1、MdCAX3、MdCAX4、MdCAX5 ;B亚型包含4个基因,即MdCAX 2、MdCAX6、MdCAX7、MdCAX8。其中MdCAX1、MdCAX3位于第4染色体上,MdCAX 2、MdCAX8 位于第9染色体上,MdCAX 7 位于第3染色体上,MdCAX 4 位于第11染色体上,MdCAX 5 位于第12染色体上,MdCAX 6位于第17染色体上(表 2)。
从表 2可见:苹果MdCAXs蛋白中A亚型蛋白质含有氨基酸数比B亚型少,等电点在4.97~6.81之间,氨基酸序列的平均亲水系数(grand average of hydropathicity,GRAVY)均为正值,表明它们的蛋白质均属于疏水蛋白,但疏水程度不同。
2.2 苹果MdCAXs的基因结构
利用苹果MdCAXs的开放阅读框(ORF)和基因组序列,确定了苹果MdCAXs基因的内含子和外显子的分布情况(图 2),分析表明,A亚型的内含子数目为10~11个,B亚型的内含子数目为12~14个;内含子在0、1、2相位均有出现。
MdCAXs在进化上是相对保守的,在氮末端具有一段32个氨基酸左右的NRR,在序列的羧基端有C-端功能区域,在M3~M4、M8~M9之间均含有保守的c-1和c-2序列,其保守序列与离子转运专一性有关[19, 20];M6~M7之间有一个酸性氨基酸序列,将MdCAXs分成大约相等的两部分;虽然A亚型和B亚型的保守氨基酸重复序列稍有不同,但A亚型的M4后均含有高亲水氨基酸区域,B亚型中含有CAF残基;M1~M2之间有9个同源性较差的氨基酸序列,可能是识别阳离子的重要区域[25];M5~M6之间有相似性较低的一个亲水区域,对拟南芥CAXs的研究发现,这段序列对胞质pH值起调节作用,称为D功能区(图 3)。
用Pfam在线软件对苹果MdCAXs蛋白序列进行分析,结果表明:8条序列中都含有Na+/Ca2+转运蛋白保守结构域,位置位于第96~456个氨基酸之间,该区域是一个保守序列比较集中的区域。其中MdCAX2在第29~202个氨基酸之间含有2个植物自交不亲和蛋白S1结构域(self-incomp-S1),MdCAX6在第490~545个氨基酸之间含有1个N末端结构域(PMR5N),MdCAX7在第490~636个氨基酸之间含有1个氨基酸跨膜转运蛋白结构域(Aa-trans)。
利用TMHMM Server v.2.0软件对MdCAXs蛋白进行跨膜结构分析,结果(图 3)表明:MdCAX2蛋白有12个跨膜区域,前2个跨膜区域位于植物自交不亲和蛋白S1结构域内,MdCAX7蛋白有14个跨膜区域,后3个跨膜区域位于氨基酸跨膜转运蛋白结构域内。其余的蛋白都是11个跨膜区域,跨膜位置基本上都位于保守的Na+/Ca2+转运蛋白保守结构域内。
2.5 苹果MdCAXs的亚细胞定位预测
用PSORT在线工具预测MdCAXs的亚细胞定位,分析结果见表 3。A亚型蛋白主要分布在质膜上,少量分布在内质网上;B亚型蛋白也是主要分布在质膜上,除内质网外,线粒体、液泡、高尔基体也有少量分布。许宽勇等[21]对MdCAX1亚细胞定位研究表明,该蛋白是一种质膜蛋白。
将生根的组培苗进行4种不同盐处理后,检测MdCAXs家族8个基因在苹果根、茎和叶中的表达水平。由图 4可见:MdCAX 1 经Na+、Ca2+、Mg2+和Mn2+处理后,与对照相比,叶和茎中的表达量增加,其中以Ca2+和Mn2+处理增加较为明显;而根中与对照相比出现下调,Mg2+处理后表达量几乎检测不到。4种离子处理后,MdCAX 2 在叶片中表达下调;在根中,除了Mn2+外,其他3种离子处理MdCAX 2 表达上调,其中以Ca2+处理上调最为明显。MdCAX 3 在4种离子处理后叶片中的表达量均上调,其中Ca2+和Mn2+处理后增加较为明显;在茎中,Na+、Ca2+处理后表达量增加,而在根中表达量基本不受影响,Mg2+和Mn2+处理,在茎和根中表达呈下调趋势。MdCAX 4的表达趋势与MdCAX1 类似,处理后茎和叶表达增加;而根中表达量下调,Mg2+处理后表达量几乎为零。MdCAX 5 只有在Ca2+处理后茎中的表达量有少量增加;叶片中的表达量在4种离子处理后都出现不同程度的下降;根中的表达量在Ca2+、Mg2+处理下出现下降,Na+、Mn2+处理后基本保持不变。MdCAX 6 在不同的离子处理后,茎中几乎没有变化,叶片和根中呈上调表达,以叶片中(尤其Mg2+处理)上调表达明显。MdCAX 7 在处理后主要是茎中的表达量增加,以Ca2+处理茎中增加最为显著;而叶和根中变化不明显,而Mg2+、Mn2+处理MdCAX 7在根、茎、叶的表达量变化较小。MdCAX8在Na+、Ca2+、Mn2+处理后根中表达量明显增加,而Mg2+处理表达量没有变化;4种离子处理茎中MdCAX 8 基因呈上调表达,尤以Mg2+处理为甚,而对叶中MdCAX 8 表达影响较小。因而,苹果MdCAXs家族基因经不同盐离子处理后,在不同器官中表现差异表达,这可能是其功能差异所导致,具体原因还需进一步研究。
通过苹果全基因组搜索,本文检索到8个CAX基因家族成员,MdCAXs A亚型的内含子数目为10~11个,B亚型的内含子数目为12~14个,与拟南芥等植物中CAXs内含子数目9~11相近,这说明CAX在进化过程中是相对保守的。氨基酸保守序列和进化分析表明,苹果MdCAXs蛋白都符合高等植物CAX基本特征,即含有5个典型的功能区,即N-端自抑制区域(NRR)、C-端功能区域、Ca2+功能域(CaD)、C功能域和D功能域。NRR功能域存在于大多数CAX蛋白中,调节CAX的功能,拟南芥CAX1的NRR区S、R、T等氨基酸残基在NRR调节Ca2+/H+反向转运活性中起重要作用[25];也有研究表明去除NRR功能域对MdCAX1转运功能影响不大[21];苹果所有CAX蛋白在氮末端都含有NRR功能域,NRR功能域在调节苹果CAX转运活性中的作用还有待进一步研究。CaD是识别Ca2+的重要区域,MdCAXs在TM1和TM2之间有9个同源性较差的氨基酸序列为钙离子结合区(CaD),对Ca2+转运的选择具有专一性,且决定CAXs转运Ca2+的能力[25]。拟南芥AtCAX2的C功能域与Mn2+专一性转运相关,CAF氨基酸残基赋予其转运Mn2+的功能[26],氨基酸序列表明MdCAX2、MdCAX6、MdCAX7和MdCAX8均含有CAF残基,同归为B亚型,推测它们可能参与Mn2+转运。D功能域对胞质的pH起调节作用[27],序列中的His残基是结合H+、感知pH的关键位点;sAtCAX2的D功能域是位于M5~M6之间的1个亲水区域,含有2个His222和His226残基,当把His222/226定点突变为带正电荷的碱性赖氨酸(K)时,突变体对Ca2+和Mn2+敏感性与sAtCAX2的一致,且不影响sAtCAX2对Mn2+转运的专一性,但突变为带负电荷的酸性天冬氨酸(D)时突变体无转运活性[28];苹果MdCAXs B亚型的M5~M6之间D功能区域中含有带正电荷的碱基K、R和H,可能是结合H+,感知pH的关键位点。A亚型在其他跨膜区域有多个His残基,影响蛋白对离子选择与转运的作用[27];MdCAX1的H331在8条序列中都是保守的,位于c-2区域中,可能与离子的选择转运相关。
对CAXs的亚细胞定位发现,CAXs主要定位于液泡膜、质膜和叶绿体类囊膜上,在线粒体膜上也有报道[29, 30]。目前已克隆的植物CAXs中大豆GmCAX1[18]、苹果MdCAX1[21]、水稻OsCAX3[17]定位于质膜上;拟南芥中的AtCAX1、AtCAX2、AtCAX3、AtCAX4,豇豆的VCAX1,水稻中的OsCAX1a,盐地碱蓬中的SsCXA1[31]和碱茅中的Put-CAX1[32]等都定位于植物的液泡膜上。本文中对苹果的CAXs进行预测,发现8个基因主要定位于质膜上,但还需进一步进行试验验证。
CAXs基因家族在不同的组织表达模式不同[33],如盐地碱蓬SsCAX 1主要在茎和叶片表达而在根部几乎检测不到,棉花GhCAX3 主要在叶、茎、柱头、花瓣和胚珠中表达,在根和纤维组织中的表达量较少[34]。苹果MdCAXs基因也有组织特异表达特征,不同的MdCAX在根、茎、叶中表达量不同。同时,CAX对不同阳离子有特异性的应答反应,说明CAX不仅是钙离子转运蛋白,还可能转运其他金属离子。在Na+、Ca2+、Mg2+和Mn2+盐处理下,MdCAX 1、MdCAX3、MdCAX4、MdCAX6和MdCAX7 基因在叶中的表达量增加,其中Ca2+处理后最为明显,而根中变化幅度不大,甚至表达量下调。而MdCAX 2 在4种离子处理后,叶中表达量下调,根中表现上调(除Mn2+处理外);MdCAX 8 对离子处理响应的器官主要在茎和根中,4种离子处理后表达明显上调,尤其是茎中MdCAX 8 对Mg2+处理响应强烈。因此,苹果不同器官内CAX对外界离子具有特异性应答反应,暗示它们存在不同的离子转运功能。
基因Gene 上游引物(5′→3′)Forward primer 下游引物(5′→3′)Reverse primer 长度/bp Length
Mdtubulin AGGATGCTACAGCCGATGAG GCCGAAGAACTGACGAGAATC 192
MdCAX1 GCTCCTGGCTGTGTTGTG CAATGCTGCTGGCTCTGG 116
MdCAX2 AAGACGGAGCAAGTGTTC CATAGGCGACGAGCATAA 178
MdCAX3 AAGTTGATGGTGAGAGGAT TACAAGGATGAGGCTGAG 182
MdCAX4 GTCAAGAACAAGCAGCATT CATACCAACCAGCCAACT 166
MdCAX5 GCTGCTCCTGGCTCTGCTG TCACAATGCTGCTGGCTCTGG 122
MdCAX6 CTCATCAGCAGCCACCAG TCGCCAAAGGACCAAAGG 182
MdCAX7 TCCAACAACCTCCTCTCC TTCCACAGCCATACAAGC 154
MdCAX8 CAGACAAGAATGCCAAGATT CAGTAAGCCTCCAAGTCA 110

图 1 苹果MdCAXs与其他物种CAXs的系统进化树 Fig. 1 Phylogenetic tree of the amino acid sequences of apple MdCAXs family and other species CAXs
类别
Group基因编号
Gene No.登录号
Accession No.染色体定位
Chromosome location氨基酸大小
Size相对分子质量
Relative molecular weight等电点
Isoelectric point平均亲水系数
GRAVY
ⅠA MdCAX1 MDP0000233396 Chr4:15321007-153245462 450 113 762.5 5.00 0.716
MdCAX3 MDP0000166875 Chr4:15322171-15319329 436 110 627.9 6.79 0.689
MdCAX4 MDP0000193502 Chr11:6587004-6583665 451 114 649.7 6.52 0.680
MdCAX5 MDP0000141538 Chr12:23553807-23557595 450 114 122.9 5.00 0.712
ⅠB MdCAX2 MDP0000165349 Chr9:9774177-9781432 709 177 622.6 6.81 0.681
MdCAX6 MDP0000244954 Chr17:12370044-12359450 817 204 277.5 6.30 0.670
MdCAX7 MDP0000289952 Chr3:3470671-3478189 651 162 937.1 7.12 0.611
MdCAX8 MDP0000320927 Chr9:12193337-12201585 600 150 031.5 4.97 0.659

图 2 苹果MdCAXs基因结构分析 Fig. 2 Structure of MdCAXs genes in apple

图 3 苹果MdCAXs家族氨基酸序列比对 Fig. 3 Alignment of the amino acid sequences of apple MdCAXs family
% 类别
Group蛋白
Protein内质网
Endoplasmic reticulum质膜
Plasma membrane线粒体
Mitochondrial液泡
Vacuolar高尔基体
Golgi
ⅠA MdCAX1 13.0 87.0
MdCAX3 13.0 87.0
MdCAX4 17.4 82.6
MdCAX5 17.4 82.6
ⅠB MdCAX2 30.4 47.8 8.7 8.7 4.3
MdCAX6 17.4 73.9 4.3 4.3
MdCAX7 17.4 69.6 4.3 4.3 4.3
MdCAX8 17.4 69.6 4.3 4.3 4.3 注:数据代表在各组织中所占比例。
Note:Data represent the proportions in tissues.
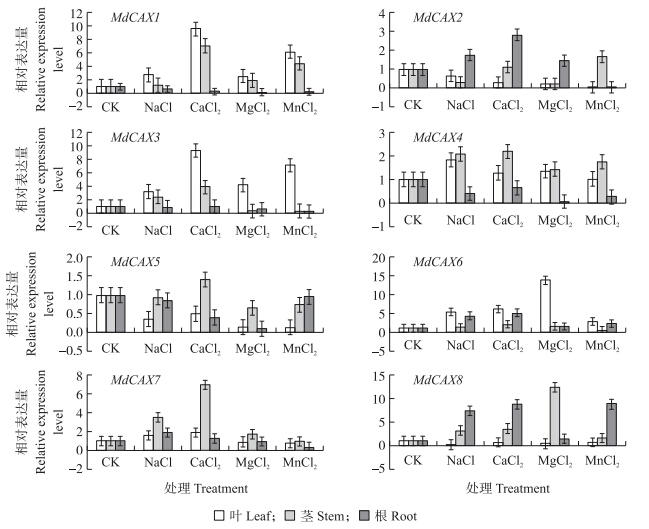
图 4 不同盐处理后MdCAXs家族基因在苹果不同营养器官中的表达分析 Fig. 4 Expression analysis of MdCAXs genes in the different vegetative organs after the different salt treatments
| [1] | Marschner H. Mineral Nutrition of Higher Plants[M]. 2nd ed. London:Academic Perss,1995 |
| [2] | Sanders D,Brownlee C,Harper J F. Communication with calcium[J]. Plant Cell,1999,11:691-706 |
| [3] | Tzu Y L,Kyaw A,Ching Y T,et al. Vacuolar Ca2+/H+ transport activity is required for systemic phosphate homeostasis involving shoot-to-root signaling in Arabidopsis[J]. Plant Physiology,2011,156:1176-1189 |
| [4] | Bush D S. Calcium regulation in plant cells and its role in signaling[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:95-122 |
| [5] | Ueoka-Nakanishi H,Nakanishi Y,Tanaka Y,et al. Properties and molecular cloning of Ca2+/H+ antiporter in the vacuolar membrane of mung bean[J]. European Journal of Biochemistry,1999,262:417-425 |
| [6] | Cheng N H,Pittman J K,Barkla B J,et al. The Arabidopsis cax1 mutant exhibits impaired ion homeostasis,development,and hormonal responses and reveals interplay among vacuolar transporters[J]. Plant Cell,2003,15(2):347-364 |
| [7] | Manohar M,Mei H,Franklin A J,et al. Zebrafish(Danio rerio)endomembrane antiporter similar to a yeast cation/H+ transporter is required for neural crest development[J]. Biochemistry,2010,49(31):6557-6566 |
| [8] | Manohar M,Shigaki T,Hirschi K D. Plant cation/H+ exchangers(CAXs):biological functions and genetic manipulations[J]. Plant Biology,2011,13(4):561-569 |
| [9] | Shigaki T,Hirschi K D. Diverse functions and molecular properties emerging for CAX cation/H+ exchangers in plants[J]. Plant Biology,2006,8(4):419-429 |
| [10] | Cheng N H,Pittman J K,Shigaki T,et al. Characterization of CAX4,an Arabidopsis H+/cation antiporter[J]. Plant Physiology,2002,128(4):1245-1254 |
| [11] | Pittman J K,Shigaki T,Marshall J L,et al. Functional andregulatory analysis of the Arabidopsis thaliana CAX2 cation transporter[J]. Plant Molecular Biology,2004,56(6):959-971 |
| [12] | Pittman J K,Edmond C,Sunderland P A,et al. A cation-regulated and proton gradient-dependent cation transporter from Chlamydomonas reinhardtii has a role in calcium and sodium homeostasis[J]. The Journal of Biological Chemistry,2009,284(1):525-533 |
| [13] | Edmond C,Shigaki T,Ewert S,et al. Comparative analysis of CAX2-like cation transporters indicates functional and regulatory diversity[J]. Biochemical Journal,2009,418(1):145-154 |
| [14] | Williams L,Pittman J. Dissecting pathways involved in manganese homeostasis and stress in higher plant cells[C]//Hell R,Mendel R R. Cell Biology of Metals and Nutrients. Berlin:Springer,2010:95-117 |
| [15] | Wu Q,Shigaki T,Williams K A,et al. Expression of an Arabidopsis Ca2+/H+ antiporter CAX1 variant in petunia enhances cadmium tolerance and accumulation[J]. Journal of Plant Physiology,2011,168(2):167-173 |
| [16] | Shen G M,Du Q Z,Wang J X. Involvement of plasma membrane Ca2+/H+ antiporter in Cd2+ tolerance[J]. Rice Science,2012,19(2):161-165 |
| [17] | Nana Y,Cattarin T,Suriyan C,et al. Expression and functional analysis of putative vacuolar Ca2+-transporters(CAXs and ACAs)in roots of salt tolerant and sensitive rice cultivars[J]. Protoplasma,2014,doi:10.1007/s00709-014-0615-2 |
| [18] | Luo G Z,Wang H W,Huang J,et al. A putative plasma membrane cation/proton antiporter from soybean confers salt tolerance in Arabidopsis[J]. Plant Molecular Biology,2005,59(5):809-820 |
| [19] | Shigaki T,Nakhleh L,Hirschi K D,et al. Identification of three distinct phylogenetic groups of CAX cation/proton antiporters[J]. Journal of Molecular Evolution,2006,63(6):815-825 |
| [20] | Kamiya T,Maeshima M. Residues in internal repeats of the rice cation/H+ exchanger are involved in the transport and selection of cations[J]. Journal of Biological Chemistry,2003,279(1):812-819 |
| [21] | 许宽勇,王三红,王庆菊,等. 富士苹果Ca2+/H+反向转运体基因克隆、序列分析及其亚细胞定位[C]//第二届全国果树分子生物学学术研讨会论文集,2009 [Xu K Y,Wang S H,Wang Q J,et al. Cloning,sequence analysis and subcellular localization of Ca2+/H+ antiporter in Fuji apple[C]//Proceedings of the Second National Symposium on Molecular Biology of Pomology,2009(in Chinese)] |
| [22] | Philip J,David B,Chang H Y,et al. InterProScan 5:genome-scale protein function classification[J]. Bioinformatics Advance Access,2014,doi:10.1093/bioinformatics/btu03 |
| [23] | Eddy S R. Profile hidden Markov models[J]. Bioinformatics,1998,14(9):755-763 |
| [24] | 蔡斌华,张计育,高志红,等. 一种改良的提取草莓属叶片总RNA的方法[J]. 江苏农业学报,2008,24(6):875-877 [Cai B H,Zhang J Y,Gao Z H,et al. An improved method for isolation of total RNA from the leaves of Fragaria spp.[J]. Jiangsu Journal of Agricultural Sciences,2008,24(6):875-877(in Chinese with English abstract)] |
| [25] | Shigaki T,Cheng N H,Pittman J K,et al. Structural determinants of Ca2+ transport in the Arabidopsis H+/Ca2+ antiporter CAX1[J]. The Journal of Biological Chemistry,2001,276(46):43152-43159 |
| [26] | Shigaki T,Pittman J K,Hirschi K D. Manganese specificity determinants in the Arabidopsis metal/H+ antiporter CAX2[J]. The Journal of Biological Chemistry,2003,278(8):6610-6617 |
| [27] | Shigaki T,Barkla B J,Miranda-Vergara M C,et al. Identification of a crucial histidine involved in metal transport activity in the Arabidopsis cation/H+ exchanger CAX1[J]. The Journal of Biological Chemistry,2005,280(34):30136-30142 |
| [28] | Pittman J K,Shigaki T,Hirschi K D. Evidence of differential pH regulation of the Arabidopsis vacuolar Ca2+/H+ antiporters CAX1 and CAX2[J]. FEBS Letters,2005,579(12):2648-2656 |
| [29] | Blackford S,Rea P A,Sanders D. Voltage sensitivity of Ca2+/H+ antiport in higher plant tonoplast suggests a role in vacuolar calcium accumulation[J]. The Journal of Biological Chemistry,1990,265:9617-9620 |
| [30] | Ettinger W F,Anne M C,Katheryn J F,et al. Identification of a Ca2+/H+ antiport in the plant chloroplast thylakoid membrane[J]. Plant Physiology,1999,119:1379-1385 |
| [31] | Ning H,Qun S,Hua Y B,et al. Cloning and characterization of a Ca2+/H+ antiporter from halophyte Suaeda salsa L.[J]. Plant Molecular Biology Reporter,2011,29:449-457 |
| [32] | Liu H,Zhang X X,Takano T,et al. Characterization of a PutCAX1 gene from Puccinellia tenuiflora that confers Ca2+ and Ba2+ tolerance in yeast[J]. Biochemical and Biophysical Research Communications,2009,383(4):392-396 |
| [33] | Cheng N H,Pittman J K,Shigaki T,et al. Functional association of Arabidopsis CAX1 and CAX3 is required for normal growth and ion homeostasis[J]. Plant Physiology,2005,138(4):2048-2060 |
| [34] | Xu L,Zahid K R,He L R,et al. GhCAX3 gene,a novel Ca2+/H+ exchanger from cotton,confers regulation of cold response and ABA induced signal transduction[J]. PLoS ONE,2013,8(6):e66303 |




