文章信息
- 赵娟, 沈佳, 李海梅, 娄群峰, 李季, 陈劲枫. 2015.
- ZHAO Juan, SHEN Jia, LI Haimei, LOU Qunfeng, LI Ji, CHEN Jinfeng. 2015.
- MTG-DAPI双染色法观察黄瓜花粉细胞半薄切片中线粒体DNA的研究
- The research of detecting the mitochondrial DNA in semi-thin sliced pollen grains of Cucumis sativus L.by MTG-DAPI double-staining method
- 南京农业大学学报, 38(1): 27-32
- Journal of Nanjing Agricultural University, 38(1): 27-32.
- http://dx.doi.org/10.7685/j.issn.1000-2030.2015.01.005
-
文章历史
- 收稿日期:2014-05-16
DAPI(4′,6-二脒基-2-苯基吲哚,4′,6-diamidino-2-phenylindole)是一种理想的DNA染料[1]。当DAPI与双股DNA结合时,最大吸收波长为364 nm,最大发射波长为454 nm,紫外光下激发呈现蓝色荧光。Kuroiwa等[2]利用DAPI染色的方法观察到了叶绿体消失的现象引起了研究者的兴趣,并一直沿用这个方法研究植物细胞器基因组检测。
由于DAPI对叶绿体和线粒体的基因组着色没有差异,所以基于半薄切片和双染色的新技术被开发出来[3, 4],该技术选用DIOC6(3,3′-二己基含氧碳菁碘代物)荧光染色剂作为线粒体膜染料。但是DIOC6染料在不同的浓度范围内可以对细胞中不同细胞器膜或核膜进行着色,选择特异性不是很强[5]。而MTG(Mito Tracker Green)是一种线粒体(mitochondria)特异绿色荧光探针,检测时的最大激发波长为488 nm,最大发射波长为516 nm。MTG对线粒体的染色不依赖于线粒体膜电位,它既可以用于活细胞匀浆染色[6],也可以对固定细胞悬液进行染色[7, 8]。目前还未见将MTG应用于细胞的树脂半薄切片中线粒体的荧光染色的报道。
不同于绝大多数植物细胞器的母系遗传规律,黄瓜种内及种间杂交研究结果表明黄瓜线粒体为父系遗传[9, 10]。因此可以推测,黄瓜花粉细胞发育过程中的生殖细胞包含有线粒体基因组并通过受精过程遗传给子代,但目前并无细胞学证据。本研究将黄瓜贴壁期(生殖细胞营养细胞共存期)花粉细胞,用DAPI和MTG两种染料对DNA及其线粒体膜进行特异染色,从而在细胞学水平上确定线粒体DNA在黄瓜花粉细胞中的存在和分布情况,为下一步深入分析植物线粒体父系遗传机制提供技术支持。
1 材料与仪器设备 1.1 材料
选择‘北京截头’黄瓜作为试验材料,于2013年3月上旬播种在含有基质的营养钵中,经40 d苗期生长后定植在南京农业大学江浦园艺试验田的塑料大棚中进行正常栽培管理。在黄瓜盛花期时,取新鲜的不同发育时期的黄瓜雄花花蕾。贴壁期是单核花粉细胞向双核转变的时期,在此阶段可以观察到花粉细胞中生殖细胞核和营养细胞核的分裂情况,因此双染色操作时选取贴壁期花粉细胞作为试验材料。
1.2 主要仪器设备
Olympus BX43型光学显微镜;Leica Ultracut R型超薄切片机;Olympus BX53型荧光显微镜。
2 方法的建立
试验采用的方法联合了醋酸洋红染色[11]、Technovit 7100树脂半薄切片和MTG-DAPI双染色3个技术。具体操作如流程图所示(图 1)。
2.1 树脂包埋样品的制备 2.1.1 取样
采集新鲜的不同发育时期的黄瓜雄花花蕾,收集于湿润的吸水纸中。在载玻片上滴10 g · L-1醋酸洋红溶液(将1 g洋红溶于100 mL冰醋酸后,将溶液与一小块锈铁加热至沸腾即可)20 μL,用镊子将花粉细胞从花药中挤入醋酸洋红溶液中,盖上盖玻片,于酒精灯上烤片(注意不要让染液沸腾)。然后将染过色的载玻片放在显微镜下观察,判断花粉细胞的发育时期。选择贴壁期的花蕾,用镊子转移至固定液中[含2.5%(体积分数)戊二醛的0.1 mol · L-1磷酸缓冲液,pH 7.2],抽真空后置于4 ℃冰箱,固定12 h。用镊子将固定液中的花蕾取出置于载玻片上,取下花药并转移至1.5 mL EP管中(注意尽量去除非花药结构的杂质)。使用微量移液器将固定液吸出弃掉,加入1 mL 0.1 mol · L-1磷酸缓冲液对花药进行清洗,每次20 min,共清洗4次,最后用蒸馏水清洗20 min。 2.1.2 乙醇脱水和渗透
将蒸馏水吸出弃掉,用乙醇对样品进行梯度脱水:15%(体积分数)乙醇30 min,30%乙醇1 h,50%乙醇过夜,70%乙醇1 h。挑选5个花药于1.5 mL EP管中用85%乙醇脱水1 h(剩余的样品于70%乙醇中保存于-20 ℃冰箱),90%乙醇1 h,95%乙醇1 h(每30 min更换1次溶液),100%乙醇(无水硫酸铜处理过)脱水2 h(中间更换2次溶液,时间不宜过长)。脱水后的花药置于预渗透液[Technovit 7100树脂(Kulzer and Co,Wehrheim,Germany)试剂盒中的Basic Liquid溶液和无水乙醇的体积比为1 ∶ 1]中室温静置3 h(预渗透时间不宜过长,控制在6 h以内)。然后转入渗透液(渗透液由100 mL的Basic Liquid与1 g Technovit 7100树脂试剂盒中的HardenerⅠ粉末混合)中常温下渗透过夜。注意预渗透液和渗透液的配置应尽可能保持干燥。 2.1.3 样品包埋和保存
用镊子将渗透好的样品加入21孔包埋板的胶囊孔中,每孔加300 μL包埋液(每500 μL渗透液加33 μL Technovit 7100树脂试剂盒中的HardenerⅡ溶液,快速轻轻混匀),调整样品方向和位置(室温操作控制在5 min以内),立即转入45 ℃恒温箱中固化5~7 d,前2 d不可以移动样品。室温较高时,室温下的操作时间也要相应的减少。包埋好的样品块置于吸水纸中常温保存。由于温度较低时样品硬度会降低,所以保存样品切片时,要提前3~5 d放置于45 ℃恒温箱中固化。
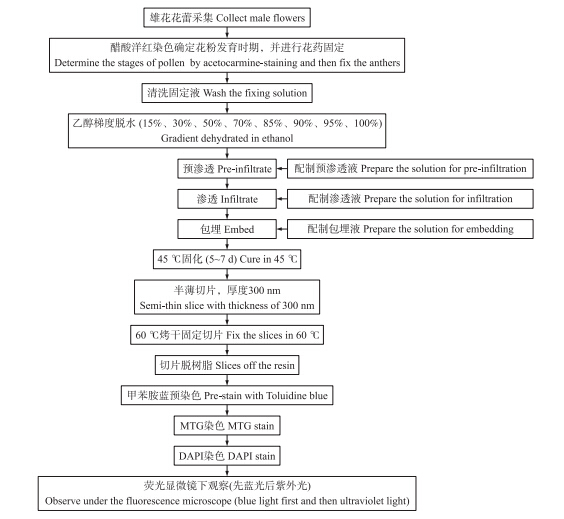 | 图 1 花粉细胞半薄切片MTG-DAPI双染色操作流程图 Fig. 1 Process of semi-thin sliced pollen grains double stained with MTG-DAPI |
将聚合好的样品块用双面刀片进行修整,在切到有花粉细胞的位置时通过体式显微镜进行辨认,此时停止修整并将样品转移到超薄切片机上。调整切片厚度为1~3 μm进行切片,通过超薄切片机清晰地观察到花粉细胞的结构时,调整厚度为300 nm进行正常切片。用经高温加热然后拉长成细丝状的玻璃丝挑起切片转移至滴有去离子水的载玻片上,60 ℃恒温箱中烤干固定(每个载玻片可放12片)。烤干后用镊子夹住附着有切片的载玻片置于无水乙醇(无水硫酸铜处理过)中,摇床上低速摇10 min,脱去切片中的树脂。 注意进行切片操作时,可能存在的问题有:样品太软、切片卷曲、切片成碎末、样品脱水过度、切片时花粉细胞的识别困难等问题。可以从以下几个方面进行调整:第一,修整样品块时尽量将切面修小(小于1 cm2),这样既可以解决样品太软的问题,也能防止切片卷曲;第二,切成粉末一般是因为沾了水,这是不可逆的,所以只能重新制样;第三,脱水到95%乙醇时可以加入固绿染液对花药壁进行染色,方便确定花粉细胞位置。 2.2.2 预染色
将脱树脂处理过的切片转移到5 g · L-1TBO(甲苯胺蓝粉末溶于70%乙醇)染色液中染色。染色时间设置梯度为:0 min、20 min、40 min、1 h、1.5 h、2 h、2.5 h和3 h,染色结束后用无水乙醇清洗3次,每次2 min,最后一次用蒸馏水清洗3 min,然后晾干。对于不同预染色处理过的切片全部用2 μmol · L-1 MTG工作液染色10 min后观察,确定最佳预处理时间。 2.2.3 MTG染色和清洗
试验材料为经过预染色但是还未进行MTG染色的切片。选择MTG染色液的浓度和染色时间2个变量,分别根据单一变量原则设置梯度试验。将MTG储液(Mito Tracker Green FMTM溶于二甲基亚砜溶液中,浓度为1 mmol · L-1)稀释成2 000、20、2×10-1、2×10-3、2×10-5和2×10-7 nmol · L-1共6个浓度的工作液,分别对切片染色10、20、30、40、50和60 min,共36个处理。处理完成后的切片置于摇床上,在50%的乙醇中清洗3 min,再于蒸馏水中清洗3 min,最后用滤纸吸走多余的水分。 2.2.4 DAPI染色和拍照
用0.1 μg · mL-1 DAPI溶液染色6 min(黑暗下)。DAPI溶液的配置:将DAPI粉末溶于Tan Buffer(含20 mol · L-1 Tris · HCl,0.5 mmol · L-1 EDTA,1.2 mol · L-1亚精胺和7 mol · L-1 β-巯基乙醇)中配制成浓度为100 mg · mL-1的储备液,使用时用Tan Buffer将储备液稀释至0.1 μg · mL-1。染色完成后的切片用吸水纸吸去染液,即可用于荧光显微镜的观察,先在蓝光下观察MTG染色结果,再在紫外光下观察DAPI染色图像并拍照。
3 结果与分析 3.1 醋酸洋红染色
由图 2可见:通过醋酸洋红染色可以明显区分出黄瓜贴壁期花粉细胞的1个生殖细胞核(紧贴花粉细胞壁)和1个营养核,细胞质中还分散一些小液泡。表明该方法能很好地确定黄瓜花粉细胞的发育时期。
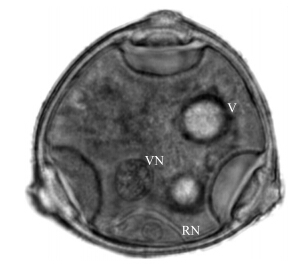 | 图 2 黄瓜贴壁期花粉细胞醋酸洋红染色图(×1 000) Fig. 2 Picture of adhere pollen of cucumber stained with acetocarmineVN:营养核Vegetative nucleus;RN:生殖细胞核Reproductive cell nucleus;V:液泡Vacuole。The same as follows. |
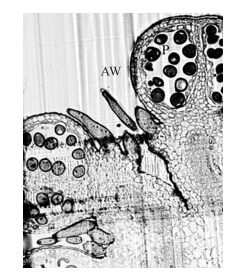 | 图 3 黄瓜花药Technovit 7100树脂 半薄切片图(×100) Fig. 3 Image of Technovit 7100 semi-thin section of cucumberP:花粉细胞Pollen cell;AW:花药壁Anther wall |
3.2 树脂切片
光镜下观察显示,Technovit 7100树脂的透光度比较好,能够保证荧光染料的着色效果。由图 3可见:厚度为300 nm的黄瓜花药树脂切片视野明亮并可清晰观察到黄瓜的花药壁及花粉细胞结构。一般每个样品切2张载玻片,每个载玻片上放12个树脂切片,就可以保证能切到花粉细胞中2个细胞核同时存在的状态。 3.3 染色条件
研究表明:影响切片染色效果的因素主要有4个方面,分别为花粉细胞壁的吸附力、荧光染料的种类、荧光染料的浓度及染色时间。 3.3.1 预染色处理条件
本研究显示花粉细胞壁对荧光染料的吸附力过强时会导致花粉细胞壁亮度过高,从而影响花粉细胞内的染色效果。此时用非荧光染料TBO进行预染色处理,让细胞壁首先吸附TBO染料,就会降低对荧光染料的吸附。最终降低花粉细胞壁的荧光着色,从而提高染色效果。
TBO预处理时间梯度检测显示:当处理时间超过1 h的时候,切片因浸泡太久发生脱落;而处理时间少于20 min时,TBO着色太浅不能起到预染色的效果。由图 4可见:TBO预处理20 min时,DAPI和MTG染色图中的花粉细胞壁染色都很亮,影响了细胞内生殖核周围细胞器的着色效果。所以用TBO进行预处理,处理时间控制在40 min左右时效果最好(图 5)。
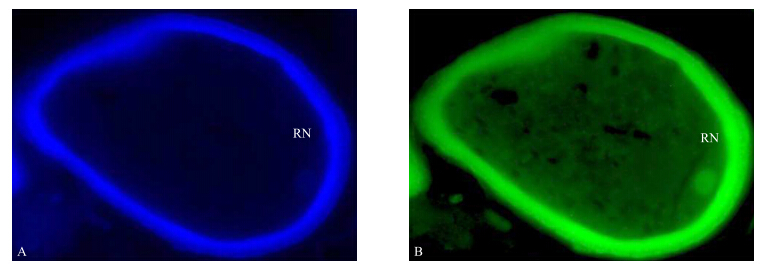 | 图 4 TBO预处理时间为20 min时的黄瓜花粉细胞染色图(×1 000) Fig. 4 Fluorescence color micrographs of cucumber pollen after pretreatment with TBO for 20 minutesA.DAPI荧光染色图DAPI-stained epifluoresence microphotograph;B.MTG荧光染色图MTG-stained epifluorescence microphotograph |
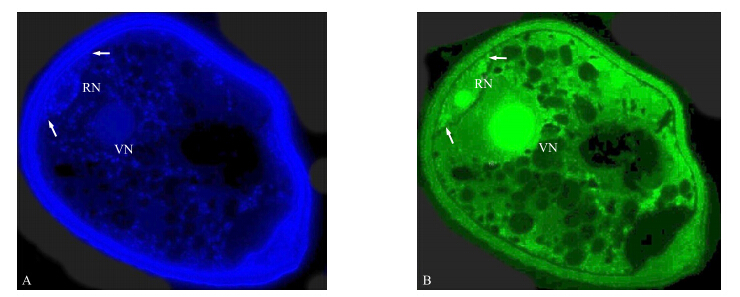 | 图 5 黄瓜贴壁期花粉细胞树脂半薄切片MTG-DAPI染色图(×1 000) Fig. 5 Fluorescence color micrographs of Technovit section of cucumber adherent pollen double-stained with MTG-DAPIA.DAPI荧光染色图DAPI-stained epifluoresence microphotograph;B.MTG荧光染色图MTG-stained epifluorescence microphotograph 箭头所示为线粒体。Arrows indicate mitochondrial. |
本研究中选择的荧光染料为MTG和DAPI,其中DAPI的处理条件为0.1 μg · mL-1的工作液染色6 min。由图 5可以看出:黄瓜贴壁期花粉细胞切片经20 nmol · L-1 MTG工作液处理30 min的条件下染色效果最好,可以清晰地区分出黄瓜贴壁期花粉细胞中的线粒体膜。细胞核和细胞器基因DAPI染色后被紫外光激发呈现蓝色(图 5-A);经MTG染色后,蓝光激发下线粒体膜呈现绿色荧光(图 5-B)。黄瓜花粉细胞半薄切片中的线粒体经荧光染色后呈现实心点状颗粒,这与其他植物中所观察到的现象一致[12]。同时,生殖细胞中的生殖核周围散布细胞器DNA,且这些部位与MTG染色中的线粒体亮点相同,证实黄瓜贴壁期花粉细胞生殖核周围的细胞器DNA属于线粒体而不是叶绿体。表明线粒体父系遗传的黄瓜中,小孢子第一次有丝分裂时没有将线粒体排除在生殖细胞之外,而是被分配到了生殖细胞中,并且此时的线粒体细胞器携带有基因信息。
4 讨论
为了能在细胞学水平上清晰地观察到黄瓜花粉细胞中生殖细胞周围的线粒体及线粒体DNA,本研究探索到一种新的荧光染色方法,使用DAPI和MTG两种荧光染料分别标记黄瓜花粉细胞中的DNA和线粒体膜。
MTG被广泛应用于活体细胞中线粒体的染色,也有研究指出MTG可对固定后细胞悬液中的线粒体着色,但是染色会发生消退现象[13]。由于MTG从未被用于Technovit 7100树脂半薄切片中线粒体膜的染色观察,所以我们在方法描述中设置了染色浓度和染色时间的梯度试验。结果验证了MTG也可以对树脂半薄切片细胞中的线粒体进行着色。而作为细胞“动力机器”的线粒体与多种生理代谢相关[14],MTG对黄瓜切片中线粒体的着色也可应用于其他材料的相关研究中。
本研究观察到黄瓜贴壁期花粉细胞中生殖细胞内的线粒体及线粒体DNA,可用于探索黄瓜花粉细胞发育过程中线粒体DNA拷贝数的变化,同时为进一步研究黄瓜线粒体父系遗传的相关生理机制奠定基础。MTG-DAPI双染色的方法也可应用于其他植物花粉细胞发育过程中线粒体的观察,用以确定植物材料是否具有线粒体父系遗传或双亲遗传的潜力,为确定植物线粒体细胞器的遗传方式提供技术支持。
| [1] | 樊懿萱,张艳丽,杨岳,等. 梅山猪骨髓间充质干细胞的分离培养及生物学特性分析[J]. 南京农业大学学报,2011,34(6):115-120. doi:10.7685/j.issn.1000-2030.2011.06.021 [Fan Y X,Zhang Y L,Yang Y,et al. Isolation,cultivation and biological characteristics of bone mesenchymal stem cells in Meishan swines[J]. Journal of Nanjing Agricultural University,2011,34(6):115-120(in Chinese with English abstract)] |
| [2] | Kuroiwa T,Kawano S,Nishibayashi S. Epifluorescent microscopic evidence for maternal inheritance of chloroplast DNA[J]. Nature,1982,298:481-483 |
| [3] | Takanashi H,Ohnishi T,Mogi M,et al. Studies of mitochondrial morphology and DNA amount in the rice egg cell[J]. Current Genetics,2010,56:33-41 |
| [4] | 崔彬彬,李云,金晓洁,等. 白杨细胞质遗传的细胞学机理(Ⅰ):生殖细胞和精细胞中细胞质DNA的存在状况[J]. 北京林业大学学报,2010,32(5):54-62 [Cui B B,Li Y,Jin X J,et al. Cytological mechanism of cytoplasmic inheritance in section Leuce:Ⅰ.Cytoplasmic DNA within generative cell and sperm cell[J]. Journal of Beijing Forestry University,2010,32(5):54-62(in Chinese with English abstract)] |
| [5] | Terasaki M,Reese T. Characterization of endoplasmic reticulum by co-localization of BiP and dicarbocyanine dyes[J]. Journal of Cell Science,1992,101(2):315-322 |
| [6] | 肖新华,周云,周峻林,等. 肿瘤坏死因子α抑制脂肪细胞线粒体生物合成及锌α2糖蛋白的表达[J]. 中国现代医学杂志,2013,23(12):6-10 [Xiao X H,Zhou Y,Zhou J L,et al. TNF-α downregulates mitochondrial biogenesis and Zinc-alpha2-glycoprotein expression in adipocytes[J]. China Journal of Modern Medicine,2013,23(12):6-10(in Chinese with English abstract)] |
| [7] | Green C S,Bavelier D. Action video game modifies visual selective attention[J]. Nature,2003,423(6939):534-537 |
| [8] | Kobayashi T,Endoh H. A possible role of mitochondria in the apoptotic-like programmed nuclear death of Tetrahymena thermophila[J]. The FEBS Journal,2005,272(20):5378-5387 |
| [9] | Calderon C I,Yandell B S,Havey M J. Genetic mapping of paternal sorting of mitochondria in cucumber[J]. Theoretical and Applied Genetics,2012,125:11-18 |
| [10] | Shen J,Kere M G,Chen J F. Mitochondrial genome is paternally inherited in Cucumis allotetraploid(C.hytivus)derived by interspecific hybridization[J]. Scientia Horticulturae,2013,155:39-42 |
| [11] | 张蜀宁,张伟,张红梅. 同源四倍体萝卜花粉母细胞减数分裂[J]. 南京农业大学学报,2009,32(1):27-30. doi:10.7685/j.issn.1000-2030.2009.01.006 [Zhang S N,Zhang W,Zhang H M. Meiosis of pollen mother cells in autotetraploid radish[J]. Journal of Nanjing Agricultural University,2009,32(1):27-30(in Chinese with English abstract)] |
| [12] | Hu Y C,Zhang Q,Rao G Y,et al. Occurrence of plastids in the sperm cells of Caprifoliaceae:biparental plastid inheritance in angiosperms is unilaterally derived from maternal inheritance[J]. Plant and Cell Physiology,2008,49(6):958-968 |
| [13] | Presley A D,Fuller K M,Arriaga E A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Chromatography B,2003,793(1):141-150 |
| [14] | 周丹,赵江哲,柏杨,等. 植物油脂合成代谢及调控的研究进展[J]. 南京农业大学学报,2012,35(5):77-86. doi:10.7685/j.issn.1000-2030.2012.05.009 [Zhou D,Zhao J Z,Bo Y,et al. Research advance in triacylglycerol synthesis,metabolism,and regulation in plants[J]. Journal of Nanjing Agricultural University,2012,35(5):77-86(in Chinese with English abstract)] |




