2. 清华大学第一附属医院(华信医院), 北京 100084;
3. 清华大学医学中心, 北京 100084;
4. 首都医科大学附属北京天坛医院北京市神经外科研究所, 北京 100050;
5. Division of Neurosurgery, Faculty of Medicine, University of Malaya, Kuala Lumpur, Malaysia;
6. Monash Medical Centre, Melbourne, Vic, Australia
2. Huaxin Hospital (First Affiliated Hospital of Tsinghua University), Beijing 100084, China;
3. Medical Center, Tsinghua University, Beijing 100084, China;
4. Beijing Neurosurgical Institute, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China;
5. Division of Neurosurgery, Faculty of Medicine, University of Malaya, Kuala Lumpur, Malaysia;
6. Monash Medical Centre, Melbourne, Vic, Australia
1 引言 1.1 CT和MRI技术
计算机断层扫描(computed tomography,CT)和核磁共振(magnetic resonance imag-ing,MRI)是现今临床上最主要的两种中高端医疗成像系统,二者同属于断层成像.有别于基本透射,断层成像是电子计算机技术和X射线检查技术相结合的产物.
常规的X射线检查,采用的是透射原理:将一束平行的X射线透过人体衰减之后的图像投影在一张二维屏幕上,这势必造成图像上的器官重叠,读片困难.美国物理学家Cormack(1963)在Journal of Applied Physics上发表了题为"Representation of aFunction by Its Line Integrals,with Some Radiological Applications"的系列文章.文章指出了从投影数据中解算出成像平面上各像素点衰减系数的可能性.依据此原理,将人体看作一个各个体素具有不同X射线衰减系数的三维函数,能通过接收器检测到的X射线强度解算出每个体素的衰减系数.由于不同组织(例如水、脂肪和骨骼)之间衰减系数相差较大,所以能在黑白图像中很好地区分不同组织,通过读取二维灰度图片重建三维器官的形状.该重建原理并不限于CT成像,只要把图像看作一个一般形式的二维密度分布函数,就可以进行三维重建(Higashida et al.2009).如果将MRI图像看作人体中某个体素发射出的磁共振信号强度的二维分布图,也可依据此原理重建三维器官.而重建的图像是通过计算机处理后产生的.
从首台CT于1972年问世后,其后的二三十年间,CT发展迅猛:从一开始的只能头部成像发展为全身成像;扫描时间从数百秒降为数秒;检测器数量从一增至上千.MRI则通过外加交变磁场激发人体内的原子核,使之产生共振,当产生共振的原子核把吸收的能量以电磁波的形式释放出来时(这种能量释放形式称为共振发射),通过线圈接收释放出的电磁波,据此分析出该原子核的种类和位置,因此能得到人体内部的精确立体图像.CT和MRI已经成为临床中应用得最为广泛的影像诊断设备(Kim et al. 2015,Roldan-Valadez et al.2014).
1.2 基于静态图像诊断的缺陷CT和传统的MRI技术发展到今天,已经可以提供分辨率极高(0.4mm左右的空间分辨率)的结构图像,并且可以通过计算机技术选择任意层面成像,因此可以观察到人体内细微的病变,这些都极大地提高了诊断的效率和准确性.除此以外,多普勒超声成像(3D ultrasound),数字减影血管造影(digital subtraction angiography,DSA),也可以实现血管的三维重建.多普勒技术有望实现快速三维成像(Cheng et al.2005),而DSA技术能够将血管从周围的组织中分离出来,更加直观(Gruber et al.2015).医学成像技术取得了长足的进步,但与此同时,它们在疾病的诊断上也存在一定限制:单纯的结构图像不能解释疾病的发生和发展过程.特别是对于血管类的疾病,血流状态和血管形状的改变、病变直接相关,仅仅将血管的形状呈现出来不能准确反应病人的真实情况.
比如,在常见的颈动脉狭窄的诊疗中,狭窄程度的判断是至关重要的,这将直接影响到临床医生是否决定手术治疗.完全根据静态图像,在临床中已有的3种狭窄率计算方法: The North American Symptomatic Carotid Endarterectomy Trial(NASCET),Eu-ropean Carotid Surgery Trial(ECST)以及Common Carotid(CC)(Slattery 1996,Ferguson et al.1999).从图 1可以看出,不管是哪种方法,基本思路都是通过在图像中找到最狭窄的部位,以这一点的直径去分别和不同部位正常血管的直径进行比较,并以此评价狭窄的程度.然而,这3种简单的图像测量方法却受到了医学实践的质疑,对于同一组病人,3种不同的评价方法给出了不同的治疗方案(Alexandrov et al. 1993,Rothwell et al.1994).这些文献表明,仅仅通过图像的测量并不能完整的反应狭窄对血流的影响.
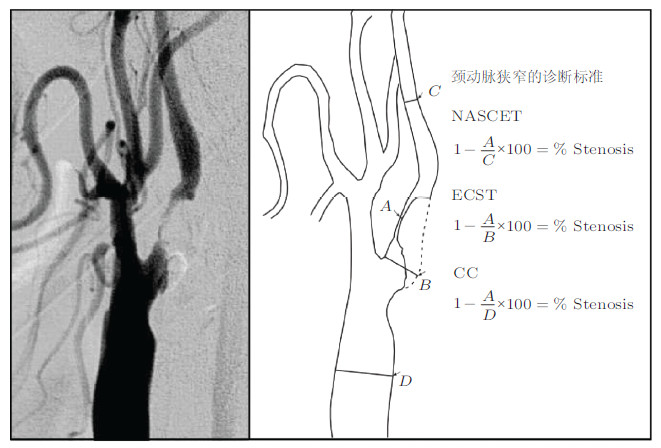
|
| 图 1 临床常用的3种判断颈动脉血管狭窄的方法(Higashida et al. 2004) |
从流体力学的角度很容易理解这种测量方法的局限性.在统一的狭窄直径下,狭窄位置A靠近B或者C,其对血流的限制作用显然是不一样的,而以上3种方法均不能识别这种影响.此外,血管的形状是三维的,仅仅通过最狭窄处的直径无法反应整个狭窄区域对血流的限制作用.正是由于有这些不足,在临床实践中,各个医院根据病人的情况积累了自己的经验,而并没有完全采纳图像的诊断标准.
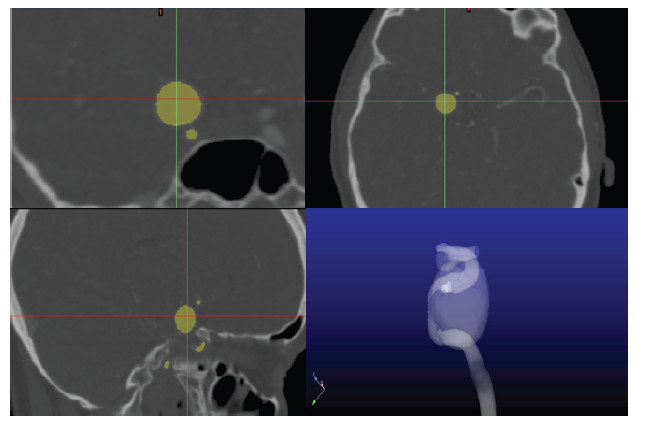
再以脑血管瘤破裂的诊断为例,图像的诊断标准通常是根据血管瘤的直径大小来做判断的.一般认为如果血管瘤的直径大于5mm就有破裂的风险,需要医学帮助(Natarajan et al.2011).然而,最新的医学统计表明,血管瘤的破裂风险不仅和血管瘤的直径相关,和血管瘤的位置、形状以及血管瘤里面血流的运动状态都相关.直径小于5mm血管瘤的破裂风险需要谨慎评估(Baharoglu et al. 2010,Forget et al.2001).虽然CT和MRI可以清晰的重建出血管瘤的形状(图 2),但在做临床判断的时候,还是要根据各个医院积累的临床经验.
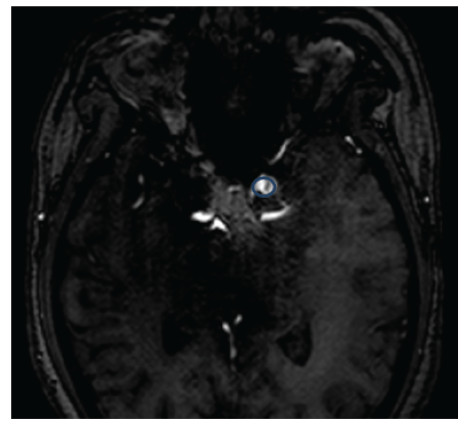
|
| 图 2 从CT或MRI图像中可以读出血管瘤的直径(如图中蓝色标记的圆形区域,清华大学第一附属医院真实病例) |
以上介绍的是静态图像对脑血管疾病诊断方面的不足.血管狭窄类疾病除了颈动脉狭窄外,还有冠脉狭窄,肾动脉狭窄等.而血管瘤,除了可以发生在颅内,也可以发生在主动脉和其他位置.静态图像对于这些部位疾病的诊断,同样存在局限性(Menke & Kowalski,2016,Schuetz et al. 2012,Patel et al.2007).虽然CT和MRI技术在血管类疾病中得到了非常广泛的应用,但对于这些疾病的诊断,如果仅仅基于静态图像,都存在之前分析过的局限性,也即忽略了血流动力学这一重要影响因素.为了契合临床需要,近年来血流动力学的研究也有了长足的进步.以下就两种不同的血流动力学研究方法进行介绍,并对比其在临床应用中的优势和不足之处.
2 血流动力学研究回顾 2.1 血流动力学的体内测量——PCMRI从硬件方面,最新发展的相位对比磁共振成像(phase-contrast magnetic resonanceimaging,PCMRI)除了能显示血管的解剖结构,还能提供包括血液流速、流量在内的血流动力学信息数据(Dymond et al. 1996,Markl et al.2003).
PCMRI的原理如下:当质子被射频信号激发后,也会以电磁波的形式向外辐射能量,这种辐射又被称为共振发射,并且可以被磁共振线圈捕获,通过计算机重建,信号的强度和位置可以被反映在图像上(McNulty et al.2015).
试想一个双极梯度磁场,该磁场由一对大小和持续时间相同,但方向相反的梯度磁场构成.当应用第一梯度场时,质子开始积累相位,随即应用第二梯度场,质子开始逐渐失去相位.因为该双极梯度场除了方向正好相反外,持续时间和强度完全相同,因此质子应该回复到被激发前的零状态.这是对静止的质子而言的.
倘若质子存在一个前进速度,这意味着在被这一对梯度场激发时,运动组织的自旋质子有了一个位移.正是这个位移使得质子相位变化将不能回复到零.而相位的移动,自然地,和质子运动位移(即速度)呈正比.简言之,在双极梯度场方向质子获得的相位移动和该质子移动的速度成正比.二者之间的关系可用公式I=γVTA来描述,其中I为相位位移的相位角;γ为磁旋比;V为应用双极梯度方向的速度;T为双极梯度的时间间隔;A为梯度场面积(Dyverfeldt et al.2015).
PCMRI正是利用了速度-相位移动的比例关系进行了血流速度的定量测量.
正如图 3中所示的那样,将两幅相位图相减,不仅能得到速度数据,还消除了未知的背景相位噪声(Markl et al.2012).然而,标准的磁共振成像方法很慢,时间分辨率和空间分辨率也不高,不可能在一个心动周期内完成全部采集,只能把采集过程分散在若干个心动周期里(Markl et al.2012).PCMRI经历了一个由2D CINE PC-MRI发展为3D CINE PC-MRI(4D FLOW MRI)的过程( van Pelt et al.2012.Borotikar et al.2012).2D CINE只能在选定的某个二维层面上测定流速流量,而3D CINE则可以测量感兴趣的空间体积内具有时间分辨率的三维速度场值(Tariq et al.2013).
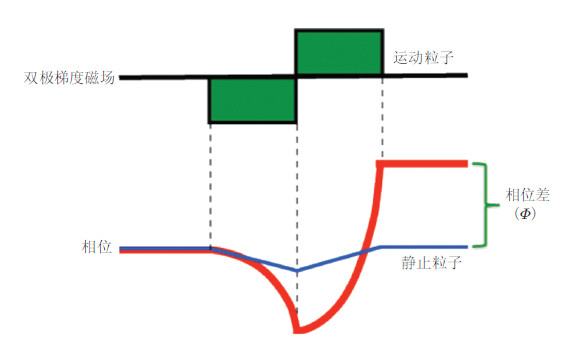
|
| 图 3 双极梯度下运动和静止自旋质子的相位变化(图片来自http://mri-q.com/phase-contrast-mra.html) |
虽然PCMRI技术还有不成熟的一面,但是与传统MRI形态学图像相比,PCMRI不仅提供了结构图像,还提供了血流速度的动态信息.它展示出一整个心动周期内多个时间点上每一个体素的三维速度向量,并且以此为基础,可以得到包括流量、每搏输出量、管壁切应力、湍流动能、相对压力等一系列血流动力学参数(Lotz et al.2002),这些参数在临床上都具有重要的意义,也可利用计算机可视化技术重现血液在血管中的流动,给予临床医师一个较为直观的体验,图 4所示即是利用计算机可视化技术得到的一例颅内动脉瘤迹线.图中红色分割结果为血管,由蓝至红色的线条显示了血液在血管内的流动状况,不同颜色代表了流速的大小,具体颜色和速度值的对应关系见图左侧标识.

|
| 图 4 一例颅内动脉瘤的迹线可视化结果(来自清华大学生物医学影像研究中心真实数据) |
除了通过硬件的测量,计算流体力学的方法也可以提供血流动力学的信息.计算流体力学(computational fluid dynamics,CFD),是基于计算机程序求解流体力学方程的方法,已经广泛应用于流体力学机械的设计和优化中.流体力学方程的通用形式可以表示为
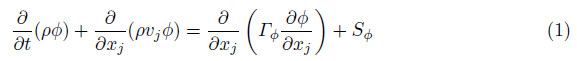
其中,φ是输运量,Γ是扩散系数.方程的4项从左到右分别是:非定常项,对流项,扩散项和源项.φ可以是速度、温度或者化学组分.对该方程的求解可以得到各种流体力学参数在某一特定区域的分布.在进行计算程序求解之前,需要明确流体流动的区域和边界,并对流动区域进行适当的网格划分,将计算节点放置在网格中点(Patankar1980).
进行CFD计算需要知道流动区域的形状和流体本身的力学参数.通过CT和MRI技术可以将血管的三维形状重建,然后再继续划分网格并进行计算.图 5是对一段血管的网格划分,网格由四面体和六面体组合而成,对于速度梯度大的区域采用比较密的六面体网格,而对流动的主区域采用四面体网格.血管的重建方法如图 6所示,主要是根据CT和MRI图像的灰度进行血管和周围组织的分离,右下方显示了分割后的三维血管瘤形状(Jamali et al.2007).

|
| 图 5 血管截面的计算网格分布(Zhang et al. 2013) |
|
| 图 6 血管形状三维重建示意图. 图中黄色标记了血管的灰度值范围(病例来自澳大利亚Monash大学医学中心) |
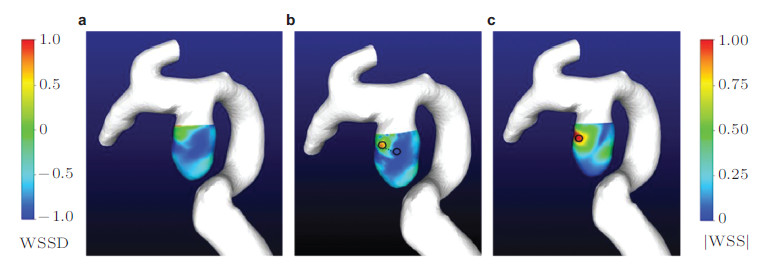
由于整个CFD计算是建立在求解偏微分方程基础上的,所以总可以通过调节空间分辨率、时间分辨率以达到满足要求的计算精度.计算流体力学结果的精度,在合理分布网格、正确设定收敛判据和时间步长的前提下是由计算程序所使用的数学差分格式决定的.图 7对比了同一血管瘤采用不同差分格式得到的数值结果,结果包含了管壁剪切力(wall shear stress,WSS)和WSS的散度(wall shear stress divergence,WSSD),具体的分析结果请参考文献(Zhang et al.2013).
|
| 图 7 不同差分精度下的计算结果对比(Zhang et al. 2013) |
然而,高精度的CFD计算结果并不等同于是准确和可信的CFD结果.影响CFD计算结果的因素主要来自于两个方面.首先,CFD的区域必须要从图像中分割出来,而图像分割本身带来的误差很难避免.如果分割出的血管形状已经和实际情况有了较大的偏差,在此基础上得到的高精度的结果也是不可信的.其次,CFD的计算结果要依赖于流体力学物理模型、以及血管壁力学模型的选择.目前的计算,血液多被假设成单相牛顿流体,而血管壁则被假想为不变形的刚体或者可均匀变形的完全弹性体,这两种假设均对实际情况做了比较大的简化,可能会造成计算结果和实际的偏差.
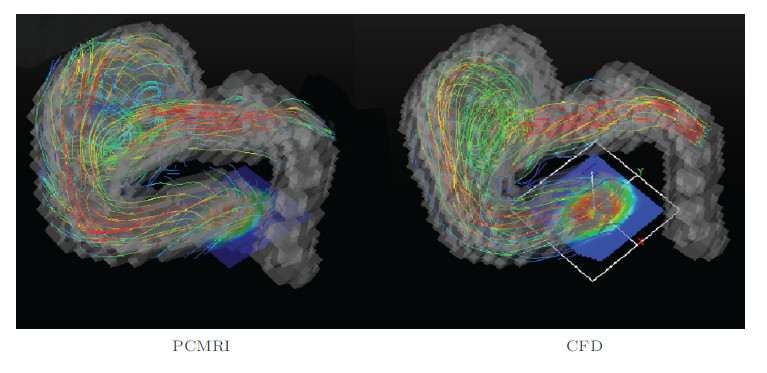
2.3 不同研究方法的对比讨论既然无论是PCMRI的实时测量还是基于图像的CFD后处理各有优点与不足,且都可以给出基本的血流动力学参数.讨论如何在应用临床实践中之前改为应用临床之前,两种方法的结果对比和讨论是十分必要的.图 8给出了PCMRI测量和计算血流动力学在同一时刻流线的对比.从中可以看出,血流状态是一致的,射流都是顺着血管壁向上进入血管瘤的.从目前的分析看来,两种方法对于基本的血流状态都能给出比较好的描述,但是在具体数值的比较方面还有比较大的偏差.在速度信号较强的区域,PCMRI和CFD结果符合的较好(误差小于5%),而在测量信号较弱(低速流动区域),PCMRI和CFD的结果偏差较大(误差可以达到50%).目前这项研究工作还在进行中,文中列出的误差范围仅具有参考意义.细致地对比两种方法得到的结果将有助于判断各自结果的可靠性.
|
| 图 8 PCMRI和血流动力学计算结果的对比——流线 |
PCMRI的关注点是血流速度,血流速度是血液流动形式的量化表达.血液通过血管时,是稳定的层流,还是湍流,亦或是其他更加复杂的流动形式,这些给予临床医师的信息截然不同.
下面试举颅内动脉瘤一例,说明PCMRI技术与该疾病诊疗的结合:
颅内动脉瘤在成人中的发病率不高,并且相当一部分动脉瘤可以保持终生不破.在直径小于5?10mm的动脉瘤中,几乎对日常生活不产生影响.因此,这部分动脉瘤没有强行治疗的必要,强行介入治疗反而加大了动脉瘤破裂的风险.另一部分动脉瘤体型巨大,或生长在关键位置,严重影响了患者的生活质量,甚至可能具有较高的破裂风险.动脉瘤一旦破裂,血液侵入颅腔,被称为蛛网膜下腔出血.蛛网膜下腔出血的后果十分严重,首次破裂出血的死亡率就高达60%.
一部分动脉瘤无症状,破裂风险小,且对患者生活几乎无影响;另一部分动脉瘤严重影响患者生存质量,且破裂风险大,甚至危及生命.因此,判断动脉瘤是否具有较高的风险性,以及是否需要手术治疗,成为临床上十分重要的课题.
长久以来,临床医师通过形态学参数判断动脉瘤的危险性.常用的形态学参数包括:动脉瘤生长位置、大小、形状、是否有子瘤,以及血管壁形态等.通过这些参数去判断动脉瘤破裂风险有一定科学性,但还不完善.
Nohra Chalouhi等(2012)在综述文章中指出,血流动力学诱导的血管内皮细胞功能障碍催生了炎症的产生,并最终导致动脉瘤的形成和生长,揭示了血流形式对动脉瘤的生长和破裂具有最根本的作用.逐渐地,人们意识到血流动力学参数在预测动脉瘤破裂风险性上具有的作用,并开展了很多相关的研究.例如Shojima等(2004)的研究结果显示,高WSS促使了动脉瘤的病发,但却是低的WSS值促使了动脉瘤的生长和破裂,很多研究者也认可这一结论(McNulty et al. 2015,Boussel et al. 2008,Acevedo-Bolton et al. 2006,Sugiyama et al.2012).然而,也有学者认为,高的和低的WSS都是导致动脉瘤破裂的影响因素,并且两者对动脉瘤破裂的影响能力并没有显著性差异(Cebral et al.2011).虽然相关的研究报道很多,但迄今为止并没有得出一个定量的基于血流动力学的评价标准.
除此之外,基于PCMRI技术的血流动力学研究在肺动脉高压疾病诊断上也有用武之地(Abolmaali et al.2004).利用三维的血流速度场可以计算出肺动脉内相对压力,这种无创的测量方法替代了有创的U型导管术,极大减轻了患者在诊断时的痛苦.
诸如此类的应用还有很多,相信未来随着PCMRI技术的进步,准确性逐步提高,扫描时间逐渐缩短,以及基于此的血流动力学研究日趋完善,该技术将会应用到越来越多的疾病诊疗当中去.
3.2 血流动力学计算和临床诊疗技术的结合基于血流动力学计算的临床诊断方法也正在研究当中.血流动力学方法的优点在于,首先从数学计算上结果的精度高,可以对误差进行控制,如果使用高阶差分格式能得到高阶的流体力学参数,从而对血流动力学与疾病的关联进行详细研究.其次,计算机模拟技术可以通过对医疗图像的处理,实现对治疗效果的预测,这一点是其他方法很难胜任的.
利用计算流体力学的方法研究血流动力学已经取得了长足的进步.Tu等(2011,2013)借助计算流体力学的研究方法对颈动脉狭窄进行了深入的研究,并且与其他工程方法相结合,在具体计算中考虑了远端流动阻力的影响.Meng等(2004,2007,2009)借助CFD的方法对不同类型血管瘤内的血流动力学进行了数值研究,并将结果和生理实验进行了对比.他们的研究发现,WSS在影响血管瘤生长和破裂的血流动力学因素中至关重要,且高WSS和低WSS的作用机理不同.Cebral等(2005a,2005b,2011a,2011b)采用计算流体力学的方法多样本分析了脑血管瘤的血流状态,并且基于计算结果和临床的对比提出了一系列脑血管瘤诊断和治疗结果预测的定量标准.由于计算流体力学可以得到高精度的速度结果,壁面剪切应力的高阶量也被用于判断血管瘤的破裂风险,比如壁面剪切应力梯度(wall shear stress gradient,WSSG),壁面剪切应力散度(WSSD),以及与一个心动周期内壁面剪切应力方向变化相关的参数(OscillatoryShear Index,OSI)等(Finol & Amon,2002,Goubergrits et al. 2012,Kawaguchi et al. 2012,Shimogonya et al.2009).作者认为这些高阶量的讨论很有意义,但是首先要保证图像分割、进出口条件以及离散化精度的要求满足获取这些高阶量所需要的条件,否则计算结果有可能包含较大的误差.总体而言,现阶段对于自然血管瘤破裂的预测还属于初步探讨,距离完全理解血流动力学对血管瘤破裂的影响还有一定的差距.相比较而言,CFD对介入治疗后血流动力学改变的预测更有价值,因为支架、弹簧圈对血液流动的影响是非常明确的.
基于前人的经验,我们对血管瘤支架治疗也做了一些尝试性的研究(Zhang et al. 2013,Chong et al.2014).作为血流动力学计算的一个应用实例,下面给予具体介绍.关于血管瘤的治疗,除了开颅进行搭桥手术外,还可以通过支架的方法来治疗.其原理就是通过介入的方法,在血管瘤颈部放置一密网支架,通过改变流阻分配来阻止血流冲击血管瘤壁,从而降低或消除血管瘤破裂的风险.对于这种治疗效果的预测是非常关键的,在实际操作中,确实有血管瘤在植入支架后由于血栓的形成而固化,从而避免了破裂的风险.但是也有相当比例的病人,在植入支架后反而形成了残余血管瘤,而残余血管瘤仍然存在破裂风险,且可能因为血流动力学的改变而加重病患的痛苦.
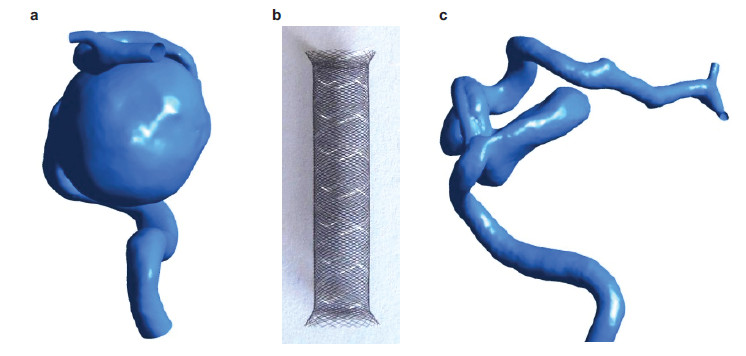
图 9为一病人的真实CT图像,左边是介入治疗前的情况,右边是植入支架之后残余血管瘤的情况.由于残余血管瘤的存在,实际对病人进行了二次介入治疗才取得了成功.我们需要分析病人形成残余血管瘤的原因,并且提出预测的标准.
|
| 图 9 真实血管瘤支架治疗病例(Zhang et al.2013).(a)介入治疗前的血管瘤,(b)密网支架,在植入过程中可根据血管形状弯曲,(c)植入支架之后的残余血管瘤 |
通过对医学图像进行三维重建可以得到原始血管瘤的形状,再使用计算机模拟的手段,可以将虚拟的支架图像和三维血管瘤的形状相耦合,从而模拟出支架植入血管瘤之后的情况.植入支架之后的血管瘤,以及根据图像计算的血流剪切力和残余血管瘤的形状如图 10所示.
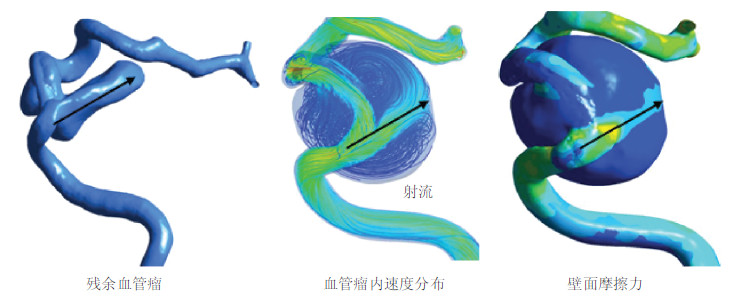
|
| 图 10 根据血管瘤的形状计算的虚拟支架介入治疗(Chong et al. 2014) |
从图中可以明显看出,残余血管瘤的形状与植入支架之后的血流状态有直接的关联.最右图中的WSS分布和残余血管瘤的形状非常契合,也同时说明WSS对于分析血管类疾病的重要性.图 11显示的是一个前瞻性的研究,病人在进行支架治疗前先经过了计算机的模拟预测,根据模拟结果,只有一次性植入双支架才可以完整的挡住血流,从而避免血管瘤破裂的风险.综合考虑病人的情况,也包括血流动力学的因素,临床决定植入双支架,病人治愈.
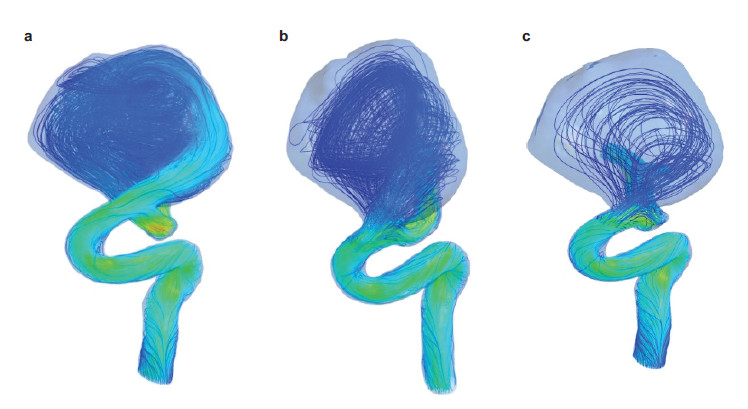
|
| 图 11 根据血管瘤的形状对血管瘤支架治疗的预测——真实病例来自Monash医学中心.(a)支架植入前的血流状态,(b)植入单支架后血流状态,(c)植入双支架之后的血流状态 |
虽然计算力学与血流动力学的结合方兴未艾,但是已经吸引了众多国内外工程学者的参与,以上就脑血管瘤支架的研究进行了具体的分析.除此以外,计算力学在心血管疾病的诊疗中,如冠状动脉狭窄、主动脉瘤、斑块形成和破裂以及瓣膜关闭等方面的研究有着更为广泛的应用(Zhang et al. 2014,Goubergrits et al. 2008,Zhang et al. 2014,Soudah et al. 2013,Fu et al. 2015,Lu et al. 2015,Pan et al.2015).
4 关于未来血流动力学发展的探讨 4.1 计算机模拟和体内测量相结合本文重点介绍了两种不同的血流动力学研究方法,PCMRI和计算机模拟.两种方法各有优缺点,可以互相补充而不能替代对方.在未来的血流动力学研究中,如何将计算机模拟和体内测量方法相结合,互相验证并提高各自的准确性是需要重点研究的内容.PCMRI方法,除了硬件方面在不断提高以外,通过相位信息转化到速度信息的数学方法也具有继续改进的空间.为了降噪,目前方法采用的数学精度不高,在未来,随着扫描设备的改进,有望采用高阶精度的算法来计算血流速度.相比较而言,基于计算流体力学的血流动力学研究方法,在数学方面更加成熟,迭代误差、差分误差可以得到很好的控制.计算模拟的失真,更多的来自于图像处理的误差,物理模型的不合理以及边界条件的不准确.而与PCMRI结果的对比,可以有效的评估这些假设条件对最终结果正确性的影响.
4.2 结合新的计算机技术提高计算效率无论是PCMRI还是计算血流动力学,都存在处理效率偏低的问题.每一个病例都需要至少数小时的处理时间,如果计算非稳态的血流状况,可能需要几天的运算时间.这种处理效率和临床病例数的规模显然是有矛盾的.计算机技术和算法一直在进步,用传统的有限体积法或有限元法对血流进行计算并不是唯一的选择.基于图像处理器(graphics processing unit,GPU)的颗粒离散算法有可能在计算效率上实现突破.
4.3 作为标准化工具,进行大规模数据采集作为血流动力学的研究方法,无论是PCMRI还是计算流体力学都需要专门的学习和训练才能有比较好的掌握.模型的选择、参数的选择、对结果正确性的把握并不是一蹴而就的.而从另一方面,大量的病例需要进行血流动力学的研究,所以在未来需要发展专门的软件平台或者计算终端,方便临床一线的医护人员使用.而计算的所有参数和模型的选择应该固化,避免人为操作造成的错误.只有计算方法和处理方法标准化,才能通过大规模的计算和数量统计产生更加定量化、精确化的诊断标准.在这之前,血流动力学的工作还只能处于研究阶段,如何缩小研究结果与临床实际需求之前的差距,如何使方法标准化,是未来血流动力学发展的重要方向,也是我们正在努力进行的工作.
5 结束语本文结合文献报道和作者自己的研究工作,介绍了血流动力学在临床诊断中的一些应用实例.总体而言,血流动力学的研究方兴未艾,目前的研究水平和实际的需求之间还有较大的差距.需要引入新的方法和思路,继续搭建工程研究与临床实际需求的桥梁.希望本文能够起到抛砖引玉的作用,让更多的工程专家开始了解血流动力学这一崭新的研究方向.
致 谢 清华大学2015年度自主科研经费(20141081265)资助项目.| Abolmaali N D, Esmaeili A, Feist P, Ackermann H, Requardt M, Schmidt H, Vogl T J. 2004. Reference values of MRI flow measurements of the pulmonary outflow tract in healthy children, RoFo:Fortschritte auf dem Gebiete der Rontgenstrahlen und der Nuklearmedizin, 176:837-845. |
| Acevedo-Bolton G, Jou L D, Dispensa B P, Lawton M T, Higashida R T, Martin A J, Young W L, Saloner D. 2006. Estimating the hemodynamic impact of interventional treatments of aneurysms:numerical simulation with experimental validation:technical case report. Neurosurgery, 59:E429-430; author reply E429-430. |
| Alexandrov A V, Bladin C F, Maggisano R, Norris J W. 1993. Measuring carotid stenosis-time for a reappraisal. Stroke, 24:1292-1296. |
| Baharoglu M I, Schirmer C M, Hoit D A, Gao B L, Malek A M. 2010. Aneurysm inflow-angle as a discriminant for rupture in sidewall cerebral aneurysms morphometric and computational fluid dynamic analysis. Stroke, 41:1423-1430. |
| Borotikar BS, Sipprell W H, Wible E E, Sheehan F T. 2012. 3rd, A methodology to accurately quantify patellofemoral cartilage contact kinematics by combining 3D image shape registration and cine-PC MRI velocity data. Journal of Biomechanics, 45:1117-1122. |
| Boussel L, Rayz V, McCulloch C, Martin A, Acevedo-Bolton G, Lawton M, Higashida R, Smith W S, Young W L, Saloner D. 2008. Aneurysm growth occurs at region of low wall shear stress patient-specific correlation of hemodynamics and growth in a longitudinal study. Stroke, 39:2997-3002. |
| Cebral J R, Castro M A, Appanaboyina S, Putman C M, Millan D, Frangi A F. 2005a. Efficient pipeline for image-based patient-specific analysis of cerebral aneurysm hemodynamics:Technique and sensitivity. IEEE T Med Imaging, 24:457-467. |
| Cebral J R, Lohner R. 2005b. Efficient simulation of blood flow past complex endovascular devices using an adaptive embedding technique. IEEE T Med Imaging, 24:468-476. |
| Cebral J R, Mut F, Raschi M, Scrivano E, Ceratto R, Lylyk P, Putman C M. 2011b. Aneurysm rupture following treatment with flow-diverting stents:computational hemodynamics analysis of treatment. AJNR. American Journal of Neuroradiology, 32:27-33. |
| Cebral J R, Mut F, Weir J, Putman C. 2011. Quantitative characterization of the hemodynamic environment in ruptured and unruptured brain aneurysms. AJNR. American Journal of Neuroradiology, 32:145-151. |
| Chalouhi N, Ali M S, Jabbour P M, Tjoumakaris S I, Gonzalez L F, Rosenwasser R H, Koch W J, Dumont A S. 2012. Biology of intracranial aneurysms:role of inflammation. J Cerebr Blood F Met, 32:1659-1676. |
| Cheng L K, Sands G B, French R L, Withy S J, Wong S P, Legget M E, Smith W M, Pullan A J. 2005. Rapid construction of a patient-specific torso model from 3D ultrasound for non-invasive imaging of cardiac electrophysiology. Med Biol Eng Comput, 43:325-330. |
| Chong W, Zhang Y, Qian Y, Lai L, Parker G, Mitchell K. 2014. Computational hemodynamics analysis of intracranial aneurysms treated with flow diverters:Correlation with clinical outcomes. Am J Neuroradiol, 35:136-142. |
| Cormack A M. 1963. Representation of a function by its line integrals with some radiological applications. J Appl Phys, 34:2722-2727. |
| Dong J, Wong K K, Tu J. 2013. Hemodynamics analysis of patient-specific carotid bifurcation:A CFD model of downstream peripheral vascular impedance. International Journal for Numerical Methods in Biomedical Engineering, 29:476-491. |
| Dymond R C, Redpath T W, McKiddie F I. 1996. Application of the principle of optical phase-contrast microscopy to velocity phase-encoded MRI of blood flow in the aorta. Brit J Radiol, 69:410-414. |
| Dyverfeldt P, Bissell M, Barker A J, Bolger A F, Carlhall C J, Ebbers T, Francios C J, Frydrychowicz A, Geiger J, Giese D, Hope M D, Kilner P J, Kozerke S, Myerson S, Neubauer S, Wieben O, Markl M. 2015. 4D flow cardiovascular magnetic resonance consensus statement. J Cardiovasc Magn R, 17. |
| Ferguson G G, Eliasziw M, Barr H W, Clagett G P, Barnes R W, Wallace M C, Taylor D W, Haynes R B, Finan J W, Hachinski V C, Barnett H J. 1999. The North American Symptomatic Carotid Endarterectomy Trial:Surgical results in 1415 patients. Stroke, 30:1751-1758. |
| Finol E A, Amon C H. 2002. Flow-induced wall shear stress in abdominal aortic aneurysms:Part I-steady flow hemodynamics. Computer Methods in Biomechanics and Biomedical Engineering, 5:309-318. |
| Forget T R, Benitez R, Vezneclaroglu E, Sharan A, Mitchell W, Silva M, Rosenwasser R H. 2001. A review of size and location of ruptured intracranial aneurysms. Neurosurgery, 49:1322-1325. |
| Goubergrits L, Schaller J, Kertzscher U, van den Bruck N, Poethkow K, Petz C, Hege H C, Spuler A. 2012. Statistical wall shear stress maps of ruptured and unruptured middle cerebral artery aneurysms, Journal of the Royal Society, Interface/the Royal Society, 9:677-688. |
| Gruber P, Menze B, Pfeiffer M, Baltsavias G, Wegener S, Steffen R, Luft A. 2015. Analysis of collateral circulation in proximal cerebral vessel occlusions based on digital subtraction angiography (DSA). Int J Stroke, 10:315-315. |
| Higashida R T, Meyers P M, Phatouros C C, Connors J J, Barr J D, Sacks D, Amer T A C. 2004. Reporting standards for carotid artery angioplasty and Stent placement. J Vasc Interv Radiol, 15:421-422. |
| Higashida R T, Meyers P M, Phatouros C C, Connors J J, Barr J D, Sacks D, So T A C A, Radiol, S I. 2009. Reporting standards for carotid artery angioplasty and stent placement (Reprinted from J Vasc Interv Radiol vol 15, pg E1-E24, 2004)/J Vasc Interv Radiol, 20:S349-S373. |
| Hoi Y M, Meng H, Woodward S H, Bendok B R, Hanel R A, Guterman L R, Hopkins L N. 2004. Effects of arterial geometry on aneurysm growth:three-dimensional computational fluid dynamics study. J Neurosurg, 101:676-681. |
| Jamali A A, Deuel C, Perreira A, Salgad C J, Hunter J C, Strong E B. 2007. Linear and angular measurements of computer-generated models:Are they accurate, valid, and reliable? Comput Aided Surg, 12:278-285. |
| Kawaguchi T, Nishimura S, Kanamori M, Takazawa H, Omodaka S, Sato K, Maeda N, Yokoyama Y, Midorikawa H, Sasaki T, Nishijima M. 2012. Distinctive flow pattern of wall shear stress and oscillatory shear index:Similarity and dissimilarity in ruptured and unruptured cerebral aneurysm blebs. J Neurosurg, 117:774-780. |
| Kim T Y, Jung J I, Kim Y J, Kim H W, Lee H G. 2015. CT and MRI evaluation of cardiac complications in patients with hematologic diseases:A pictorial review. Int J Cardiovas Imag, 31:159-167. |
| Lotz J, Meier C, Leppert A, Galanski M. 2002. Cardiovascular flow measurement with phase-contrast MR imaging:Basic facts and implementation. Radiographics, 22:651-671. |
| Markl M, Chan F P, Alley M T, Wedding K L, Draney M T, Elkins C J, Parker D W, Wicker R, Taylor C A, Herfkens R J, Pelc N J. 2003. Time-resolved three-dimensional phase-contrast MRI. J Magn Reson Imaging, 17:499-506. |
| Markl M, Frydrychowicz A, Kozerke S, Hope M, Wieben O. 2012. 4D flow MRI. J Magn Reson Imaging, 36:1015-1036. |
| McNulty J P, Lonergan R, Brennan P C, Evanoff M G, O'Laoide R, Ryan J T, Tubridy N. 2015. Diagnostic efficacy of conventional MRI pulse sequences in the detection of lesions causing internuclear ophthalmoplegia in multiple sclerosis patients. Clin Neuroradiol, 25:233-239. |
| Meng H, Wang Z J, Hoi Y, Gao L, Metaxa E, Swartz D D, Kolega J. 2007. Complex hemodynamics at the apex of an arterial bifurcation induces vascular remodeling resembling cerebral aneurysm initiation. Stroke, 38:1924-1931. |
| Menke J, Kowalski J. 2016. Diagnostic accuracy and utility of coronary CT angiography with consideration of unevaluable results:A systematic review and multivariate Bayesian random-effects meta-analysis with intention to diagnose. Eur Radiol, 26:451-458. |
| Natarajan S K, Xiang J P, Tremmel M, Ma D, Mocco J, Hopkins L N, Siddiqui A H, Levy E I, Meng H. 2011. Hemodynamic-morphologic discriminants for intracranial aneurysm rupture. Stroke, 42:E139-E139. |
| Patankar SV. 1980. Numerical Heat Transfer and Fluid Flow. Hemisphere Publishing Corporation, US. |
| Patel M B, Berkenblit R, Amis E S, Hoenig D M. 2007. Defining a new modality to diagnose medullary sponge kidney (MSK):Multi-detector CT (MDCT) scan studies on patients with MSK. J Endourol, 21:A12-A12. |
| Roldan-Valadez E, Martinez-Anda J J, Corona-Cedillo R. 2014. 3T MRI and 128-slice dual-source CT cisternography images of the cranial nerves a brief pictorial review for clinicians. Clinical Anatomy, 27:31-45. |
| Rothwell P M, Gibson RJ, Slattery J, Sellar R J, Warlow C P. 1994. Equivalence of measurements of carotid stenosis-a comparison of 3 methods on 1001 angiograms. Stroke, 25:2435-2439. |
| Schuetz G M, Schlattmann P, Dewey M. 2012. Use of 3×2 tables with an intention to diagnose approach to assess clinical performance of diagnostic tests:meta-analytical evaluation of coronary CT angiography studies. Brit Med J, 345. |
| Shimogonya Y, Ishikawa T, Imai Y, Matsuki N, Yamaguchi T. 2009. Can temporal fluctuation in spatial wall shear stress gradient initiate a cerebral aneurysm? A proposed novel hemodynamic index, the gradient oscillatory number (GON). Journal of Biomechanics, 42:550-554. |
| Shojima M, Oshima M, Takagi K, Torii R, Hayakawa M, Katada K, Morita A, Kirino T. 2004. Magnitude and role of wall shear stress on cerebral aneurysm- Computational fluid dynamic study of 20 middle cerebral artery aneurysms. Stroke, 35:2500-2505. |
| Slattery J. 1996. Endarterectomy for moderate symptomatic carotid stenosis:Interim results from the MRC European Carotid Surgery Trial. Lancet, 347:1591-1593. |
| Sugiyama S, Meng H, Funamoto K, Inoue T, Fujimura M, Nakayama T, Omodaka S, Shimizu H, Takahashi A, Tominaga T. 2012. Hemodynamic analysis of growing intracranial aneurysms arising from a posterior inferior cerebellar artery. World Neurosurgery, 78:462-468. |
| Tariq U, Hsiao A, Alley M, Zhang T, Lustig M, Vasanawala S S. 2013. Venous and arterial flow quantification are equally accurate and precise with parallel imaging compressed sensing 4D phase contrast MRI. J Magn Reson Imaging, 37:1419-1426. |
| Tremmel M, Dhar S, Levy E I, Mocco J, Meng H. 2009. Influence of intracranial aneurysm-to-parent vessel size ratio on hemodynamics and implication for rupture:results from a virtual experimental study. Neurosurgery, 64:622-630; discussion 630-621. |
| Tu J Y, Wong K K L, Cheung S C P, Beare R, Phan T. 2011. Analysis of patient-specific carotid bifurcation models using computational fluid dynamics. J Med Imag Health In, 1:116-125. |
| van Pelt R, Nguyen H, ter Haar Romeny B, Vilanova A. 2012. Automated segmentation of blood-flow regions in large thoracic arteries using 3D-cine PC-MRI measurements. International Journal of Computer Assisted Radiology and Surgery, 7:217-224. |
| Xiang J, Natarajan S K, Tremmel M, Ma D, Mocco J, Hopkins L N, Siddiqui A H, Levy E I, Meng H. 2011. Hemodynamic-morphologic discriminants for intracranial aneurysm rupture. Stroke, 42:144-152. |
| Zhang J M, Zhong L, Su B Y, Wan M, Yap J S, Tham J P L, Chua L P, Ghista D N, Tan R S. 2014. Perspective on CFD studies of coronary artery disease lesions and hemodynamics:A review. Int J Numer Meth Bio, 30:659-680. |
| Zhang Q, Gao B, Gu K Y, Chang Y, Xu J C. 2014. The study on hemodynamic effect of varied support models of BJUT-Ⅱ VAD on coronary artery:A primary CFD study. Asaio J, 60:643-651. |
| Zhang Y, Chong W, Qian Y. 2013. Investigation of intracranial aneurysm hemodynamics following flow diverter stent treatment. Med Eng Phys, 35:608-615. |
| Zhang Y, Takao H, Murayama Y, Qian Y. 2013. Propose a wall shear stress divergence to estimate the risks of intracranial aneurysm rupture. Sci World J. |


