文章信息
- 吴丽芳, 魏晓梅, 陆伟东.
- Wu Lifang, Wei Xiaomei, Lu Weidong.
- 白刺花胚性愈伤组织诱导及体细胞胚发生
- Embryonic Callus Induction and Somatic Embryogenesis of Sophora davidii
- 林业科学, 2019, 55(7): 170-177.
- Scientia Silvae Sinicae, 2019, 55(7): 170-177.
- DOI: 10.11707/j.1001-7488.20190719
-
文章历史
- 收稿日期:2018-09-03
- 修回日期:2019-01-04
-
作者相关文章
白刺花(Sophora davidii)为豆科(Leguminosae)槐属(Sophora)多年生落叶小灌木。在我国华北、陕西、甘肃、河南、江苏、浙江、湖北、湖南、广西、四川、贵州、云南、西藏等地均有分布(陈强等,2003)。白刺花根系强大,具有较强的抗旱能力(何晓,2007;何建利等,2018;吴丽芳等,2018a),可作水土保持的先锋树种;其小花数多且密集,是优良的蜜源植物;花、根、叶和种子可入药,具有清热利咽、消热解暑和凉血消肿等作用,可治肺热咳嗽、咽喉肿痛、痢疾、腹痛、便血等病症(毛晓健等,2009);白刺花多生长于天然环境中,尚未受到农药、化肥等的污染,是天然无公害“绿色食品”(樊建等,2005)。白刺花种子较硬实(吴丽芳等,2014),具有一定的休眠性(吴丽芳等,2018b),种子繁殖常出苗不整齐,极大地限制了育苗造林及开发利用。植物组织培养技术是在人工控制的培养条件下,对离体器官、组织、细胞和原生质体等进行培养,具有不受时空限制,且生长速度快、生长周期短、繁殖系数高等特点,能在短期内提供规格一致的优质苗木,是珍稀良种快速繁殖的理想方法之一。然而,白刺花离体培养研究报道较少,仅见吴丽芳等(2018c;2019a;2019b)以无菌苗叶片为外植体,筛选出了最佳的愈伤组织诱导培养基,吴丽芳等(2019a;2019b)以无菌苗下胚轴、子叶、茎段建立了白刺花体细胞胚发生再生体系,而以叶片作为外植体,氮源种类及比例、无机盐浓度对白刺花的体细胞胚发生、萌发影响的研究尚未见报道。体细胞胚发生体系不仅可以用于种苗繁殖,且胚性愈伤组织或胚性悬浮细胞也是遗传转化的理想受体材料,通过外源基因转入,再通过体细胞胚发生途径获得的再生植株具有转化率高、嵌合体少、遗传稳定性好等优点,是通过基因工程技术改良植物品种特性的良好受体材料。基于此,本试验以白刺花叶片为外植体进行白刺花胚性愈伤组织诱导及体细胞胚发生和植株再生条件的研究,以期建立白刺花体细胞胚发生、发育及调控技术体系,为种苗快速繁殖体系建立及遗传转化研究提供参考。
1 材料与方法 1.1 供试材料试验于2016年3月—2018年6月在曲靖师范学院生物资源与食品工程学院生物技术实验室及云南省高校云贵高原动植物多样性及生态适应性进化重点实验室进行。试验材料为每年3—7月在曲靖师范学院校园内生长健康无病虫害的白刺花植株上采集的幼嫩叶片,采集时间均为上午8: 00—11: 00。
1.2 外植体的处理与表面灭菌将采集的白刺花叶片于4 ℃冰箱内预处理24 h后,自来水下流水冲洗30 min,于超净工作台上进行表面灭菌处理。先用75%乙醇浸泡30 s后,转入1.0 g ·L-1的HgCl2溶液中,并滴加2滴吐温80,浸泡处理10 min,无菌水冲洗4~6次后备用。
1.3 胚性愈伤组织诱导将表面灭菌后的幼嫩叶片叶尖及叶柄部位剪切掉,横切成0.5 cm×0.5 cm大小,平放于诱导培养基上。诱导培养基以MS为基本培养基,蔗糖浓度为40 g ·L-1,琼脂为7.0 g ·L-1,pH5.8,2, 4-D 1.0、2.0、3.0、4.0 mg ·L-1,NAA 0、0.5、0.8、1.0 mg ·L-1,6-BA 0.2、0.5、1.0、2.0 mg ·L-1,TDZ 0、0.2、0.5、1.0 mg ·L-1,按正交设计共进行16次试验。每瓶接种外植体6块,每个处理组合3次重复,接种后先暗培养10天,然后转到10 μmol ·m-2s-1光照下培养,每天光照14 h,培养温度(25±1)℃。培养45天后,待愈伤组织或胚性愈伤组织形成后,统计愈伤组织和胚性愈伤组织的形成情况,利用改良苯酚品红染液在显微镜下观察非胚性细胞及胚性细胞形态。
1.4 体细胞胚的形成和发育将胚性愈伤组织转接到体细胞胚诱导培养基上,分别比较NAA(0、0.2、0.5 mg ·L-1)、6-BA(0、0.5、1.0 mg ·L-1)和TDZ(0、0.2、0.5 mg ·L-1)不同生长调节剂组合,以及改良的MS培养基中氮素KNO3(质量分数分别为0、1倍、2倍)和NH4NO3(质量分数分别为0、1/2、1倍、2倍)不同浓度组合对体细胞胚发生的影响。蔗糖浓度为40 g ·L-1,琼脂7.0 g ·L-1,谷氨酰胺100 mg ·L-1,pH5.8,每瓶接种胚性愈伤组织3~5块,每个处理3次重复,20 μmol ·m-2s-1的光照条件下培养,每天光照14 h,温度(25±1)℃。培养40天后,统计体细胞胚发生率及不同培养基上每克鲜质量愈伤组织的体细胞胚总数和不同发育时期体细胞胚的数量和比例。
1.5 体细胞胚的成熟、萌发及植株再生挑取肉眼可见的已发育至球形期的体细胞胚分别接种于体胚萌发培养基上,培养基为改良MS培养基(大量元素用量分别为1/5、1/4、1/3、1/2和1)+NAA 0.2 mg ·L-1 + 6-BA 0.1 mg ·L-1 +活性炭2.0 g ·L-1 +蔗糖25 g ·L-1 +琼脂7 g ·L-1,pH5.8, 30 μmol ·m-2s-1光照下培养,每瓶接种3~5个球形胚,每个处理3次重复。直至获得完整幼苗后,统计体细胞胚萌发率、体细胞胚发生系数,测定体细胞胚成苗质量。然后将幼苗炼苗后移栽至装有基质(红壤土:腐殖土:珍珠岩=2 :2 :1,体积比)的花盆中,30天后统计植株成活率。
1.6 试验统计愈伤组织诱导率(%)=形成愈伤组织外植体数/接种外植体数×100%;
胚性愈伤组织诱导率(%)=形成胚性愈伤组织的外植体数/接种外植体数×100%;
体细胞胚发生率(%)=产生体细胞胚的愈伤组织数/接种胚性愈伤组织数×100%;
体细胞胚萌发率(%)=萌发成幼苗的体胚数/接种的体胚数× 100%;
体细胞胚成苗质量(g)=体细胞胚成苗鲜质量-接种时球形胚鲜质量;
植株成活率(%)=移栽成活的植株数/移栽的总株数×100%。
2 结果与分析 2.1 外植体接种后愈伤组织的形成当白刺花叶片接种5天后,叶片边缘表皮细胞及伤口处可见增厚卷缩,有水浸状白色小泡,再经约5天培养,叶缘部或表皮细胞部位首先启动细胞脱分化,有白色瘤状小突起。继续培养30天后,可见不同质地、颜色及形态的非胚性愈伤组织和胚性愈伤组织块。不同生长调节剂组合培养基上,能观察到3种类型的愈伤组织:第Ⅰ类颜色偏绿,质地较硬,结构紧密,不易分开,生长缓慢,属于非胚性愈伤组织(图 1A)。第Ⅱ类颜色偏白,透明或半透明、水渍状、结构疏松,易褐化死亡,没有分化能力,属于非胚性愈伤组织(图 1B)。第Ⅲ类颜色淡黄色或黄绿色,质地较碎,结构疏松、表面瘤状突起,细胞团排列紧密,属胚性愈伤组织(图 1C)。显微观察,非胚性愈伤组织形状不规则,细胞大,核小且偏向一侧(图 1D);胚性愈伤组织细胞排列规则、紧密,细胞小、核大,细胞核多位于细胞中央(图 1E)。
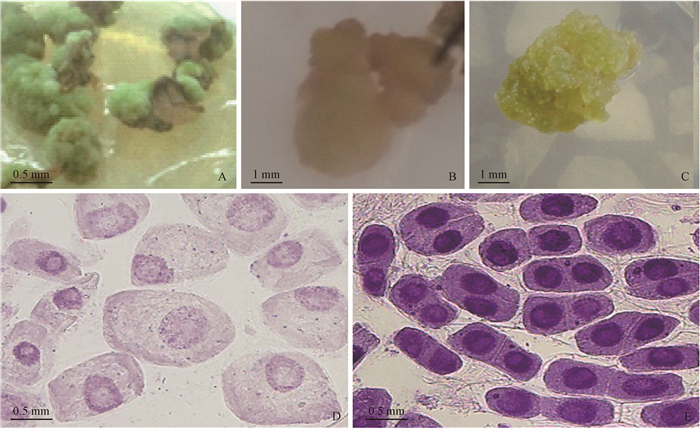
|
图 1 白刺花不同类型的愈伤组织 Fig. 1 Different type of callus of Sophora davidii A, B:非胚性愈伤组织;C:胚性愈伤组织;D:非胚性愈伤组织的细胞;E:胚性愈伤组织的细胞。 A, B:Non-embryonic callus; C:Embryonic callus; D: Cell of non-embryonic callus; E: Cell of embryonic callus. |
白刺花叶片接种于不同生长调节剂组合培养基上,均能诱导出愈伤组织和胚性愈伤组织,但愈伤组织的形态和质地因不同生长调节剂组合而存在差异,其中,2, 4-D对愈伤组织影响最大(表 1)。2, 4-D为1.0 mg ·L-1时,多形成第Ⅰ类愈伤组织;2, 4-D在2.0、3.0 mg ·L-1时,多形成第Ⅲ类愈伤组织;2, 4-D4.0 mg ·L-1时,主要形成第Ⅱ类愈伤组织。在16种组合试验中,不同生长调节剂组合之间愈伤组织诱导率有所差异,变幅在50.4%~90.3%之间。处理I11即MS + 2, 4-D 3.0 mg ·L-1 + NAA 0.8 mg ·L-1 + 6-BA 0.5 mg ·L-1 + TDZ 0.2 mg ·L-1 +蔗糖40 g ·L-1 +琼脂7.0 g ·L-1的培养基上愈伤组织诱导率高达90.3%;而仅有2, 4-D和6-BA组合的培养基上,愈伤组织诱导率最低,仅50.4%。胚性愈伤组织形成中,同样也受生长调节剂组合的影响,尤其2, 4-D的影响较大。2, 4-D为1.0 mg ·L-1时,胚性愈伤组织诱导率在22.3%~28.2%之间;而2, 4-D在2.0、3.0 mg ·L-1时,胚性愈伤组织诱导率上升至33.3%~42.0%之间,最佳的胚性愈伤组织诱导培养基为MS+ 2, 4-D 3.0 mg ·L-1 + NAA 0.5 mg ·L-1 + 6-BA 0.2 mg ·L-1 + TDZ 1.0 mg ·L-1 +蔗糖40 g ·L-1+琼脂7.0 g ·L-1;而当2, 4-D为4.0 mg ·L-1时,胚性愈伤组织诱导率在23.1%~28.7%之间。以上结果说明不同生长调节剂组合对愈伤组织的形成及胚性愈伤组织的诱导具有不同作用,其中2, 4-D的影响较大。
|
|
观察白刺花诱导的胚性愈伤组织形态特征发现,体细胞胚均是通过愈伤组织这一间接途径发生(图 2),且体细胞胚可通过愈伤组织表面(图 2A)和愈伤组织内部(图 2B)2种方式发生。在白刺花体细胞胚发生诱导中,体细胞胚可以一步法在愈伤组织诱导培养基上发生,但发生率相对低,也可以通过多步诱导得到体细胞胚。

|
图 2 白刺花体细胞胚发生和植株再生过程 Fig. 2 Somatic embryogenesis and plant regeneration of Sophora davidii A:外部发生的体细胞胚;B:内部发生的体细胞胚;C:球形期和心形期体细胞胚;D:鱼雷期体细胞胚;E:子叶期体细胞胚;F:球形胚萌发;G:再生植株。 A: Somatic embryo from outer callus; B: Somatic embryo from inner callus; C: Globular and heart-shaped somatic embryo; D: Torpedo-shaped somatic embryo; E: Cotyledonary somatic embryo; F: Globular somatic embryo germination; G: Plantlet regeneration. |
1) 不同生长调节剂对白刺花体细胞胚发生及发育的调控作用 胚性愈伤组织接种于不同生长调节剂种类及浓度的培养基上,体细胞胚发生的情况如表 2所示。在不加任何生长调节剂的培养基上,5~10天内接种的胚性愈伤组织外形上无变化,培养30~40天后能够观察到有一些原胚细胞(PE:不同时间胚性愈伤组织中观察到的最接近子叶胚的胚状体)和球形胚形成;而在添加生长调节剂的培养基上,培养5~10天即可有原胚细胞产生,40天后能够观察到不同发育期的体胚(图 2 C-E)。
|
|
不同生长调节剂对白刺花体胚发生及发育的调控作用非常明显(表 2),在无任何生长调节剂的培养基上,体细胞胚的发生率仅27.59%,而添加生长调节剂能使体细胞胚发生率提高至40.35%~78.46%,总胚数与对照相比提高至153.57%~363.29%。其中仅有1种细胞分裂素6-BA时,体细胞胚发生率为40.35%,而仅有TDZ的培养基上体细胞胚发生率为49.09%,说明不同细胞分裂素对体细胞胚发生的影响不同,TDZ对白刺花体细胞胚发生的作用比6-BA效果好。虽然细胞分裂素对体细胞胚的形成具有促进作用,但从表 2中看出仅有细胞分裂素的培养基上(T1、T4和T7)体细胞胚发生率不及生长素与细胞分裂素组合的培养基。3种生长调节剂适当组合的T3培养基中体细胞胚发生率最高,达78.46%。说明生长素与细胞分裂素适当比例组合有利于体细胞胚的发生,生长调节剂不仅影响体细胞胚形成的数量,还影响体细胞胚发育的进程。
2) 氮素形态及浓度对白刺花体细胞胚发生及发育的影响 氮素是体细胞胚发生所必需的元素,表 3为改良的MS + NAA 0.5 mg ·L-1 + 6-BA 1.0 mg ·L-1 + TDZ 0.5 mg ·L-1 +蔗糖40 g ·L-1 +谷氨酰胺100 mg ·L-1 +琼脂7.0 g ·L-1的培养基中硝态氮和铵态氮添加的比例,从表中结果可以看出,改良MS培养基中仅加入KNO3或NH4NO3(TN-1、TN-2、TN-5和TN-6)对体细胞胚发生与对照相比均有抑制作用,且形成的体细胞胚多处于球形胚期和心形胚期。NH4NO3为基本培养基1/2浓度(TN-3和TN-4)时,对体细胞胚的形成有促进作用,其中当KNO3浓度提高1倍、NH4NO3的浓度为基本培养基1/2(TN-3)时处理效果最好,体细胞胚发生率高达91.33%,总胚数为对照的138.73%,各时期发育的体细胞胚都明显增加。以上结果说明不同的氮源对体细胞胚的发生及发育有影响,降低铵态氮浓度对体细胞胚形成和发育有促进作用。
|
|
将球形期的体胚接种于体胚萌发培养基上(图 2F),10天左右下胚轴开始生长,最先白色根伸长,子叶长出逐渐变绿,1个月后完整植株长成(图 2G)。不同萌发培养基上体胚的萌发情况不同(表 4),在未降低无机盐浓度的MS培养基上,多数接种的球形胚可再次脱分化,从而影响体胚的萌发;随着无机盐浓度的调整变化,愈伤组织逐渐减少,其中1/3MS培养基上体胚萌发最好,体胚萌发率高达82.75%,幼苗长势最好,平均鲜质量为每株76 mg。幼苗长至5 cm左右进行驯化,30天后成活率可达90%以上。
|
|
体细胞胚发生是植物离体快繁或进行遗传转化关键的步骤之一,对于多数植物而言,通常包括愈伤组织诱导、胚性愈伤组织的转化、体细胞胚发生和发育,体细胞胚成苗等过程,在这些过程中,外植体类型、生长调节剂种类和比例、培养基中氮源种类和比例及培养基矿质营养浓度等均会产生影响。吴丽芳等(2019a;2019b)比较了白刺花下胚轴、子叶和茎段在不同激素组合培养基上胚性愈伤组织诱导情况,得出下胚轴较易诱导,诱导率75%以上;本文中采用叶片为外植体,其胚性愈伤组织诱导率仅44.3%,说明外植体的类型及生理状况对白刺花诱导胚性愈伤组织有较大影响。在一些研究中,通常培养基中加入2, 4-D可促进细胞脱分化, 形成胚性愈伤组织(Gaj,2004;Jimcncz,2005;吕守芳等,2005;Elhiti et al., 2013), 但不同材料对2, 4-D浓度的要求不同。在豆科植物研究中,薛仁镐等(1995)使用高达10 mg ·L-1的2, 4-D诱导大豆(Glycine max)胚性愈伤组织;习洋等(2012)采用5.0 mg ·L-1的2, 4-D使刺槐(Robinia pseudoacacia)胚性愈伤组织诱导率达95.42%。本研究中2, 4-D浓度对胚性愈伤组织的诱导也具有影响,2, 4-D在2.0~3.0 mg ·L-1时,能成功诱导胚性愈伤组组织,而低于或高于这一浓度范围,多形成无分化能力的非胚性愈伤组织。
体细胞胚发生过程中, TDZ等细胞分裂素对体胚发生的作用因材料而异,在天竺葵(Pelargonium hortorum)(Visser et al., 1992)、水稻(Oryza sativa)(Gairi et al., 2004)、竹(Bambusoideae)(Lin et al., 2004)、花烛(Anthurium andraeanum)(辛伟杰等,2006)、香蕉(Musa nana)(Xiao et al., 2007;魏岳荣等,2007)等体胚的诱导中具有促进作用,而在棉花(Gossypium spp.)(王清连等,2004)中具有抑制作用。本试验中,单独使用TDZ时,体细胞胚发生率为49.09%,比单一使用6-BA(40.35%)效果好,NAA, 6-BA和TDZ适当浓度组合可使体细胞胚发生率提高至78.46%。
培养基中氮源的种类对体细胞胚发生也具有较大的影响(孟玉玲等,1995),本研究在MS培养基中,单一加入KNO3或NH4NO3对体细胞胚发生具有抑制作用,且形成的体细胞胚多处于球形胚期和心形胚期。而当培养基中KNO3提高1倍、NH4NO3减半能促进体细胞的形成,体细胞胚发生率高达91.33%,总胚数为采用MS基本培养基时的1.4倍,这一研究结果与Trolinder等(1988)和迟古娜等(2005)的研究结果相同,可能是由于N03-可稳定培养基的pH值,而NH4+的吸收会使培养基pH值下降,二者适量的组合使用,比2种离子单独作用要大。
球形胚形成后,适当降低培养基中无机盐浓度可以促进体细胞胚萌发。本研究中,在未降低无机盐浓度的MS培养基上,多数接种的球形胚可再次重新脱分化形成愈伤组织,从而影响体胚的萌发,而在1/3MS培养基上显著提高了体胚的萌发率,且形成的幼苗长势好,平均每株鲜质量为76 mg。这一结果与Choi等(2002)对西伯利亚参(Crepis sibirica)体胚培养的结果一致,在体细胞胚培养后期,降低培养基无机盐浓度,可显著提高体细胞胚的产量。
4 结论白刺花叶片外植体接种于添加2, 4-D、NAA、6-BA和TDZ不同浓度组合的脱分化培养基上,可形成3种类型的愈伤组织,其中2, 4-D在1.0~4.0 mg ·L-1随浓度的变化形成的愈伤组织质地和形态均存在差异。最佳胚性愈伤组织诱导培养基为MS + 2, 4-D 3.0 mg ·L-1 + NAA 0.5 mg ·L-1+ 6-BA 0.2 mg ·L-1 + TDZ 1.0 mg ·L-1 +蔗糖40 g ·L-1 +琼脂7.0 g ·L-1,诱导率为42.0%。最佳的体细胞胚发生培养基为改良的MS(2KNO3+1/2NH4NO3)+NAA0.5 mg ·L-1+ 6-BA 1.0 mg ·L-1 + TDZ 0.5 mg ·L-1 +蔗糖40 g ·L-1 +谷氨酰胺100 mg ·L-1+琼脂7.0 g ·L-1,体细胞胚发生率高达91.33%。白刺花体细胞胚可以通过间接途径从胚性愈伤组织表面和内部发生,TDZ有利于体细胞胚的形成,适当的生长素与细胞分裂素组合及硝态氮和铵态氮的比例对体胚的形成和发育具有调控作用,降低MS无机盐浓度可提高体胚萌发率,幼苗移栽成活率达90%以上。
陈强, 王达明, 李品荣, 等. 2003. 白刺花的育苗造林技术及开发利用前景. 中国野生植物资源, 21(6): 30-31. (Chen Q, Wang D M, Li P R, et al. 2003. Research on afforestation technology and the development and utilization prospect of Sophora davidii. Chinese Wild Plant Resources, 21(6): 30-31. DOI:10.3969/j.issn.1006-9690.2003.06.011 [in Chinese]) |
迟吉娜, 马峙英, 韩改英, 等. 2005. 陆地棉组织培养体细胞胚胎发生技术改进. 棉花学报, 17(4): 195-200. (Chi J N, Ma Z Y, Han G Y, et al. 2005. Technical improvement of tissue culture and somatic embryogenesis in upland cotton. Cotton Science, 17(4): 195-200. DOI:10.3969/j.issn.1002-7807.2005.04.001 [in Chinese]) |
樊建, 桂明英, 赵天瑞, 等. 2005. 野生苦刺花食用价值研究. 中国野生植物资源, 24(1): 23-25. (Fan J, Gui M Y, Zhao T R, et al. 2005. Study on the nutritional components of wild Sophora davidii Rom ex Pavol. Chinese Wild Plant Resources, 24(1): 23-25. DOI:10.3969/j.issn.1006-9690.2005.01.007 [in Chinese]) |
何晓. 2007.岷江上游干旱河谷白刺花种群特征及其更新特点的空间差异性研究.成都: 四川大学硕士学位论文. (He X. 2007. Spatial variation of population characteristic and natural regeneration of Sophora viciifolia in the dry valley of the upper Mingjiang river. Chengdu: MS thesis of Sichuan University. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10610-2008027656.htm |
何建利, 张利, 刘千里, 等. 2018. 岷江干旱河谷区典型灌木对干旱胁迫的生理生化响应. 生态学报, 38(7): 2362-2371. (He J L, Zhang L, Liu Q L, et al. 2018. Physiological and biochemical response of typical shrubs to drought stress in the Minjiang River dry valley. Acta Ecologica Sinica, 38(7): 2362-2371. [in Chinese]) |
吕守芳, 张守攻, 齐力旺, 等. 2005. 日本落叶松体细胞胚胎发生的研究. 林业科学, 41(2): 48-53. (Lü S F, Zhang S G, Qi L W, et al. 2005. Somatic embryogenesis from immature embryos of Larix kaempferi. Scientia Silvae Sincae, 41(2): 48-53. [in Chinese]) |
毛晓健, 温敏, 蒋孝悝. 2009. 白刺花水煎剂的部分药效学研究. 云南中医中药杂志, 30(2): 44-46. (Mao X J, Wen M, Jiang X L. 2009. Research on water decoction partial pharmacodynamics of Sophora viciifolia. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 30(2): 44-46. DOI:10.3969/j.issn.1007-2349.2009.02.033 [in Chinese]) |
孟玉玲, 谷祝平. 1995. 正交设计在诱导植物体细胞胚胎发生中的应用. 西北植物学报, 15(1): 10-15. (Meng Y L, Gu Z P. 1995. Application of orthogonal experiment on induction of plant somatic embryogenesis. Acta Botanica Boreali-Occidentalia Sinica, 15(1): 10-15. DOI:10.3321/j.issn:1000-4025.1995.01.003 [in Chinese]) |
王清连, 王敏, 师海荣. 2004. 植物激素对棉花体细胞胚胎发生的诱导及调节作用. 生物技术通讯, 15(6): 577-579. (Wang Q L, Wang M, Shi H R. 2004. Hormones regulation on cotton somatic embryogenesis. Letters in Biotechnology, 15(6): 577-579. DOI:10.3969/j.issn.1009-0002.2004.06.010 [in Chinese]) |
魏岳荣, 杨护, 黄秉智, 等. 2007. Picloram, ABA和TDZ对香蕉体细胞胚胎发生的影响. 园艺学报, 34(1): 81-86. (Wei Y R, Yang H, Huang B Z, et al. 2007. Effects of picloram, ABA and TDZ on somatic embryogenesis of banana. Acta Horticulture Sinica, 34(1): 81-86. DOI:10.3321/j.issn:0513-353X.2007.01.017 [in Chinese]) |
吴丽芳, 陆伟东, 魏晓梅, 等. 2014. 不同处理方法对白刺花硬实种子萌发特性的影响研究. 当代畜牧, 2(6): 47-49. (Wu L F, Lu W D, Wei X M, et al. 2014. Effect of different treatment methods on hard seed germination characteristics for Sophora davidii. Modern Animal Husbandry, 2(6): 47-49. [in Chinese]) |
吴丽芳, 魏晓梅, 尹辉, 等. 2018a. 干旱胁迫对白刺花根尖染色体变异的影响. 江苏农业科学, 46(9): 256-259. (Wu L F, Wei X M, Yin H, et al. 2018a. Effects of drought stress on mitosis of root tip cells of Sophora davidii. Jiangsu Agricultural Science, 46(9): 256-259. [in Chinese]) |
吴丽芳, 魏晓梅, 陆伟东, 等. 2018b. 白刺花硬实种子的休眠机制及休眠解除. 南方农业学报, 49(5): 944-949. (Wu L F, Wei X M, Lu W D, et al. 2018b. Dormancy mechanism and breaking methods for hard seeds of Sophora davidii. Journal of Southern Agriculture, 49(5): 944-949. [in Chinese]) |
吴丽芳, 魏晓梅, 应倩倩, 等. 2018c. 不同生长调节剂对白刺花叶片愈伤组织诱导质量分析. 北方园艺, (10): 63-69. (Wu L F, Wei X M, Ying Q Q, et al. 2018c. Analysis of different plant hormone on callus induction quality of Sophora davidii leaf. Northern Horticulture, (10): 63-69. [in Chinese]) |
Wu L F, Wei X M, Lu W D. 2019a. Embryogenic callus induction and establishment of plant regeneration system of Sophora davidii. Plant Physiology Journal, 55(2): 218-224. |
吴丽芳, 魏晓梅, 陆伟东. 2019b. 白刺花胚性愈伤组织诱导及体细胞胚发生和萌发. 生物技术通报, 35(4): 13-19. (Wu L F, Wei X M, Lu W D. 2019b. Embryonic callus induction of Sophora davidii and their somatic embryogenesis and germination. Biotechnology Bulletin, 35(4): 13-19. [in Chinese]) |
习洋, 胡瑞阳, 王欢, 等. 2012. 刺槐未成熟合子胚的体细胞胚胎发生和植株再生. 林业科学, 48(1): 60-69. (Xi Y, Hu R Y, Wang H, et al. 2012. Somatic embryogenesis and plant regeneration from immature zygotic embryos of black locust (Robinia pseudoacacia). Scientia Silvae Sincae, 48(1): 60-69. DOI:10.3969/j.issn.1672-8246.2012.01.009 [in Chinese]) |
辛伟杰, 徐彬, 王广东, 等. 2006. 花烛体细胞胚胎发生及植株再生. 园艺学报, 33(6): 1281-1286. (Xin W J, Xu B, Wang G D, et al. 2006. Somatic embryogenesis and plant regeneration of Anthurium andraeanum. Acta Horticulturae Sinica, 33(6): 1281-1286. DOI:10.3321/j.issn:0513-353X.2006.06.020 [in Chinese]) |
薛仁镐, 刘淑兰, 韩碧文. 1995. 大豆未成熟子叶诱导胚状体发生再生植株. 延边农学院学报, 17(3): 148-152. (Xue R G, Liu S L, Han B W. 1995. Plant regeneration from immature cotyledons culture of soybean via somatic embryogenesis. Journal of Yanbian Agricultural College, 17(3): 148-152. [in Chinese]) |
Choi Y E, Lee K S, Kim E Y, et al. 2002. Mass production of Siberian ginseng plantlets through large-scale tank culture of somatic embryos. Plant Cell Reports, 21(1): 24-28. DOI:10.1007/s00299-002-0470-z |
Elhiti M, Hebelstrup K H, Wang A, et al. 2013. Function of type-2 Arabidopsis hemoglobin in the auxin-mediated formation of embryogenic cells during morphogenesis. Plant Journal for Cell & Molecular Biology, 74(6): 946-958. |
Gairi A, Rashid A. 2004. TDZ-induced somatic embryogenesis in non-responsive caryopses of rice using a short treatment with 2, 4-D. Plant Cell, Tissue and Organ Culture, 76(1): 29-33. |
Gaj M D. 2004. Factors influencing somatic embryogenesis induction and plant regeneration with particular reference to Arabidopsis thaliana(L.) Heynh. Plant Growth Regulation, 43(1): 27-47. DOI:10.1023/B:GROW.0000038275.29262.fb |
Jimenez V M. 2005. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis. Plant Growth Regulation, 47(2/3): 91-110. |
Lin C S, Lin C C, Chang W C. 2004. Effect of thidiazuron on vegetative tissue-derived somatic embryogenesis and flowering of bamboo Bambusa edulis. Plant Cell, Tissue and Organ Culture, 76(1): 75-82. |
Trolinder N L, Goodin J R. 1988. Somatic embryogenesis in cotton (Gossypium) Ⅱ:Requirements for embryo development and plant regeneration. Plant Cell Tissue and Organ Culture, 12(1): 43-53. |
Visser C, Qureshih J A, Gill R. 1992. Morphoregulatory role of thidiazuron substitution of auxin and cytokinin requirement for the induction of somatic embryogenesis in Geranium hypocotyl cultures. Plant Physiology, 99(4): 1704-1707. DOI:10.1104/pp.99.4.1704 |
Xiao W, Huang X L, Huang X, et al. 2007. Plant regeneration from protoplasts of Musa acuminata cv. Mas(AA) via somatic embryogenesis. Plant Cell, Tissue and Organ Culture, 90(2): 191-200. |
 2019, Vol. 55
2019, Vol. 55
