文章信息
- 贾荛祯, 王明, 王传华.
- Jia Raozhen, Wang Ming, Wang Chuanhua.
- 川金丝猴食源地衣长松萝生长、存活与生理学特征对模拟氮沉降的响应
- Growth, Survival and Physiological Response of Food Lichens Usnea longissima of Rhinopithecus roxellana to Simulated Nitrogen Deposition
- 林业科学, 2019, 55(7): 17-26.
- Scientia Silvae Sinicae, 2019, 55(7): 17-26.
- DOI: 10.11707/j.1001-7488.20190702
-
文章历史
- 收稿日期:2018-01-04
- 修回日期:2019-05-31
-
作者相关文章
2. 三峡库区生态环境教育部工程研究中心 宜昌 443002;
3. 三峡大学生物与制药学院 宜昌 443002
2. China Engineering Research Center of Eco-Environment in the Three Gorges Reservoir Region, Ministry of Education Yichang 443002;
3. College of Life Science and Pharmacy, China Three Gorges University Yichang 443002
地衣作为一类能够指示氮污染的生物,其氮敏感性形成机制始终备受关注。地衣氮敏感性与氮素在地衣体内的积累机制以及铵态氮对细胞的毒性密切相关,如部分具有氮敏感性的地衣可选择性地吸收铵态氮,而铵态氮既破坏地衣共生体中真菌或藻类质膜完整性,又损伤藻类的光合色素、光合电子传递链并阻碍ATP的合成(Munzi et al., 2009;Hauck, 2010)。在某些地衣中,过量吸收的氮可破坏地衣体内氮与磷营养的平衡,导致地衣磷酸单脂酶(PME)活性上调和磷限制(Hogan et al., 2010),且地衣体内过量氨氮积累,是由于地衣缺乏足够的碳骨架生成氨基酸导致的(Hauck, 2010),可见,地衣的氮耐受能力与地衣体的光合能力密切相关。除此之外,还有研究认为高等植物氮代谢关键酶(谷氨酰胺合成酶GS和硝酸还原酶NR)活性与其耐氮性相关(Cruz et al., 2006),但是否与地衣氮的敏感性相关尚未见报道。
神农架地处我国秦巴山区,拥有保存完好的亚热带森林生态系统,是我国特有珍稀物种川金丝猴(Rhinopithecus roxellana)的重要栖息地。目前,该地区湿氮沉降为7.99 kgN·hm-2a-1(杨林等,2018),高于森林生态系统地衣3.1 kgN·hm-2a-1的阈值(Fenn et al., 2008)。研究表明,本地区拥有较高的地衣多样性,分布着200余种地衣,其中部分地衣是川金丝猴冬季的主要食物来源,尤其是松萝属(Usnea)地衣,在川金丝猴食谱中占很大比例(Li, 2006; 杨敬元等,2014),该地区地衣植物对于川金丝猴的种群维持具有重要价值。由于该地区主要树生地衣均具有较强的氮敏感性(王传华等,2015;郭华等,2016),因此,氮沉降可能对该地区的地衣多样性及川金丝猴食源地衣供应产生重要影响。
许多松萝属地衣具有较强的氮敏感性。对伦敦地区松萝属地衣氮敏感性的研究表明,较耐氮的石黄衣属地衣如Xanthoria parietina、X. polycarpa敏感程度仅为2,而松萝属地衣如Usnea cornuta高达8左右(Davies et al., 2007);同时,欧洲地区降水中NO3-、NH4+、SO4-的增加使松萝属地衣明显减少,并且NH4+在其中起到重要作用(Van Herk et al., 2003)。长松萝(Usnea longissima)是神农架地区常见的树生枝状地衣,也是川金丝猴重要的食源地衣之一(Guo et al., 2007)。北美地区的研究表明,长松萝的多度与区域性的氮沉降梯度负相关(Fenn, et al., 2003),我国的研究也证实氮沉降能显著影响长松萝的细胞膜完整性、光合电子传递等生理特征(王传华等,2015)。但是,氮沉降影响神农架地区长松萝生长和存活的定量研究以及氮沉降损伤长松萝健康的作用机制尚未见报道。鉴于此,本研究通过室内、野外人工模拟氮沉降的方法,研究了不同氮沉降强度对长松萝生长、存活及生理特征的影响,旨在回答:氮沉降对长松萝生物量积累和繁殖体存活有无影响,氮沉降损伤长松萝健康的生理机制是什么。上述问题的回答,可为科学管理川金丝猴的地衣食物供应、理解氮沉降背景下神农架地区树生地衣群落的演替趋势提供理论支撑。
1 研究区概况研究区位于湖北省神农架地区红坪镇温水村温水林场严家屋场(110°23′E,31°34′N)。该区海拔1 700 m,年均气温12 ℃,年均降水量1 000~1 800 mm (Ge et al., 1997;铁军,2009;陈露等,2013),湿氮沉降强度7.99 kgN·hm-2a-1,雨水氮浓度0.097 mmol N·L-1(杨林等,2018)。主要植被类型为针阔混交林(铁军, 2009),土壤类型为山地黄棕壤(张于光等,2014)。
2 材料与方法 2.1 试验材料2015年3月,在海拔1 900 m处收集健康、个体较为一致的长松萝500株,供野外和室内试验。用于室内试验的地衣,在室温下风干48 h后置于-18 ℃冰箱中保存备用。
2.2 试验设计与氮处理为了系统研究长松萝生长、存活及其生理特征对模拟氮沉降的响应,本研究设计1个野外试验和3个室内试验。
2.2.1 氮添加对地衣生长与氮积累的影响本试验在野外完成,采用单因素完全随机设计,试验因子为模拟的氮沉降强度,设置0.6、6.25、12.5、25.0和50.0 kgN·hm-2a-1共5个氮添加梯度,每梯度20次重复。考虑到本地区氮沉降背景值为7.99 kgN·hm-2a-1,因此,模拟的实际氮沉降强度为8.59~57.99 kgN·hm-2a-1。
在研究区选择海拔1 750 m的稀疏次生林设置面积约1 hm2的试验场,在样地内选择5个地点,各建立一个高2 m、面积1.2 m × 2.0 m、3面侧壁上部用透明薄膜封紧的木架,在1.8 m高处安装带有12个微喷头的自动喷雾系统。采用0.04、0.41、0.82、1.63和3.25 mmol·L-1的NH4NO3溶液进行氮处理,每个木架内随机悬挂地衣20株。通过精度为秒级的微电脑开关(卓一电子,上海)控制喷雾时间为18 s,2015年4月1日至11月1日每天早晨喷雾1次,模拟的氮沉降强度为0.6、6.25、12.5、25.0和50.0 kgN·hm-2a-1。基于“参考法”测定长松萝地衣体起始质量(McCune et al., 1996)。将110株地衣置于室温下平衡水分48 h,测定生物量m1(精确至0.1 mg)并编号,然后随机选择10株作为对照,置于-18 ℃冰箱中保存(McCune et al., 1996)。其余100株随机分为5组,分别接受0.04、0.41、0.82、1.63和3.25 mmol·L-1的NH4NO3溶液处理。
氮处理结束后,取回地衣,与对照地衣一同置于室温下风干48 h,测定各株地衣的生物量m2。将对照地衣在65 ℃下烘干至恒质量,计算试验起始和结束时地衣的含水量,并据此计算地衣的起始真实生物量m′1和最终的真实生物量m′2。
为了分析植物体内氮积累情况,收集野外样品后烘干磨细,称取500 mg,每个氮处理3次重复。参考赵世杰等(1998)的H2SO4+H2O2方法消煮样品,定容至100 mL备用,然后用连续流动分析仪(Skalar,Breda,The Nether-lands)测定消煮液的铵态氮、硝酸盐氮、凯氏总氮和总磷,以凯氏总氮和总磷数据计算地衣体的氮磷比。
2.2.2 氮沉降对地衣繁殖体存活的影响本试验在实验室进行,采用单因素完全随机设计,试验因子为模拟的氮沉降强度,设置0、0.05、0.1、0.2和0.4 mmol·L-1 5个氮浓度梯度的含NH4NO3人工雨水,每梯度4次重复。制备若干5 cm × 8 cm的带皮皂柳(Salix fargesii)木块,小心去除表面的地衣后,置于120 ℃烘箱中杀菌24 h备用(Armstrong, 1990; Sillett et al., 2000)。将长松萝室温下风干,手动将其碾碎,过2~5 mm筛。木块在无菌水中浸泡24 h后,在每片木片上均匀放置60段地衣,共20片,随机分为5组,每组4片(即4次重复)。将4片木片放入15 cm × 20 cm透明的塑料盒中,置于15±2 ℃、相对湿度(RH)60%±5%、明暗各12 h、光照强度60~80 μmol·m-2s-1的光照培养箱中培养,每3天喷雾1次至地衣体水分饱和,共处理6个月。试验结束时,在体视显微镜下观察地衣体颜色以判断其是否存活,然后统计各处理的存活率。
2.2.3 地衣对硝态氮和氨态氮吸收的选择性本试验在实验室进行,采用单因素完全随机设计。为模拟自然雨水的氮浓度,取(NH4)2SO4溶于0.2 mmol·L-1的CaSO4溶液中配制0.1、0.2、0.4、0.8、1.6和2.0 mmol·L-1 6个氮浓度梯度的溶液,KNO3则设置0.02、0.05、0.1、0.2、0.4、0.8、1.6和2.0 mmol·L-1 8个梯度、每梯度5次重复。选择保存良好的地衣,置于15 ℃、相对空气湿度(RH)95%、光照强度40~60 μmol·m-2s-1的培养箱中,喷人工雨水活化7天(Johansson et al., 2012)。取出后室温下风干,称取50 mg地衣体,用去离子水冲洗干净,转入0.2 mmol·L-1的CaSO4溶液中,预培养24 h,排除自由空间中残留氮素的影响;然后从培养箱中取出地衣,用吸水纸吸干表面水分,将其浸泡于10 mL不同浓度的氮溶液中30 min,并用摇床不断震荡(Dahlman et al., 2004)。最后,在65 ℃下将地衣烘干至恒质量,测定地衣干质量m;采用纳氏试剂法测定溶液的铵态氮含量,用紫外分光度法测定溶液的硝态氮含量(郭华等,2016),根据溶液铵态氮和硝酸盐氮浓度变化计算地衣体的氮吸收速率。
2.2.4 氮沉降对谷氨酰胺合成酶(GS)、硝酸还原酶(NR)和磷酸单酯酶(PME)活性的影响本试验在实验室内进行,采用单因素完全随机设计。设置0.1、0.2、0.4、0.8和1.6 mmol·L-1 5个梯度的NH4NO3溶液模拟自然雨水的氮浓度,以探讨氮沉降对谷氨酰胺合成酶(GS)活性和硝酸还原酶(NR)活性的影响。选择健康地衣18株,随机分为6组,每组3株(即3次重复)。每组随机接受不同浓度的氮溶液喷雾,直至地衣体水分饱和为止。每3天喷雾1次,置于15 ℃、相对空气湿度(RH)95%、光照强度40~60 μmol·m-2s-1的培养箱中培养60天。参考赵世杰等(1998)的方法测量硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性。酶活性以单位时间、单位鲜质量地衣反应后溶液吸光值(A·g-1h-1FW)表示。
参照Tunner等(2001)的方法测定磷酸单酯酶PME活性。选择健康地衣置于15 ℃、40~60 μmol·m-2s-1、相对空气湿度(RH)95%的培养箱中,模拟6.25、12.5、25.0和50.0 kgN·hm-2a-1的氮沉降,每个浓度梯度4次重复,培养60天。然后将地衣体在碾钵中捣碎后置于盛有2.9 mL、浓度为0.02 mol·L-1的柠檬酸-柠檬酸钠缓冲液(pH=2.5)试管中,加入0.1 mL的p-NPP溶液(90 mmol·L-1);黑暗条件下,在15 ℃水浴摇床中反应30 min。取2.5 mL反应液于另一试管,加入0.25 mL反应终止液(1.1 mol·L-1 NaOH, 27.5 mmol·L-1EDTA, 0.55 mol·L-1K2HPO4),在405 nm波长下测定吸光度值,并计算地衣水解生成对硝基苯酚(p-NP)的量。将地衣样本取出,在80 ℃下烘干24 h后称干质量。酶活性以单位时间、单位干质量地衣水解p-NPP生成的对硝基苯酚的量(μgNO2-·g-1h-1DW)来表示。
2.3 数据处理地衣体生长率(G)计算方法为:
| $ G = (m{^{'} _2} - m{^{'} _1})/m{^{'} _1} \times 100\% 。$ | (1) |
氮吸收率(A)计算方法为:
| $ A = ({N_t} - {N_0})/m。$ | (2) |
式中:Nt为氮处理后溶液的铵态氮或硝态氮浓度;N0为氮处理前溶液的铵态氮或硝态氮含量。
对地衣体生长速率、地衣繁殖体存活率、地衣体氮磷含量及GS、NR和PME酶活性数据,用SPSS软件进行单因素ANOVA分析(P<0.05时差异显著),并采用Tukey’s (HSD)进行多重比较,Origin7.5软件作图。对硝态氮和氨态氮的吸收速率,只进行单因素ANOVA分析,以比较各氮水平之间的差异。
3 结果与分析 3.1 氮沉降对长松萝地衣体生长及繁殖体存活的影响在8.59~20.94 kgN·hm-2a-1的氮沉降处理下,长松萝地衣体生长速率随氮沉降强度增加而增加;而在32.99和57.99 kgN·hm-2a-1的氮沉降处理下,生长速率变为负值,生长被显著限制(P<0.05,图 1)。同时,在0~0.2 mmol·L-1氮处理下长松萝繁殖体的存活率变化不明显,在0.4 mmol·L-1时存活率显著降低(P<0.05,图 1)。
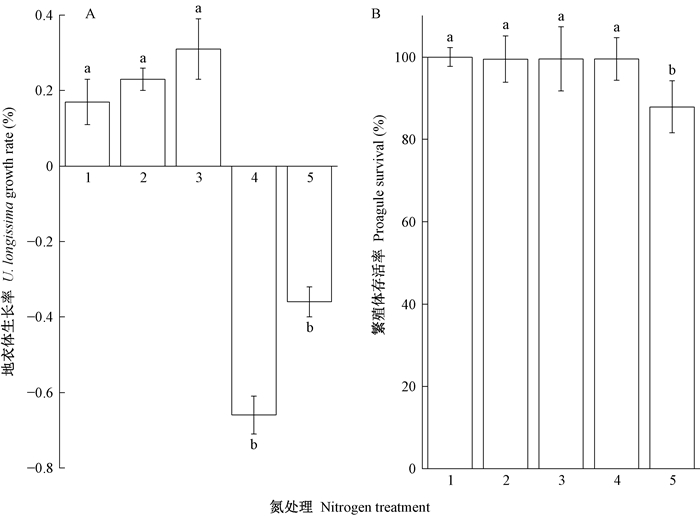
|
图 1 氮沉降增加对长松萝生长速率和繁殖体存活率的影响 Fig. 1 Impacts of increased nitrogen deposition on lichen individual growth rate and propagule survival of U. longissima 在图 1A中,1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1的氮处理;在图 1B中,1~5分别为0、0.05、0.1、0.2和0.4 mmol·L-1的氮处理。 In Fig. 1A, treatments 1-5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen treatment; in Fig. 1B, treatments 1-5 were 0, 0.05, 0.1, 0.2, and 0.4 mmol·L-1 nitrogen treatment. |
长松萝对铵态氮和硝态氮的吸收存在显著选择性(图 2、3),对铵态氮的吸收率随溶液中氮浓度增加而增加,吸收率在0.1~0.8 mmol·L-1氮处理间存在显著差异(P<0.05),且在高浓度处理下也没有表现出明显饱和(图 3)。各处理下长松萝均不能吸收硝酸盐氮,反而向溶液中释放硝态氮,在0.8 mmol·L-1氮处理时的释放率显著高于0.1和2.0 mmol·L-1氮处理(P<0.05,图 3)。
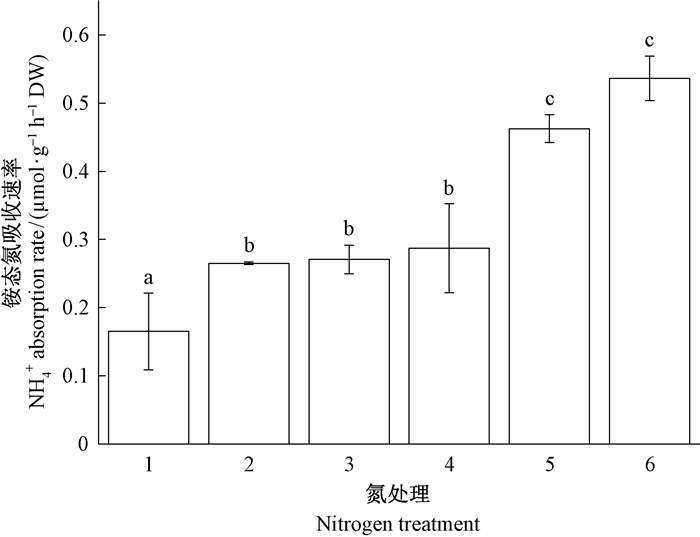
|
图 2 长松萝NH4+吸收速率对氮浓度增加的响应 Fig. 2 Responses of ammonium absorption rate of U. longissima to increasing nitrogen availability 1~6分别为0.1、0.2、0.4、0.8、1.6和2.0 mmol·L-1硫酸铵溶液。Treatments 1-6 were 0.1, 0.2, 0.4, 0.8, 1.6, and 2.0 mmol·L-1(NH4)2SO4 solution. |
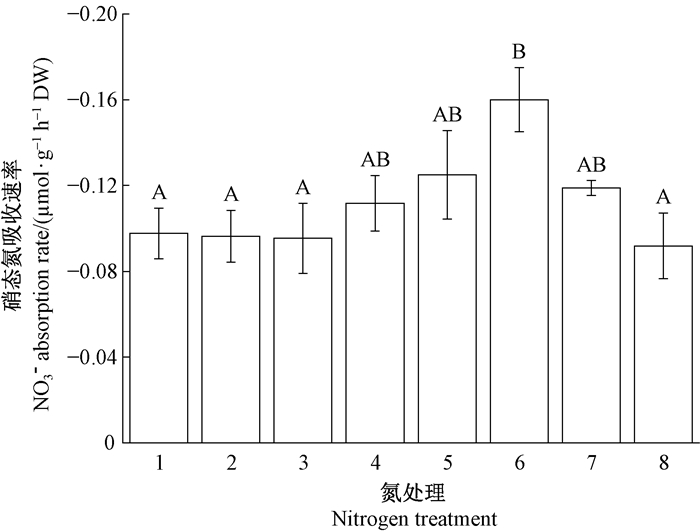
|
图 3 长松萝NO3-吸收速率对氮浓度增加的响应 Fig. 3 Responses of nitrate absorption rate of U. longissima to increasing nitrogen availability 1~8分别为0.02, 0.05, 0.1, 0.2, 0.4, 0.8, 1.6和2.0 mmol·L-1 KNO3溶液。 Treatments 1-8 were 0.02, 0.05, 0.1, 0.2, 0.4, 0.8, 1.6, and 2.0 mmol·L-1 KNO3 solution. |
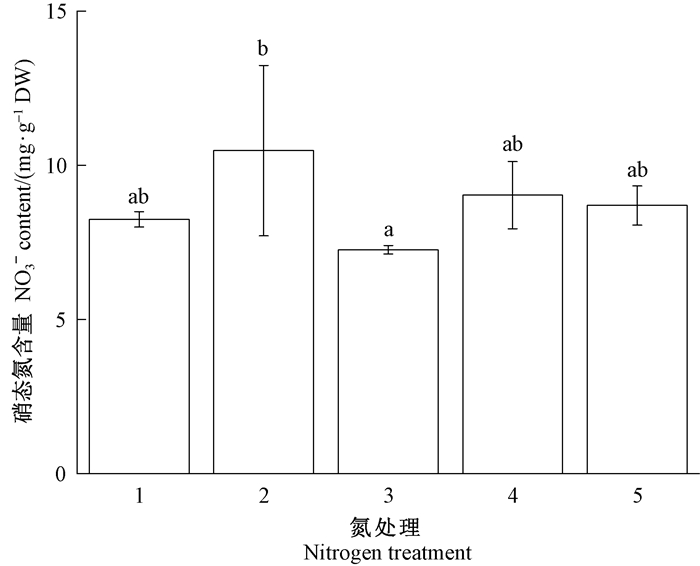
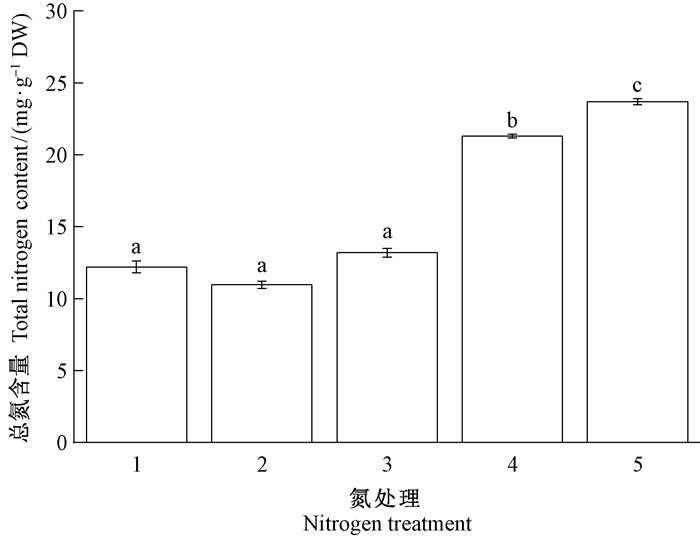
表 1表明,外界施氮处理对长松萝体内铵态氮、总氮存在显著影响(P<0.05),且总氮和铵态氮之间的相关性极显著(P<0.01),而硝态氮含量与其他变量不相关。具体而言,在不同浓度氮处理下,长松萝体内铵态氮和硝态氮含量存在显著差异(图 4和5),地衣体总氮含量随施氮浓度增加呈增加趋势(图 6)。其中,铵态氮在处理432.99 kgN·hm-2a-1显著高于处理1~38.59~20.94 kgN·hm-2a-1,处理557.99 kgN·hm-2a-1处理4显著高于32.99 kgN·hm-2a-1。这表明氮沉降增加导致长松萝体内铵态氮的积累,总氮含量增加主要是由于铵态氮增加引起的。
|
|
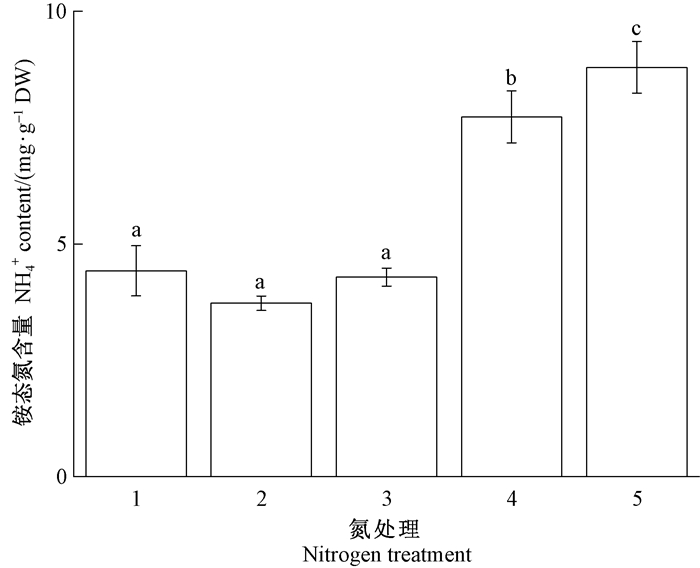
|
图 4 模拟氮沉降对长松萝体内铵态氮含量的影响 Fig. 4 Impacts of simulated nitrogen deposition on ammonium content of U. longissima 1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1的氮处理。 Treatments 1-5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen treatment. |
|
图 5 模拟氮沉降对长松萝体内硝态氮含量的影响 Fig. 5 Impacts of simulated nitrogen deposition on nitrate content of U. longissima 1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1的氮处理。 Treatments 1-5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen treatment. |
|
图 6 模拟氮沉降对长松萝总氮含量的影响 Fig. 6 Impacts of simulated nitrogen deposition on total nitrogen content of U. longissima 1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1的氮处理。 Treatments 1~5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen treatment. |
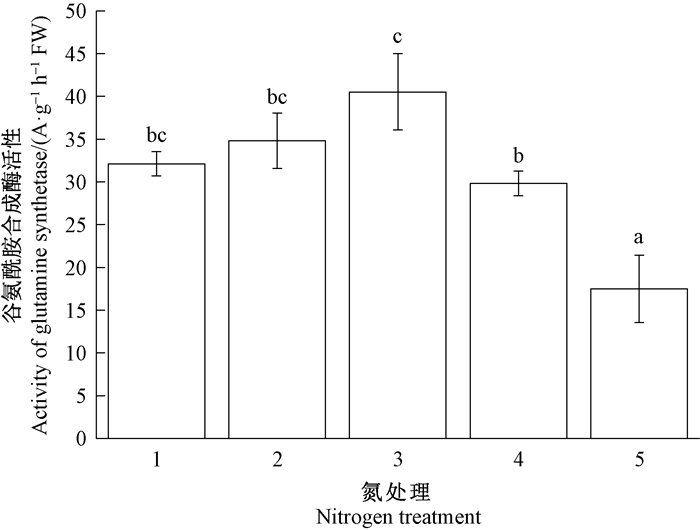
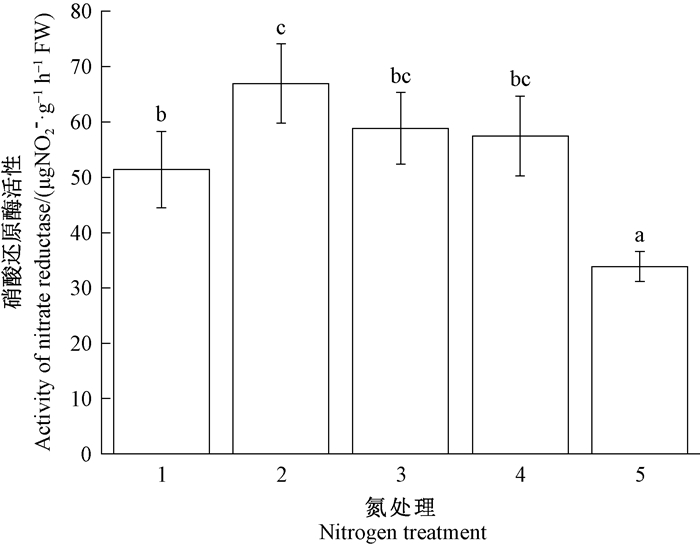
图 7、8表明,随着施氮浓度不断增加,长松萝体内GS和NR活性均先上升后降低。GS活性在0.1~0.4 mmol·L-1氮处理下显著升高,超过0.4 mmol·L-1后显著降低(P<0.05),在最高浓度(1.6 mmol·L-1)处理下活性最低(图 7)。NR活性在0.2 mmol·L-1氮处理下显著高于0.1 mmol·L-1氮处理(P<0.05),在0.4~0.8 mmol·L-1氮处理下略有降低,在最高浓度1.6 mmol·L-1处理下最低,且与其他处理差异显著(P<0.05,图 5)。
|
图 7 施氮量对长松萝谷氨酰胺合成酶活性的影响 Fig. 7 Impacts of nitrogen addition on activity of glutamine synthetase(GSA) of U. longissima 1~5分别为0.1、0.2、0.4、0.8和1.6 mmol·L-1 NH4NO3溶液。 Treatments 1-5 were 0.1, 0.2, 0.4, 0.8, and 1.6 mmol·L-1 NH4NO3 solution. |
|
图 8 施氮量对长松萝硝酸还原酶活性的影响 Fig. 8 Impacts of nitrogen addition on activity of nitrate reductase of U. longissima 1~5分别为0.1、0.2、0.4、0.8和1.6 mmol·L-1的NH4NO3溶液。 Treatments 1-5 were 0.1, 0.2, 0.4, 0.8, and 1.6 mmol·L-1 NH4NO3 solution. |
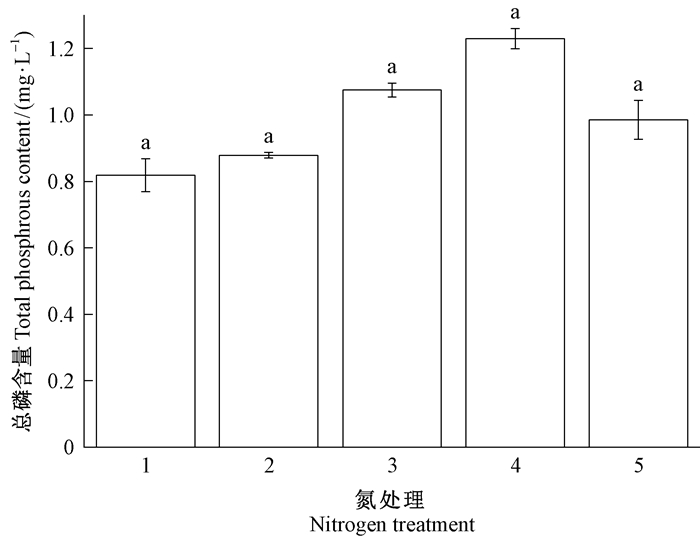
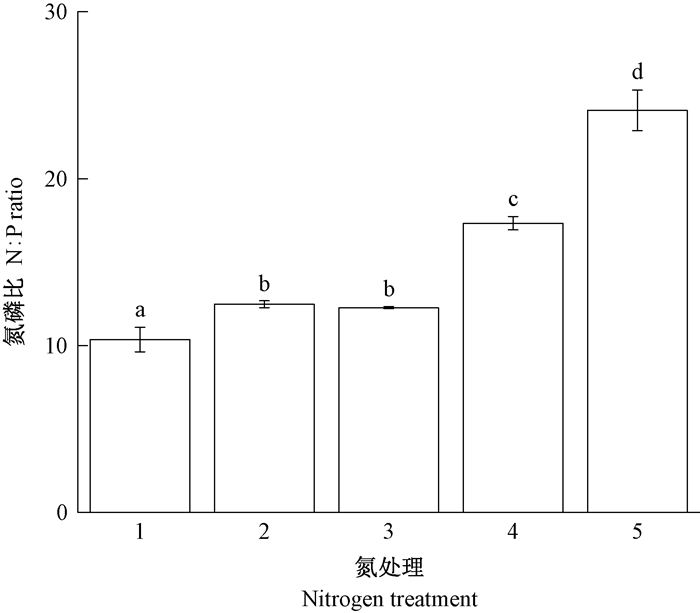
长松萝体内总磷含量在8.59~32.99 kgN·hm-2a-1氮处理中呈上升趋势,到57.99 kgN·hm-2a-1时降低,但各氮处理间差异不显著(图 9)。氮磷比(总氮:总磷)随模拟氮沉降增加呈上升趋势,从10.35增加到24.09,在氮沉降从20.94 kgN·hm-2a-1增加到57.99 kgN·hm-2a-1时尤为显著(图 10)。
|
图 9 氮处理对长松萝体内总磷含量的影响 Fig. 9 Effects of nitrogen addition on total phosphrous in thalli of U. longissima 1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1氮处理。 Treatments 1-5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen treatment. |
|
图 10 长松萝地衣体氮磷比对氮沉降增加的响应 Fig. 10 Thalli N-P ratio response of U. longissima to increasing nitrogen deposition 1~5分别为8.59、14.24、20.94、32.99和57.99 kgN·hm-2a-1的模拟氮沉降。 Treatments 1-5 were 8.59, 14.24, 20.94, 32.99, and 57.99 kgN·hm-2a-1 nitrogen deposition. |
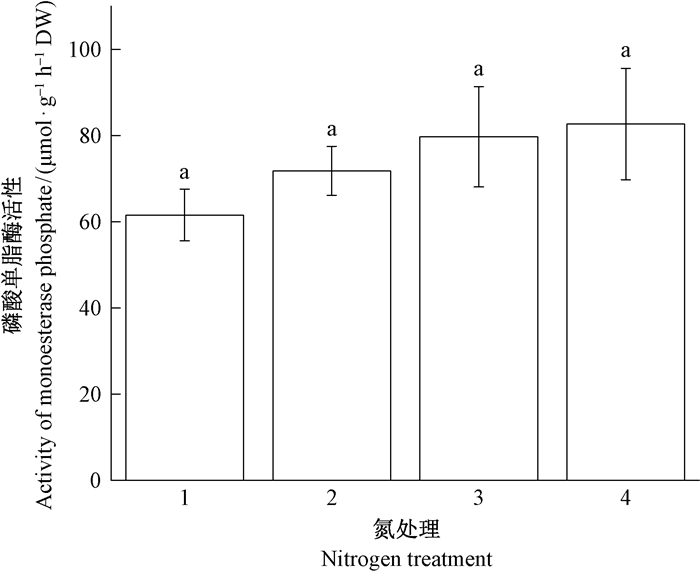
PME活性在6.25~50.0 kgN·hm-2a-1氮处理中大致呈上升趋势,但处理间差异并不显著(图 11)。在25.0和50.0 kgN·hm-2a-1的模拟氮沉降下,PME活性约增加到1.3倍,说明氮沉降增加诱导了长松萝的贫磷胁迫。
|
图 11 长松萝磷酸单脂酶活性随施氮量的变化 Fig. 11 Monoesterase phosphale activity response of U. longissima to increasing nitrogen deposition 1~4分别代表 6.25、12.5、25.0和50.0 kgN·hm-2a-1的模拟氮沉降。 Treatments 1-4 were 6.25, 12.5, 25.0, and 50.0 kgN·hm-2a-1 nitrogen deposition. |
本研究结果显示,低强度氮沉降对长松萝的生长速率具有一定促进作用,这种低强度氮添加引起的施肥效应在其他松萝属地衣相关研究中也被观察到(Carreras et al., 1998)。而高强度氮沉降会强烈抑制长松萝生长,显著降低繁殖体存活率,证实了长松萝的氮敏感性。目前,神农架地区的氮沉降背景值为7.99 kgN·hm-2a-1(降雨的年均N浓度为0.097 mmolN·L-1),当前的氮沉降可能并未影响长松萝的生长存活,但在未来氮沉降不断增加的趋势下,长松萝的生长繁殖可能面临严峻考验。长松萝是我国川金丝猴和滇金丝猴(Rhinopithecus bieti)重要的食源地衣(铁军,2009;Xiang et al., 2007),氮沉降持续增加造成的地衣丰盛度下降对川金丝猴种群维持的影响值得进一步关注。
本研究表明,相对于NO3-,长松萝具有较强的NH4+吸收能力,与许多氮敏感性地衣偏好于利用NH4+的研究结果一致(Dahlman et al., 2002; 2004; Gaio-Oliveira et al., 2005; Miller et al., 2007; Hauck, 2010)。目前的解释是,地衣细胞壁上有阳离子交换位点,铵离子以可交换形式结合在细胞壁上,然后转移到原生质体,这是一个物理吸收过程,因此,铵离子被动、非代谢地进入细胞内(Miller et al., 1999)。地衣对硝酸盐的吸收则需要呼吸作用供能,因此从耗能角度可以解释长松萝吸收NO3-的能力较NH4+吸收能力弱。另有研究表明,绿藻地衣中的光合藻类没有硝酸盐吸收能力,从环境中吸收硝态氮仅由共生真菌完成(Munzi et al., 2012)。因此,作为一种绿藻地衣(彭锋等,2012),长松萝对硝态氮的吸收很可能也仅由真菌完成,这可能是长松萝对硝态氮吸收效率低下的另一个原因。综合来看,在氮沉降中最终进入长松萝体内导致氮积累过多的主要氮形式是NH4+。
本研究表明,氮沉降能够影响氮代谢关键酶谷氨酰胺合成酶(GS)和硝酸还原酶(NR)的活性,随氮浓度增加呈先上升后下降的趋势,与高等植物的研究结果一致,如在甜菜(Beta vulgaris)叶片和块茎中GS活性(刘娜等,2015)、玉米(Zea mays)穗位叶GS活性(吴雅薇等,2017)均会随着施氮水平提高而增加,超过某一限度后活性下降。硝酸还原酶是NO3-同化的第一步所需要的酶,也是硝态氮同化全过程的限速酶。一般认为,在低等植物、真菌与高等植物中,NO3-可以诱导硝酸还原酶基因的转录(刘丽等,2004);同时,在对许多作物的研究中均观察到外源NH4+对硝酸还原酶活性的抑制(赵越等,2003;杜旭华,2009)。谷氨酰胺合成酶是催化NH4+与谷氨酸(Gln)合成谷氨酰胺(Glu)的关键酶,外源NH4+可以提高谷氨酰胺合成酶的活性,NO3-对部分植物的谷氨酰胺合成酶基因表达也有一定诱导作用(李常健等,2001)。因此,低浓度氮处理下硝酸还原酶和谷氨酰胺合成酶活性升高可能与氮源的诱导作用有关。反过来,这种诱导作用可能加剧长松萝的铵态氮毒害,因为地衣体不可能在短时间内合成足够的碳骨架来消纳吸收或转化的铵。在高氮环境下这2种酶的活性降到极低,表明地衣体健康已经受到破坏,而硝酸还原酶和谷氨酰胺合成酶活性下调,则有可能进一步加剧地衣的氮毒害,因为,硝酸还原酶和谷氨酰胺合成酶活性下调使地衣体将铵态氮转化为无毒的氨基酸(例如精氨酸)加以储存的能力下降(Dahlman et al., 2003)。本研究结果说明,硝酸还原酶和谷氨酰胺合成酶活性对长松萝氮敏感性形成具有重要作用,证实了Cruz等(2006)在水稻(Oryza sativa)研究中的相关结论。因此,在今后地衣氮敏感性形成机制的研究中,应该对硝酸还原酶和谷氨酰胺合成酶活性变化给予重视。
本研究表明,在高强度氮沉降下,长松萝体内氮含量显著上升而磷含量增加不显著甚至降低,氮磷比约增到1.3倍,因此,氮沉降增加时长松萝处于氮诱导的缺磷状态。在欧洲的研究也证实,氮沉降导致地衣体氮含量和氮磷比增加为原来的1.3和1.4倍,使地衣体处于氮诱导的缺磷限制状态(Hogan et al., 2010)。PME活性变化是反映敏感植物磷供应状态的良好指标。Turner等(2001)发现英格兰高山苔藓的PME活性显著高于瑞典北部的同类苔藓,反映了英格兰高山处大量的大气氮沉降以及竞争激烈的磷资源;Hogan等(2010)的研究也证实氮敏感地衣具有上调PME活性的特征。本研究发现,在长松萝磷含量缓慢增加的同时,其PME活性缓慢增加,证明长松萝已经处于贫磷胁迫状态。由于植物对自身稳态的调节,即便外界提供的氮磷比变化10倍,植物体内可能也只有2~3倍的变化,但真菌和藻类的这种调节能力要弱一些,并且N变化很容易引起苔藓植物和地衣体内氮磷比的改变(Güsewell, 2004)。因此,长松萝磷缺乏很可能是氮沉降危害其健康的另一个重要机制。
5 结论中低程度(<20.94 kgN·hm-2a-1)的模拟氮沉降对长松萝的生长速率有促进作用,在此范围内长松萝体内硝酸还原酶、谷氨酰胺合成酶和磷酸单脂酶活性都会不同程度提高,加快了对氮和磷的利用。高强度(>32.99 kgN·hm-2a-1)的模拟氮沉降会抑制长松萝生长,繁殖体存活率也变低。总而言之,长松萝的氮敏感性是其偏好吸收、积累铵态氮以及氮供应增加使氮磷营养失衡和氮代谢关键酶活性下调等综合作用的结果。
陈露, 汪正祥, 雷耘, 等. 2013. 1990-2010年神农架林区气候变化特征分析. 湖北大学学报:自然科学版, 35(1): 11-16. (Chen L, Wang Z X, Lei Y, et al. 2013. The characteristics of climate change in Shennongjia forest area from 1990 to 2010. Journal of Hubei University:Natural Science, 35(1): 11-16. [in Chinese]) |
杜旭华. 2009.氮素形态对茶树生长及氮素吸收利用的影响.南京: 南京林业大学博士学位论文. (Du X H. 2009. Research on the effect of nitrogen form on growth physiology and nitrogen absorption-utilization in four tea varieties (Camellia sinensis L.). Nanjing: PhD thesis of Nanjing Forestry University.[in Chinese]) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1645724 |
李常健, 林清华, 张楚富. 2001. 高等植物谷氨酰胺合成酶研究进展. 生物学杂志, 18(4): 1-3. (Li C J, Lin Q H, Zhang C F. 2001. Progress of the studies on glutamine synthetase in higher plants. Chinese Journal of Ecology, 18(4): 1-3. [in Chinese]) |
刘丽, 甘志军, 王宪泽. 2004. 植物氮代谢硝酸还原酶水平调控机制的研究进展. 西北植物学报, 24(7): 1355-1361. (Liu L, Gan Z J, Wang X Z. 2004. Advances of studies on the regulation of nitrate metabolism of plants at nitrate reductase level. Acta Botanica Boreali-Occidentalia Sinica, 24(7): 1355-1361. DOI:10.3321/j.issn:1000-4025.2004.07.038 [in Chinese]) |
刘娜, 闫志山, 范有君, 等. 2015. 不同氮素水平对甜菜氮代谢酶和可溶性蛋白含量的影响. 中国农学通报, 31(30): 149-154. (Liu N, Yan Z S, Fan Y J, et al. 2015. Effects of different nitrogen application levels on the content of soluble protein and key enzyme activities in nitrogen metabolism of sugar beet. Chinese Agricultural Science Bulletin, 31(30): 149-154. DOI:10.11924/j.issn.1000-6850.casb15040052 [in Chinese]) |
郭华, 王传华, 杨林. 2016. 神农架四种树生地衣对不同形态氮素胁迫的生理响应. 生态学杂志, 35(3): 605-611. (Guo H, Wang C H, Yang L. 2016. Physiological response of four epiphytic lichens in Shennongjia Natural Reserve to different nitrogen stress. Chinese Journal of Ecology, 35(3): 605-611. [in Chinese]) |
彭锋, 边静, 彭湃, 等. 2012. 松萝属地衣植物的研究进展. 林产化学与工业, 32(1): 111-118. (Peng F, Bian J, Peng P, et al. 2012. Research progress of genus Usnea. Chemistry and Industry of Forest Products, 32(1): 111-118. [in Chinese]) |
铁军. 2009.神农架川金丝猴栖息地植物构成和食源植物评价研究.北京: 北京林业大学博士学位论文. (Tie J. 2009. The plant composition in the habitat and food resources evaluation of Rhinopitheeus roxellana in Shennongjia, China. Beijing: PhD thesis of Beijing Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10022-2009134668.htm |
王传华, 杨林, 袁巧玲, 等. 2015. 神农架地区川金丝猴栖息地四种树生地衣的氮敏感性. 生态学杂志, 34(3): 626-633. (Wang C H, Yang L, Yuan Q L, et al. 2015. Nitrogen sensitivity of four epiphytic lichens from habitats of Rhinopithecus roxellana in Shennongjia Natural Reserve. Chinese Journal of Ecology, 34(3): 626-633. [in Chinese]) |
吴雅薇, 李强, 豆攀, 等. 2017. 氮肥对不同耐低氮性玉米品种生育后期叶绿素含量和氮代谢酶活性的影响. 草业学报, 26(10): 188-197. (Wu Y W, Li Q, Dou P, et al. 2017. Effects of nitrogen fertilizer on leaf chlorophyll content and enzyme activity at late growth stages in maize cultivars with contrasting tolerance to low nitrogen. Acta Prataculturae Sinica, 26(10): 188-197. DOI:10.11686/cyxb2017006 [in Chinese]) |
杨林, 王明, 王传华. 2018. 神农架地区次生林主要树种林冠雨的氮磷营养特征. 生态学杂志, 37(4): 1018-1025. (Yang L, Wang M, Wang C H. 2018. Nitrogen and phosphorous characteristics of canopy rainfall of eight dominant tree species in secondary forests of Shennongjia Moutain. Chinese Journal of Ecology, 37(4): 1018-1025. [in Chinese]) |
杨敬元, 刘学聪, 廖明尧. 2014. 神农架一个川金丝猴群的食物分布. 动物学杂志, 49(4): 465-475. (Yang J Y, Liu X C, Liao M Y. 2014. Food distribution for a group of Rhinopithecus roxellana in Shennongjia, China. Chinese Journal of Zoology, 49(4): 465-475. [in Chinese]) |
赵世杰, 刘华山, 董新纯. 1998. 植物生理学实验指导. 北京: 中国农业科技出版社, 42, 96. (Zhao S J, Liu H S, Dong X C. 1998. Experimental instruction in plant physiology. Beijing: China Agriculture Science and Technique Press, 42, 96. [in Chinese]) |
赵越, 魏自民, 马凤鸣. 2003. 不同水平铵态氮对甜菜硝酸还原酶和谷氨酰胺合成酶活力的影响. 中国糖料, 25(1): 22-25. (Zhao Y, Wei Z M, Ma F M. 2003. Influence of the different level ammonium nitrogen on NRA and GSA in sugar beet. Sugar Crops of China, 25(1): 22-25. DOI:10.3969/j.issn.1007-2624.2003.01.006 [in Chinese]) |
张于光, 宿秀江, 丛静, 等. 2014. 神农架土壤微生物群落的海拔梯度变化. 林业科学, 50(9): 161-166. (Zhang Y G, Su X J, Cong J, et al. 2014. Variation of soil microbial community along elevation in the Shennongjia Mountain. Scientia Silvae Sinicae, 50(9): 161-166. [in Chinese]) |
Armstrong R A. 1990. Dispersal, establishment and survival of soredia and fragments of the lichen, Hypogymnia physodes (L.) Nyl. New Phytologist, 114(2): 239-245. DOI:10.1111/j.1469-8137.1990.tb00396.x |
Carreras H A, Gudiño G L, Pignata M L. 1998. Comparative biomonitoring of atmospheric quality in five zones of Córdoba City (Argentina) employing the transplanted lichen Usnea sp. Environmental Pollution, 103(2): 317-325. |
Cruz C, Bio A F M, Domínguez-Valdivia M D, et al. 2006. How does glutamine synthetase activity determine plant tolerance to ammonium?. Planta, 223(5): 1068-1080. DOI:10.1007/s00425-005-0155-2 |
Dahlman L, Nasholm T, Palmqvist K. 2002. Growth, nitrogen uptake, and resource allocation in the two tripartite lichens Nephroma arcticum and Peltigera aphthosa during nitrogen stress. New Phytologist, 153(2): 307-315. DOI:10.1046/j.0028-646X.2001.00321.x |
Dahlman L, Persson J, Näsholm T, et al. 2003. Carbon and nitrogen distribution in the green algal lichens Hypogymnia physodes and Platismatia glauca in relation to nutrient supply. Planta, 217(1): 41-48. |
Dahlman L, Persson J, Palmqvist K, et al. 2004. Organic and inorganic nitrogen uptake in lichens. Planta, 219(3): 459-467. |
Davies L, Bates J W, Bell J N B, et al. 2007. Diversity and sensitivity of epiphytes to oxides of nitrogen in London. Environmental Pollution, 146(2): 299-310. DOI:10.1016/j.envpol.2006.03.023 |
Fenn M E, Baron J S, Allen E B, et al. 2003. Ecological effects of nitrogen deposition in the western United States. BioScience, 53(4): 404-420. DOI:10.1641/0006-3568(2003)053[0404:EEONDI]2.0.CO;2 |
Fenn M E, Jovan S, Yuan F, et al. 2008. Empirical and simulated critical loads for nitrogen deposition in California mixed conifer forests. Environmental Pollution, 155(3): 492-511. DOI:10.1016/j.envpol.2008.03.019 |
Gaio-Oliveira G, Dahlman L, Palmqvist K, et al. 2005. Nitrogen uptake in relation to excess supply and its effects on the lichens Evernia prunastri (L.) Ach and Xanthoria parietina (L.) Th. Fr. Planta, 220(5): 794-803. DOI:10.1007/s00425-004-1396-1 |
Ge J W, Wu J Q, Zhu Z Q, et al. 1997. Studies on plant diversity and present situation of conservation in Shennongjia Biosphere Reserve, Hubei, China. Plant Science Journal, 15(4): 341-352. |
Guo S, Li B, Watanabe K. 2007. Diet and activity budget of Rhinopithecus roxellana in the Qinling Mountains, China. Primates, 48(4): 268-276. DOI:10.1007/s10329-007-0048-z |
Güsewell S. 2004. N:P ratios in terrestrial plants:variation and functional significance. New Phytologist, 164(2): 243-266. DOI:10.1111/j.1469-8137.2004.01192.x |
Hauck M. 2010. Ammonium and nitrate tolerance in lichens. Environmental Pollution, 158(5): 1127-1133. DOI:10.1016/j.envpol.2009.12.036 |
Hogan E J, Minnullina G, Sheppard L J, et al. 2010. Response of phosphomonoesterase activity in the lichen Cladonia portentosa to nitrogen and phosphorus enrichment in a field manipulation experiment. New Phytologist, 186(4): 926-933. DOI:10.1111/j.1469-8137.2010.03221.x |
Johansson O, Palmqvist K, Olofsson J. 2012. Nitrogen deposition drives lichen community changes through differential species responses. Global Change Biology, 18(8): 2626-2635. DOI:10.1111/j.1365-2486.2012.02723.x |
Li Y. 2006. Seasonal variation of diet and food availability in a group of Sichuan snub-nosed monkeys in Shennongjia Nature Reserve, China. American Journal of Primatology, 68(3): 217-233. DOI:10.1002/ajp.20220 |
McCune B, Derr C C, Muir P S, et al. 1996. Lichen pendants for transplant and growth experiments. The Lichenologist, 28(2): 161-169. DOI:10.1006/lich.1996.0014 |
Miller B D, Hawkins B. 2007. Ammonium and nitrate uptake, nitrogen productivity and biomass allocation in interior spruce families with contrasting growth rates and mineral nutrient preconditioning. Tree Physiology, 27(6): 901-909. DOI:10.1093/treephys/27.6.901 |
Miller J E, Brown D H. 1999. Studies of ammonia uptake and loss by lichens. The Lichenologist, 31(1): 85-93. DOI:10.1006/lich.1998.0178 |
Munzi S, Pirintsos S A, Loppi S. 2009. Chlorophyll degradation and inhibition of polyamine biosynthesis in the lichen Xanthoria parietina under nitrogen stress. Ecotoxicology and Environmental Safety, 72: 281-285. DOI:10.1016/j.ecoenv.2008.04.013 |
Munzi S, Paoli L, Fiorini E, et al. 2012. Physiological response of the epiphytic lichen Evernia prunastri(L.)Ach.to ecologically relevant nitrogen concentrations. Environmental Pollution, 171(1): 25-29. |
Sillett S C, McCune B, Peck J E, et al. 2000. Dispersal limitations of epiphytic lichens result in species dependent on old-growth forests. Ecological Applications, 10(3): 789-799. DOI:10.1890/1051-0761(2000)010[0789:DLOELR]2.0.CO;2 |
Turner B L, Baxter R, Ellwood N T W, et al. 2001. Characterization of the phosphatase activities of mosses in relation to their environment. Plant, Cell & Environment, 24(11): 1165-1176. |
Van Herk C M, Mathijssen-Spiekman E A M, deZwart D. 2003. Long distance nitrogen air pollution effects on lichens in Europe. The Lichenologist, 35(4): 347-359. DOI:10.1016/S0024-2829(03)00036-7 |
Xiang Z F, Huo S, Xiao W, et al. 2007. Diet and feeding behavior of Rhinopithecus bieti at Xiaochangdu Tibet:adaptations to a marginal environment. American Journal of Primatology, 69(10): 1141-1158. DOI:10.1002/ajp.20412 |
 2019, Vol. 55
2019, Vol. 55

