文章信息
- 周乃富, 宋晓波, 张俊佩, 常英英, 裴东.
- Zhou Naifu, Song Xiaobo, Zhang Junpei, Chang Yingying, Pei Dong.
- 核桃芽接愈合的组织学机制
- Histological Mechanism of Bud Grafting in Walnut
- 林业科学, 2019, 55(6): 37-43.
- Scientia Silvae Sinicae, 2019, 55(6): 37-43.
- DOI: 10.11707/j.1001-7488.20190605
-
文章历史
- 收稿日期:2019-02-20
- 修回日期:2019-03-26
-
作者相关文章
嫁接是有目的地将一株植物上的芽或枝等器官接到另一株带有根系的植株上,使二者愈合成活形成一个新植物体的技术(王幼群,2011),是农林业生产中重要的无性繁殖方式之一。嫁接繁殖既保持了接穗品种的优良性状,又能充分利用砧木抗寒、抗旱、抗病虫害等优良特性,被广泛用于良种繁育、种质资源保存等方面(何海洋等,2016)。核桃(Juglans regia)是我国重要的木本油料树种(张志华等,2018),核桃嫁接历史悠久,20世纪60年代正式立项开展核桃嫁接技术研究,主要采用双舌接的枝接方式,因其工序复杂,成本高且嫁接成活率低,以至于90年代后期,我国首批选育出的早实核桃良种推广过程受到严重制约(汤睿等,2017)。直至21世纪初才突破核桃方块芽接技术,极大地提高了嫁接成活率。方块芽接具有成本低、繁育周期短、成活率高等优点,被普遍应用于核桃嫁接生产中。前人对于核桃嫁接技术的研究多集中在砧木和接穗质量(Hesabi et al., 2016; 蒲光兰等,2016)、嫁接时期(刘玉礼,2002)、环境因素(Ebrahimi et al., 2007; Mir et al., 2011)和嫁接方法(Paunovic et al., 2011; Majd et al., 2018)等方面,对于嫁接愈合过程的基础理论研究报道较少。有关嫁接砧穗愈合的研究表明,砧穗间的愈合过程主要经历4个阶段,分别为砧穗隔离期、愈伤组织的形成、愈伤组织的增殖和连接以及砧穗输导组织的连接(刘婧冉等,2018)。对于核桃嫁接愈合过程的组织学研究认为形成层是愈合的关键,是产生愈伤细胞的主要来源;愈伤组织的后期分化会产生新的形成层,并由其来完成后期的诱导连接(丁平海等,1991;何文等,2017)。对于核桃嫁接过程中,同一嫁接方法其愈合方式是否唯一,愈伤细胞的分化来源,完成愈合需要的时间等问题还有待进一步的研究。本研究采用解剖学方法,观察不同嫁接时期愈合过程中组织细胞的变化特点,以期为核桃嫁接成活机制研究和生产实践提供参考。
1 材料与方法 1.1 试验材料核桃嫁接试验在河北省保定市易县(E115°12′,N39°07′)进行,属于温带季风气候区,地势平坦,沙壤土,管理水平中上。
砧木为2年生本地核桃实生苗,苗高120~150 cm,地径2.5~3.0 cm, 株行距2.0 m×3.0 m。嫁接部位是半木质化新梢,新梢直径0.6~1.0 cm,嫁接位置离地面100 cm左右,方位为阳面。接穗取自当地12年生采穗圃中‘香玲’品种当年生新梢中部芽片,新梢直径0.5~0.8 cm。
1.2 芽接方法与样品采集采用方块芽接法进行嫁接,方块芽接操作:芽片取自接穗中部,先将芽片从接穗条上取下,芽片大小约长2.5 cm×宽0.6 cm。在砧木嫁接部位,按接芽大小纵切两刀,去掉砧木皮,然后将接芽贴紧,用塑料薄膜绑紧。分别于2017年和2018年连续2年进行芽接试验。易县核桃萌芽时间在4月10日左右,分别于萌芽后40~47天和100~107天进行嫁接,3次重复,每次重复嫁接60株。嫁接部位上端保留2片复叶,剪顶。分别于嫁接后3、4、5、6、9、12、15、20、25、30天取样,每个时间点采6个嫁接茎段。接后25天统计嫁接成活率,解绑后叶柄脱落,接穗芽膨大或萌发视为嫁接成活。
1.3 切片制作及解剖观察样品用改进的固定液(70%叔丁醇:35%~40%甲醛:丙酸:丙三醇体积比为85:5:5:5)固定,抽真空处理,4 ℃保存。并参照周乃富等(2018)的方法,进行软化处理和切片制作,厚度25 μm,甲苯胺蓝O染色,Olympus BX51显微镜观察并拍照。
2 结果与分析 2.1 木射线细胞主导的砧穗愈合新方式通过组织切片观察发现,在核桃芽接愈合过程中除了常见的形成层主导的嫁接愈合方式外,还存在一种新的愈合方式,出现在萌芽后100~107天的嫁接愈合过程中,其愈合过程如图 1A-I所示。嫁接初期,砧穗间存在一定间隙,其表面均形成较厚的黑褐色隔离层(图 1A),嫁接后4天,砧木木质部区域的木射线细胞脱分化形成愈伤细胞(图 1B),并开始迅速的分裂增殖(图 1C),与此同时,隔离层开始被突破,并逐渐溶解消失(图 1D);嫁接后6天,可观察到砧木一侧的愈伤组织呈条状,且大量增殖(图 1E);嫁接后9天,砧穗木质部间的愈伤组织连接(图 1F),实现初步愈合。嫁接12天后,愈伤组织进入分化阶段,细胞壁增厚,细胞由圆球形转变成方形,且排列更规则(图 1G)。嫁接后15天,可观察到愈伤组织在靠近接穗的位置分化出新的导管(图 1H);嫁接后25天,愈伤组织分化出新的形成层,新的形成层主要分化成木质部组织,同时形成层区域的射线原始细胞开始分裂,径向延长,与砧木和接穗的木射线连接(图 1I)。从而实现砧穗维管组织的连接,完成整个愈合过程。
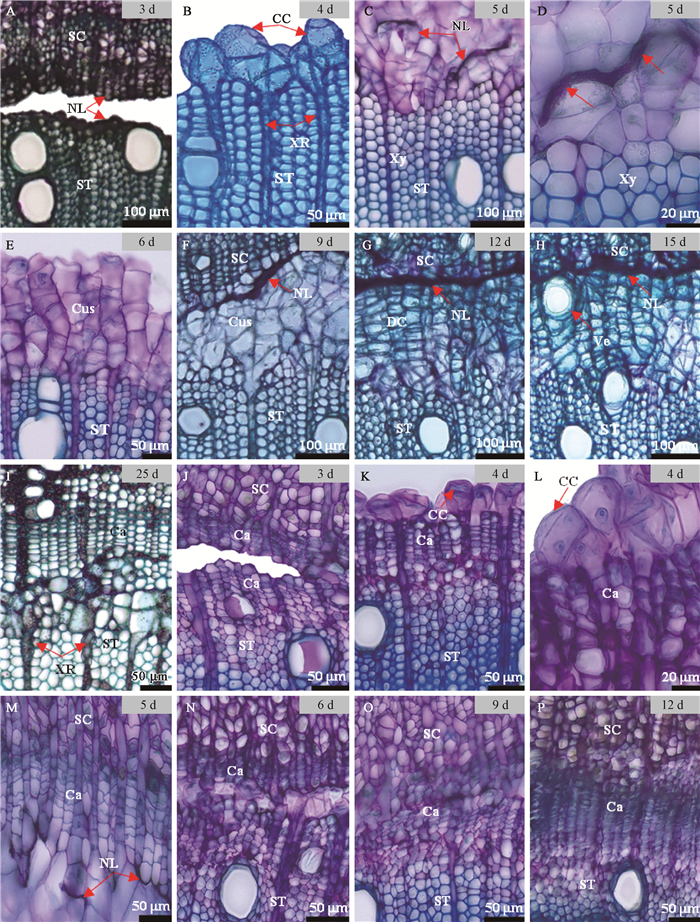
|
图 1 形成层细胞和木射线细胞主导砧穗愈合过程的解剖观察 Fig. 1 Anatomical observation on the healing process of stock and scion induced by cambium cell and xylem ray cell A-I:射线细胞主导的砧穗愈合方式;J-P:形成层细胞主导的砧穗愈合方式。CC:愈伤细胞;Ca:形成层;Cus:愈伤组织;DC:分化中的愈伤组织;SC:接穗;ST:砧木;NL:坏死细胞层;XR:木射线;Xy:木质部;Ve:导管。 A-I:Ray cell induced the healing process of stock and scion; J-P:Cambium cell induced the healing process of stock and scion. CC: Callus cells; Ca: Cambium; Cus: Callus; DC: Developing callus; SC: Scion; ST: Stock; NL: Necrotic layer; XR: Xylem ray; Xy: Xylem; Ve: Vessel. |
形成层主导的砧穗愈合方式出现在萌芽后40~47天的嫁接愈合过程中,如图 1J-P所示。嫁接后3天,可见砧木和接穗间的间隙,且各自表面均形成隔离层(图 1J);嫁接后4天,接口表面的部分形成层细胞开始恢复分裂能力,产生愈伤细胞(图 1K),且能清晰地观察到正在分裂的愈伤细胞(图 1L);嫁接后5天,愈伤组织开始增殖,并迅速填满砧穗间的缝隙(图 1M)。嫁接后6天,砧穗间愈伤组织完成连接(图 1N);嫁接后9天,砧穗间已完成部分形成层的修复和连接(图 1O);嫁接后12天,愈伤组织完成砧穗间完整形成层的连接(图 1P)。
2.2 愈合过程中隔离层的溶解在木射线细胞主导的砧穗木质部的愈合过程中发现,砧木表面隔离层要先于接穗发生溶解。砧木一侧的隔离层在嫁接后第5天,由于愈伤细胞膨大和增殖产生物理挤压,发生破裂,同时新的愈伤组织可以吸收隔离层的坏死细胞成分,使其逐渐被溶解,并于嫁接后9天完全消失。而接穗表面隔离层在愈伤组织进行分化时依然存在(图 1G,H),至后期分化出新的形成层时才完全消失。在形成层细胞主导的砧穗愈合过程中,砧穗隔离层的消失无明显的先后顺序,在嫁接后6天砧穗愈伤组织完成连接时(图 1N),均已完全消失。
2.3 2种愈合方式的比较分析在核桃芽接愈合过程中发现了上述2种不同的愈合方式,即木射线细胞主导的砧穗愈合(方式1)和形成层细胞主导的砧穗愈合(方式2)。这2种愈合方式产生的主要原因是芽片从接穗条、砧木皮从砧木上分离时的位置不同造成的。从木质部区域发生分离(图 2B),会出现愈合方式1,其实质是砧穗木质部间的愈合过程;从形成层区域发生分离(图 2C),则会出现愈合方式2,其实质是砧穗形成层间的愈合过程。萌芽后40~47天和100~107天嫁接时的主要愈合方式分别为方式2和方式1,嫁接成活率分别为95.6%和61.7%,二者差异极显著(P<0.01)。
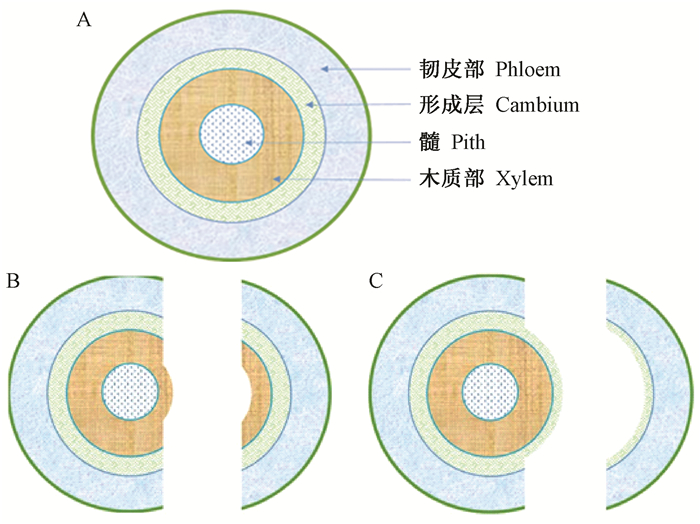
|
图 2 核桃茎段横截面及其分离方式示意 Fig. 2 Schematic diagram of the cross section and the way of separation of walnut stems A:完整的茎段横截面;B:从木质部区域发生分离;C:从形成层区域发生分离。 A:Complete cross section of stem; B:Separation from the xylem; C:Separation from the cambium. |
对2种愈合方式进行比较发现,其愈合过程均会经历砧穗隔离期、愈伤组织形成和砧穗愈伤组织的连接3个阶段。其不同之处(表 1)主要体现在:第一,愈伤细胞来源不同,方式1中愈伤细胞来源于次生木质部的木射线细胞,方式2来源于形成层细胞。第二,愈伤组织后期分化过程不同,方式1中愈伤组织会先分化出导管,再分化产生新的形成层,最后由形成层细胞来完成砧穗间木质部的连接;而方式2中能观察到砧穗间原有形成层的修复和连接,但未观察到导管的分化。第三,完成愈合过程所需时间不同,方式1完成愈合需25~30天,方式2完成愈合所需时间较短,仅需12~15天。
|
|
嫁接技术是基于植物再生能力而实现的(孙贝贝等,2016),在双子叶植物的茎中,位于木质部和韧皮部之间的形成层,是重要的分生组织,具有很强的分裂和分化能力。因此,在嫁接过程中砧穗间形成层的愈合是常见的愈合方式,形成层细胞在整个愈合过程中发挥重要的作用(兖攀等,2018)。在本研究中发现,核桃芽接愈合过程中还存在由木射线细胞主导完成的砧穗木质部间的愈合过程,此过程中由于砧木和接穗均是从位于形成层内侧的次生木质部区域发生的分离,所以整个愈合过程没有原形成层细胞的参与。
本研究中2个不同的嫁接时期均采用相同的芽接操作,由于分离位置明显不同,造成2种不同的嫁接后愈合方式。核桃生长期枝条或健壮发育枝在年生长周期中存在2次生长高峰(张志华等,2018),萌芽后40~47天处于新梢第1次迅速生长期,之后会出现停长,萌芽后100~107天则处于新梢第2次迅速生长期,二者发育状态一致,均处于半木质化状态,但是组织学结构上存在一定差异:萌芽后40~47天的茎段中(图 3A),形成层细胞层数多,细胞体积较大,木质部导管数量少,芽接时更易从形成层区域发生分离;而萌芽后100~107天的茎段中(图 3B),形成层细胞层数明显减少,且细胞体积变小,而新形成的木质部细胞壁薄,导管数量多,因此分离位置更易发生于木质部区域。这可能是造成不同嫁接时期芽片分离位置不同的重要原因,而分离位置的不同直接造成这2种不同的嫁接后愈合方式。
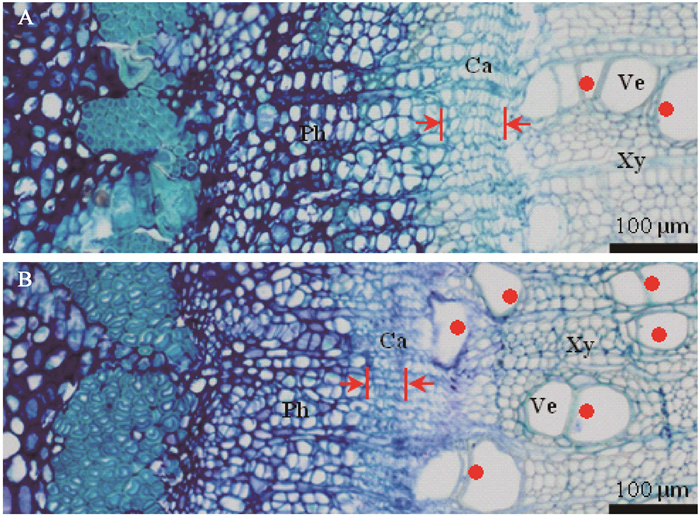
|
图 3 萌芽后不同天数核桃茎段横截面的解剖观察 Fig. 3 Anatomical observation of cross section of walnut stem segments on different days after germination A:萌芽后40~47天茎段横截面切片;B:萌芽后100~107天茎段横截面切片。红色箭头指示形成层厚度,红点表示导管。Ca:形成层;Ph:韧皮部;Xy:木质部;Ve:导管。 A: Cross section of stem 40-47 days after germination; B: Cross section of stem 100-107 days after germination. Red arrow indicates the thickness of cambium, and red dot indicates the vessel.Ca: Cambium; Ph: Phloem; Xy: Xylem; Ve: Vessel. |
这2种愈合方式的差异主要体现在愈伤组织的来源、隔离层的溶解和愈伤组织后期的分化连接过程。木射线细胞是由形成层的射线原始细胞衍生形成,其分化程度要高于射线原始细胞,但在损伤诱导下依然能分化出愈伤细胞(刘昊,2017)。不同愈合方式其愈伤细胞的来源不相同。方式1中愈伤组织主要来源于砧木木射线细胞;方式2中,愈伤组织由砧木和接穗形成层细胞分化形成。在植物嫁接中发现愈伤组织的来源有很多,包括形成层细胞、韧皮射线和韧皮部细胞、木射线细胞、周皮与韧皮部之间的薄壁细胞(郑坚端等,1980;苗丽等,2017)。而在本研究中,愈伤组织主要来自形成层细胞和木射线细胞,这与嫁接时砧木和接穗的分离位置相关,从形成层和木质部2个位置发生分离,分离面上的细胞受到物理损伤诱导,从而产生愈伤细胞(Pina et al., 2012)。嫁接愈合过程中,砧穗切口表面隔离层的形成能有效防止水分散发,阻止异物的浸染,是应对损伤的保护作用(Moore et al., 1981)。本研究发现,不同方式愈合过程中隔离层的厚度存在明显差异,方式1中隔离层的厚度明显大于方式2,可能与木质部细胞的细胞壁厚度高于形成层细胞相关,因为隔离层主要是由细胞壁残留物和一些高电子密度的物质累积形成的(Tiedemann, 1989)。方式2中砧穗隔离层的消失无明显的先后顺序,但方式1中砧木表面隔离层先消失,接穗表面隔离层在愈伤组织分化时依然存在,在分化出形成层后才完全融解消失。由此可见,方式1中大部分愈伤组织均来自砧木,且砧木愈伤组织的增殖能力强于接穗。愈伤细胞的增殖能力与植物营养物质的供应密切相关,根据细胞全能性理论,砧木和接穗均可形成愈伤细胞(金银根,2006);愈伤细胞的形成及增殖需要营养物质,芽接接穗主要由芽和韧皮部组成,养分供应能力有限,而砧木能通过根系和叶片为嫁接区域提供营养(张红梅等,2012)。愈伤组织的连接是砧穗间的初步愈合,是植物嫁接成活的首要条件(杨志坚等,2013)。方式1中愈伤组织需要依次分化形成导管和形成层,并由新形成层进一步分化产生木质部组织来完成砧穗维管组织的连通,整个过程相对复杂;而方式2中愈伤组织并没有分化产生导管,只是完成砧穗原有形成层的修复和连接,重新形成一个完整的形成层,整个过程较简单。愈合方式的差异导致砧穗完成愈合所需时间不同,愈合时间短更有利于嫁接成活。方式1和方式2完成整个愈合所需时间分别为25~30天和12~15天。因此,40~47天愈合时间短,嫁接成活率高;100~107天愈合时间长,嫁接成活率低。
方式1愈合实质是完成砧木和接穗木质部的重新连接过程,在没有原形成层细胞参与的情况下,需要通过木射线细胞脱分化形成愈伤组织,在靠近接穗区域形成新的形成层,然后由新的形成层来诱导后期的输导组织连接过程,实现最后的嫁接愈合;方式2愈合实质是完成砧木和接穗形成层的重新连接过程,只需要完成砧穗原形成层组织的连接,共同形成新的形成层即实现了嫁接愈合。
本研究发现了核桃芽接中存在由木射线细胞主导的砧穗木质部间的愈合新方式,并对其愈合过程中愈伤细胞的产生、隔离层的溶解、愈伤组织连接和分化,进行了组织学观察。后期研究应从超微结构入手,将形成层细胞和木射线细胞向愈伤细胞转化时、愈伤组织分化时的细胞特征作为研究的重点,进一步探索不同愈合方式下,砧穗间输导组织连接的差异。另外,不同的愈合方式的深入研究还需要与细胞功能变化(Melnyk et al., 2015)、生理生化过程(Hudina et al., 2014; Gainza et al., 2015)和关键信号转导(Stegemann et al., 2009; Aloni et al., 2013)等方面的研究相结合,进一步阐明核桃嫁接愈合机制。
4 结论核桃芽接愈合过程中,存在由木射线细胞主导的砧穗木质部间的愈合新方式,其愈伤组织由木射线细胞脱分化产生,且砧木隔离层要先于接穗发生溶解,砧木隔离层在完成愈伤组织连接后完全溶解,接穗隔离层在形成新的形成层后才消失。相比常见的砧穗形成层间的愈合方式,其愈伤组织绝大部分来自砧木,且后期分化过程复杂,完成愈合时间较长。
丁平海, 郗荣庭. 1991. 核桃枝接愈合过程的解剖学观察. 林业科学, 27(4): 457-460, 489. (Ding P H, Xi R T. 1991. The anatomical observation on the uniting process of walnut grafting branch. Scientia Silvae Sinicae, 27(4): 457-460, 489. [in Chinese]) |
何海洋, 彭方仁, 张瑞, 等. 2016. 嫁接繁殖研究进展及其在林木遗传改良中的应用前景. 世界林业研究, 29(4): 25-29. (He H Y, Peng F R, Zhang R, et al. 2016. Research advances on grafting propagation and its application prospects in genetic improvement of forest trees. World Forestry Research, 29(4): 25-29. [in Chinese]) |
何文, 潘鹤立, 潘腾飞, 等. 2017. 果树砧穗互作研究进展. 园艺学报, 44(9): 1645-1657. (He W, Pan H L, Pan T F, et al. 2017. Research progress on the interaction between scion and rootstock in fruit trees. Acta Horticulturae Sinica, 44(9): 1645-1657. [in Chinese]) |
金银根. 2006. 植物学. 北京: 科学出版社. (Jin Y G. 2006. Botany. Beijing: Science Press. [in Chinese]) |
刘昊. 2017.核桃复幼促进扦插生根的多激素作用机制.北京: 中国林业科学研究院博士学位论文. (Liu H. 2017. The mechanism of multiple hormones on promoting rooting during cutting of walnut rejuvenation. Beijing: PhD thesis of Chinese Academy of Forestry.[in Chinese]) |
刘婧冉, 杜长霞, 樊怀福. 2018. 植物嫁接砧穗愈合机制研究进展. 浙江农林大学学报, 35(3): 552-561. (Liu J R, Du C X, Fan H F. 2018. Research advance on healing mechanism of plant grafting. Journal of Zhejiang A&F University, 35(3): 552-561. [in Chinese]) |
刘玉礼. 2002. 核桃方块芽接技术研究. 河南农业大学学报, 36(4): 322-326. (Liu Y L. 2002. Study on the technology of square bud graft of Juglans regia. Journal of Henan Agricultural University, 36(4): 322-326. DOI:10.3969/j.issn.1000-2340.2002.04.005 [in Chinese]) |
苗丽, 李衍素, 范兴强, 等. 2017. 植物嫁接体接口愈合机制的研究进展. 植物生理学报, 53(1): 17-28. (Miao L, Li Y S, Fan X Q, et al. 2017. Research advances on mechanism of interface healing of plant grafting. Plant Physiology Journal, 53(1): 17-28. [in Chinese]) |
蒲光兰, 肖千文, 赖腾跃, 等. 2016. 核桃砧木、穗条内含物及其与嫁接成活率的关系. 陕西师范大学学报:自然科学版, 44(2): 79-84. (Pu G L, Xiao Q W, Lai T Y, et al. 2016. Study on the correlation between the inclusion variations in stock and scion walnut and grafting survival rate. Journal of Shaanxi Normal University: Natural Science, 44(2): 79-84. [in Chinese]) |
孙贝贝, 刘杰, 葛亚超, 等. 2016. 植物再生的研究进展. 科学通报, 61(36): 3887-3902. (Sun B B, Liu J, Ge Y C, et al. 2016. Recent progress on plant regeneration. Chinese Science Bulletin, 61(36): 3887-3902. [in Chinese]) |
汤睿, 刘静波, 刘劲, 等. 2017. 中国核桃嫁接繁殖技术研究进展. 农学学报, 7(8): 60-65. (Tang R, Liu J B, Liu J, et al. 2017. Walnut in China: research advances in grafting propagation techniques. Journal of Agriculture, 7(8): 60-65. [in Chinese]) |
王幼群. 2011. 植物嫁接系统及其在植物生命科学研究中的应用. 科学通报, 56(30): 2478-2485. (Wang Y Q. 2011. Plant grafting and its application in biological research. Chinese Science Bulletin, 56(30): 2478-2485. [in Chinese]) |
兖攀, 彭方仁, 张瑞, 等. 2018. 美国山核桃嫁接愈合过程的组织细胞学观察. 南京林业大学学报:自然科学版, 42(2): 202-206. (Yan P, Peng F R, Zhang R, et al. 2018. Histo-cytological observation on the graft union formation in Carya illinoinensis. Journal of Nanjing Forestry University: Natural Sciences Edition, 42(2): 202-206. [in Chinese]) |
杨志坚, 冯金玲, 陈辉. 2013. 油茶芽苗砧嫁接口愈合过程解剖学研究. 植物科学学报, 31(3): 313-320. (Yang Z J, Feng J L, Chen H. 2013. Study on the anatomical structures in development of the nurse seed grafted union of Camellia oleifera. Plant Science Journal, 31(3): 313-320. [in Chinese]) |
张红梅, 丁明, 姜武, 等. 2012. 不同苗龄接穗西瓜嫁接体愈合的组织细胞学研究. 园艺学报, 39(3): 493-500. (Zhang H M, Ding M, Jiang W, et al. 2012. Histological and cytological research on graft union formation of grafted watermelon seedlings with different scion ages. Acta Horticulturae Sinica, 39(3): 493-500. [in Chinese]) |
张志华, 裴东. 2018. 核桃学. 北京: 中国农业出版社. (Zhang Z H, Pei D. 2018. Walnut science. Beijing: China Agriculture Press. [in Chinese]) |
郑坚端, 余肖娟, 邱德勃, 等. 1980. 橡胶树芽接愈合过程的解剖观察. 热带作物学报, 1(1): 54-60. (Zheng J D, Yu X J, Qiu D B, et al. 1980. Anatomical observation of healing process of budding in hevea. Chinese Journal of Tropical Crops, 1(1): 54-60. [in Chinese]) |
周乃富, 张俊佩, 刘昊, 等. 2018. 木本植物非均质化组织石蜡切片制作方法. 植物学报, 53(5): 653-660. (Zhou N F, Zhang J P, Liu H, et al. 2018. New protocols for paraffin sections of heterogeneous tissues of woody plants. Chinese Bulletin of Botany, 53(5): 653-660. [in Chinese]) |
Aloni B, Cohen R, Karni L, et al. 2013. Hormonal signaling in rootstock-scion interactions. Sci Hortic, 127(2): 119-126. |
Ebrahimi A, Vahdati K, Fallahi E. 2007. Improved success of Persian walnut grafting under environmentally controlled conditions. International Journal of Fruit Science, 6(4): 3-12. DOI:10.1300/J492v06n04_02 |
Gainza F, Opazo I, Munoz C. 2015. Graft incompatibility in plants: metabolic changes during formation and establishment of the rootstock/scion union with emphasis on Prunus species. Chilean Journal of Agricultural Research, 75(1): 20-31. |
Hesabi F G, Sharafi Y, Tabatabasi S J, et al. 2016. Effect of budding method, rootstock age and cut below budding union on budding success in Persian walnut. Journal of Nuts, 7(2): 119-124. |
Hudina M, Orazem P, Jakopic J, et al. 2014. Scion-rootstock interaction affects the phytochemical composition of Prunus phloem. European Journal of Horticultural Science, 79(5): 248-259. |
Majd R S, Vahdati K, Roozban M R, et al. 2018. Exploring combinations of graft cover and grafting method in commercial walnut cultivars. nternational Journal of Fruit Science. DOI:10.1080/15538362.2018.1535355 |
Melnyk C W, Schuster C, Leyser O, et al. 2015. A developmental framework for graft formation and vascular reconnection in Arabidopsis thaliana. Current Biology, 25(10): 1306-1318. DOI:10.1016/j.cub.2015.03.032 |
Mir M, Kumar A. 2011. Effect of different methods, time and environmental conditions on grafting in walnut. International Journal of Farm Sciences, 1(2): 17-22. |
Moore R, Walker D B. 1981. Studies of vegetative compatibility-incompatibility in higher plants. I. A structural study of a compatible autograft in Sedum telephoides (Crassulaceae). American Journal of Botany, 68(6): 820-830. DOI:10.1002/ajb2.1981.68.issue-6 |
Paunovic S M, Miletic R, Mitrovic M, et al. 2011. Effect of callusing conditions on grafting success in walnut (Juglans regia L.). Journal of Fruit and Ornamental Plant Research, 19(2): 5-14. |
Pina A, Errea P, Martens H J. 2012. Graft union formation and cell-to-cell communication via plasmodesmata in compatible and incompatible stem unions of Prunus spp. Scientia Horticulturae, 143: 144-150. DOI:10.1016/j.scienta.2012.06.017 |
Stegemann S, Bock R. 2009. Exchange of genetic material between cells in plant tissue grafts. Science, 324(5927): 649-651. DOI:10.1126/science.1170397 |
Tiedemann R. 1989. Graft union development and symplastic phloem contact in the heterograft Cucumis sativus on Cucurbita ficifolia. Journal of Plant Physiology, 134(4): 427-440. DOI:10.1016/S0176-1617(89)80006-9 |
 2019, Vol. 55
2019, Vol. 55

