文章信息
- 陈婷婷, 王鹏凯, 张稼霁, 施季森, 成铁龙, 陈金慧.
- Chen Tingting, Wang Pengkai, Zhang Jiaji, Shi Jisen, Cheng Tielong, Chen Jinhui.
- 脱落酸和玉米素结合使用对杂交鹅掌楸体胚分化及发育的影响
- Effects of Combined ABA and ZT Treatment on Somatic Embryogenesis and Development of Liriodendron sino-americanum
- 林业科学, 2019, 55(3): 64-71.
- Scientia Silvae Sinicae, 2019, 55(3): 64-71.
- DOI: 10.11707/j.1001-7488.20190307
-
文章历史
- 收稿日期:2018-05-10
- 修回日期:2018-08-05
-
作者相关文章
2. 南京林业大学南方现代林业协同创新中心 南京 210037;
3. 南京林业大学生物与环境学院 南京 210037
2. Co-Innovation Center of Sustainable Forestry in Southern China, Nanjing Forestry University Nanjing 210037;
3. College of Biology and the Environment, Nanjing Forestry University Nanjing 210037
目前,许多林木已利用体细胞胚胎发生技术实现快繁,其主要难点在于胚性愈伤组织的诱导以及体胚分化阶段的优化。林木体胚发生过程受到多种内外因素的影响,如外植体类型及其成熟程度、培养基类型、外源激素配比以及培养环境等。众多研究结果表明,合理应用植物激素是成功诱导植物体胚发生的主要因素(Jiménez,2005)。脱落酸(Abscisic acid,ABA)对植物体胚发生发育具有重要的促进作用,但是单独使用ABA有可能抑制植物的体胚发生(Akula et al., 2000)。ABA加麦芽提取物或谷氨酰胺促进黑莓(Rubus subgenus Eubatus)体胚形成和发育(Sabooni et al., 2017),ABA加GSH能够促进巴西罗汉松(Podocarpus lambertii)体胚成熟(De Freitas Fraga et al., 2016)。细胞分裂素类(Cytokinin,CTK)在植物体胚诱导中同样发挥着重要作用(李明等,2011),据统计约有32%~60%的植物利用CTK来诱导体胚发生,如核桃类(Juglans)的体胚发生利用的主要生长调节剂是细胞分裂素类(汤浩茹等,2000);1.0~4.0 mg ·L-1的玉米素(Zeatin,ZT)能够诱导杂交鹅掌楸(Liriodendron sino-americanum)体胚发生(陈金慧等,2003)。CTK单独使用以及和生长素共同使用能够诱导体胚发生(宁国贵等,2010),然而CTK与脱落酸共同使用在林木体胚发生中尚未见报道。
杂交鹅掌楸是一种树形优美、生长迅速的园林绿化观赏树种,还是具有优良生态效益的造林树种,但其具有自然结实率低、实生苗遗传差异大等缺陷,传统的育苗方式已无法完全满足需求,限制了良种的大规模使用。南京林业大学对杂交鹅掌楸体细胞胚胎发生技术进行了研究,成功诱导出体细胞胚,建立了稳定高效的杂交鹅掌楸体胚发生和快速成苗体系(陈金慧等,2003;2012),并对杂交鹅掌楸体胚发生多种影响因素进行了研究,主要有基因型、外植体、生长调节剂配比、光照培养条件、活性炭、液体悬浮培养等(陈志等,2007;Li et al., 2012;鲁路等,2016)。但目前仍有部分问题需改善,如缩短体胚诱导周期,提高体胚诱导效率,减少畸形体胚数量等。
本研究主要探索体胚诱导阶段单独使用ABA以及和ZT结合使用对杂交鹅掌楸体细胞胚胎发生发育等方面的影响,最终筛选出高频发生且体胚发育状态正常的杂交鹅掌楸体细胞胚胎发生的培养基,为杂交鹅掌楸的良种繁育及遗传转化奠定基础。
1 材料与方法 1.1 试验材料15-5202基因型杂交鹅掌楸胚性愈伤组织取自南京林业大学林木遗传与生物技术重点实验室,于2015年以杂交鹅掌楸未成熟胚为外植体诱导获得,诱导参照成铁龙等(2017)描述的方法,胚性愈伤组织呈淡黄色,颗粒状,质感细腻,疏松易散。
1.2 试验方法 1.2.1 胚性愈伤组织的增殖选取生长状态良好的胚性愈伤组织,继代培养于增殖培养基上,25天继代1次,所用培养基为3/4MS + Vc 5 mg ·L-1 + 2, 4-D 1.0 mg ·L-1+ BA 0.2 mg ·L-1 +水解酪蛋白(CH) 0.5 g ·L-1 +蔗糖30 g ·L-1+水晶洋菜2.5 g ·L-1,其中3/4MS为将大量元素减少到原来的3/4,pH5.7,23 ℃暗培养。
1.2.2 胚性愈伤组织悬浮系的建立、继代及过渡培养以已建立的杂交鹅掌楸体胚发生体系(陈金慧等,2003)为基础,参照文献描述的方法(陈志等,2007;施季森等,2010;Li et al., 2012)进行体胚的分化。液体悬浮培养所用培养基为3/4MS + Vc 5 mg ·L-1 + 2, 4-D 2.0 mg ·L-1+ BA 0.2 mg ·L-1 + CH 0.5 g ·L-1 +蔗糖30 g ·L-1,pH5.7,基本流程是:取继代培养15天左右长势较好的胚性愈伤组织,于无菌操作台内接种于250 mL三角瓶中,按照1 :9的固液比例进行悬浮培养。将接种好的悬浮细胞系置于摇床内,23 ℃下暗培养,95 r ·min-1,7天继代1次。
将继代2次以后的悬浮细胞系用筛孔直径为280 μm和150 μm的无菌细胞筛进行物理筛选,获得大小均匀、形态规则、内含物丰富的胚性悬浮单细胞(陈金慧等,2003)。将筛选后的单细胞反冲于过渡培养基中,过渡培养所用培养基为3/4MS + Vc 5 mg ·L-1 + NAA 0.2 mg ·L-1+ KT 0.5 mg ·L-1 + BA 0.2 mg ·L-1 +水解乳蛋白(LH) 0.5 g ·L-1 +蔗糖30 g ·L-1,pH5.7,置于摇床内暗培养2天,23 ℃,95 r ·min-1。
1.2.3 不同浓度ABA对杂交鹅掌楸体胚发生的影响在体胚分化培养基中,将ABA设置6个浓度梯度,即3/4MS + Vc 5 mg ·L-1 +ABA(0,0.5,1.0,1.5,2.0,2.5 mg ·L-1)+ LH 0.2 g ·L-1 +活性炭2 g ·L-1+蔗糖40 g ·L-1+琼脂7 g ·L-1,pH5.7。调整悬浮单细胞密度约为400个·mL-1,取2 mL均匀涂于预先配制好的体胚诱导培养基,每个浓度梯度6皿,置于23 ℃暗培养。平板培养后每周观察体胚长势并拍照,3周统计每种处理的体胚总数、子叶胚数、畸形体胚数;暗培养30天后将体胚材料移至光照下培养2周(23 ℃,光照每天16 h,光照强度为15 μmol ·m-2s-1);分析不同浓度ABA对杂交鹅掌楸体胚发生的影响。后期将材料接种至3/4MS基本培养基,继续培养至再生植株(23 ℃,光照每天16 h,光照强度为15 μmol ·m-2s-1)。
1.2.4 ABA和ZT结合使用对杂交鹅掌楸体胚发生的影响在最佳体胚诱导浓度2.0 mg ·L-1 ABA的基础上,分别再添加0、0.2、0.4、0.6、0.8和1.0 mg ·L-1ZT,每个浓度梯度6皿,每皿涂2 mL悬浮单细胞,观察、统计方法参照1.2.3。
1.3 数据统计与分析将每皿(2 mL)体胚数目换算为单位体积(1 mL)的体胚数进行分析,使用GraphPad Prism Version6.0(GraphPad software,La Jolla,CA,USA)对试验数据进行统计处理并制表作图,并进行单因素方差分析(one way ANOVA)检验各处理组数据与对照组的差异,平均值的比较采用Duncan多重比较检验,显著性水平设为α=0.05一个水平,图表中所示数据均为重复测定的平均值和标准误差。主要计算公式如下:总体胚数=子叶胚数+畸形体胚数+其他发育时期体胚数。
2 结果与分析 2.1 ABA对杂交鹅掌楸体胚发生的影响 2.1.1 ABA对杂交鹅掌楸体胚分化的影响暗培养3周后观察发现,添加0.5~1.5 mg ·L-1 ABA时,能够加快部分体胚生长发育,且体胚形态正常(图 1B-D);添加2.0 mg ·L-1 ABA时(图 1E),体胚生长发育同步性较好,大多处于乳白色子叶胚阶段,且发育程度快于不添加ABA的对照(图 1A);添加2.5 mg ·L-1 ABA时,体胚生长受到抑制,呈球状白点,发育较慢(图 1F)。
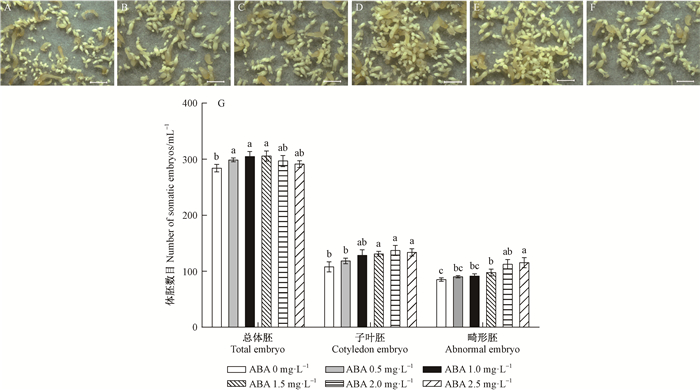
|
图 1 不同浓度ABA对杂交鹅掌楸体胚分化的影响 Fig. 1 Somatic embryos differentiation of Liriodendron sino-americanum treated with different concentration of ABA 标尺Bar: 2 mm. A-F分别是ABA 0,0.5,1.0,1.5,2.0,2.5 mg ·L-1诱导的体胚经暗培养3周后的状态;G表示不同浓度ABA诱导体胚分化的数目。不同小写字母表示在5%水平差异显著。下同。 The state of somatic embryos cultured on medium with 0, 0.5, 1.0, 1.5, 2.0, 2.5 mg ·L-1 ABA after 3 weeks of dark culture are shown in figure A-F; the number of somatic embryo induced by different concentrations of ABA is shown in figure G. The different lowercase letters indicate significant differences at 5% level. The same below. |
暗培养3周统计各处理的总体胚数、成熟子叶胚数以及畸形体胚数,每mL悬浮液可获约290个体胚,畸形体胚约占30%,且不同处理存在差异,结果见图 1G。在体胚分化培养基中添加ABA对体胚的分化具有促进作用,且显著优于对照,但浓度过高易产生畸形体胚。1.5 mg ·L-1 ABA时总体胚数最多,平均约306(±9)个·mL-1;2.0 mg ·L-1 ABA时子叶胚数最多,平均约137(±8)个·mL-1。不添加ABA的对照组,总体胚数平均约284(±7)个·mL-1,子叶胚数平均约107(±10)个·mL-1。而添加2.0~2.5 mg ·L-1 ABA,虽使体胚分化率明显提高,但畸形胚比例增加。总的来说,对于基因型为15-5202的杂交鹅掌楸胚性愈伤组织,2.0 mg ·L-1 ABA时子叶胚数目最高,体胚分化效果最优。
2.1.2 ABA对杂交鹅掌楸体胚生长和发育的影响经过2周的光培养,添加低浓度ABA诱导出的体胚呈现淡绿色,且子叶逐渐伸展转绿(图 2B-D),而不添加ABA诱导出的体胚呈白色,子叶淡黄色(图 2A),可见添加适宜低浓度的ABA能够促进体胚成熟。但随着ABA浓度的增加,体胚生长发育受到明显的抑制,具体表现在体胚下胚轴呈现短小粗壮的现象,并且在浓度较高时(图 2F),体胚颜色较深,呈圆柱状,子叶及胚根未正常分化。低浓度ABA诱导下的体胚经3/4MS基本培养基培养1个月可发育成小苗,而2.5 mg ·L-1 ABA诱导出的体胚后期生长发育受到抑制(图 2G-L)。总的来说,添加ABA 2.0 mg ·L-1时,子叶胚数目最多,并且此时体胚发育同步性较好,因此后期研究选择2.0 mg ·L-1 ABA。

|
图 2 不同浓度ABA对杂交鹅掌楸体胚生长和发育的影响 Fig. 2 Effects of different concentrations of ABA on somatic embryos' growth and development of Liriodendron sino-americanum 标尺Bar: 1 cm. A-F表示ABA 0,0.5,1.0,1.5,2.0,2.5 mg ·L-1诱导的体胚经光培养2周后状态;G-L表示经3/4MS基本培养基培养1个月后再生植株状态。 A-F represent the state of somatic embryos cultured on medium with 0, 0.5, 1.0, 1.5, 2.0, 2.5 mg ·L-1 ABA after 2 weeks of light culture; G-L represent plantlets after 1 month's light culture on 3/4MS medium. |
培养基中添加不同浓度的ZT对杂交鹅掌楸体胚诱导存在一定的影响。当单独添加2.0 mg ·L-1 ABA时,培养2周后体胚均为早期球形胚(图 3A);在一定范围内体胚生长速度随ZT浓度升高而加快(图 3B-D);当ZT浓度为0.4 mg ·L-1时,2周后开始出现子叶胚(图 3C);ZT浓度超过0.8 mg ·L-1时,体胚状态不佳,不利于杂交鹅掌楸体胚诱导(图 3E-F)。这表明,培养基中加入适当浓度ZT能够促进细胞分裂和分化,加快体胚生长发育。

|
图 3 ABA结合ZT对杂交鹅掌楸体胚早期发育状况的影响 Fig. 3 Effect of ABA and ZT combinations on early development of somatic embryos of Liriodendron sino-americanum 标尺Bar: 1 mm. A-F: ABA 2.0 mg ·L-1 +ZT 0,0.2,0.4,0.6,0.8,1.0 mg ·L-1,暗培养2周时的状态。 A-F: Somatic embryos cultured on medium with 2.0 mg ·L-1 ABA and 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1ZT separately, after 2 weeks of dark culture. |
暗培养3周观察发现,未添加ZT的对照组则大多为乳白色子叶胚(图 4A),当添加较低浓度的ZT时,能够明显加快体胚发育进程,体胚形态发育正常,表面光滑,生长状况良好(图 4B-D);而随着ZT浓度进一步提高至0.8~1.0 mg ·L-1时,体胚发育状态不同步(图 4E,F)。
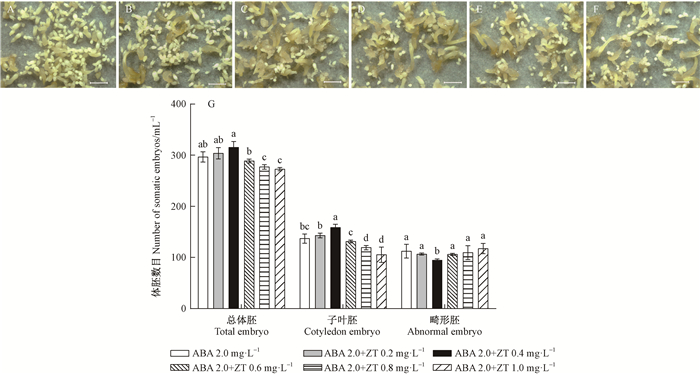
|
图 4 ABA结合ZT对杂交鹅掌楸体胚分化的影响 Fig. 4 Somatic embryos differentiation of Liriodendron sino-americanum treated with different concentration of ABA and ZT 标尺Bar: 2 mm. A-F分别为ABA 2.0 mg ·L-1+ZT 0,0.2,0.4,0.6,0.8,1.0 mg ·L-1诱导的体胚经暗培养3周后状态;G表示ABA 2.0 mg ·L-1+ZT 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1诱导体胚分化的数目。 The state of somatic embryos cultured on medium with ABA 2.0 mg ·L-1+ZT 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1 after 3 weeks of dark culture are shown in figure A-F. The number of somatic embryo induced by different concentrations of ABA 2.0 mg ·L-1+ZT 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1 is shown in figure G. |
不同处理的体胚分化效果存在差异,如图 4G所示。在体胚诱导培养基中同时添加ABA及ZT对体胚诱导具促进作用,但ZT浓度过高易产生畸形体胚。在0.4 mg ·L-1 ZT时总体胚数最多,平均约315(±10)个·mL-1,明显优于对照296(±8)个·mL-1;在0.4 mg ·L-1 ZT时子叶胚数最高,平均约158(±7)个·mL-1,显著优于对照137(±6)个·mL-1;当ZT浓度超过0.6 mg ·L-1时,体胚诱导效果不佳,畸形胚比例增加。总而言之,在2.0 mg ·L-1 ABA的基础上,添加0.2~0.4 mg ·L-1 ZT时总体胚数和子叶胚数都比不加ZT的效果好,畸形体胚数也呈下降趋势。
2.2.3 ABA和ZT结合使用对杂交鹅掌楸体胚生长和发育的影响经过2周的光培养,添加0.2 mg ·L-1 ZT时,体胚子叶分化明显且胚根发育正常,体胚生长状况较佳(图 5B);添加0.4 mg ·L-1 ZT时,光培养2周后体胚已发育成熟,第1片真叶形成且胚根发育健壮(图 5C),体胚生长状况明显优于未添加ZT的对照(图 5A);添加0.6 mg ·L-1 ZT时,体胚生长健壮,胚轴肥壮(图 5D);添加0.8 mg ·L-1ZT时,体胚子叶初步萌发,胚轴短小粗壮(图 5E);添加1.0 mg ·L-1 ZT时,体胚萌发不正常,发育明显受到抑制,胚轴短小粗壮(图 5F)。ABA结合低浓度ZT诱导下的体胚在3/4MS基本培养基上培养1个月可发育成小苗,并最终发育生长为体胚再生植株(图 5G-L)。

|
图 5 ABA结合ZT对杂交鹅掌楸体胚生长和发育的影响 Fig. 5 Effects of ABA and ZT combinations on growth and development of somatic embryos of Liriodendron sino-americanum 标尺Bar: 1 cm. A-F表示ABA 2.0 mg ·L-1+ZT 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1诱导的体胚经光培养2周后状态;G-L表示经3/4MS基本培养基培养1个月后再生植株状态。 A-F represent the state of somatic embryos cultured on medium with 2.0 mg ·L-1ABA and 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg ·L-1 ZT after 2 weeks of light culture; G-L represent plantlets after 1 month's light culture on 3/4MS medium. |
综合分析,在杂交鹅掌楸体胚诱导中,以2.0 mg ·L-1 ABA结合0.4 mg ·L-1 ZT为最优组合。ABA和ZT联合使用能够促进体胚生长,缩短体胚成熟时间,并且低浓度的ZT能够提高杂交鹅掌楸的体胚分化效率;而ZT浓度较高时,畸形胚数量明显上升,且部分畸形胚初期不能分化出子叶,但经过后期培养可以生长成正常植株。
3 讨论 3.1 脱落酸与鹅掌楸体细胞胚胎分化脱落酸对植物体胚的分化至关重要。本研究发现,添加0.5~2.0 mg ·L-1 ABA时,体胚发生数量及体胚成熟度优于对照,尤其添加2.0 mg ·L-1 ABA时,体胚发育同步性好,子叶胚数目最多;当ABA浓度为2.5 mg ·L-1时,体胚数量虽多于对照,但体胚生长状态较差,短小粗壮,生长受到抑制。在五味子(Schisandra chinensis)等植物的研究中同样发现ABA可促进体胚的高频萌发及成熟(Nishiwaki et al., 2000;Smiskova et al., 2005)。类似地,在疏花火烧兰(Epipactis veratrifolia)的研究中发现,在培养基中添加ABA可诱导出体细胞胚胎,且低浓度ABA能够提高体胚发生效率(Moradi et al., 2017),但高浓度ABA对体胚发生或体胚形态的正常发育具抑制作用,易产生更多畸形胚,体胚生长状态不佳(Vahdati et al., 2008)。因此,基于这一现象,在进行植物体胚诱导时需筛选并利用合适的ABA浓度。此外,ABA还会影响其他激素或调节基因的表达从而对体胚发生和发育产生影响。有研究指出,ABA通过影响细胞内局部生长素合成、极性运输和分布从而在植物体胚发生过程中起重要作用(Su et al., 2009)。ABA在拟南芥(Arabidopsis thaliana)体细胞胚胎发生过程中是必须的,且发现干细胞决定基因WUSCHEL(WUS)以及胚胎特征基因LEAFY COTYLEDON 1(LEC1)和LEAFY COTYLEDON 2(LEC2)在外源施加ABA时表达水平也受影响,可见ABA也会影响胚胎特征基因的表达而影响体胚再生(苏玉晓,2011)。
3.2 脱落酸结合玉米素与鹅掌楸体细胞胚胎分化本研究发现,在添加2.0 mg ·L-1ABA的基础上,同时添加0.2~0.4 mg ·L-1 ZT可改善体胚生长状态,促进杂交鹅掌楸体胚发生,缩短体胚成熟时间,使得体胚高频发生且质量较好。ZT在牛膝(Achyranthes bidentata)、金花茶(Camellia nitidissima)、五味子等植物胚性愈伤组织诱导中具有显著作用(Lü et al., 2013;Duan et al., 2016;Sun et al., 2016),并且可促进毛竹(Phyllostachys edulis)、五味子的体胚发生(Yuan et al., 2013;Sun et al., 2013)。在培养野生棉花克劳茨基棉(Gossypium klotzschianum)的MS培养基中添加ZT,可获得胚性愈伤组织且进一步发育为胚状体,其适宜浓度为3.0或5.0 mg ·L-1;同样在棉花的研究中发现,将含有ZT的培养基上形成的愈伤组织转至含有ZT的分化培养基上,才有体细胞胚形成,其他生长调节剂都不能代替ZT的作用(冯大领等,2007)。ZT作为胚胎发生中起重要作用的内源激素(Xu et al., 2013),在山竹(Garcinia mangostana)早期体细胞胚胎发生过程中,其生物合成基因均上调,且涉及细胞分裂素途径的19种基因均上调,进一步说明细胞分裂素相关基因可能在体胚发生中起正调节作用(Mahdavi-Darvari et al., 2017)。
在后期试验中,可以考虑其他类激素的结合使用,如KT、BA等细胞分裂素类,IAA,NAA等生长素类,以期利用更多的其他外源激素促进体胚分化率和成熟率,建立更加高效的体胚培养体系,获得优质的体胚再生植株。
4 结论在以15-5202基因型杂交鹅掌楸胚性愈伤组织进行体胚诱导时,单独使用ABA进行体胚诱导的最适浓度为2.0 mg ·L-1,平均每mL可获约250株体胚苗,且不同基因型的最适ABA浓度及分化效率存在一定差异。在ABA 2.0 mg ·L-1的基础上添加0.2~0.4 mg ·L-1低浓度的ZT能缓解高浓度ABA对体胚形态产生的抑制作用,提高体胚分化效率、促进体胚生长发育,平均每mL可获约300株体胚苗。综合分析,在杂交鹅掌楸体胚诱导中,以2.0 mg ·L-1 ABA结合0.4 mg ·L-1 ZT为最优组合。后期在进行杂交鹅掌楸体胚诱导时,须充分考虑生长调节剂的种类及使用浓度,将体细胞胚高频发生体系不断优化,促进优质种苗的规模化繁育。
陈金慧, 施季森, 诸葛强, 等. 2003. 杂交鹅掌楸体细胞胚胎发生研究. 林业科学, 39(4): 49-53. (Chen J H, Shi J S, Zhuge Q, et al. 2003. Studies on the somatic embryogenesis of Liriodendron hybrids. Scientia Silvae Sinicae, 39(4): 49-53. DOI:10.3321/j.issn:1001-7488.2003.04.008 [in Chinese]) |
陈金慧, 张艳娟, 李婷婷, 等. 2012. 杂交鹅掌楸体胚发生过程的起源及发育过程. 南京林业大学学报:自然科学版, 36(1): 16-20. (Chen J H, Zhang Y J, Li T T, et al. 2012. Study on origin and development of somatic embryos of Liriodendron hybrids. Journal of Nanjing Forestry University:Natural Science Edition, 36(1): 16-20. [in Chinese]) |
陈志, 陈金慧, 边黎明, 等. 2007. 杂交鹅掌楸胚性细胞悬浮系的建立. 分子植物育种, 5(1): 137-140. (Chen Z, Chen J H, Bian L M, et al. 2007. Establishment of embryogenic callus suspension culture system in Liriodendron hybrids. Molecular Plant Breeding, 5(1): 137-140. DOI:10.3969/j.issn.1672-416X.2007.01.025 [in Chinese]) |
成铁龙, 孟岩, 陈金慧, 等. 2017. 茉莉酸甲酯对杂交鹅掌楸体胚发育的影响. 南京林业大学学报:自然科学版, 41(6): 41-46. (Cheng T L, Meng Y, Chen J H, et al. 2017. Effects of methyl jasmonic acid on somatic embryogenesis of Liriodendron hybrid. Journal of Nanjing Forestry University:Natural Science Edition, 41(6): 41-46. [in Chinese]) |
冯大领, 孟祥书, 王艳辉, 等. 2007. 植物生长调节剂在植物体细胞胚发生中的应用. 核农学报, 21(3): 256-260. (Feng D L, Meng X S, Wang Y H, et al. 2007. Application of exogenous plant growth regulator in plant somatic embryogenesis. Journal of Nuclear Agricultural Sciences, 21(3): 256-260. DOI:10.3969/j.issn.1000-8551.2007.03.013 [in Chinese]) |
李明, 王树香, 冯大领. 2011. 植物体细胞胚发生及发育研究进展. 中国农学通报, 27(3): 237-241. (Li Ming, Wang S X, Feng D L. 2011. The advance of plant somatic embryogenesis and development. Chinese Agricultural Science Bulletin, 27(3): 237-241. [in Chinese]) |
鲁路, 陆叶, 盛宇, 等. 2016. 不同种活性炭对杂交鹅掌楸体胚发生的影响. 南京林业大学学报:自然科学版, 40(2): 1-7. (Lu L, Lu Y, Sheng Y, et al. 2016. The effects of different activated charcoal on somatic embryogenesis of Liriodendron hybrids. Journal of Nanjing Forestry University:Natural Science Edition, 40(2): 1-7. [in Chinese]) |
宁国贵, 吕海燕, 张俊卫, 等. 2010. 梅花不同外植体离体培养及体细胞胚诱导植株再生. 园艺学报, 37(1): 114-120. (Ning G G, Lü H Y, Zhang J W, et al. 2010. In vitro culture of different explants and plant regeneration via embryogenesis from immature cotyledons of Prunus mume. Acta Horticulturae Sinica, 37(1): 114-120. [in Chinese]) |
施季森, 李婷婷, 陈金慧, 等. 2010.杂交鹅掌楸体胚发生同步化控制方法: CN102037896B. (Shi J S, Li T T, Chen J H, et al. 2010. The synchronization control method on the somatic embryogenesis of Liriodendron hybrids: CN102037896B.[in Chinese]) |
苏玉晓. 2011. ABA在拟南芥体细胞胚胎发生过程中的功能研究.泰安: 山东农业大学硕士学位论文. (Su Y X. 2011. Molecular basis of ABA function in Arabidopsis somatic embryogenesis. Tai'an: MS thesis of Shandong Agricultural University.[in Chinese]) |
汤浩茹, 王永清, 任正隆. 2000. 核桃体细胞胚发生与转基因研究进展. 林业科学, 36(3): 102-110. (Tang H R, Wang Y Q, Ren Z L. 2000. An overview of progress on somatic embryogenesis and transformation in walnut. Scientia Silvae Sinicae, 36(3): 102-110. DOI:10.3321/j.issn:1001-7488.2000.03.017 [in Chinese]) |
Akula A, Akula C, Bateson M. 2000. Betaine a novel candidate for rapid induction of somatic embryogenesis in tea (Camellia sinensis (L.) O. Kuntze). Plant Growth Regulation, 30(3): 241-246. DOI:10.1023/A:1006323213621 |
De Freitas Fraga H P, do Nascimento Vieira L, Puttkammer C C, et al. 2016. Glutathione and abscisic acid supplementation influences somatic embryo maturation and hormone endogenous levels during somatic embryogenesis in Podocarpus lambertii Klotzsch ex Endl. Plant Science, 253: 98-106. DOI:10.1016/j.plantsci.2016.09.012 |
Duan H, Ding W, Song J, et al. 2016. Roles of plant growth substance in callus induction of Achyranthes bidentata. Research in Plant Biology, 6: 6-13. |
Jiménez V M. 2005. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis. Plant Growth Regulation, 47(2): 91-110. |
Li T, Chen J, Qiu S, et al. 2012. Deep sequencing and microarray hybridization identify conserved and species-specific microRNAs during somatic embryogenesis in hybrid yellow poplar. PLoS One, 7(8): e43451. DOI:10.1371/journal.pone.0043451 |
Lü J, Chen R, Zhang M, et al. 2013. Plant regeneration via somatic embryogenesis and shoot organogenesis from immature cotyledons of Camellia nitidissima Chi. Journal of Plant Physiology, 170(13): 1202-1211. DOI:10.1016/j.jplph.2013.03.019 |
Mahdavi-Darvari F, Noor N M. 2017. New insight into early somatic embryogenesis of Mangosteen (Garcinia mangostana) through de novo and comparative transcriptome analyses. Tropical Plant Biology, 10(1): 30-44. DOI:10.1007/s12042-016-9182-3 |
Moradi S, Dianati Daylami S, Arab M, et al. 2017. Direct somatic embryogenesis in Epipactis veratrifolia, a temperate terrestrial orchid. The Journal of Horticultural Science and Biotechnology, 92(1): 88-97. DOI:10.1080/14620316.2016.1228434 |
Nishiwaki M, Fujino K, Koda Y, et al. 2000. Somatic embryogenesis induced by the simple application of abscisic acid to carrot (Daucus carota L.) seedlings in culture. Planta, 11(5): 756-759. |
Sabooni N, Shekafandeh A. 2017. Somatic embryogenesis and plant regeneration of blackberry using the thin cell layer technique. Plant Cell, Tissue and Organ Culture, 130(2): 313-321. DOI:10.1007/s11240-017-1225-4 |
Smiskova A, Vlasinova H, Havel L. 2005. Somatic embryogenesis from zygotic embryos of Schisandra chinensis. Biologia Plantarum, 49(3): 451-454. DOI:10.1007/s10535-005-0027-4 |
Su Y H, Zhao X Y, Liu Y B, et al. 2009. Auxin-induced WUS expression is essential for embryonic stem cell renewal during somatic embryogenesis in Arabidopsis. The Plant Journal, 59(3): 448-460. DOI:10.1111/tpj.2009.59.issue-3 |
Sun D, Lang W X, Li H B, et al. 2013. An improve method for somatic embryogenesis of Schisandra chinensis (Turcz.) Baillon. Pakistan Journal of Biological Sciences, 16(3): 127-134. DOI:10.3923/pjbs.2013.127.134 |
Sun D, Yu Y F, Qin H Y, et al. 2016. Cryopreservation of Schisandra chinensis (Turcz.) Baill callus and subsequent plant regeneration. Genetics and Molecular Research, 15(4). DOI:10.4238/gmr15049342 |
Vahdati K, Bayat S, Ebrahimzadeh H, et al. 2008. Effect of exogenous ABA on somatic embryo maturation and germination in Persian walnut (Juglans regia L.). Plant Cell, Tissue and Organ Culture, 93(2): 163-171. DOI:10.1007/s11240-008-9355-3 |
Xu Z Z, Zhang C J, Zhang X Y, et al. 2013. Transcriptome profiling reveals auxin and cytokinin regulating somatic embryogenesis in different sister lines of cotton cultivar CCRI24. Journal of Integrative Plant Biology, 55(7): 631-642. DOI:10.1111/jipb.12073 |
Yuan J L, Yue J J, Wu X L, et al. 2013. Protocol for callus induction and somatic embryogenesis in moso bamboo. PLoS One, 8(12): e81954. DOI:10.1371/journal.pone.0081954 |
 2019, Vol. 55
2019, Vol. 55

