文章信息
- 倪妍妍, 肖文发, 刘建锋, 张玉婷, 胡军.
- Ni Yanyan, Xiao Wenfa, Liu Jianfeng, Zhang Yuting, Hu Jun.
- 不同种源北美乔柏和北美香柏幼苗叶挥发性成分的比较
- Comparison of Chemical Constituents of Volatile Compounds in Thuja plicata and Thuja occidentalis Seedlings Leaves of Different Provenances
- 林业科学, 2019, 55(3): 22-35.
- Scientia Silvae Sinicae, 2019, 55(3): 22-35.
- DOI: 10.11707/j.1001-7488.20190303
-
文章历史
- 收稿日期:2018-01-28
- 修回日期:2018-07-20
-
作者相关文章
2. 中国林业科学研究院森林生态与环境保护研究所 国家林业和草原局森林生态环境重点实验室 北京 100091;
3. 南昌市林业科学研究所 南昌 330004
2. Key Laboratory of Forest Ecology and Environment of State Forestry Administration, Research Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091;
3. Nanchang Institute of Forestry Nanchang 330004
崖柏属(Thuja)是柏科(Cupressaceae)的一个小属,现存5种,其中北美香柏(T. occidentalis)和北美乔柏(T. plicata)在北美分布广泛。北美香柏从北部针叶-苔原地带到南部落叶被子植物林带均有分布(Naser, 2005),而北美乔柏则主要分布在太平洋沿海山脉和北美西部的落基山脉(Peng, 2008),二者是北美重要的用材与绿化树种,被欧洲和亚洲许多国家引种栽植(Jain et al., 2017)。除用材与绿化用途外,北美香柏和北美乔柏其精油可用于生产化妆品、肥皂、除臭剂等工业产品(Kamden et al., 1993; Duke, 1988),还可用于医疗(如皮肤抑菌外用药、鼻减充血剂和止咳剂等)(FAO, 1995)、食品(如保鲜剂和防腐剂等)、农林业(如天然驱虫剂、除草剂、木材防腐剂) (Guleria et al., 2008; Tsiri et al., 2009; James et al., 2011)等领域。此外,其挥发油作为一种绿色健康抗菌剂在建筑物防腐上具有广泛前景(James et al., 2011)。
丁洪美等(1986)发现北美香柏挥发油以苧酮(54.81%)、葑酮(10.33%)、7-癸烯-2-酮(6.81%)含量最高,北美乔柏则以苧酮(42.18%)、桧烯(11.99%)含量较高;Tsiri等(2011)发现2种北美乔柏(T. plicata, T. plicata ‘gracialis’)和2种北美香柏(T. occidentalis ‘globosa’, T. occidentalis ‘aurea’)挥发油主要成分均为单萜类的α-崖柏酮、β-崖柏酮、葑酮和桧萜以及二萜类的苯胺和芮木泪柏烯。不同的研究发现北美香柏挥发油主要成分存在差异,但大多数含有崖柏酮和α-蒎烯(Harnischfeger et al., 1983; Magda et al., 2004; Ismile et al., 2014; Khubeiz et al., 2016; Lis et al., 2016)。此外,北美香柏和北美乔柏挥发性物质具有抗病毒、抗过敏、抗癫痫、抗炎、抗菌、抗氧化和抗真菌等生物活性(Akers et al., 1980; Ayensu et al., 1985; Tsiri et al., 2011; Jasuja et al., 2013; Tanveer et al., 2015; Elsharkawy et al., 2017; Han et al., 2017)。综上,学者对北美香柏或北美乔柏的研究多侧重于挥发油成分的生物活性,而对于不同种源北美乔柏和北美香柏挥发油成分的对比研究尚未见报道。本研究通过固相微萃取技术提取北美乔柏和北美香柏不同种源植物叶片中的挥发性成分,利用气相色谱质谱联用(GC-MS)定性分析,比较两树种不同种源间叶片挥发性成分的异同,为崖柏属植物化学成分的开发与利用提供依据。
1 材料与方法 1.1 试验材料收集不同种源北美乔柏和北美香柏种子,2015年4月在中国林业科学研究院育苗,种子种源地信息见表 1。育苗基地(40°0′10″N,116°14′38″E,海拔61 m)温室室温约24 ℃,白天温度不高于30 ℃,夜间低温不低于15 ℃,透光度为50%~60%,湿度为55%~65%。2017年8月底,选择大小相近、长势一致的2年生幼苗,以幼苗顶端当年生新叶为材料,测量并鉴定挥发性气体成分。每个树种每个种源选择3株,共30株。
|
|
气相色谱-质谱联用仪(7890A, 美国, 安捷仑公司), 固相微萃取手动进样专用手柄及Carboxen/PAMS中性黄色萃取针头(规格75 μm, 美国, Supec公司)以及顶空进样瓶(规格15 mL, 中国, 安普公司)。
1.3 试验方法 1.3.1 样品准备称取0.3~0.4 g新鲜叶片放入15 ml进样瓶中静置1 h,将固相微萃取专用萃取针头在气相色谱进样口于180 ℃条件下老化30 min,去除所有杂峰。老化后将萃取针头通过瓶盖插入进样瓶,并将针头控制在距离瓶盖1 cm的顶空位置。顶空吸附1 h后,取出针头,迅速插入温度为220 ℃的GC-MS进样口,解析1 min后进行GC-MS分析。
1.3.2 GC-MS条件色谱条件:色谱柱为5MS石英毛细管柱,规格为30 m×0.25 mm×0.25 μm。起始温度40 ℃,保持2 min后,以2 ℃ ·min-1的速度升至105 ℃,再以10 ℃ ·min-1升至220 ℃,保持10 min。汽化室温度为230 ℃, 传输线温度为230 ℃,载气为He,载气流量为20 ml ·min-1,不分流模式。
质谱检测条件:EI源,电子能量70 eV,离子源220 ℃,接口温度230 ℃,全扫描模式,扫描质量范围为50~600 amu。
1.3.3 挥发性物质化合物鉴定采用质谱进行定性。利用检索标准普库NIST11分析组分的质谱数据,结合相关质谱资料,对挥发油成分进行鉴定。通过峰面积归一化法进行定量,求算各挥发性物质化学成分的相对含量。
2 结果与分析 2.1 植物叶挥发油成分鉴定通过SPME-GC-MS提取并鉴定北美乔柏和北美香柏幼苗叶挥发油成分,共分析出156个色谱峰;成分主要为萜烯类化合物,其中单萜类化合物37种,倍半萜类化合物35种,其他萜类化合物6种。北美乔柏幼苗鉴定出74种化合物,种源Mon、Col、Pur、Er和Py分别鉴定出39、36、38、37和45种化合物(表 2);北美香柏幼苗鉴定出95种化合物,种源OH、WI、Kin、Lim和TB分别鉴定出45、47、55、50和40化合物(表 2)。
|
|
北美乔柏和北美香柏挥发油成分均以单萜类化合物为主,且北美乔柏的含量(80.258%)高于北美香柏(69.445%)。两树种的10个种源共有成分仅6种(表 2),其中α-崖柏酮、γ-松油烯和(8β, 13β)-13-methyl-17-Norkaur-15-ene在2树种挥发油中的含量差别较大,均以北美乔柏高于北美香柏;而α, α-4-三甲基-3-环己烯-1-甲醇乙酸酯、石竹烯在北美香柏挥发油中含量明显高于北美乔柏,棕榈酸甲酯在两树种中含量相近。
由表 2可知,两树种的挥发油成分组成存在差异。不同种源北美乔柏幼苗叶挥发油成分共鉴定出74种,低于北美香柏(95种)。其中,2种化合物在北美乔柏叶挥发油中鉴定出,而在北美香柏中没有;同时,35种化合物北美香柏叶挥发油中鉴定出,而在北美乔柏中没有。两树种叶挥发油主要成分差异显著。北美乔柏幼苗叶挥发油主要成分(含量>5%)有α-崖柏酮、β-水芹烯、β-蒎烯、异松油烯、左旋-β-蒎烯、γ-松油烯、棕榈酸甲酯和α-侧柏烯(表 2),而北美香柏幼苗叶挥发油中以α-崖柏酮、侧柏酮、1, 3, 3-三甲基-二环[2.2.1]庚-2-酮、β-水芹烯、(8β, 13β)-13-methyl-17-Norkaur-15-ene、松时烯、乙酸龙脑脂、棕榈酸甲酯和[4aS-(4aα, 4bβ, 7α, 8aα)]-7-ethenyl-1, 2, 3, 4, 4a, 4b, 5, 6, 7, 8, 8a, 9-dodecahydro-1, 1, 4b, 7-tetramethyl-Phenanthrene为主要成分,共同含有α-崖柏酮和β-水芹烯。
2.3 北美乔柏不同种源叶挥发油成分比较 2.3.1 不同种源北美乔柏幼苗叶挥发性成分类别及含量比较由图 1可知,北美乔柏5个种源幼苗叶挥发油成分均以单萜类化合物为主,平均相对含量为80.258%,以种源Pur最高(83.393%),种源Col最低(76.713%);倍半萜类化合物相对含量相对较低(1.098%~6.091%),且种源间化合物数量差异较大,种源Py倍半萜类化合物13种,而种源Pur仅3种;其他萜类化合物的平均相对含量和数量均最低,分别为1.183%、1.4;种源间烯烃酯类化合物相对含量相近(13.131%~16.362%),且化合物数量最多(14~18个)。
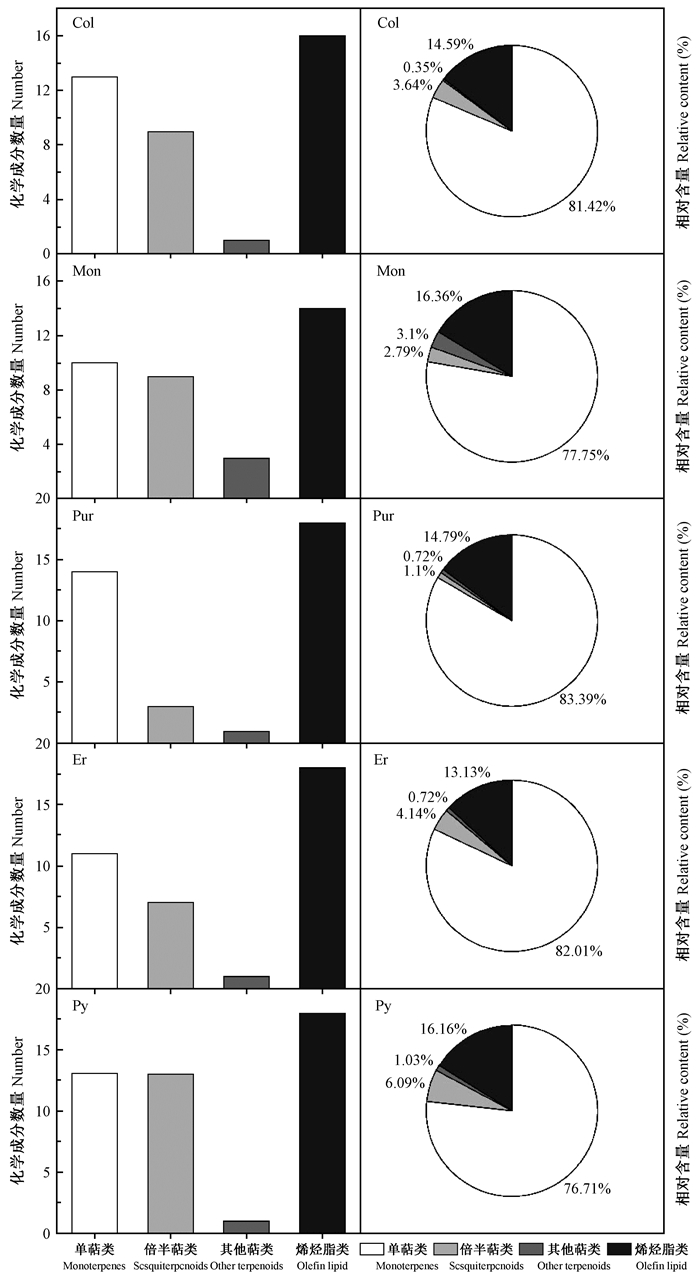
|
图 1 不同种源北美乔柏挥发油成分化合物的类别及相对含量 Fig. 1 Types and relative content of the volatile compounds in T. plicata from 5 provenances Col:加拿大不列颠哥伦比亚省British Columbia, CAN; Mon:美国蒙大拿州Montana, USA; Pur:加拿大普尔顿山Purden Mountain, CAN; Er:加拿大伊利山Erie Mountain, CAN; Py:加拿大皮拉米德山Pyramid Mountain, CAN. |
种源Col、Mon、Pur、Er和Py幼苗叶挥发油中共有化合物9种,分别占总含量的65.465%、70.025%、62.606%、68.563%和71.272%。5个种源共有成分中含量较高的化合物整体一致。由图 2可知,α-崖柏酮、β-水芹烯、异松油烯(在种源Pur中较低)、γ-松油烯和棕榈酸甲酯在5个种源中含量较高,是各个种源的主要成分,也是北美乔柏挥发油的主要组成;而α, α-4-三甲基-3-环己烯-1-甲醇乙酸酯、三甲基十四烷、(trans-Oxiraneundecanoic acid, 3-pentyl-, methyl ester)和石竹烯含量较低。5个种源的共有成分也存在差异,如种源Mon、Pur、Er和Py以α-崖柏酮含量最高(35.817%~45.435%),β-水芹烯含量次之(7.267%~16.629%);而种源Col以β-水芹烯含量最高(29.944%),异松油烯次之(17.391%),α-崖柏酮仅含5.969%。

|
图 2 北美乔柏不同种源叶中共有挥发油成分 Fig. 2 The common volatiles of T. plicata's leaves in 5 provenances |
北美香柏5个种源幼苗的挥发油成分中单萜类化合物相对含量最高,种源WI最大(72.902%),种源Kin最小(64.919%);烯烃脂类化合物数量最多,平均相对含量为15.386%;倍半萜类化合物平均10个占5.814%,相对含量最低;其他萜类平均相对含量为9.355%,但数量最少(图 3)。
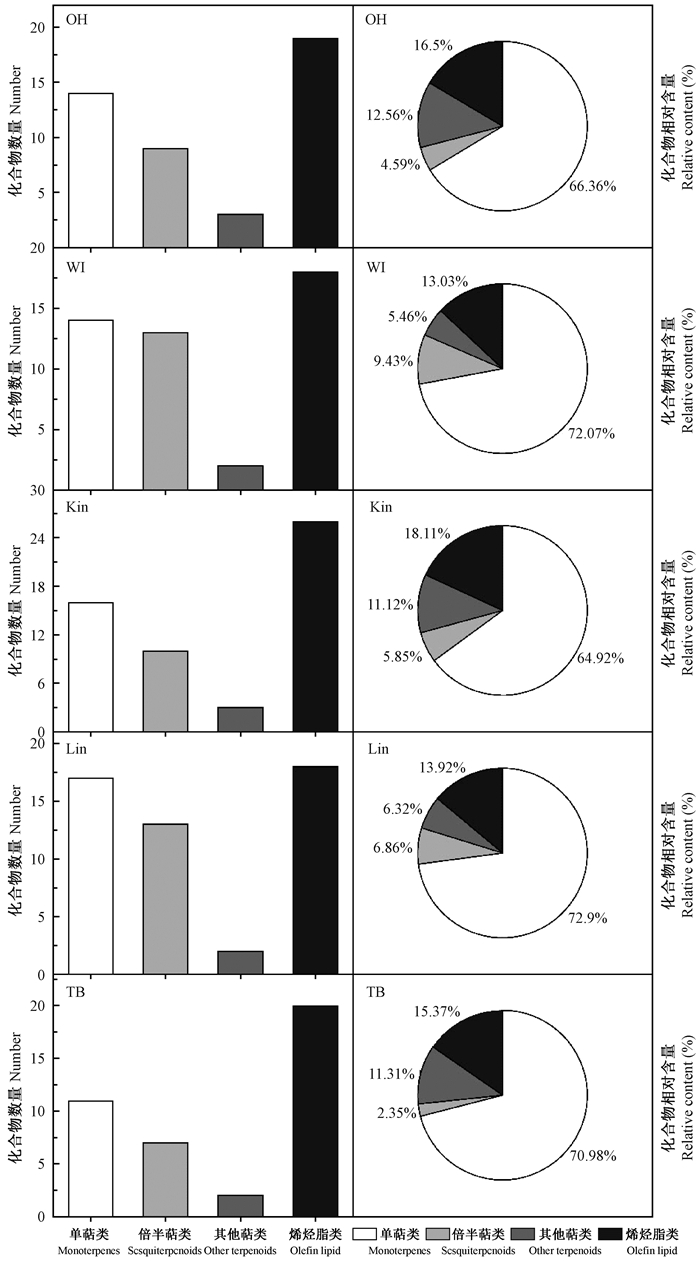
|
图 3 不同种源北美香柏挥发油成分的类别及相对含量 Fig. 3 Types and relative content of the volatile compoundsin T. occidentalis from 5 provenances OH:美国俄亥俄州Ohio, USA; WI:美国威斯康星州Wisconsin, USA;Kin:加拿大金斯顿Kingston, CAN; Lim:加拿大里姆斯顿Limestone, CAN; TB:加拿大桑德贝Thunder Bay, CAN. |
种源OH、WI、Kin、Lim和TB幼苗叶挥发油中共有成分12种,分别占总含量的36.745%、21.030%、72.956%、68.111%和68.711%。从图 4可以看出,同一成分的相对含量在不同种源间差异显著,如α-崖柏酮含量在种源Kin和Lim中均大于40%,种源TB为23.158%,而种源OH仅含有5.027%,种源WI中无此化合物;1, 3, 3-三甲基-二环[2.2.1]庚-2-酮在不同种源中含量较高,种源TB中占21.382%,而其他4种源仅含6.609%~7.433%。5个种源成分含量较高的化合物也存在差异,如除α-崖柏酮和, 3, 3-三甲基-二环[2.2.1]庚-2-酮外,种源OH和TB的(8β, 13β)-13-methyl-17-Norkaur-15-ene含量较高,而种源Kin含[4aS-(4aα, 4bβ, 7α, 8aα)]-7-ethenyl-1, 2, 3, 4, 4a, 4b, 5, 6, 7, 8, 8a, 9-dodecahydro-1, 1, 4b, 7-tetramethyl-Phenanthrene较多。
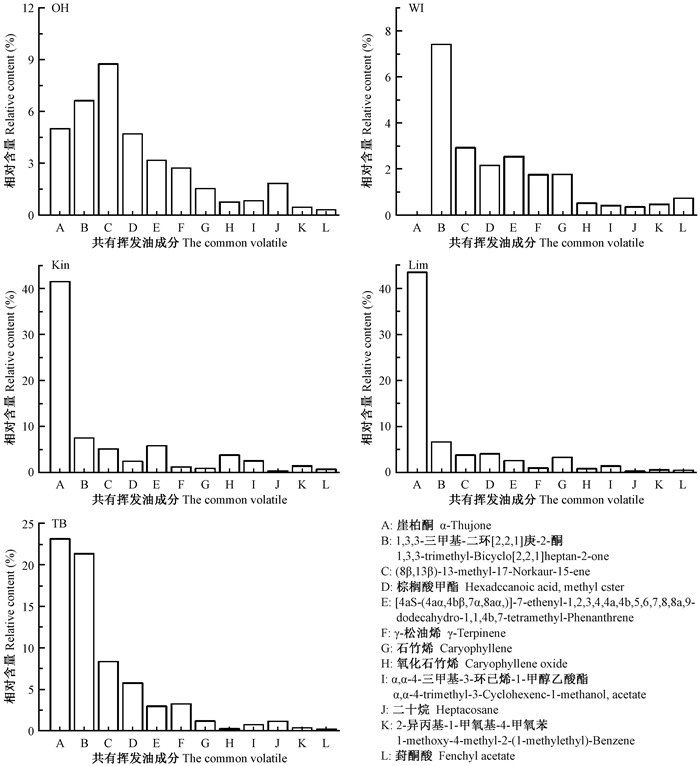
|
图 4 不同种源北美香柏叶中共有挥发油成分 Fig. 4 The common volatile compoundsfrom T. occidentalis's leaves within5 provenances |
本研究通过SPME-GC-MS分析发现不同种源北美乔柏和北美香柏幼苗叶片的挥发性成分组成差异显著,这与大多数研究结果一致(丁洪美等, 1989; Buben et al., 2009; Tsiri et al., 2009)。同一物种不同种源间挥发性成分也存在显著区别,这可能是因为植物幼苗挥发油的化学成分组成主要受长期自然区域适应形成的遗传特征影响。本研究仅在生长季对2年生幼苗新叶挥发油成分进行鉴定,确定结论需要结合更深一步的观测进行验证。有学者研究也发现,生长在不同地点的植物其挥发油化学成分也存在显著差异(何静等, 1989; Hafez et al., 2004; Elsharkawy et al., 2017)。何静等(1989)发现北京植物园的成年北美香柏叶片挥发油化学成分含19种,而庐山的北美香柏达26种,这可能是因为植物挥发性成分具有不稳定性,且植物本身是一个动态环境,其质量及含量与生长环境土壤、气候条件等有关。本研究利用不同种源2年生幼苗进行挥发性成分分析,在5个北美香柏种源幼苗中鉴定出40~55种化学成分,种类多于之前研究(丁洪美等,1989;何静等,1989),这可能是因为挥发性成分与不同季节、植物采摘时间、植物生理年龄、生理状态、空间分布相关(杜永均等, 1994; 刘喜梅等, 2014);此外,分析仪器精确性以及分析手段的提高也有利于对微量成分的鉴定,进一步提高了本研究对挥发性成分鉴定分析结果的准确性。
本研究发现北美乔柏和北美香柏叶挥发油主要成分差异明显。北美香柏主要成分以α-崖柏酮(α-Thujone)、β-崖柏酮(β-Thujone)、1, 3, 3-三甲基-二环[2.2.1]庚-2-酮、β-水芹烯(β-Phellandrene)较高,北美乔柏则以α-崖柏酮、β-水芹烯、β-蒎烯、异松油烯含量较高。丁洪美等(1989)发现北美香柏的主要成分有苧酮(即α-崖柏酮)、葑酮、7-癸烯-2-酮,而北美乔柏以宁酮和桧烯含量较高。但Tsiri等(2011)发现北美香柏和北美乔柏均以α-崖柏酮、β-崖柏酮、葑酮(Fenchone)、桧萜(Sabinene)、二萜苯胺(The diterpenes beyerene)和芮木泪柏烯(Rimuene)为主要成分。虽然不同学者的研究结果存在差异,但都证明两树种挥发油主要成分中均以α-崖柏酮含量最高(Von Rudloff, 1962; Svajdlenka et al., 2001; Manimegalai et al., 2010; Lis et al., 2016)。崖柏酮在自然状态下一般以α-和β-崖柏酮的同分异构体共同存在(Sondermann et al., 1962; Traud et al., 1983),且崖柏酮有抗癌活性(Kosuge et al., 1985; Naser et al., 2005; Akkol, 2015; Elsharkawy et al., 2017)。此外,两树种的另一主要挥发性成分为β-水芹烯。β-水芹烯既是一种香料和香料的中间体,也是一种具有生物活性的天然杀虫剂,对储粮常见虫害具有明显的杀灭和抑制作用(夏克坚等, 2001),是国外生物杀虫剂中常用的重要活性成分(Traynor et al., 1985)。天然植物中β-水芹烯在天然植物中的含量较少,之前有学者发现β-水芹烯是侧柏叶片挥发油化学成分中的主要成分(杨克玉等, 2016)。因此,北美香柏和北美乔柏挥发性成分具有较高的医药价值和化工农业经济价值。
无论是北美香柏还是北美乔柏,不同地理种源幼苗的叶片挥发油化学成分种类及相对含量都存在较大差异。植物体内物质代谢与物种或者种源的原始环境因子显著相关,而不同植物或者同一植物不同种源在相同环境下体内物质代谢水平存在显著差异(Bannister, 1981; 倪妍妍等, 2017)。环境条件改变可能限制或者促进植物生长,植物通过生理调节适应环境变化,进而改变植物体内次生代谢物质含量及分配(苏文华等, 2005)。目前,对植物体内次生代谢产物的形成和积累的生理机制受环境条件影响的研究结果存在争议(Fawe et al., 1998; Spitaler et al., 2006; Solar et al., 2006),如生长/分化平衡假说(Frischknecht et al., 2001)认为对植物光合作用具有不同程度影响作用的环境因子都会导致次生代谢物质的变化,对植物光合作用促进作用越强,则会更加抑制次生代谢产物的产生与积累(孔垂华等, 2000)。在本研究中不同种源的北美香柏或北美乔柏幼苗生长(地径、株高)存在差异但并不显著(未发表),但是幼苗的生长与挥发性物质化学成分及相对含量间存在的确切关系尚待结合进一步的测定和辅助的控制试验加以讨论。
4 结论不同地理种源北美香柏和北美乔柏幼苗叶片挥发油中共鉴别出156种成分,且以单萜类化合物为主。然而不同种源北美乔柏和北美香柏挥发油化学成分组成及相对含量差异显著,但均含较高的α-崖柏酮,在医药领域具有很大的开发潜力,具有进一步探索、开发的实际意义。
丁洪美, 马骥. 1989. 四种柏树叶精油成分的比较研究与分类. 植物学通报, 6(1): 43-47. (Ding H M, Ma J. 1989. Comparison and classification composition of the essential oils from leaves of 4 Platycladu species. Chinese Bulletin of Botany, 6(1): 43-47. [in Chinese]) |
杜永均, 严福顺. 1994. 植物挥发性次生物质在植食性昆虫、寄主植物和昆虫天敌关系中的作用机理. 昆虫学报, 37(2): 233-250. (Du Y J, Yan F S. 1994. The role of plant volatiles in tritrophic interactions among phytophagous insects, their host plants and natural enemies. Acta Entomologica Sinica, 37(2): 233-250. DOI:10.3321/j.issn:0454-6296.1994.02.007 [in Chinese]) |
何静, 丁红美. 1989. 北美香柏枝叶精油化学成分分析及其利用. 北京林业大学学报, 11(4): 118-125. (He J, Ding H M. 1989. Chemical components of the essential oil in the leaves of Thuja occidentali and its potential values. Journal of Beijing Forestry University, 11(4): 118-125. [in Chinese]) |
孔垂华, 徐涛, 胡飞, 等. 2000. 环境胁迫下植物的化感作用及其诱导机制. 生态学报, 20(5): 849-854. (Kong C H, Xu T, Hu F, et al. 2000. Allelopathy under environmental stress and its induced mechanism. Acta Ecologica Sinica, 20(5): 849-854. DOI:10.3321/j.issn:1000-0933.2000.05.022 [in Chinese]) |
刘喜梅, 李海朝. 2013. 2个地区祁连圆柏叶挥发油化学成分分析. 林业科学, 49(10): 149-154. (Liu X M, Li H C. 2013. Analysis of the chemical constituents in the volatile oils from leaves of Sabina przewalskii in two different regions. Scientia Silvae Sinicae, 49(10): 149-154. [in Chinese]) |
刘喜梅, 李海朝. 2014. 不同海拔高度祁连圆柏叶中挥发性成分的比较. 北京林业大学学报, 36(1): 126-131. (Liu X M, Li H C. 2014. Comparison of volatile components of Sabina przewalski in different altitudes. Journal of Beijing Forestry University, 36(1): 126-131. [in Chinese]) |
倪妍妍, 胡军, 刘建锋, 等. 2017. 不同地理种源栓皮栎幼苗生长与物质分配的变化趋势. 西北植物学报, 37(3): 534-540. (Ni Y Y, Hu J, Liu J F, et al. 2017. The trends in growth and substance allocation in Quercus variabili seedlings from five provenances. Acta Botanica Boreali-Occidentalia Sinica, 37(3): 534-540. [in Chinese]) |
苏文华, 张光飞, 李秀华, 等. 2005. 植物药材次生代谢产物的积累与环境的关系. 中草药, 36(9): 1415-1418. (Su W H, Zhang G F, Li X H, et al. 2005. Relationship between accumulation of secondary metabolismin medicinal plant and environmental condition. Chinese Traditional and Herbal Drugs, 36(9): 1415-1418. DOI:10.3321/j.issn:0253-2670.2005.09.052 [in Chinese]) |
夏克坚, 任宇红, 聂丽娟, 等. 2001. β-水芹烯的合成与应用. 南昌大学学报:理科版, 25(4): 380-382. (Xia K J, Ren Y H, Nie L J., et al. 2001. The synthesis and application of β-phellandrene. Journal of Nanchang University:Natural Science, 25(4): 380-382. [in Chinese]) |
杨克玉, 李燕敏, 黄佳, 等. 2016. 固相微萃取结合气-质联用分析侧柏叶中的挥发性成分. 化学研究与应用, 28(4): 462-471. (Yang K Y, Li H M, Huang J., et al. 2016. Extraction and analysis of volatile compounds in leaf of Platycladus orientali (L.) Franco by SPME-GC-MS. Chemical Research and Application, 28(4): 462-471. DOI:10.3969/j.issn.1004-1656.2016.04.007 [in Chinese]) |
Akers H A, Abrego V A, Garland E. 1980. Thujaplicins from Thuja plicata as iron transport agents for Salmonella typhimurium. Journal of Bacteriology, 141(1): 164-168. |
Bannister P. 1981. Carbohydrate concentration of health plants of different geographical origin. Journal of Ecology, 69(3): 769-780. DOI:10.2307/2259635 |
Buben I, Karmazin M, Tiojánková J, et al. 1990. Seasonal variability in the contents and composition of essential oil in various Thuja species occuring in Czechoslovakia. European Journal of Pharmacology, 183(2): 573-574. |
Duke J A. 1988. CRC Handbook of Medicinal Herbs. Handbook of Medicinal Herbs, 5(1): 74. |
Duke J A, Ayensu E S. 1985. Medicinal plants of China. Algonac: Reference Publications.
|
Elsharkawy E R, Aljohar H, Abd El Raheim M. 2017. Comparative study of antioxidant and anticancer activity of Thuja orientalis growing in Egypt and Saudi Arabia. British Journal of Pharmaceutical Research, 15(5): 1-9. |
FAO (Food and Agriculture Organization of the United Nations). 1995. Non-wood forest products from Conifers. Chapter 7-Essential Oils; FAO:Rome, Italy, 12: 86. |
Fawe A, Abouzaid M, Menzies J G, et al. 1998. Silicon-mediated accumulation of flavonoid phytoalexins in cucumber. Phytopathology, 88(5): 396-401. DOI:10.1094/PHYTO.1998.88.5.396 |
Frischknecht P M, Schuhmacher K, Müller-Scharer H, et al. 2001. Phenotypic plasticity of Senecio vulgari from contrasting habitat types:growth and pyrrolizidine alkaloid formation. Journal of Chemical Ecology, 27(2): 343-358. DOI:10.1023/A:1005684523068 |
Guleria S, Kumar A, Tiku A K. 2008. Chemical composition and fungitoxic activity of essential oil of Thuja orientalis L. grown in the north-western Himalaya. Zeitschrift für Naturforschung C, 63(3/4): 211-214. |
Hafez S S, Abdel-Salam H A. 2004. Chemical composition and antimicrobial activity of the volatile constituents of Thuja occidentali L. growing in Egypt. Alexandria Journal of Pharmaceutical Sciences, 18(1): 41-46. |
Han X, Parker T L. 2017. Arborvitae (Thuja plicat) essential oil significantly inhibited critical inflammation- and tissue remodeling-related proteins and genes in human dermal fibroblasts. Biochimie Open, 4: 56-60. DOI:10.1016/j.biopen.2017.02.003 |
Harnischfeger G, Stolze H. 1983. Bewährte pflanzendrogen in wissenschaft und medizin. Notamed Verlag, Bad Homburg/Melsungen, 250. |
Ismail A, Mohsen H, Bassem J, et al. 2015. Chemical composition of Thuja orientali L. essential oils and study of their allelopathic potential on germination and seedling growth of weeds. Archives of Phytopathology and Plant Protection, 48(1): 18-27. DOI:10.1080/03235408.2014.882107 |
Jain N, Sharma M. 2017. Ethanobotany, phytochemical and pharmacological aspects of Thuja orientalis: a review. International Journal of Pure Applied Bioscience, 5(3): 73-83. |
James H, Michael K, Selvarani V. 2011. The antimicrobial properties of cedar leaf (Thuja plicata) oil; asafe and efficient decontamination agent for buildings. International Journal of Environmental Research & Public Health, 8(12): 4477-4487. |
Jasuja N D, Sharma S K, Saxena R, et al. 2013. Antibacterial, antioxidant and phytochemical investigation of Thuja orientali leaves. Journal of Medicinal Plant Research, 725(725): 1886-1893. |
Kamdem P D, Hanover J W. 1993. Inter-tree variation of essential oil composition of Thuja occidentali L. Journal of Essential Oil Research, 5(3): 279-282. DOI:10.1080/10412905.1993.9698220 |
Khubeiz M J, Mansour G, Zahraa B. 2016. Antibacterial and phytochemical investigation of Thuja orientalis (L.) leaves essential oil from Syria. International Journal of Current Pharmaceutical Review and Research, 7(5): 243-247. |
Kosuge T, Yokota M, Sugiyama K, et al. 1985. Studies on anticancer principles in Chinese medicines. Ⅱ. Cytotoxic principles in Biota orientali (L.) ENDL. and Kaempferia galang L. Chemical and Pharmaceutical Bulletin, 33(12): 5565-5567. DOI:10.1248/cpb.33.5565 |
Lis A, Liszkiewicz R, Krajewska A. 2016. Comparison of chemical composition of the essential oils from different parts of Thuja occidentalis L. 'Brabant' and T. occidentalis L. 'Smaragd'. Herba Polonica, 62(3): 20-27. DOI:10.1515/hepo-2016-0014 |
Magda T, Nevein I, Abdel-Hady M, et al. 2004. 13-GC/MS analysis and biochemical studies of the essential oil of Thuja orientalis L. growing in Egypt. Bulletin of Faculty of Pharmacy, Cairo University, 42: 151-156. |
Manimegalai S, Adhithya R, Vellaikumar S, Paramasivam, et al. 2010. Separation and characterization of antibacterial compounds from Aegle marmelos Correa and Thuja orientalis L. against silkworm pathogens. International Journal of Genetic Engineering and Biotechnology, 1(3): 177-186. |
Moussa Kéïta S, Vincent C, Schmidt J P., et al. 2001. Insecticidal effects of Thuja occidentalis (Cupressaceae) essential oil on Callosobruchus maculatus [Coleoptera:Bruchidae]. Canadian Journal of Plant Science, 81: 173-177. DOI:10.4141/P00-059 |
Naser B, Bodinet C, Tegtmeier M, et al. 2005. Thuja occidentalis (Arbor vitae):a review of its pharmaceutical, pharmacological and clinical properties. eCAM, 2: 69-78. |
Peng D, Wang X Q. 2008. Reticulate evolution in Thuj inferred from multiple gene sequences:implications for the study of biogeographical disjunction between eastern Asia and North America. Molecular Phylogenetics and Evolution, 47: 1190-1202. DOI:10.1016/j.ympev.2008.02.001 |
Solar A, Colari Dč M, Usenik V, et al. 2006. Seasonal variations of selected flavonoids, phenolic acids and quinones in annual shoots of common walnut (Juglans regia L.). Plant Science, 170: 453-461. DOI:10.1016/j.plantsci.2005.09.012 |
Sondermann W, Schweers W. 1962. Vber die Biogenese von Thujon in Thuja occidentalis. Tetrahedron Lett, 7: 259-260. |
Spitaler R, Schlorhaufer P D, Ellmerer E P, et al. 2006. Altitudinal variation of secondary metabolite profiles in flowering heads of Arnica montan cv. ARBO. Phytochemistry, 67(4): 409-417. DOI:10.1016/j.phytochem.2005.11.018 |
Svajdlenka E, Má;rtonfi P, Tomasko I, et al. 1999. Essential oil composition of Thuja occidentali L. samples from Slovakia. Journal of Essential Oil Research, 11(5): 532-536. DOI:10.1080/10412905.1999.9701208 |
Tanveer M Z, Javeed A, Ashraf M, et al. 2015. Evaluation of anti-inflammatory and analgesic potential of aqueous methanolic extract of Thuja orientali in albino rats. Journal of Animal & Plant Sciences, 25(4): 1183-1186. |
Traud J, Musche H. 1983. Bestimmung und identifizierung von α- und β-thujon in pflanzen mittels Capillar-Gas-Chromatographie-Massenspektronomie (GC/MS). Analytical and Bioanalytical Chemistry, 315(3): 221-226. |
Traynor S G, Kane B J, Betkouski M F, et al. 1979. Facile syntheses of optically active terpene sulfonic acids. Application to the resolution of (±)-phenylglycine. Journal of Organic Chemistry, 44(9): 1557-1559. |
Tsiri D, Graikou K, Pobłocka-Olech L, et al. 2009. Chemosystematic value of the essential oil composition of Thuj species cultivated in Poland-antimicrobial activity. Molecules, 14(11): 4707-4715. DOI:10.3390/molecules14114707 |
Von Rudloff E. 1962. Gas-liquid chromatography of terpenes Ⅵ. The volatile oil of Thuja plicata Donn. Phytochemistry, 1: 195-202. DOI:10.1016/S0031-9422(00)82822-8 |
 2019, Vol. 55
2019, Vol. 55

