文章信息
- 江成, 周厚君, 赵岩秋, 何辉, 楚立威, 宋学勤, 卢孟柱.
- Jiang Cheng, Zhou Houjun, Zhao Yanqiu, He Hui, Chu Liwei, Song Xueqin, Lu Mengzhu.
- 干旱和高盐胁迫下钙离子依赖核酸酶基因CDD对银腺杨84K生长发育的影响
- Effects of CDD Gene on the Growth and Development of Populus alba×P. glandulosa '84K' in Response to Drought and Salt Stresses
- 林业科学, 2019, 55(2): 33-40.
- Scientia Silvae Sinicae, 2019, 55(2): 33-40.
- DOI: 10.11707/j.1001-7488.20190204
-
文章历史
- 收稿日期:2018-03-05
- 修回日期:2018-03-22
-
作者相关文章
由于不可移动,植物长期处于来自环境的各种不间断的非生物胁迫,比如干旱、盐碱、极端温度和营养元素匮乏等。这些环境因素对于多年生木本植物来说尤为突出,在发育的各个阶段常常多种胁迫同时存在限制了其生长、发育,影响物种的分布范围。植物经过长期的进化拥有复杂的机制来适应各种环境,比如关闭气孔限制营养生长来适应缺水环境(Flexas et al., 2002),诱导胁迫响应基因的表达适应不利环境条件(Matsui et al., 2008)。植物在受胁迫时诱导相关基因进行转录水平上的调控,改变胁迫相关特异基因时空表达模式是植物应对胁迫环境的一种重要方式(Rushton et al., 1998)。植物也可以通过程序化死亡(programmed cell death, PCD),改变生长发育状态应对严重胁迫环境(Gan et al., 1997; Swidzinski et al., 2002)。PCD是动植物中普遍存在的一种程序性细胞死亡过程,具有严格的调控机制,对细胞体内平衡的维持、组织特化作用、清除受损和感染细胞以及应激反应具有重要作用(Dellaporta et al., 1993; Fukuda, 2000; Gan et al., 1997; Gunawardena, 2008; Gunawardena et al., 2004)。木本植物依靠木质部来输导水分,木质部分化过程中管状分子的形成是一类典型的PCD过程(Arnaud, 2010; Fukuda, 1996),因此该过程对于木本植物抗逆响应显得尤为重要。
PCD过程离不开脱氧核糖核酸酶,后者导致DNA的降解(Chen et al., 2012)。核酸酶属于在功能和结构上非常多样性的酶类,在真核生物中它们涉及DNA修复、重组和基因组降解。根据所需二价离子不同可分为2类:Zn2+ 依赖核酸内切酶(Ito et al., 2002; Pérezamador et al., 2000)和Ca2+ 依赖核酸内切酶(Mittler et al., 1995)。其中Ca2+ 依赖核酸内切酶因需要Ca2+并且最佳pH为中性,当有Zn2+ 时将抑制核酸酶活性。在甘露糖诱导玉米(Zea mays)悬浮细胞PCD过程中发现1个大小为35 kDa内切核酸酶与DNA ladder有关,这一内切核酸酶定位于细胞质中并属Ca2+依赖型(Stein et al., 1999)。在利用小麦(Triticum aestivum)种子诱导PCD过程中发现1个35 kDa定位细胞质中核酸内切酶和1个50 kDa定位细胞核中核酸内切酶(Dominguez et al., 2006),这2个酶都属于Ca2+依赖型核酸酶家族。在木本植物杜仲(Eucommia ulmoides)的未成熟木质部细胞中发现有2个Ca2+依赖型核酸酶EuCaN1和EuCaN2,它们都具有降解单链或双链DNA的功能,并且蛋白定位在细胞核中(Chen et al., 2012)。在拟南芥(Arabidopsis thaliana)中存在2个Ca2+依赖型核酸酶AtCaN1和AtCaN2,2个蛋白体外酶活性试验都具有降解单链或双链DNA的活性,并且AtCaN2能够与AtCYSb互作降低核酸降解活性(Guo et al., 2013; Isono et al., 2000; Le Ds' niewicz et al., 2012)。目前所报道的大部分PCD相关的Ca2+依赖型核酸酶都与植物发育有关,包括胚乳退化、管状分子分化、叶片衰老等(Bariola et al., 1997)。然而,在非生物胁迫条件下与植物PCD相关的核酸内切酶的功能研究鲜有报道。
在胁迫条件下,植物会诱发一系列的非生物胁迫信号传导、胁迫相关基因的表达以及代谢的变化,使植物对所处的逆境产生一定的耐受能力(Vinocur et al., 2005),如植物中的水通道蛋白、生物合成限速酶、脱毒酶以及转运蛋白。水通道蛋白作为一类跨膜蛋白,主要作用为水分跨膜运输。目前,已有大量水通道蛋白被发现与水分运输相关(Li et al., 2014; Maurel et al., 2008)。水通道蛋白被认为是调节水分平衡的重要因子,尤其是在正常或干旱、盐、寒冷等胁迫条件下细胞的伸长和扩张发育过程中。环境刺激导致的渗透胁迫也能够调节水通道蛋白的表达。目前研究表明,水通道蛋白主要存在于高效运输水分的组织或器官中,例如植物的根(Gomes et al., 2009; Javot et al., 2002; Secchi et al., 2009)。因此植物能够通过调控根细胞质膜上的水通道蛋白的表达来调整多样化环境条件下水分的吸收。但地上部分是如何通过根来感知并且根中的水通道蛋白是如何被调控的尚未清楚。
杨树(Populus)作为多年生木本植物,其生长发育受到盐碱和干旱的严重制约,研究其逆境胁迫机制有重要意义。本研究以CDD 转基因银腺杨84K(P. alba × P. glandulosa ‘84K’)为对象,观察其在干旱、高盐胁迫条件下生长发育的变化,进一步利用组织化学方法分析CDD 在胁迫条件下对植株维管组织变化的影响,通过qRT-PCR检测CDD 转基因植株中水通道蛋白PIP 基因的表达情况。通过以上研究来探讨CDD在杨树胁迫反应中的作用。
1 材料与方法 1.1 植物材料银腺杨84K为中国林业科学研究院林木遗传育种国家重点实验室保存及繁殖。胁迫处理所用PtoCDD过表达和PagCDD 敲除突变体银腺杨84K为实验室前期研究所获得的材料,PtoCDD 与PagCDD为同源基因,序列比对发现具有完全一致的氨基酸序列。经定量PCR检测PtoCDD过表达、PagCDD缺失突变体84K杨各选取2个株系进行研究(过表达株系:CDD-OE-1,CDD-OE-2;缺失突变体:CDD-KO-1,CDD-KO-2)。将对照84K、CDD过表达、CDD缺失突变体组培苗植株统一截取相同大小扦插在生根培养基(1/2MS基础培养基+ 0.05 mg·L-1IBA+0.02 mg·L-1NAA,pH5.8~6.0)上进行培养。
1.2 干旱及盐胁迫处理组培苗培养基为生根培养基(1/2MS基础培养基+0.05 mg·L-1IBA+0.02 mg·L-1NAA,pH5.8~6.0),培养条件为16 h光照/8 h黑暗,23~25 ℃,光照强度50 μmol·m-2s-1。干旱、高盐胁迫处理分别为生根培养基里加入200 mmol·L-1的甘露醇和100 mmol·L-1的氯化钠,培养3周后进行拍照观察、表型统计及取材。
1.3 表型观察转基因及对照银腺杨84K经处理培养后进行表型观察,统计其株高、不定根数目,试验均重复3次,每次统计个体数为9株。取离培养基最近的节间处的茎段用5%(W/V)琼脂糖包埋,经修块至合适大小与角度利用振荡切片机Leica VT1200S(Leica公司)切成厚度为50 μm的切片,切片保存在磷酸缓冲盐溶液(phosphate buffer solution, PBS)中。拍照前用0.002%(W/V)的甲苯胺蓝O(Toluidine blue O, TBO)染色30 s并用PBS清洗多余的染色液,拍照观察使用蔡司Zeiss Axio Imager A1(Zeiss公司)显微镜。对切片木质部纤维细胞层数进行统计,切片观察做了5个生物学重复,每个样品内做了3个重复。所有统计数据均使用t检验法检验差异显著性水平。
1.4 RNA提取和qRT-PCR分析植株经不同条件处理后在茎段部分取材提取RNA,所有材料RNA提取均使用EASYspin Plus植物RNA快速提取试剂盒(Aidlab公司),每组试验做4个生物学重复。反转录使用PrimeScriptTM RT reagent Kit(Perfect Real Time)试剂盒(TaKaRa公司)。qRT-PCR使用SYBR Premix Ex Taq TM Ⅱ试剂盒(TaKaRa公司)在Roche 480定量PCR仪(Roche公司)上完成,每个样品4次技术重复,杨树Actin 基因作为内参。所有定量引物均由Oligo6软件设计,引物信息见表 1。
|
|
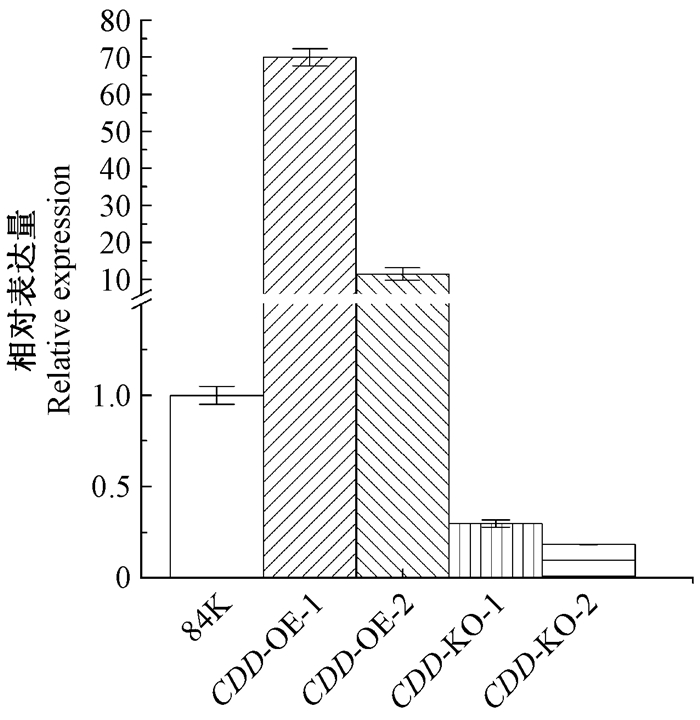
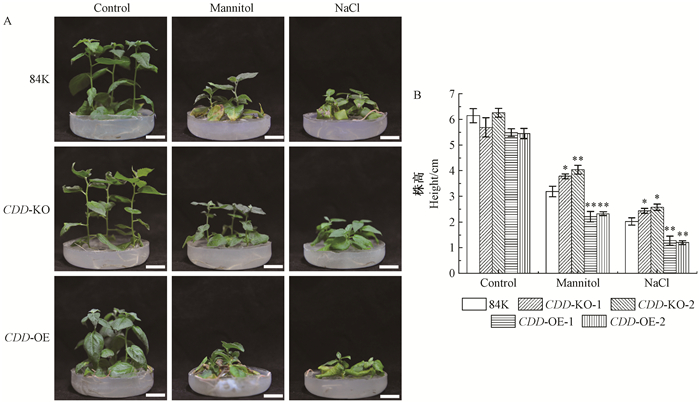
对CDD转基因材料进行定量检测,结果如图 1所示。将对照84K、CDD过表达、CDD缺失突变体组培苗植株统一截取相同大小扦插在生根培养基上,共3种处理(对照、干旱、高盐),培养3周后进行表型观察及统计。表型观察发现,正常生长条件下CDD缺失突变体植株瘦小、叶片微黄,而CDD过表达植株叶片大且绿,呈下垂状(图 2A);对其平均株高统计分析发现无显著差异(对照84K为6.14 cm,CDD-KO 2个株系分别为5.68、6.25 cm,CDD-OE 2个株系分别为5.47、5.45 cm)(图 2B)。干旱条件下对照84K植株生长明显受抑制,叶片明显发黄,呈现出对干旱胁迫的敏感性,平均株高相比正常生长情况下降低48.1%;CDD 缺失突变体植株在干旱胁迫下株高比正常生长情况下降低了33.5%和35.4%,植株形状未出现明显变化;而CDD过表达植株在干旱下表现出更高的敏感性,叶片发黄并卷曲,株高较正常生长降低了59.6%和57.3%。干旱条件下CDD缺失突变体和CDD过表达株高均与对照84K差异达到显著水平(图 2)。CDD转基因植株在高盐胁迫下所表现出的生长规律与干旱胁迫相类似,对照84K、CDD缺失突变体和CDD过表达株高较其正常条件下分别降低了67.1%、57.1%和58.8%(2个株系)、76.7%和78.0%(2个株系)。以上结果表明,CDD调控了杨树对胁迫环境的敏感性。
|
图 1 CDD表达量分析 Fig. 1 Expression of CDD 84K:对照植株84K杨;CDD-KO: CDD 缺失突变体84K杨;CDD-OE:CDD过表达84K杨。 84K: Control 84K poplar; CDD-KO: CDD knockout 84K poplar; CDD-OE: CDD overexpression 84K poplar. |
|
图 2 CDD转基因84K杨干旱和高盐下的植株形态 Fig. 2 Phenotype of CDD transgenic 84K poplar under drought and salt stress 比例尺Scale bars:2 cm。 84K:对照植株84K杨;CDD-KO: CDD缺失突变体84K杨;CDD-OE: CDD过表达84K杨;Control:未处理对照组; Mannitol:200 mmol·L-1甘露醇处理;NaCl:100 mmol·L-1 NaCl处理。t检验:*,P < 0.05; **,P < 0.01。下同。 84K: Control 84K poplar; CDD-KO: CDD knockout 84K poplar; CDD-OE: CDD overexpression 84K poplar; Control: No treatment; Mannitol: 200 mmol·L-1 mannitol treatment; NaCl: 100 mmol·L-1 NaCl treatment. t test: *, P < 0.05; **, P < 0.01. The same below. |
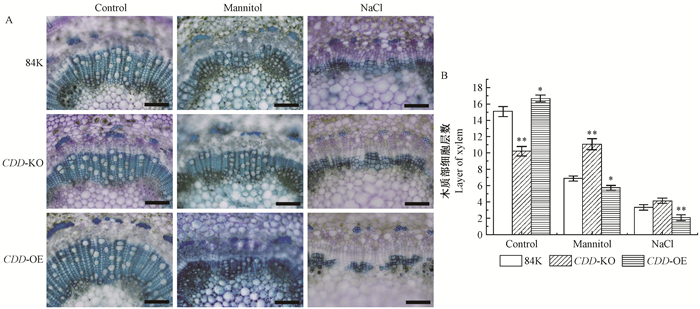
已知胁迫处理能够影响CDD在杨树生长发育过程中的作用,而根据之前的报道CDD主要影响杜仲的木质部分化(Chen et al., 2012)。为了进一步了解在干旱、高盐胁迫下CDD对木质部发育的影响,利用组织化学手段分析了茎的木质部。由观察、统计结果可知,在正常生长条件下CDD缺失突变体和CDD过表达植株中木质部细胞层数与对照84K相比差异均达到显著水平,表明CDD能够促进杨树木质部形成(图 3)。而当受到干旱胁迫时,随着CDD在植株中的表达情况木质部呈现不同的分化程度。在对照84K中干旱胁迫抑制了木质部的分化,使木质部细胞层数减少;当植株中CDD缺失后,干旱胁迫对木质部分化的抑制作用减缓,细胞层数相比对照84K显著增多;而当植株中CDD 过表达时,干旱胁迫下木质部的分化受到明显抑制(图 3)。当受到高盐胁迫时,植株几乎不生长(图 2A),木质部分化也不活跃(图 3A)。但是相比之下,CDD缺失植株木质部分化比对照84K活跃,对照84K又比CDD过表达植株活跃。结合CDD转基因杨树在干旱和高盐下表现出的植株形态以及其木质部分化情况分析表明,CDD对杨树在干旱、高盐逆境胁迫中的响应主要表现对木质部分化的影响,或者说CDD 对木质部分化的作用受干旱、高盐逆境胁迫影响。
|
图 3 干旱和高盐下CDD对84K杨木质部分化的影响 Fig. 3 Effects of CDD on the xylem differentiation of 84K poplar under drought and salt stress 比例尺Scale bars:0.1 mm. |
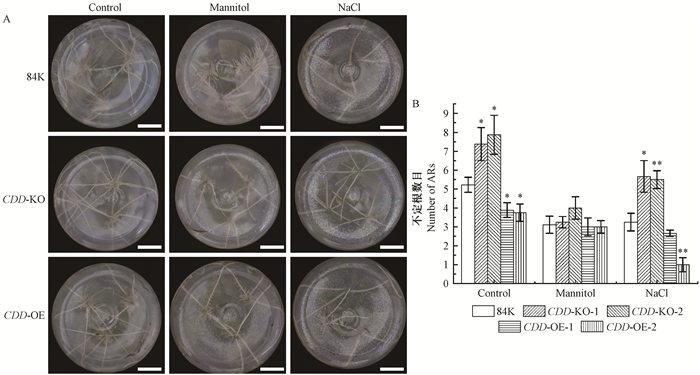
在干旱、高盐胁迫环境中,植物的根系是植物所有器官中最直接接触环境的部分。并且干旱、高盐对植物的胁迫主要表现为水分的吸收和运输失衡。根系吸水是杨树最主要的水分吸收途径。对CDD 转基因植株胁迫条件下不定根生长情况统计发现,在正常生长条件下CDD 缺失突变体植株不定根数目(7.4和7.9)与对照84K杨(5.2)相比呈显著增多,而CDD 过表达植株(3.9和3.8)与对照84K杨相比呈显著减少(图 4)。在高盐胁迫条件下杨树不定根数目与CDD表达也具有显著相关性,CDD 缺失突变体不定根数目为5.7和5.5,而CDD 过表达为2.6和1,与对照84K杨(3.3)呈显著性差异。在干旱胁迫条件下,各材料样品不定根数目差异不显著。以上结果表明,CDD能够调控不定根发育,尤其是在高盐等胁迫条件下,CDD过表达抑制了不定根的发生,影响植株正常生长发育。
|
图 4 干旱和高盐下CDD转基因84K杨不定根分析 Fig. 4 CDD altered the transgenic 84K poplar adventitious root(AR) under drought and salt stress 比例尺Scale bars:2 cm. |
植物在干旱、高盐胁迫环境下最终都会导致植株体细胞渗透势改变,影响植物对水分的吸收。水通道蛋白(PIP)作为质膜上的第1道屏障影响水分从细胞外环境流向细胞内环境。当在盐胁迫下PIP表达显著升高(Boursiac et al., 2005),过表达一些PIP 时能增加植株抗旱、抗盐能力(Obroucheva et al., 2010; Wang et al., 2006)。在对CDD 转基因84K杨中PIP 基因表达量的检测时发现,正常条件下在CDD 缺失突变体植株中PIP 基因表达显著上调的有4个,在CDD过表达植株中有6个(图 5A),过表达植株中多出的2个基因为PIP2;1和PIP2;6。在干旱条件下,CDD 缺失突变体和CDD 过表达植株中PIP 基因表达显著上调分别为1个(PIP2;3)和3个(PIP1;1、PIP1;4、PIP2;8)(图 5B)。在高盐胁迫下CDD 缺失突变体和CDD 过表达植株中PIP基因表达显著上调分别为7个和5个(图 5C),CDD 缺失突变体植株中特异表达上调的为PIP1;1和PIP2;4。而在所有材料中,PIP基因显著下调的个数都不超过2个。
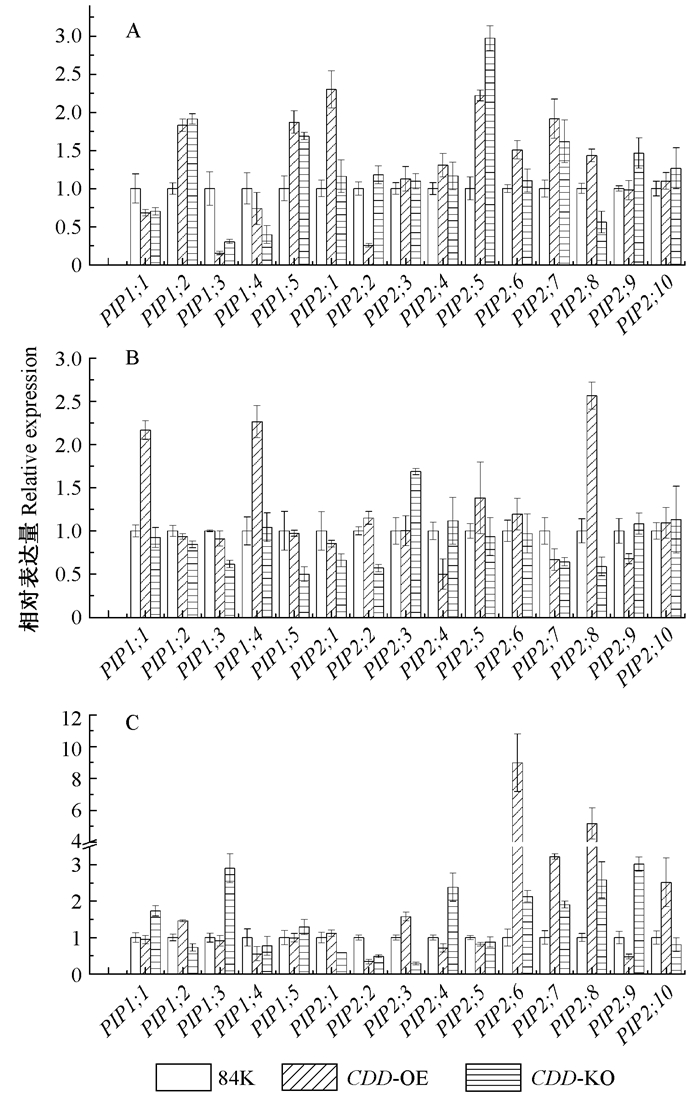
|
图 5 CDD转基因84K杨中PIP表达分析 Fig. 5 Relative expression of PIP in CDD transgenic 84K poplar A:正常条件;B: 200 mmol·L-1甘露醇处理下;C: 100 mmol·L-1NaCl处理。 A: No treatment; B: 200 mmol·L-1 mannitol treatment; C: 100 mmol·L-1 NaCl treatment. |
钙离子依赖型脱氧核糖核酸酶(CDD)在杜仲中特异在未成熟木质部中表达,并参与木质部发育(Chen et al., 2012; Guo et al., 2013)。木质部是重要的输水器官,CDD对木本植物逆境下生长、发育的影响值得研究。
本研究通过对转基因CDD 过表达和CDD 突变体84K杨进行干旱、高盐胁迫处理,进一步分析其对84K杨生长、发育的影响。正常生长条件下CDD过表达植株叶片肥大,木质部分化快于对照84K杨(图 2, 图 3),这表明CDD 作为杜仲核酸酶同源基因在84K杨维管组织发育中发挥了促进作用。而在干旱、高盐胁迫下,CDD 过表达植株表现出更强的敏感性,生长严重受抑制,叶片发黄卷曲,这表明超表达CDD可诱导较多的细胞程序化死亡(PCD)(Bleecker et al., 1997),PCD是植物对逆境胁迫的一种应激反应(Wituszyńska et al., 2013)。在干旱、高盐胁迫下,CDD 过表达植株的木质部发达,但水分供给已经满足不了正常生理需求(图 3A),反而CDD 对干旱、高盐胁迫环境更敏感。
为了进一步了解CDD 对杨树水分吸收和运输的影响,对CDD 过表达植株和CDD 缺失突变体不定根数目进行了统计,并对水通道蛋白PIP基因的表达进行了检测。结果发现过表达CDD 能减少不定根的数目,缺失CDD 使杨树发生更多的不定根。定量分析发现在过表达CDD 时能引起部分PIP基因的上调表达,尤其是在未受到胁迫时,有6个PIP基因上调(图 5A),其中PIP2;1和PIP2;6为过表达杨树中特有的。据报道在拟南芥中过量或抑制PIP2;1的表达将改变根原基水分的进入而减缓了侧根的发生,最终都表现出延缓侧根的形成(Péret et al., 2012);本研究中过表达CDD杨树中PIP2;1和PIP2;6上调表达可能与过表达杨树中不定根数目减小有关。而在缺失 CDD 时同样引起PIP基因的上调表达,受高盐胁迫时最明显,有7个PIP基因上调,其中PIP1;1、PIP2;4为CDD 缺失突变体中特异表达上调的基因。据报道玉米经2 h盐胁迫处理后PIP1;1、PIP1;5、PIP2;4在根上表皮细胞中的表达显著增高,这些基因被优先转录来参与水分运输(Zhu et al., 2005)。由此可知,盐胁迫下在CDD 缺失突变体杨树中特异上调表达的PIP1;1、PIP2;4的主要作用可能是维持不定根数目发生、保持水分运输以至于增强杨树对高盐胁迫环境适应性。值得注意的是,不定根的数目与PIP基因上调的个数相关(图 4,图 5)。
在干旱胁迫条件下,CDD 对杨树不定根的数目影响不大,这说明干旱和盐胁迫下CDD 对杨树的影响差别比较大。由水通道蛋白介导的根液压的改变只是一个基本的水动态调节,尤其是在水环境良好的情况下,当受到干旱胁迫时这种调节作用将微乎其微(Perrone et al., 2012)。这也许表明,CDD 在调控杨树木质部发育过程的同时还主要通过调控不定根的多少来应对环境胁迫,特别是盐胁迫环境。转基因CDD能够改变不同PIP基因成员的表达,改变了植物对环境胁迫的敏感性,这与前期大量研究相同,即过量表达水通道蛋白不但能提高植物抗性,还会增加高表达植物对胁迫的敏感性(Aharon et al., 2003; Katsuhara et al., 2003; Peng et al., 2007; Guo et al., 2006; Wang et al., 2011; Zhang et al., 2013)。
4 结论本研究通过对钙离子依赖型脱氧核糖核酸酶基因CDD 转基因84K杨进行干旱、高盐胁迫处理,分析了CDD 在干旱、高盐胁迫条件下对杨树木质部分化的影响以及CDD 差异表达对杨树响应胁迫环境的影响。结果表明,CDD 的表达变化影响杨树不定根的发生,还能够引起水通道蛋白基因PIP不同成员的差异表达。在受到干旱、高盐胁迫时,CDD 过表达增加了杨树对胁迫的敏感性,CDD 缺失植株表现出更强的适应性。干旱和高盐下由于CDD 的表达变化引起了杨树的生长变化。这些研究结果将为揭示CDD 基因在逆境下对杨树生长发育的调控作用提供参考。
Aharon R, Shahak Y, Wininger S, et al. 2003. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress. Plant Cell, 15(2): 439-447. DOI:10.1105/tpc.009225 |
Arnaud D. 2010. Wood formation in angiosperms. Comptes Rendus Biologies, 333: 325. DOI:10.1016/j.crvi.2010.01.010 |
Bariola P A, Green P J. 1997. Plant ribonucleases. New York: Academic.
|
Bleecker A B, Patterson S E. 1997. Last exit:senescence, abscission, and meristem arrest in Arabidopsis. Plant Cell, 9(7): 1169-1179. DOI:10.1105/tpc.9.7.1169 |
Boursiac Y, Chen S, Luu D T, et al. 2005. Early effects of salinity on water transport in Arabidopsis roots. Molecular and cellular features of aquaporin expression. Plant Physiology, 139(2): 790-805. |
Chen H M, Pang Y, Zeng J, et al. 2012. Ca2+-dependent DNases are involved in secondary xylem development in Eucommia ulmoides. Journal of Integrative Plant Biology, 54(7): 456-470. DOI:10.1111/jipb.2012.54.issue-7 |
Dellaporta S L, Calderon-Urrea A. 1993. Sex determination in flowering plants. Plant Cell, 5(10): 1241-1251. DOI:10.1105/tpc.5.10.1241 |
Dominguez F, Cejudo F. 2006. Identification of a nuclear-localized nuclease from wheat cells undergoing programmed cell death that is able to trigger DNA fragmentation and apoptotic morphology on nuclei from human cells. Biochemical Journal, 397(3): 529-536. DOI:10.1042/BJ20051809 |
Flexas J, Medrano H. 2002. Drought-inhibition of photosynthesis in C3 plants:stomatal and non-stomatal limitations revisited. Ann Bot, 89(2): 183-189. DOI:10.1093/aob/mcf027 |
Fukuda H. 1996. Xylogenesis:initiation, progression, and cell death. Annual Review of Plant Physiology & Plant Molecular Biology, 47(1): 299-325. |
Fukuda H. 2000. Programmed cell death of tracheary elements as a paradigm in plants. Plant Molecular Biology, 44(3): 245-253. DOI:10.1023/A:1026532223173 |
Gan S, Amasino R M. 1997. Making sense of senescence (molecular genetic regulation and manipulation of leaf senescence). Plant Physiology, 113(2): 313-319. |
Gomes D, Agasse A, Thiébaud P, et al. 2009. Aquaporins are multifunctional water and solute transporters highly divergent in living organisms. Biochimica Et Biophysica Acta, 1788(6): 1213-1228. DOI:10.1016/j.bbamem.2009.03.009 |
Gunawardena A H. 2008. Programmed cell death and tissue remodelling in plants. Journal of Experimental Botany, 59(3): 445-451. DOI:10.1093/jxb/erm189 |
Gunawardena A H, Greenwood J S, Dengler N G. 2004. Programmed cell death remodels lace plant leaf shape during development. Plant Cell, 16(1): 60-73. DOI:10.1105/tpc.016188 |
Guo K, Bu Y, Takano T, et al. 2013. Arabidopsis cysteine proteinase inhibitor AtCYSb interacts with a Ca2+-dependent nuclease, AtCaN2. Febs Letters, 587(21): 3417-3421. DOI:10.1016/j.febslet.2013.09.019 |
Guo L, Wang Z Y, Lin H, et al. 2006. Expression and functional analysis of the rice plasma-membrane intrinsic protein gene family. Cell Research, 16(3): 277-286. DOI:10.1038/sj.cr.7310035 |
Isono K, Satoh K, Kobayashi H. 2000. Molecular cloning of a cDNA encoding a novel Ca2+-dependent nuclease of Arabidopsis that is similar to staphylococcal nuclease. Biochimica Et Biophysica Acta, 1491(1): 267-272. |
Ito J, Fukuda H. 2002. ZEN1 is a key enzyme in the degradation of nuclear DNA during programmed cell death of tracheary elements. Plant Cell, 14(12): 3201-3211. DOI:10.1105/tpc.006411 |
Javot H, Maurel C. 2002. The role of aquaporins in root water uptake. Ann Bot, 90(3): 301-313. DOI:10.1093/aob/mcf199 |
Katsuhara M, Koshio K, Shibasaka M, et al. 2003. Over-expression of a barley aquaporin increased the shoot/root ratio and raised salt sensitivity in transgenic rice plants. Plant & Cell Physiology, 44(12): 1378-1383. |
Le Ds' niewicz K, Poręba E, Smolarkiewicz M, et al. 2012. Plant plasma membrane-bound staphylococcal-like DNases as a novel class of eukaryotic nucleases. BMC Plant Biology, 12(1): 195. DOI:10.1186/1471-2229-12-195 |
Li G, Santoni V, Maurel C. 2014. Plant aquaporins:roles in plant physiology. Biochim Biophys Acta, 1840(5): 1574-1582. DOI:10.1016/j.bbagen.2013.11.004 |
Matsui A, Ishida J, Morosawa T, et al. 2008. Arabidopsis transcriptome analysis under drought, cold, high-salinity and ABA treatment conditions using a tiling array. Plant & Cell Physiology, 49(8): 1135-1149. |
Maurel C, Verdoucq L, Luu D T, et al. 2008. Plant aquaporins:membrane channels with multiple integrated functions. Annual Review of Plant Biology, 59(59): 595-624. |
Mittler R, Lam E. 1995. Identification, characterization, and purification of a tobacco endonuclease activity induced upon hypersensitive response cell death. Plant Cell, 7(11): 1951-1962. DOI:10.1105/tpc.7.11.1951 |
Obroucheva N V, Sin'Kevich I A. 2010. Aquaporins and cell growth. Russian Journal of Plant Physiology, 57(2): 153-165. DOI:10.1134/S1021443710020019 |
Peng Y, Lin W, Cai W, et al. 2007. Overexpression of a Panax ginseng tonoplast aquaporin alters salt tolerance, drought tolerance and cold acclimation ability in transgenic Arabidopsis plants. Planta, 226(3): 729-740. DOI:10.1007/s00425-007-0520-4 |
Péret B, Li G, Zhao J, et al. 2012. Auxin regulates aquaporin function to facilitate lateral root emergence. Nature Cell Biology, 14(10): 991-998. DOI:10.1038/ncb2573 |
Pérezamador M A, Abler M L, De E R, et al. 2000. Identification of BFN1, a bifunctional nuclease induced during leaf and stem senescence in Arabidopsis. Plant Physiology, 122(1): 169-180. DOI:10.1104/pp.122.1.169 |
Perrone I, Gambino G, Chitarra W, et al. 2012. The grapevine root-specific aquaporin VvPIP2;4N controls root hydraulic conductance and leaf gas exchange under well-watered conditions but not under water stress. Plant Physiology, 160(2): 965. DOI:10.1104/pp.112.203455 |
Rushton P J, Somssich I E. 1998. Transcriptional control of plant genes responsive to pathogens. Current Opinion in Plant Biology, 1(4): 311-315. DOI:10.1016/1369-5266(88)80052-9 |
Secchi F, Maciver B, Zeidel M L, et al. 2009. Functional analysis of putative genes encoding the PIP2 water channel subfamily in Populus trichocarpa. Tree Physiology, 29(11): 1467-1477. DOI:10.1093/treephys/tpp060 |
Stein J C, Hansen G. 1999. Mannose induces an endonuclease responsible for DNA laddering in plant cells. Plant Physiology, 121(1): 71-80. |
Swidzinski J A, Sweetlove L J, Leaver C J. 2002. A custom microarray analysis of gene expression during programmed cell death in Arabidopsis thaliana. Plant Journal for Cell & Molecular Biology, 30(4): 431-446. |
Vinocur B, Altman A. 2005. Recent advances in engineering plant tolerance to abiotic stress:achievements and limitations. Current Opinion in Biotechnology, 16(2): 123-132. DOI:10.1016/j.copbio.2005.02.001 |
Wang X, Li Y, Ji W, et al. 2011. A novel glycine soja tonoplast intrinsic protein gene responds to abiotic stress and depresses salt and dehydration tolerance in transgenic Arabidopsis thaliana. Journal of Plant Physiology, 168(11): 1241-1248. DOI:10.1016/j.jplph.2011.01.016 |
Wituszyńska W, Karpiński S. 2013. rogrammed cell death as a response to high light, UV and drought stress in plants. Rijeka: INTECH.
|
Zhang J, Li D, Zou D, et al. 2013. A cotton gene encoding a plasma membrane aquaporin is involved in seedling development and in response to drought stress. Acta Biochim Biophys Sin, 45(2): 104-114. DOI:10.1093/abbs/gms096 |
Zhu C, Schraut D, Hartung W, et al. 2005. Differential responses of maize MIP genes to salt stress and ABA. Journal of Experimental Botany, 56(421): 2971-2981. DOI:10.1093/jxb/eri294 |
 2019, Vol. 55
2019, Vol. 55

