文章信息
- 范伟健, 相伟芳, 王静, 白鹏华, 潘丽娜, 杨艺新, 朱耿平, 李敏.
- Fan Weijian, Xiang Weifang, Wang Jing, Bai Penghua, Pan Lina, Yang Yixin, Zhu Gengping, Li Min.
- 农药与紫外胁迫对白蛾周氏啮小蜂小分子热激蛋白sHSP12.2基因表达的影响
- Effects of Insecticides and Ultraviolet on the Expression of sHSP12.2 Gene in Chouioia cunea
- 林业科学, 2019, 55(2): 128-136.
- Scientia Silvae Sinicae, 2019, 55(2): 128-136.
- DOI: 10.11707/j.1001-7488.20190213
-
文章历史
- 收稿日期:2017-05-02
- 修回日期:2018-10-16
-
作者相关文章
2. 漯河市豫中南林业有 害生物天敌繁育研究中心 漯河 462300;
3. 天津市农业科学研究院植物保护研究所 天津 300384
2. Luohe City Yuzhongnan Breeding and Research Center for Forest Pest's Natural Enemy, Henan Province Luohe 462300;
3. Institute of Plant Protection, Tianjin Academy of Agricultural Sciences Tianjin 300384
自然界中,绝大多数昆虫为体型微小的变温动物,较易受到如紫外线辐射、化学杀虫剂、极端温度等胁迫因子的影响(Denlinger et al., 1998)。在遭遇不良环境时,一类高度保守的蛋白——热激蛋白(heat shock proteins, HSPs)会在昆虫体内快速的合成,对机体会产生保护作用(Zhao et al., 2012)。一般将HSPs分为几大家族,包括HSP90、HSP70、HSP60和Small HSP(sHSP)等(Kim et al., 1998; 王国强, 2010)。其中sHSP是一类不依赖于ATP的分子伴侣,能指导蛋白质正确折叠,避免蛋白质在不良环境下因错误折叠而对机体产生不良影响,其有多个家族成员包括α-crystallin-type proteins(α-HSPs)、HSP33、GroES、GrpE、HSP15等(王国强,2010;郭虹霞等,2013)。
目前对于HSPs功能的研究主要集中在一些害虫中,如小菜蛾(Plutella xylostella) (Chen et al., 2015)、绿盲蝽(Apolygus lucorum) (Sun et al., 2014)、赤拟谷盗(Tribolium castaneum) (Xu et al., 2010)和家蝇(Musca domestica) (Tang et al., 2012)等类群中。上述研究结果均表明HSPs参与了害虫对农药的抗逆性反应。也有部分研究报道了HSPs参与了寄生性天敌,如翼蚜外茧蜂(Praon volucre) (Colinet et al., 2012)、菜蛾盘榕茧蜂(Cotesia vestalis)和棉长管蚜蚜茧蜂(Aphidius ervi) (Nguyen et al., 2008)等类群的的抗逆性反应。在野外条件下,天敌昆虫同样会遇到各种不良的极端环境,如紫外辐射和极端温度等不利条件的胁迫,紫外辐射能引起昆虫强烈的抗氧化反应,对DNA会造成损伤(Ali et al., 2017)。当化学杀虫剂被应用于虫害防治中时,它们对寄生性天敌昆虫也会产生不利影响。在当前全球变暖、化学农药被广泛使用的背景下,理解天敌昆虫对不良条件进行响应的分子机制和耐受限度,可以为将来更好地利用天敌昆虫进行虫害防治提供理论指导。
白蛾周氏啮小蜂(Chouioia cunea)是我国重要入侵害虫美国白蛾(Hyphantria cunea)的重要寄生性天敌,体长1.1~1.5 mm (杨忠岐, 1989;1990),群集内寄生于美国白蛾的蛹中,是抑制美国白蛾的主要天敌因子,对控制美国白蛾的危害起到重要作用(杨忠岐, 1990;王洪魁等, 1997)。在实际生产中,阿维菌素、灭幼脲等农药均是用于防治美国白蛾等虫害常用的农药(莫建初等, 2002;张彦龙等,2008;唐良德等, 2014;肖达等, 2014)。在实验室条件下,阿维菌素、苏云金杆菌、灭幼脲和高效氯氰菊酯等农药对于白蛾周氏啮小蜂寿命的影响,其结果表明,不同的农药对小蜂寿命的影响存在巨大的差异(乔鲁芹等, 2009)。然而,目前白蛾周氏啮小蜂体内对于农药的抗逆性机制尚不明确。
为此,本研究对白蛾周氏啮小蜂的一个sHSP基因shsp12.2进行了克隆及进化分析,并利用qPCR技术测定了经紫外照射及用阿维菌素、苏云金杆菌、灭幼脲和高效氯氰菊酯4种农药处理后,白蛾周氏啮小蜂shsp12.2表达量变化,以期为探明周氏啮小蜂的抗逆性机制提供基础。
1 材料与方法 1.1 供试材料供试的白蛾周氏啮小蜂为本实验室室内传代培养种群。培养条件:置于人工气候箱(PQX-350H)中,温度25 ℃,相对湿度75%,光周期13 L:11D。自接种于柞蚕(Antheraea pernyi)(Lepidoptera: Saturniidae)蛹后,培养14天获得老熟幼虫,培养20天获得成虫。
1.2 主要试剂Transzol试剂(M101)、RNA溶解液(ET101-01)、TranScript First-Strand cDNA Synthesis SuperMix试剂(AT301-02)购于全式金公司,Goscript(TM)Reverse Transcription System(A5000)、GoTaq© Green Master Mix(M7122)(Promage),SYBR© select Master Mix(4472894)(Application Biology),氯仿、异丙醇(天津市化学试剂一厂),无水乙醇(生工),阿维菌素、灭幼脲、苏云金杆菌、高效氯氰菊酯商品(西川Lvyun公司)。
1.3 白蛾周氏啮小蜂Ccshsp12.2基因的克隆及分析 1.3.1 总RNA的提取与第1链cDNA的合成取羽化1天内的白蛾周氏啮小蜂的成虫,采用Trizol法提取白蛾周氏啮小蜂的总RNA,总体积为20 μL。利用NanoDrop 2000 Spectro-photometer (Thermo Scientific)和琼脂糖凝胶电泳检测RNA的质量和浓度。取5 μg总RNA为模版,利用Goscript(TM)Reverse Transcription System(A5000)试剂盒,以AOLP(表 1)为反转录引物、BOD为接头引物,合成第1链cDNA。
|
|
1) Ccshsp12.2 cDNA序列的5′ RACE (Rapid amplified of cDNA end)根据白蛾周氏啮小蜂转录本测序得到的Ccshsp12.2片段(predict),设计2对下游特异性引物(表 1),均分别与NUP引物配对,以1709 3R与BOD为引物,以第1链cDNA为模版,进行Touchdown PCR (Don et al., 1991)。扩增程序:95 ℃预变性2 min,95 ℃变性35 s,67~57 ℃退火45 s,72 ℃延伸35 s;95 ℃变性35 s,57 ℃退火45 s,72 ℃延伸35 s,进行20个循环,72 ℃终延伸5 min。产物用1%琼脂糖凝胶电泳检验。
对PCR产物进行10倍稀释并作为模版,以BOD与1709 2R为引物扩增,进行下一轮巢式常规PCR,按照说明书设定扩增程序:其中55 ℃退火45 s,72 ℃延伸35 s,进行35个循环后,72 ℃延伸5 min。产物经过1%凝胶电泳检验并回收目的片段。
以回收产物为模版,再次进行上述PCR程序。用1%琼脂糖凝胶电泳检验。送生物公司测序。
2) Ccshsp12.2 cDNA序列的3′ RACE根据白蛾周氏啮小蜂转录本测序得到的shsp12.2 (predict),设计2对上游特异性引物(表 1),均分别与AP引物配对。以1709 3F与AP为引物,以第一链cDNA为模版,进行Touchdown PCR (Don et al., 1991)。扩增程序:95 ℃预变性2 min,95 ℃变性35 s,69~59 ℃退火45 s,72 ℃延伸35 s;95 ℃变性35 s,57 ℃退火45 s,72 ℃延伸35 s,进行25个循环,72 ℃终延伸5 min,再用1%琼脂糖凝胶电泳检验。
以10倍稀释后的PCR产物为第1轮巢式PCR的模版,以1709 2F与AP为引物进行扩增。按照说明书进行扩增程序,其中57 ℃退火45 s,72 ℃延伸35 s,进行35个循环后,72 ℃延伸5 min,用1%凝胶电泳检验。
以10倍稀释后的第1轮巢式PCR为模版,以1709 1F与AP为引物,进行第2轮巢式常规PCR。扩增程序中:57 ℃退火45 s,72 ℃延伸35 s,进行35个循环后,72 ℃延伸5 min。产物经1%琼脂糖凝胶电泳回收片段并外送测序。
3′、5′ RACE的测序结果显示:Shsp12.2基因3′-末端和5′-末端序列具有与3′、5′ RACE产物有重复区。运用BioEdit Sequence Alignment Editor进行序列拼接以获得cDNA全长。后采用NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder/)预测全长cDNA的开放阅读框(open reading frame,ORF),选取最佳ORF。应用NCBI的Blast工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分别对核苷酸序列与氨基酸序列进行分析。将最佳的Ccshsp12.2序列用SWISS-MODEL(https://www.swissmodel.expasy.org)进行结构预测,选取最优结果作为预测结果。
1.4 Ccshsp12.2生物信息学分析在NCBI上进行BLASTs搜索,下载与目标序列相似度最高的8条膜翅目和1条双翅目昆虫氨基酸序列进行后续分析。这些氨基酸序列分别为:丽蝇蛹集金小蜂(Nasonia vitripennis)alpha-crystallin A chain isoform X3 [XP_016839873.1] (对应mRNA登录号: [XM_016984384.1],下同); 毁侧沟茧蜂(Microplitis demolitor)alpha-crystallin B chain isoform X2;XP_014300343.1] ([XM_014444857.1]); 短管赤眼蜂(Trichogramma pretiosum)heat shock protein Hsp-12.2 isoform X3[XP_014224726.1] ([XM_014369238.1]); 阿根廷蚁(Linepithema humile)alpha-crystallin A chain isoform X2 [XP_012225858.1] ([XM_012370435.1]); 埃及扁胸切叶蚁(Vollenhovia emeryi)heat shock protein beta-1 isoform X2[XP_011867213.1] ([XM_012011823.1]); 小火蚁(Wasmannia auropunctata)heat shock protein beta-1 isoform X2 [XP_011696443.1] ([XM_011698141.1]); 切叶蚁(Acromyrmex echinatior)alpha-crystallin A chain isoform X2 [XP_011055349.1] ([XM_011057047.1]); 麦茎蜂(Cephus cinctus)heat shock protein beta-1 isoform X2 [XP_015600593.1]和西绕实蝇(Rhagoletis zephyria)alpha-crystallin A chain-like [XP_017490976.1])。
利用EMBOSS Pairwise Alignment Algorithm(http://www.ebi.ac.uk/emboss/align/)对Ccshsp12.2和8条膜翅目昆虫的氨基酸序列进行比对,并计算出氨基酸一致性和相似性。
将双翅目西绕实蝇(Rhagoletis zephyria)[XP_017490976.1])作为外群,将Ccshsp12.2与8条膜翅目昆虫的氨基酸序列进行比对后,用MEGA 6.0中邻接法(neighbor joining, NJ)与最小进化法(minimum-evolution, ME)构建系统发育树。
利用Single Likelihood Ancestor Counting(SLAC)软件包(http://www.datamonkey.org/)(Suzuki et al., 1999)分析标靶基因所受的选择压力。在线提交选取8条膜翅目核苷酸序列与Ccshsp12.2核苷酸序列比对结果,利用最大似然法(Maximum likelihood)构建祖先序列并计算非同义替换与同义替换的比值Ka/Ks(即dN/dS)。利用双尾法检验得出P值。
核苷酸的替代速率可通过其同义突变频率(Ks)和非同义突变频率(Ka)来进行评价(Nei et al., 1986)。通过MEGA6.0中的modified Nei-Gojobori方法进行运算。分析Ccshsp12.2与所有膜翅目昆虫的核苷酸序列比对结果。
将所有膜翅目昆虫的核苷酸序列比对结果,用DnaSP 5.0 (Rozas et al., 2003)中的Codon Usage Bias进行密码子选择偏好性分析。
1.5 白蛾周氏啮小蜂在不同条件胁迫下Ccshsp12.2表达模式分析 1.5.1 不同胁迫状态蜂源收集取50头成虫置于30 mL的无菌锥形瓶中,用封口膜密封,再用紫外灯(X射线,最大波长为365 nm;Spectronics,Westbury,NY)产生的UV-A(400 μW·cm-2)(Li et al., 2014)于24 ℃,相对湿度80%培养1 h。设置3组生物学重复。
另取4个30 mL的无菌锥形瓶,分别喷撒1 840 mg·L-1阿维菌素、4 mIU·L-1的苏云金杆菌、40 mg·L-1灭幼脲和、40 mg·L-1的高效氯氰菊酯(每喷为0.09 mg,每锥形瓶喷撒4次)。分别取50只成虫置于锥形瓶中,用封口膜密封,于24 ℃,相对湿度75%,光周期18 h:4 h(L:D)条件下倒置培养1 h (Yang et al., 2006; 乔鲁芹等, 2009);取50只成虫作为对照组,置于洁净锥形瓶中,密封,于相同条件下未做任何处理,培养1 h。设置3组生物学重复。
1.5.2 qPCR分析用总RNA的提取及第1链cDNA合成将1.5.1中处理过的小蜂,分别用Trizol法提取总RNA,溶于RNA溶解液中,总体积为20 μL。利用NanoDrop2000 Spectro-photometer (Thermo Scientific)和琼脂糖凝胶电泳检测RNA的质量、浓度与完整性。按照Transcript First-Strand cDNA Synthesis Super Mix试剂盒(AT301-02)说明书操作:加入总RNA 5 μL;Random Primer 1 μL;2XTS Reaction Mix 10 μL;RT/RI Enzyme Mix 1 μL;RNase-free Water 3 μL,制备成反转录体系。25 ℃水浴10 min,42 ℃水浴30 min,85 ℃水浴5 min,合成第一链cDNA。
1.5.3 Ccshsp12.2 mRNA相对表达量分析以cDNA作为模版,用SYBR© select Master Mix进行RT-qPCR。选用GADPH作为内参基因,扩增引物2970 F & R见表 1。扩增条件如下:50 ℃,120 s, 95 ℃,120 s; 95 ℃,15 s, 60 ℃,30 s(40个循环),后以95 ℃、15 s,60 ℃、60 s,95 ℃、30 s,60 ℃、15 s进行溶解曲线(Melt curve)绘制,记录Ct值。
当目的基因与内参基因的扩增效率相近时,采用2-ΔΔCt法计算各个条件下Ccshsp12.2基因mRNA相对表达量,用SPSS19.9软件进行单因素方差分析,Duncan氏新复极差法检验不同处理间差异显著性,P<0.05。
2 结果与分析 2.1 白蛾周氏啮小蜂Ccshsp12.2生物信息学分析通过NCBI的ORF Finder预测出Ccshsp12.2的开放阅读框,长度为621 bp,编码206个氨基酸,相对分子量为23.1kDa。3′端非翻译区为151 bp,5′端非翻译区为105 bp(序列号KY113118)。C端有保守的α-晶状体蛋白结构域(图 1a),此为小分子热激蛋白的典型结构(刘康等,2005;郭虹霞等,2013)。经SWISS-MODEL预测结果显示Ccshsp12.2的最优蛋白模板为牛肉绦虫(Taenia saginata) (SMTL id: 2bol.1) (Stamler et al., 2005)。序列差异度为18.71,覆盖氨基酸位点范围为29~194,占全长75%(图 1b)。
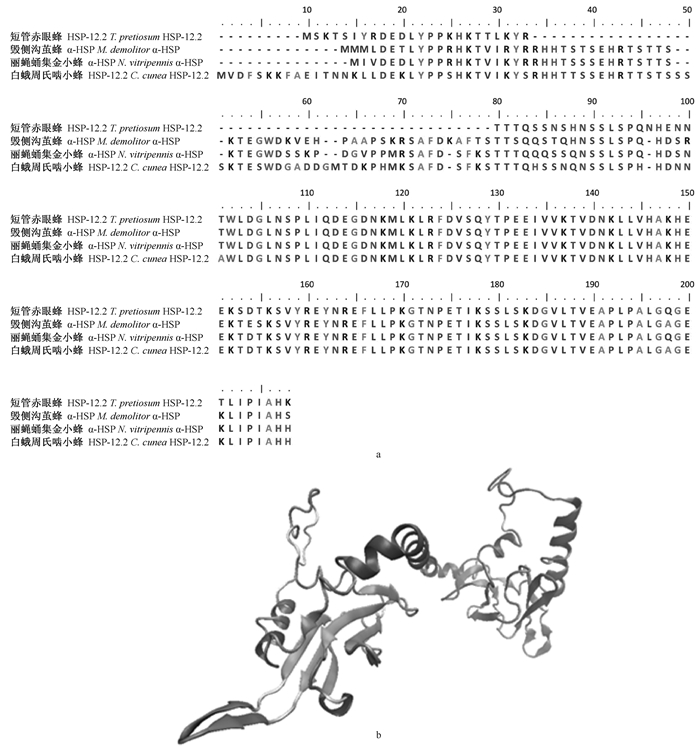
|
图 1 比对后sHSP氨基酸序列(α-晶状体蛋白结构域于294位—370位)(a)及ACD结构域(b) Fig. 1 Group of pictures of sHSPs amino acid sequences after alignment [α-crystallin domain (ACD) is between 294-370](a) and its ACD domain(b) |
Ccshsp12.2与膜翅目8种昆虫的氨基酸序列的一致性平均为64.28%,其中与丽蝇蛹集金小蜂的一致性最高,为79.2%,其余7种在60%~64%之间;白蛾周氏啮小蜂与8种昆虫氨基酸序列的相似性平均为74.3%,与丽蝇蛹集金小蜂的相似性为84.1%外,与其他7种昆虫的相似性存在较大差异。
氨基酸序列比对矩阵共有618个氨基酸位点,其中简约信息位点(Parsimony information sites)57个。聚类结果如图 2所示。Ccshsp12.2与其他4种寄生性膜翅目昆虫的相关基因聚成一支系,节点支持率为97/98。而自由生活类群聚为一支,节点支持率为99/99(NJ/ME)。

|
图 2 根据氨基酸序列构建的NJ和ME树 Fig. 2 Neighbor joining and minimum-evolution tree of amino acid sequences 每个节点处的数字代表节点支持率,“/”前方数字代表基于邻接法给出的节点支持率,“/”后方数字代表基于最小进化法给出的节点支持率, 图中物种拉丁名对应中文名见材料与方法1.4 Ccshsp12.2生物信息学分析。 The number at the node before "/" represents the bootstrap supports based on neighbor joining tree and the number behind "/" represents bootstrap supports based on minimum evolution tree. The species names shown in this figure coordinate with 1.4 of this context. |
选取的9条基因平均Ka/Ks(即dN/dS)值是0.674 067,主要接受负选择。在0.01显著性水平上未检测到正选择位点,显著水平为0.09时,检测到一个正选择位点,为第41号编码位置上,dN-dS=1.19,P=0.09。由SLAG提供的分析,可知这个位置是Ccshsp12.2的第13个残基脯氨酸(Pro),另有2个物种与之一致。在剩余的6个物种中,有3个物种的对应位点氨基酸残基为亮氨酸(Leu),2个物种对应残基为精氨酸(Arg),一个为谷氨酰胺(Gln)。在该显著性水平上有16个位点接受负选择,当显著性水平为0.000 7,仅有一个位点接受负选择,为211,所有物种对应氨基酸残基为天冬酰胺(Asn)。
9条序列比对后共有760个核苷酸位点。其中保守位点(Conserved sites)有290个,变异位点(Variable sites)有296个,简约信息位点205个,单突变位点(Singletonsites)有89个。Ccshsp12.2相关的Ks及Ka结果见表 2。Ccshsp12.2与丽蝇蛹集金小蜂(N. vitripennis)的Ks是0.205,Ka是0.210,为最低值。
|
|
密码子偏好性分析结果(表 3)显示:Ccshsp12.2的ENC为58.952,与其最接近的是短管赤眼蜂(T. pretiosum)的ENC,为58.763。寄生性昆虫的平均密码子选择偏好性指数为0.344,自由生活昆虫的平均密码子选择偏好性指数为0.353。
|
|
与对照组相比,经过几种农药处理后,Ccshsp12.2表达量均显著上升(P < 0.05),其中以阿维菌素处理诱导表达量最高,高效氯氰菊酯最低;紫外照射也导致Ccshsp 12.2 mRNA相对表达量显著升高(P < 0.05),达对照组的3.72倍(图 3)。
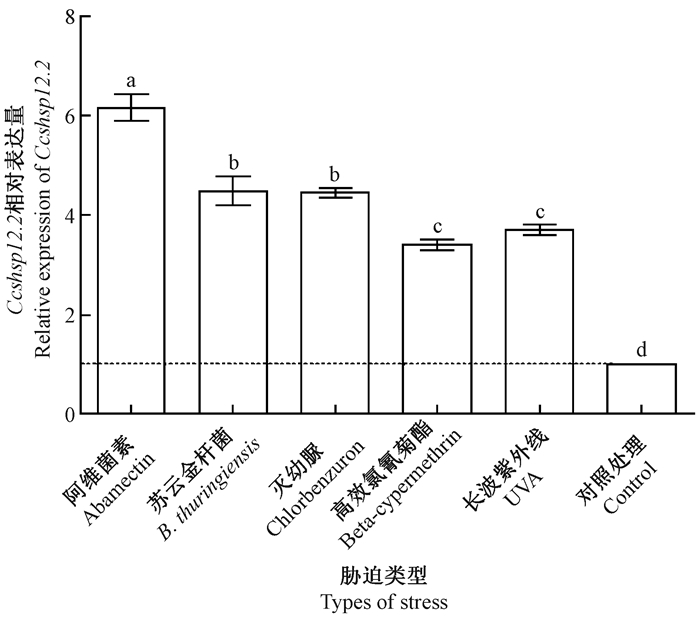
|
图 3 4种农药及长波紫外线(UV-A)处理后Ccshsp12.2的相对表达量 Fig. 3 Relative expression level of Ccshsp12.2 mRNA in C. cunea after treated by 4 kinds of pesticide and ultraviolet-a radiation (UV-A) 柱形图上不同小写字母分别代表相互有显著性差异(P < 0.05)的显著性水平。 Each lowercase represents different significant levels (P < 0.05) which have significant difference with each other. |
本研究首次鉴定了白蛾周氏啮小蜂的一个小分子热激蛋白Ccshsp12.2。该基因编码的蛋白C端有热激蛋白典型的α-晶状体结构域。
聚类结果显示膜翅目类群分化为2支,一支为自由生活类群,如麦茎蜂等,另一支为寄生性类群,寄生于各种虫态中,如短管赤眼蜂(卵寄生),毁侧沟茧蜂(幼虫寄生),周氏啮小蜂和丽蝇蛹集金小蜂(蛹寄生)。系统发育结果暗示,小分子热激蛋白与昆虫生活方式可能存在一定的相关性。
选择压力分析表明,该基因受负选择压力,表明Ccshsp12.2有着重要的生理功能。通过计算Ccshsp12.2对另外8个膜翅目昆虫的相关的序列Ka/Ks值,发现所有寄生性昆虫的结果值小于0.86,平均为0.805,自由生活昆虫的Ka/Ks值平均为0.987,而总体的平均Ka/Ks结果值为0.906,几乎所有基因都接受负选择(Crow et al., 1970; Suzuki et al., 1999)。但寄生性小蜂的Ka/ Ks值小于所有供测昆虫平均值和自由生活昆虫。Ka /Ks可反映正选择与负选择共同作用的结果,数值越小,表明受到的负选择作用越大(Crow et al., 1970; Suzuki et al., 1999)。寄生性类群受到的负选择压力比自由生活类群大,可能是如白蛾周氏啮小蜂等寄生性类群,Shsp12.2需要稳定的功能才能使得寄生性类群更好地适应寄主体内环境。自由生活类群所处环境较为多变,Shsp12.2的Ka/Ks接近于1,表现出中性选择的进化模式。可能Shsp12.2对寄生性类群的发育过程更为重要。
基于密码子偏好性分析,寄生性小蜂的平均CBI为0.344,自由生活昆虫的平均CBI为0.362,比寄生性小蜂的高。在本研究中,密码子偏好性指数较高的自由生活昆虫,其Ks值较低,而寄生性小蜂密码子偏好性低,对应的Ks值较高,本研究结果支持密码子偏好性与Ks值成反比(Sharp et al., 1989; Shields et al., 1988)的观点。
在野外,阿维菌素、苏云金杆菌、灭幼脲和和高效氯氰菊酯均是防治美国白蛾常用的农药。乔鲁芹等(2009)报道,阿维菌素对白蛾周氏啮小蜂成虫寿命有显著的影响,在一些文献也报道过,阿维菌素对一些寄生性天敌如松毛虫赤眼蜂(Trichogramma dendrolimi)、丽蚜小蜂(Encarsia formosa)、红侧沟茧蜂(Microplitis mediator)均有显著影响(唐良德等, 2014;肖达等, 2014)。一些研究中表明,在响应阿维菌素逆境的过程中,大分子热激蛋白HSP90起到了重要的作用(Feng et al., 2010; Tian et al., 2015)。HSP90、HSP70在抵抗苏云金杆菌、灭幼脲和和高效氯氰菊酯中,均发挥重要作用(Zhu et al., 2017)。本研究表明,研究结果表明4种农药均能显著的诱导Ccshsp12.2的大量表达,在白蛾周氏啮小蜂中,小分子热激蛋白Ccshsp12.2对抵抗阿维菌素逆境也可能起到重要作用。
紫外辐射通过诱导生物体内产生活性氧,使得蛋白质受损,脂质过氧化,DNA受损而对生物体产生一定的危害(Meng et al., 2009)。在长波紫外线(UV-A)照射下,棉铃虫成虫寿命减少,F1代幼虫存在发育延缓现象(Zhang et al., 2011)。赤拟谷盗在长波紫外线照射下,其繁殖力也出现了下降现象,小分子热激蛋白shsp27有上调现象(Sang et al., 2012)。在本研究中,暴露在UV-A照射下的白蛾周氏啮小蜂Ccshsp12.2表达量为对照组的3.72倍。推测Ccshsp12.2的表达能增强白蛾周氏啮小蜂在夏季强日照的环境下的存活率与繁殖力,但目前Ccshsp12.2的作用机制尚不明确。进一步的结论有待对Ccshsp12.2基因进行敲除等实验进行验证。
4 结论随着全球气候变暖和杀虫剂的大量使用,对热激蛋白的深入研究可为探讨天敌昆虫抗逆机制以及农药-天敌综合治理提供一定的理论基础。白蛾周氏啮小蜂是美国白蛾蛹期重要的寄生蜂。通过分子进化分析,发现寄生性与自由生活的膜翅目昆虫其热激蛋白所受的进化压力有显著差别。本研究结果证实了Ccshsp12.2与白蛾周氏啮小蜂对抗农药与紫外逆境相关。Ccshsp12.2对于阿维菌素和苏云金杆菌的胁迫最为敏感,其次为灭幼脲及高效氯氰菊酯;长波紫外线胁迫对Ccshsp12.2的诱导表达效果最弱。在野外放蜂与农药结合的虫害综合治理中,应尽量避免选择阿维菌素和苏云金杆菌的使用。本研究结果为进一步研究白蛾周氏啮小蜂小分子热激蛋白功能及其参与对杀虫剂抗性的机制提供了基础。
郭虹霞, 王创云, 赵丽, 等. 2013. 小分子热激蛋白的研究进展. 山西农业科学, 41(12): 1421-1423. (Guo H X, Wang C Y, Zhao L, et al. 2013. Research progress of small heat shock protein. Journal of Shanxi Agricultural Sciences, 41(12): 1421-1423. [in Chinese]) |
刘康, 王一. 2005. α晶状体蛋白的研究进展. 眼科新进展, 25(2): 171-173. (Liu K, Wang Y. 2005. Progression of alpha crystalline protein. Recent Advances in Ophthalmlogy, 25(2): 171-173. DOI:10.3969/j.issn.1003-5141.2005.02.026 [in Chinese]) |
莫建初, 滕立, 杨天赐, 等. 2002. 阿维菌素对黄胸散白蚁Reticulitermes-speratus的毒效. 农药学学报, 4(4): 86-89. (Mo J C, Teng L, Yang T C, et al. 2002. The toxicity of Abamectin for Reticulitermes speratus. Chinese Journal of Pesticide Science, 4(4): 86-89. DOI:10.3321/j.issn:1008-7303.2002.04.018 [in Chinese]) |
乔鲁芹, 曲良建, 杨忠岐, 等. 2009. 不同药剂对美国白蛾重要天敌-白蛾周氏啮小蜂的影响. 林业科学研究, 22(4): 559-562. (Qiao L Q, Qu L J, Yang Z Q, et al. 2009. Effects of different pesticides on Chouioia cunea Yang, an important natural enemy of Hyphantria cunea Drury. Forest Research, 22(4): 559-562. DOI:10.3321/j.issn:1001-1498.2009.04.016 [in Chinese]) |
唐良德, 邱宝利, 任顺祥. 2014. 天敌昆虫抗药性研究进展. 应用昆虫学报, 51(1): 13-25. (Tang L D, Qiu B L, Ren S X. 2014. A review of insecticide resistance in the natural enemies of pest insects. Chinese Journal of Applied Entomology, 51(1): 13-25. [in Chinese]) |
王国强. 2010. 小分子热休克蛋白生物学功能的研究进展. 安徽农业科学, 38(19): 9946-9947, 9949. (Wang G Q. 2010. Research progress in biology function of small heat shock proteins. Journal of Anhui Agricultural Science, 38(19): 9946-9947, 9949. DOI:10.3969/j.issn.0517-6611.2010.19.005 [in Chinese]) |
王洪魁, 许国庆. 1997. 利用柞蚕蛹人工繁殖白蛾周氏啮小蜂的研究. 沈阳农业大学学报, 28(1): 16-21. (Wang H K, Xu G Q. 1997. Artificial breeding of Chouioia cunea Yang with Tussah pupa. Journal of Shengyang Agricultureal University, 28(1): 16-21. [in Chinese]) |
肖达, 郭晓军, 王甦, 等. 2014. 3种杀虫剂对几种昆虫天敌的毒力测定. 环境昆虫学报, 36(6): 951-958. (Xiao D, Guo X J, Wang S, et al. 2014. The toxicity of three insecticides to natural enemy. Journal of Environment Entomology, 36(6): 951-958. [in Chinese]) |
杨忠岐. 1989. 中国寄生于美国白蛾的啮小蜂一新属一新种(膜翅目, 姬小蜂科, 啮小蜂亚科). 昆虫分类学报, 1(1): 117-130. (Yang Z Q. 1989. A new genus and species of Eulophidae(Hymenoptera:Chalcidoidea)parasitizing Hyphantria cunea (Drury)(Lepidoptera:Arctiidae) in China. Entomotaxonomia, 1(1): 117-130. [in Chinese]) |
杨忠岐. 1990. 美国白蛾的有效天敌——白蛾周氏啮小蜂. 森林病虫通讯, (2): 7. (Yang Z Q. 1990. The efficient natural enemy of Hyphantria cunea(Drury)- Chouioia cunea Yang. Forest Pest and Disease, (2): 7. [in Chinese]) |
张彦龙, 陈合志, 武三安. 2008. 灭幼脲Ⅲ号对白蛾周氏啮小蜂的安全性测试. 安徽农业科学, 36(4): 1486-1487. (Zhang Y L, Chen H Z, Wu S A. 2008. Safety testing of Dimilin Ⅲ on Chouioia cunea. Journal of Anhui Agricultural Sciences, 36(4): 1486-1487. DOI:10.3969/j.issn.0517-6611.2008.04.094 [in Chinese]) |
Ali A, Rashid M A, Huang Q Y, et al. 2017. Influence of UV-A radiation on oxidative stress and antioxidant enzymes in Mythimna separata (Lepidoptera:Noctuidae). Environmental Science and Pollution Research, 24(9): 8392-8398. DOI:10.1007/s11356-017-8514-7 |
Chen X E, Zhang Y l. 2015. Identification and characterisation of multiple glutathione S-transferase genes from the diamondback moth, Plutella xylostella. Pest Management Science, 71(4): 592-600. DOI:10.1002/ps.2015.71.issue-4 |
Colinet H, Renault D, Charoy-Guével B, et al. 2012. Metabolic and proteomic profiling of diapause in the aphid parasitoid Praon volucre. PLoS One, 7(2): e32606. DOI:10.1371/journal.pone.0032606 |
Crow J F, Kimura M. 1970. An introduction to population genetics theory. First edition. West Caldwell: Blackburn Press, 386-387.
|
Denlinger D L, Hallman G J. 1998. Temperature sensitivity in insects and application in integrated pest management. Entomologia Experimentalis et Applicata, 91(2): 373-374. |
Don R, Cox P, Wainwright B, et al. 1991. 'Touchdown' PCR to circumvent spurious priming during gene amplification. Nucleic Acids Research, 19(14): 4008. DOI:10.1093/nar/19.14.4008 |
Feng H, Wang L, Liu Y, et al. 2010. Molecular characterization and expression of a heat shock protein gene (HSP90) from the carmine spider mite, Tetranychus cinnabarinus (Boisduval). Journal of Insect Science, 10(1): 112. |
Kim K K, Kim R, Kim S H. 1998. Crystal structure of a small heat-shock protein. Nature, 394(6693): 595-599. DOI:10.1038/29106 |
Li Y, Zhang J, Zhao Y, et al. 2014. Characteristic fingerprint based on low polar constituents for discrimination of Wolfiporia extensa according to geographical origin using UV spectroscopy and chemometrics methods. Journal of Analytical Methods in Chemistry, 2014: 51924. |
Meng J Y, Zhang C Y, Zhu F, et al. 2009. Ultraviolet light-induced oxidative stress:effects on antioxidant response of Helicoverpa armigera adults. Journal of Insect Physiology, 55(6): 588-592. DOI:10.1016/j.jinsphys.2009.03.003 |
Nei M, Gojobori T. 1986. Simple methods for estimating the numbers of synonymous and nonsynonymous nucleotide substitutions. Molecular Biology and Evolution, 3(5): 418-426. |
Nguyen T T A, Boudreault S, Michaud D, et al. 2008. Proteomes of the aphid Macrosiphum euphorbiae in its resistance and susceptibility responses to differently compatible parasitoids. Insect Biochemistry and Molecular Biology, 38(7): 730-739. DOI:10.1016/j.ibmb.2008.04.005 |
Rozas J, Sánchez-DelBarrio J C, Messeguer X, et al. 2003. DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics, 19(18): 2496-2497. DOI:10.1093/bioinformatics/btg359 |
Sang W, Ma W H, Qiu L, et al. 2012. The involvement of heat shock protein and cytochrome P450 genes in response to UV-A exposure in the beetle Tribolium castaneum. Journal of Insect Physiology, 58(6): 830-836. DOI:10.1016/j.jinsphys.2012.03.007 |
Sharp P M, Li W H. 1989. On the rate of DNA sequence evolution in Drosophila. Journal of Molecular Evolution, 28(5): 398-402. DOI:10.1007/BF02603075 |
Shields D C, Sharp P M, Higgins D G, et al. 1988. "Silent" sites in Drosophila genes are not neutral:evidence of selection among synonymous codons. Molecular Biology and Evolution, 5(6): 704-716. |
Stamler R, Kappé G, Boelens W, et al. 2005. Wrapping the α-crystallin domain fold in a chaperone assembly. Journal of Molecular Biology, 353(1): 68-79. |
Sun Y, Sheng Y, Bai L, et al. 2014. Characterizing heat shock protein 90 gene of Apolygus lucorum (Meyer-Dür) and its expression in response to different temperature and pesticide stresses. Cell Stress and Chaperones, 19(5): 725-739. DOI:10.1007/s12192-014-0500-0 |
Suzuki Y, Gojobori T. 1999. A method for detecting positive selection at single amino acid sites. Molecular Biology and Evolution, 16(10): 1315-1328. DOI:10.1093/oxfordjournals.molbev.a026042 |
Tang T, Wu C, Li J, et al. 2012. Stress-induced HSP70 from Musca domestica plays a functionally significant role in the immune system. Journal of Insect Physiology, 58(9): 1226-1234. DOI:10.1016/j.jinsphys.2012.06.007 |
Tian H, Yu S, Liu B, et al. 2015. Molecular cloning of heat shock protein gene HSP90 and effects of abamectin and double-stranded RNA on its expression in Panonychus citri (Trombidiformes:Tetranychidae). Florida Entomologist, 98(1): 37-43. DOI:10.1653/024.098.0107 |
Xu J, Shu J, Zhang Q. 2010. Expression of the Tribolium castaneum (Coleoptera:Tenebrionidae) hsp83 gene and its relation to oogenesis during ovarian maturation. Journal of Genetics and Genomics, 37(8): 513-522. DOI:10.1016/S1673-8527(09)60071-0 |
Yang Z Q, Wei J, Wang X Y. 2006. Mass rearing and augmentative releases of the native parasitoid Chouioia cunea for biological control of the introduced fall webworm Hyphantria cunea in China. Biocontrol, 51(4): 401-418. DOI:10.1007/s10526-006-9010-z |
Zhang C Y, Meng J Y, Wang X P, et al. 2011. Effects of UV-A exposures on longevity and reproduction in Helicoverpa armigera, and on the development of its F1 generation. Insect Science, 18(6): 697-702. DOI:10.1111/j.1744-7917.2010.01393.x |
Zhao L, Jones W. 2012. Expression of heat shock protein genes in insect stress responses. Invertebrate Surviv J, 9(1): 93-101. |
Zhu G, Pan L, Zhao Y, et al. 2017. Chemical investigations of volatile kairomones produced by Hyphantria cunea (Drury), a host of the parasitoid Chouioia cunea Yang. Bulletin of Entomological Research, 107(2): 234-240. DOI:10.1017/S0007485316000833 |
 2019, Vol. 55
2019, Vol. 55

