文章信息
- 陈志成, 刘畅, 刘晓静, 万贤崇
- Chen Zhicheng, Liu Chang, Liu Xiaojing, Wan Xianchong
- 光强和树体大小对锐齿栎树木水、碳平衡的影响
- Effects of Irradiation and Tree Size on the Carbon-Water Balances of Quercus aliena var. acuteserrata
- 林业科学, 2017, 53(9): 18-25.
- Scientia Silvae Sinicae, 2017, 53(9): 18-25.
- DOI: 10.11707/j.1001-7488.20170903
-
文章历史
- 收稿日期:2016-05-03
- 修回日期:2016-06-06
-
作者相关文章
2. 中国林业科学研究院资源管护处 北京 100091;
3. 河南宝天曼国家级自然保护区管理局 南阳 474350
2. Resources Management Office, Chinese Academy of Forestry Beijing 100091;
3. Baotianman Nature Reserve Administrative Bureau Nanyang 474350
树木幼年阶段高生长较快,但是当生长到一定高度后高生长减弱或停止并且同一树种在资源贫乏的地方树木高度更低(Ryan et al., 1997a; 2006)。呼吸假说(respiration hypothesis)、营养限制假说(nutrient limitation hypothesis)、分生组织成熟假说(maturation hypothesis)等都曾用来解释这个现象(Ryan et al., 1997b),而Ryan等(1997a)提出的水力限制假说(hydraulic limitation hypothesis, HLH)是迄今为止被认为是解释树高限制最合理的假说。HLH认为从土壤到高大树木冠层的漫长水力路径会导致水力导度下降,而水力导度的降低会促使气孔关闭进而减弱光合固碳,最终导致树高生长降低。水分在木质部中运输时,需要0.01 MPa·m-1的压力梯度来克服摩擦阻力;另外重力也会产生0.01 MPa·m-1的水势梯度(Zimmermann, 1983)。木质部导管内水柱张力过大(水势过低)容易产生气穴栓塞,使树木长距离水分运输受阻(Tyree et al., 1991)。气孔关闭会限制树木水分散失,避免树木发生水力失衡(hydraulic failure),但气孔关闭也限制了树木叶片的气体交换,不利于光合固碳,树木会在最小化水分散失和最大化光合固碳之间进行权衡(Ambrose et al., 2009)。Yoder等(1994)认为高大树木白天气孔过早关闭是由树高产生的水力限制导致的。Koch等(2004)用HLH解释了目前地球上最高的北美红杉(Sequoia sempervirens)的树高限制(最大树高112.7 m),发现水势和光合速率随着树高增加而降低。另外,森林每年新的生产力在森林郁闭后往往会降低,这可能与树高造成的水力限制有关(Barnard et al., 2003),但在目前与HLH有关的研究中,还未见实例证明这种推测。
非结构性碳(non-structural carbohydrate, NSC)是光合产物,主要为可溶性糖和淀粉,其储备能代表树木固定碳和利用碳之间的动态关系。细胞膨压是细胞扩展和分裂的驱动力,高大树木冠层的水分有效性降低会通过限制细胞扩展和分裂降低对NSC的利用(Woodruff et al., 2004)。Sala等(2009)发现叶片中NSC随着树高增加而增加。另外,郁闭森林中光资源稀少或不均衡,即使同一株大树树冠的不同位置,光有效性也不同。不同的光环境对树木光合特性和其他生理生态功能的塑造也不同(Boardman, 1977; Rijkers et al., 2000; Henry et al., 2001)。Rijkers等(2000)发现在森林内随着树高增加,光有效性增加,光合速率也随之增加。而树体大小和空气饱和水分亏缺影响树木的水分平衡(Barnard et al., 2003)。树冠不同部位除受光不同之外,其蒸腾需求也不同。同时比较不同树体大小和不同光照(蒸腾需求)对光合和NSC的影响有利于了解高大树木高生长放缓的机制。
在本研究选择宝天曼锐齿栎(Quercus aliena var. acuteserrata)成年树树冠上部、树冠下部、林下幼树和林窗幼树作为研究对象。宝天曼锐齿栎林冠层郁闭,成年树树冠下部和林下幼树的光有效性相近;成年树树冠上部与林窗幼树的树高差异显著,但二者光有效性相同。本研究探索成年树树冠上部、树冠下部、林下幼树和林窗幼树之间的水分状况、光合作用、NSC和其他功能性状的差异,特别是成年树树冠下部与林下幼树之间、成年树树冠上部和林窗幼树之间的差异,并分析这种差异的原因。这是首次对不同光环境下不同树体大小的水分状况、光合作用和NSC进行研究。
1 材料与方法 1.1 研究地概况研究地点位于河南省西南部的宝天曼国家级自然保护区内的宝天曼森林生态定位研究站(111°47′—112°04′E,33°20′—33°36′N),属伏牛山南坡,大陆性季风气候。宝天曼的最高海拔为1 830 m,成土母质主要是花岗岩,低海拔为山地黄棕壤和褐土,高海拔为山地棕壤,研究地海拔约为1 400 m,主要为山地棕壤。气象数据是由距生态站200 m以内的气象站采集,年均温15.1 ℃,年均降雨量900 mm,年蒸发量991.6 mm,极端高温41.2 ℃,极端低温-14.8 ℃,相对湿度68%,年积温4 200~ 4 900 ℃。保护区植物种类丰富,共有种子植物150科783属2 147种。植被区划属暖温带落叶阔叶林,在研究地锐齿栎是主要优势冠层树种。
1.2 试验材料和设计试验区域的锐齿栎林是在1950年末的皆伐迹地上生长起来的天然次生林,林龄约为60年,锐齿栎树高一般在18~25 m。目前宝天曼锐齿栎林冠层郁闭,致使锐齿栎树木一般没有典型的大树冠,而近似于圆柱形。本研究以成年树树冠上部、树冠下部、林下幼树和没有任何遮挡的林窗幼树为研究对象,通过攀爬宝天曼的碳通量塔(高38 m)来获取成年树树冠上部和树冠下部样本,所以成年树树冠和林下幼树的研究地点在碳通量塔周围,林窗幼树设在距离碳通量塔500 m处的1个大林窗内。此林窗是人为活动造成的,长宽均超过80 m。通过攀爬通量塔可以取到周围5株成年树的样本,林下幼树和林窗幼树也是选取5个重复。成年树胸径为(25±5.3) cm,林下幼树胸径为(2.7±0.5) cm,林窗幼树胸径为(2.8±0.2) cm,林下幼树和林窗幼树的树高都不超过3 m。成年树树冠上部的取样部位距离地面是19~23 m,树冠下部是13 m左右。
1.3 试验方法 1.3.1 叶面积指数、光照强度测定通量塔附近林分的叶面积指数用LAI-2200冠层分析仪(Li-Cor Inc., Lincoln, NE, USA)测定。在2015年从4月27日—10月17日每月测定1~2次,总共测定11次。在2015年7月,选择晴朗天气中午,用LI-250A辐照计(Li-Cor Inc., Lincoln, NE, USA)测定林窗、林下、树冠上部、树冠下部的太阳辐射强度,测定林下光强时避开光斑。
1.3.2 枝条水势测定2015年7月晴天用便携式压力室(model 1000; PMS Instruments Co., Corvallis, OR, USA)测定凌晨水势和中午水势。凌晨水势(ψpd)测定时间为5:30—6:30,中午水势(ψmd)测定时间为11:30—13:00。每个个体用高枝剪采集1~2个枝条,现场测定。
1.3.3 光合特性测定为去除枝条中的栓塞,维持剩余枝条的水柱连续所采集的测定气体交换、光合光响应曲线和叶绿素荧光参数的枝条长度都超过1 m,将枝条马上插入盛有水的桶中,在水中将枝条剪断,使枝条长度大约为50 cm左右。通过这样的处理,离体叶片的气体交换在30 min内没有显著变化,确保测定的离体叶片样品生理活性与树体上的一致。
测定水势当天的9:30—11:30用便携式光合仪(LI-6400, Li-Cor, Lincoln Inc., NE, USA)进行气体交换测定,包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等生理参数和样品室CO2浓度(Ca)等环境参数。设定光合有效辐射强度(PAR)为1 500 μmol·m-2 s-1,环境温度为23~27 ℃。每个个体测定3个叶片,水分利用效率WUE=Pn /Tr,气孔限制值Ls=1-Ci/Ca。
选择2015年7月晴朗天气,在9:00—12:00用LI-6400光合仪测定光合光响应曲线。设定的光照强度为2 000,1 800,1 500,1 200,900,600,300,100,50,20和0 μmol·m-2 s-1。每个光强维持120 s记录数据,共5个重复。因为研究对象的光补偿点都小于50 μmol·m-2 s-1,所以用0,20和50 μmol·m-2 s-1光强所对应的Pn进行线性回归,得到暗呼吸速率(Rd)、光补偿点(LCP)和表观量子效率(AQY),根据光响应曲线的趋势,判断光饱和点(LSP)。
选择2015年7月晴朗天气,用PAM-2500便携式调制叶绿素荧光仪(Heinz Walz GmbH,Effeltrich,Germany)测定叶片的荧光慢速动力学曲线来获得叶绿素荧光参数。由仪器测定软件获得PSⅡ实际光化学效率(ΦPSⅡ)、可调节性能量耗散(ΦNPQ)、非光化学猝灭系数(NPQ)和光化学猝灭系数(qP)、PSⅡ有效光化学效率(Fv′/Fm′)等荧光参数。
1.3.4 树体水力导度土壤到植物的整树水力导度(ks-p)用如下公式(schoonmaker et al., 2010)计算:
| $ {K_{{\rm{s - p}}}} = {\rm{Tr/}}\left({{\psi _{{\rm{md}}}} - {\psi _{{\rm{soil}}}}} \right)。$ |
其中:成年树树冠上部、树冠下部和林下幼树的ψsoil用林下幼树的ψpd来代表,林窗幼树的ψsoil即为林窗幼树的ψpd。Tr和ψmd分别为4个研究对象上午气体交换测定的蒸腾速率和中午水势。
1.3.5 气孔密度和气孔长度测定用指甲油印记法测定气孔形态。将采到新鲜叶片后将指甲油涂于叶片背面,晾干后用尖头镊子小心取下,装在载玻片上带回实验室。用光学显微镜(Axio Imager A1, Carl Zeiss Inc., Oberkochen, Germany)物镜放大20倍观察气孔并拍照。气孔密度(SD)是单位面积内的气孔数量,气孔长度(SL)是保卫细胞的长度。每个处理至少观察8个叶片,每个叶片至少观察3个视野。
1.3.6 非结构性碳测定叶片非结构性碳(NSC)在1天中的波动较大,因此测定凌晨水势的同时采集测定可溶性糖(SS)、淀粉(St)的叶片、枝条和细根(0.5~5 mm)。枝条分为木质部与韧皮部。105 ℃杀青30 min,75 ℃烘干72 h,烘干样品研磨过100目筛。SS和St浓度之和即为总非结构性碳(TNC)浓度。用蒽酮-硫酸法(Hanson et al., 1975)测定可溶性糖和淀粉浓度。
1.3.7 其他叶片和枝条的功能性状每个个体采集2个枝条,每个枝条上所有的叶片都用叶面积仪(Li-3000C; Li-Cor Inc., Lincoln, NE, USA)测定叶面积,枝条边材面积与枝条总叶面积的比值为Huber值。在这些叶片中选取6个以上的成熟展开叶,计算平均的叶片面积。扫描叶片后立即在105 ℃杀青30 min,之后75 ℃烘干72 h,单叶叶面积与叶片干质量的比值为比叶面积(SLA)。
1.4 数据分析用SPSS17.0软件的One-way ANOVA和最小显著差数法(LSD)检验不同处理间的差异显著程度,当P < 0.05时认为差异显著。用SigmaPlot12.5软件作图。
2 结果与分析 2.1 锐齿栎林光环境 2.1.1 锐齿栎林叶面积指数年变化如图 1所示,锐齿栎叶片刚萌发后的4月份叶面积指数最低,在1.0左右。6—7月份的叶面积指数最高,最大值在4.0左右。7月份以后叶面积指数又呈降低趋势。试验主要在叶面积指数较高的7月份进行。

|
图 1 宝天曼锐齿栎林叶面积指数年变化 Fig.1 Seasonal variation of leaf area index of Q. aliena var. acuteserrata forest in Baotianman |
图 2是7月26日天气晴朗的中午成年树树冠上部、树冠下部、林下、林窗4个不同位置的光照辐射强度。这4个位置的光照强度差异显著,树冠上部和林窗的光有效性相同,且显著大于树冠下部和林下。树冠下部的光强也显著大于林下,但相对而言,二者的光强相近。林下光强均值为18 μmol·m-2 s-1,约为林外光强的百分之一。

|
图 2 晴天树冠上部、树冠下部、林下和林窗的光通量密度 Fig.2 Photon flux density of canopy top, canopy bottom, understory and gap in sunny day 不同字母表示不同处理间差异显著(P < 0.05)。 Different letters denote significant differences between treatments (P < 0.05). |
成年树树冠上部的凌晨水势最低,其次是树冠下部,林下幼树与林窗幼树的凌晨水势最高且差异不显著。树冠上部的中午水势也是最低。林窗幼树的整树水力导度最高,林下幼树最低,成年树树冠上部与树冠下部差异不显著(表 1)。林窗幼树与成年树树冠上部的蒸腾速率差异不显著(P>0.05)(表 2),但是林窗幼树的整树水力导度显著大于树冠上部,表明树冠上部的水分状况较差。树冠上部、树冠下部、林下幼树、林窗幼树之间的气孔密度和气孔长度均差异显著(P < 0.05)。树冠上部叶片的气孔密度最大,而林下幼树的气孔密度最小,气孔长度最大。
|
|
净光合速率(Pn)与气孔导度(Gs)都是林窗幼树>成年树树冠上部>树冠下部>林下幼树(P < 0.05)。4种生境下的Pn与Gs呈显著线性关系(图 3A),其胞间二氧化碳浓度(Ci)与Pn也呈显著线性关系(图 3B)。且林下幼树的气孔限制值显著低于树冠上部、树冠下部和林窗幼树,意味着林下幼树较低的Pn是由非气孔限制造成。林窗幼树和成年树树冠上部的蒸腾速率(Tr)最高,林下幼树Tr最低;林窗幼树叶片的瞬时水分利用效率(WUE)最高,这与其具有较高净光合速率有关,其次是成年树树冠上部。

|
图 3 净光合速率与气孔导度和胞间二氧化碳浓度的关系 Fig.3 Net photosynthetic rate plotted against stomatal conductance (Gs) and intercellular CO2 concentration (Ci) |
林窗幼树的光补偿点(LCP)、表观量子效率(AQY)、暗呼吸速率(Rd)和光饱和点(LSP)都是最高(表 2),成年树树冠上部的LCP、LSP与林窗幼树差异不显著。树冠下部和林下幼树的LCP和Rd均为最低,且林下幼树的LSP也是最低。
|
|
PSⅡ有效光化学效率(Fv′/Fm′)与PSⅡ实际光化学效率(ΦPSⅡ)都是树冠上部和林窗幼树>树冠下部>林下幼树(表 2)。可调节性能量耗散(ΦNPQ)与非光化学猝灭系数(NPQ)都是林下幼树>树冠下部>树冠上部和林窗幼树。林窗幼树的光化学猝灭系数(qP)最高,林下幼树最低。光合与叶绿素荧光参数说明,成年树树冠上部与林窗幼树叶片PSⅡ的光合同化力高于树冠下部和林下幼树,其中林下幼树的光合同化力最弱。
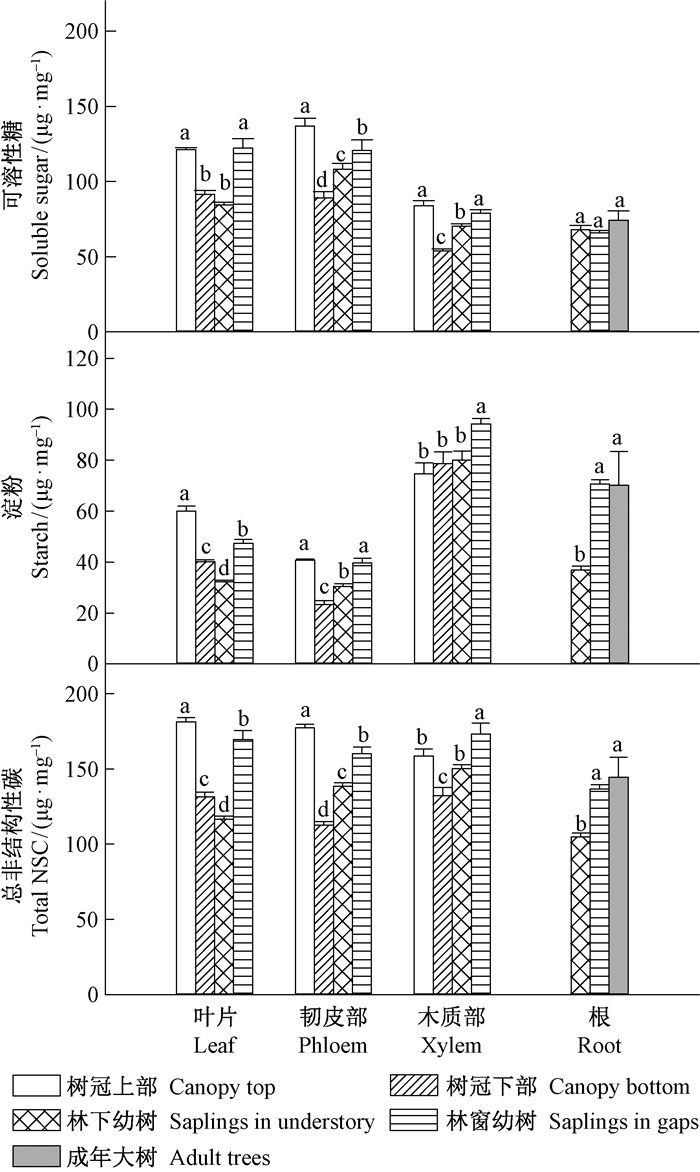
2.4 非结构性碳林下幼树叶片的可溶性糖(SS)、淀粉(St)和总非结构性碳(TNC)浓度都是最小;成年树树冠上部和林窗幼树的叶片SS浓度差异不显著;但成年树树冠上部叶片St浓度显著高于林窗幼树;最终叶片的TNC浓度为成年树树冠上部>林窗幼树>树冠下部>林下幼树。韧皮部的SS浓度和TNC浓度都是树冠上部>林窗幼树>林下幼树>树冠下部;St浓度与SS、TNC浓度规律相近,也是成年树树冠上部和林窗幼树最大。成年树树冠上部和林窗幼树木质部的SS浓度最高,林窗幼树木质部的St浓和TNC浓度最大。林下幼树根部的St和TNC浓度显著低于成年树和林窗幼树。
|
|
林下幼树的比叶面积、单叶面积最大,Huber值最小;树冠上部的比叶面积、单叶叶面积最小,Huber值最大。林窗幼树的Huber、单叶叶面积与成年树树冠上部差异不显著。
|
图 4 叶片、韧皮部、木质部和根的非结构性碳 Fig.4 Nonstructural carbohydrate of leaf, phloem, xylem and root |
Barnard等(2003)认为用HLH解释高大树木的树高限制必须满足3个条件:1) 气孔导度必须随着水力阻力的变化而响应;2) 水力阻力必须随着树高而增大;3) 大树树冠叶片的光合速率必须相对更低。在本研究中,对锐齿栎成年树树冠上部而言,这3个条件全部满足。气孔受光照和木质部水势的调节,在相同光照下(树冠上部和林窗幼树),树冠上部的气孔导度和净光合速率都显著低于林窗幼树;树冠上部的水力导度也小于林窗幼树。Ryan等(2006)总结了与HLH相关的51个研究,共涉及6部分内容,分别为中午叶片水势调节、水力导度降低、气孔或蒸腾降低、光合作用或初级生产力降低、用光合作用降低来解释生长降低和高大树木对水力阻力的适应调整。但是在这些研究中,均未同时涉及到这6部分内容,并且只有3个研究检验了其中的5个内容。而在本研究中成年树树冠上部叶片的气孔密度变大、气孔长度变小,这种气孔形态的变化有利于树冠上部叶片更有效地控制水分,可看作是一种对高大树木水力阻力变大的适应调整。本研究全部涉及到Ryan等(2006)总结的与HLH相关的6部分内容。本研究的结果支持HLH假说。
3.2 树体大小及不同位置对水分关系、光合特征和NSC的影响成年树树冠上部的凌晨水势、中午水势都显著低于树冠下部、林下幼树和林窗幼树,其整树水力导度和叶片气孔长度也显著小于林窗幼树,叶片气孔密度显著大于林窗幼树。这说明由于从土壤到大树冠层上部水力路径的摩擦力、重力及冠层上部遭受更大的空气饱和水分亏缺等因素,成年树树冠上部木质部导管张力更大,处在一定程度的水分胁迫状态。成年树树冠下部的高度也显著高于幼树,其凌晨水势低于幼树约0.1 MPa,恰好相当于10 m高的水柱压力差。这些结果都表明,高大树木需要更大的木质部导管张力来维持树体上下的水分平衡。另外,树冠下部叶片气孔长度显著小于林下幼树,气孔密度显著大于林下幼树,也说明树冠下部的水分有效性显著低于林下幼树。虽然树冠下部的光强显著低于树冠上部和林窗幼树,但是仍显著大于林下幼树,这导致其气孔导度和蒸腾速率显著大于林下幼树,最终使其整树水力导度显著大于林下幼树。这说明除了水力路径会影响树木的水分有效性外,光照也显著影响树木的水力导度。光照可以提高某些树种的整树水力导度,而遮荫环境会降低整树水力导度(Schoonmaker et al., 2010)。
成年树树冠下部叶片的蒸腾需求虽然高于林下幼树,但没有受到明显的水分胁迫,其净光合速率、气孔导度、蒸腾速率、气孔限制值、光饱和点、F′v,F′m、ΦPSⅡ和qP显著高于林下幼树,胞间CO2浓度、ΦNPQ和NPQ显著低于林下幼树。并且,光有效性高的成年树树冠上部和林窗幼树的净光合速率、气孔导度、蒸腾速率、水分利用效率、光补偿点、Fv′/Fm′、ΦPSⅡ显著大于树冠下部和林下幼树,ΦNPQ和NPQ显著小于树冠下部和林下幼树。这些都说明强光照在塑造锐齿栎具有重要作用。
在森林郁闭后,森林的生产力往往会降低(Barnard et al., 2003; Ryan et al., 2006),这种现象是否与水力限制假说(HLH)有关还不能完全证明。高大树木造成的水力限制会降低冠层细胞膨压,而细胞膨压是细胞扩展和分裂的驱动力,所以水力限制会影响树木对NSC的利用(Woodruff et al., 2004; Ryan et al., 2006; McDowell, 2011)。Woodruff等(2004)发现高大树木叶片的膨压比小树更低,并且枝条生长更慢、叶片更厚;而Ryan等(1997)发现冠层郁闭后,所研究树木的木材生长只占当年光合所固定碳的20%~30%。本研究中成年树树冠上部与林窗幼树的光有效性相同,但成年树树冠上部叶片的净光合速率和暗呼吸速率都显著低于林窗幼树。对于树木来说,光合作用是碳源,而呼吸代谢、生长(NSC转化为纤维素等木材组织)和NSC储备是重要的汇(Woodruff et al., 2011)。叶片是光合作用的源器官,韧皮部是光合产物的输导组织,木质部薄壁细胞中的NSC可用于木质部导管的栓塞修复(McDowell, 2011; Pfautsch et al., 2015)。本研究中,成年树树冠上部叶片、韧皮部的总非结构性碳(TNC)浓度显著大于林窗幼树,而木质部TNC浓度显著小于林窗幼树,推测这是由成年树树冠上部的水分限制导致的。水分限制降低了细胞膨压,从而减弱了冠层上部叶片、韧皮部对NSC的利用。生长势的大小与呼吸代谢直接相关,树冠上部叶片的暗呼吸速率显著低于林窗幼树,也表明树冠上部的生长弱于林窗幼树。另外,成年树树冠上部水势更低,其木质部栓塞风险更大,这就需要更多的可溶性糖进入导管维持张力和进行栓塞修复,从而需要更多的淀粉转化为可溶性糖。而树冠上部木质部的可溶性糖浓度与林窗幼树差异不显著,但淀粉浓度和TNC浓度显著低于林窗幼树。综上所述,HLH假说认为水力限制导致的光合固碳减弱限制了大树的高生长,这与本研究结果一致;并且冠层上部与林窗幼树的NSC差异也反映了冠层上部生长迟缓,不能用于树木生长的碳的比例增多。
3.3 锐齿栎(幼树)对低光环境的响应光强不但会影响树木的生理生态特性(Boardman, 1977),而且会驱动森林演替、改变森林结构(Pacala et al., 1996)。包括遮荫在内的多种形式的外界胁迫,会在长时间内导致植物固定的碳小于消耗的碳,当NSC降低到一定程度时,植物会因碳饥饿死亡(McDowell, 2011; Sevanto et al., 2014)。Poorter等(2007)发现森林内树种的存活率随着NSC浓度的增加而增大,而更耐荫的树种具有更高的NSC储备。目前宝天曼锐齿栎林冠层郁闭,虽然每年的种子雨很大,春天萌发的锐齿栎幼苗也很多,但是锐齿栎幼树很少,说明现在锐齿栎这个树种更新能力趋弱。而在晴天,宝天曼锐齿栎林下光照强度只约为林外的百分之一,长期的林下遮荫环境显著降低了林下幼树的光合潜能和固碳。总体上其TNC浓度显著低于成年树和林窗幼树,并且林下幼树的光补偿点与林下实际的光照强度非常相近,稍有干扰时,林下幼树就只能用NSC储备来满足新陈代谢需求(Myers et al., 2007)。随着林下幼树生长对NSC需求增大,林下这种遮蔽环境很容易导致锐齿栎幼树碳亏缺甚至碳饥饿,这或许是宝天曼锐齿栎难以更新的原因。
4 结论1) 锐齿栎成年树冠层上部存在明显的水力限制,导致成年树冠层上部的净光合速率、气孔导度都显著低于林窗幼树。由于树冠顶部的水分胁迫及由此带来的生长下降,使得成年树冠层上部叶片和韧皮部的非结构性碳(NSC)相对积累;而经常性的栓塞修复消耗了树冠上部木质部大量的NSC。
2) 光有效性高的成年树冠层上部和林窗幼树叶片的光合能力显著大于冠层下部和林下幼树;没有受到明显水分胁迫的成年树冠层下部的光合能力也显著大于林下幼树,即光照因素对锐齿栎光合作用的塑造具有重要作用。
3) 林下遮荫环境导致的碳饥饿可能是宝天曼锐齿栎树种难以更新的主要原因。
| [] | Ambrose A R, Sillett S C, Dawson T E. 2009. Effects of tree height on branch hydraulic, leaf structure and gas exchange in California redwood. Plant, Cell & Environment, 32(7): 743–757. |
| [] | Barnard H R, Ryan M G. 2003. A test of the hydraulic limitation hypothesis in fast-growing Eucalyptus saligna. Plant, Cell & Environment, 26(8): 1235–1245. |
| [] | Boardman N K. 1977. Comparative photosynthesis of sun and shade plants. Annual Review of Plant Physiology, 28: 355–377. DOI:10.1146/annurev.pp.28.060177.002035 |
| [] | Hanson J, Moller I. 1975. Percolation of starch and soluble carbohydrates from plant tissue for quantitative determination with anthrone. Annals of Biochemistry, 68(1): 87–94. DOI:10.1016/0003-2697(75)90682-X |
| [] | Henry H A L, Aarssen L W. 2001. Inter-and intraspecific relationships between shade tolerance and shade avoidance in temperate trees. Oikos, 93(3): 477–487. DOI:10.1034/j.1600-0706.2001.930313.x |
| [] | Koch G W, Sillett S C, Jennings G M, et al. 2004. The limits to tree height. Nature, 428(6985): 851–854. DOI:10.1038/nature02417 |
| [] | McDowell N G. 2011. Mechanisms linking drought, hydraulics, carbon metabolism, and vegetation mortality. Plant Physiology, 155(3): 1051–1059. DOI:10.1104/pp.110.170704 |
| [] | Myers J A, Kitajima K. 2007. Carbohydrate storage enhances seedling shade and stress tolerance in a neotropical forest. Journal of Ecology, 95(2): 383–395. DOI:10.1111/jec.2007.95.issue-2 |
| [] | Pacala S W, Canham C D, Saponara J, et al. 1996. Forest models defined by field measurements:estimation, error analysis and dynamics. Ecological Monographs, 66(1): 1–43. DOI:10.2307/2963479 |
| [] | Pfautsch S, Renard J, Tjoelker M G, et al. 2015. Phloem as capacitor:radial transfer of water into xylem of tree stems occurs via symplastic transport in ray parenchyma. Plant Physiology, 167(3): 963–971. DOI:10.1104/pp.114.254581 |
| [] | Poorter L, Kitajima K. 2007. Carbohydrate storage and light requirements of tropical moist and dry forest tree species. Ecology, 88(4): 1000–1011. DOI:10.1890/06-0984 |
| [] | Rijkers T, Pons T L, Bongers F. 2000. The effect of tree height and light availability on photosynthetic leaf traits of four neotropical species differing in shade tolerance. Functional Ecology, 14(1): 77–86. DOI:10.1046/j.1365-2435.2000.00395.x |
| [] | Ryan M G, Yoder B J. 1997a. Hydraulic limits to tree height and tree growth. Bioscience, 47(4): 235–242. DOI:10.2307/1313077 |
| [] | Ryan M G, Lavigne M B, Gower S T. 1997b. Annual carbon cost of autotrophic respiration in boreal forest ecosystems in relation to species and climate. Journal of Geophysical Research, 102(D24): 28871–28884. DOI:10.1029/97JD01236 |
| [] | Ryan M G, Phillips N, Bond B J. 2006. The hydraulic limitation hypothesis revisited. Plant, Cell & Environment, 29(3): 367–381. |
| [] | Sala A, Hoch G. 2009. Height-related growth declines in ponderosa pine are not due to carbon limitation. Plant, Cell & Environment, 32(1): 22–30. |
| [] | Schoonmaker A L, Hacke U G, Landhäusser S M, et al. 2010. Hydraulic acclimation to shading in boreal conifers of varying shade tolerance. Plant, Cell & Environment, 33(3): 382–393. |
| [] | Sevanto S, McDowell N G, Dickman L T, et al. 2014. How do trees die? A test of the hydraulic failure and carbon starvation hypotheses. Plant, Cell and Environment, 37(1): 153–161. DOI:10.1111/pce.2014.37.issue-1 |
| [] | Tyree M T, Ewers F W. 1991. The hydraulic architecture of trees and other woody plants. New Phytologist, 119(3): 345–360. DOI:10.1111/nph.1991.119.issue-3 |
| [] | Woodruff D R, Meinzer F C. 2011. Water stress, shoot growth and storage of non-structural carbohydrates along a tree height gradient in a tall conifer. Plant, Cell & Environment, 34(11): 1920–1930. |
| [] | Woodruff D R, Bond B J, Meinzer F C. 2004. Does turgor limit growth in tall trees?. Plant, Cell & Environment, 27(2): 229–236. |
| [] | Yoder B J, Ryan M G, Waring R H, et al. 1994. Evidence of reduced photosynthetic rates in old trees. Forest Science, 40(40): 513–527. |
| [] | Zimmermann M H. 1983. Xylem structure and the ascent of sap. Berlin, Springer-Verlag. |
 2017, Vol. 53
2017, Vol. 53

